- Туберкулез и ВИЧ
- Открытая и закрытая формы. Коинфекция: ВИЧ и туберкулез. Как лечат туберкулез. Профилактика.
- ВИЧ + туберкулез
- Как лечат туберкулез?
- Профилактика
- Народные средства от туберкулеза при вич
- Авторизация
- Восстановление пароля
- Болезнь, не думавшая сдаваться
- Болезнь, не думавшая сдаваться
- Конкурс «био/мол/текст»-2018
- Несколько слов о туберкулезе
- Первые шаги
- Чахотка по Гиппократу
- Диагностика туберкулеза
- Лечение туберкулеза
- Как «чистили» легкие от туберкулеза пока не было таблеток?
- Ноу-хау против чахотки
- В поисках точной диагностики
- В погоне за инновационным лечением
- Проект EteRNA
- Заключение
Туберкулез и ВИЧ
Открытая и закрытая формы. Коинфекция: ВИЧ и туберкулез. Как лечат туберкулез. Профилактика.
Сейчас туберкулез называют лидером по смертности среди инфекционных заболеваний. Ежегодно от него умирают около 2 млн человек, более 200 тысяч из которых — дети. При этом заболевают каждый год, по данным ВОЗ, около 10 миллионов человек. В 80-90% случаев при туберкулезе поражаются органы дыхания, однако очаги поражения могут находиться и в других органах. Внелегочные формы встречаются существенно реже и могут дать о себе знать лишь спустя десятилетия после заражения.
Палочка может также атаковать:
- кожу и подкожно-жировой слой
- глаза
- кости и суставы
- мозг и нервную систему
- лимфатические узлы
- сердце
- мочеполовую систему
- органы пищеварения
Туберкулез протекает в открытой и закрытой формах. Заразна только первая. В этом случае в мокроте больного присутствуют бактерии, и он способен передать палочку еще 10-15 людям. В противотуберкулезном диспансере проводят анализ, в ходе которого выявляют, есть ли в мокроте больного бациллы и является ли он опасным для окружающих. Выявить заболевание возможно и с помощью флюорографии, рентгена или компьютерной томографии.
Внелегочную форму обнаружить гораздо сложнее — участки разрушения тканей либо совсем отсутствуют, либо не имеют связи с бронхами. Часто закрытая форма туберкулеза маскируется под простуду, авитаминоз и «синдром хронической усталости». Для ее выявления могут провести биопсию, отдельно исследовать органы с помощью КТ, УЗИ и МРТ или назначить стандартное лечение и после оценить результаты.
ВИЧ + туберкулез
Примерно 12-14 млн населения нашей планеты инфицированы одновременно ВИЧ и микобактериями туберкулеза. Такое сочетание особенно опасно, это фактически бомба для иммунитета. Но излечение возможно даже в этом случае. Важно, чтобы в период лечения туберкулеза пациент получал антиретровирусную терапию (АРВТ), если по каким-то причинам он не принимал ее ранее. Поскольку туберкулез более опасен для ВИЧ-положительных людей, им в качестве профилактики рекомендуют делать флюорографию дважды в год как группе риска. Кроме того, на поздних стадиях ВИЧ проба Манту и Диаскинтест показывают отрицательные значения и не реагируют на палочку, поэтому в таких случаях эффективными методами диагностики могут стать компьютерная томография с контрастным веществом и ПЦР.
Так как вероятность заболеть туберкулезом у ВИЧ-инфицированного человека в 20-30 раз выше, чем у ВИЧ-отрицательных людей, пациентам с низким уровнем лимфоцитов назначают химиопрофилактику. Это либо монотерапия одним препаратом, либо комбинированное лечение, которое не дает инфекции перейти в болезнь.
Заболеть туберкулезом не просто
Чаще всего инфекция передается от больного легочным туберкулезом, который не получает достаточного лечения. По данным ВОЗ, треть населения мира инфицирована бактериями туберкулеза, но пока еще не заболела им и не может передавать болезнь. Так, бактерия, подавляемая иммунитетом, может прожить в организме много лет. Вероятность заболеть у таких людей от 5 до 15% (в зависимости от иммунитета), но сильный стресс, недостаточное потребление витаминов и полезных веществ, плохой сон, курение, диабет или заболевания иммунитета могут спровоцировать болезнь.
Когда человек с открытой формой туберкулеза кашляет или чихает, он распространяет взвесь частиц с бактериями. Если в организм здорового человека попадет одна такая бактерия, она, скорее всего, не осядет в легких, а выйдет при выдохе или погибнет. Если же скопление микобактерий туберкулеза слишком велико, то при вдохе они, вероятнее всего, останутся на задней стенке горла, откуда попадут в желудок и кишечник, где и погибнут.
В целом, заболеть туберкулезом не так-то просто, должен совпасть целый ряд факторов: идеальный размер капельки с бактериями, идеальная взвесь бактерий в этой капельке и сниженный иммунитет. И даже в этом случае, активная фаза болезни может миновать. В больницах и диспансерах принято считать, что палочка передается через общую посуду, рукопожатия, одежду и постельное белье. Эти принципы изоляции сохранились с давних пор, несмотря на то, что давно доказано обратное.
Однако риск заражения возможен, если зайти в помещение, где недавно находился больной. Поэтому чрезвычайно важно, чтобы оно хорошо проветривалось.
Как лечат туберкулез?
Важно помнить, что туберкулез излечим. Основа его лечения — антибактериальная химиотерапия четырьмя препаратами: рифампицином, изониазидом, пиразинамидом и этамбутолом. Эти препараты оказывают воздействие на бациллы, предотвращают привыкание и не дают палочке мутировать. Лечение обычно занимает от 6 до 8 месяцев. Для эффективной терапии необходима поддержка врача и постоянное наблюдение. При приеме курса важно соблюдать все предписания специалистов, чтобы не распространять болезнь дальше и избежать рецидива.
Однако, если не принимать таблетки в одно и то же время суток, концентрация препарата в организме снижается и бактерия получает шанс на развитие множественной лекарственной устойчивости (резистентности). Такой туберкулез не чувствителен к изониазиду и рифампицину и требует лечения препаратами так называемого второго ряда (терапия, основанная на других препаратах, к которым у штамма нет устойчивости).
Профилактика
К сожалению, полностью защититься от туберкулезной инфекции нельзя, но можно предотвратить развитие болезни или постараться выявить ее на ранней стадии. Наши легкие не имеют нервных окончаний, поэтому «почувствовать» туберкулез невозможно. Зато плановая ежегодная диспансеризация и флюорография способны обнаружить болезнь до начала осложнений.
В настоящее время в России новорожденных прививают вакциной БЦЖ, ее делают из искусственно выращенной ослабленной туберкулезной палочки. Привитые дети либо получают иммунитет, либо не имеют возможности заболеть тяжелой формой туберкулеза.
Ревакцинация считается спорной из-за того, что БЦЖ в некоторых случаях может вызывать у взрослых осложнения. Поэтому подростки и взрослые люди находятся в группе риска.
Самые простые, но самые важные способы профилактики заболевания — это здоровый образ жизни, отсутствие хронического психоэмоционального стресса, хороший сон и качественное питание.
Источник
Народные средства от туберкулеза при вич
Производится перенаправление с сайта
Всероссийской акции по тестированию на ВИЧ-инфекцию
Авторизация
Восстановление пароля
- Главная
- Образ жизни
- В чем кроется опасность туберкулеза для ВИЧ-инфицированных?
Среди людей, живущих с ВИЧ, одним из самых распространенных осложнений является туберкулез. Что представляет собой это заболевание? Возможна ли профилактика туберкулеза при ВИЧ инфекции и насколько вероятно полное излечение в случае проявившихся симптомов?
Среди людей, живущих с ВИЧ, одним из самых распространенных осложнений является туберкулез. Что представляет собой это заболевание? Возможна ли профилактика туберкулеза при ВИЧ инфекции и насколько вероятно полное излечение в случае проявившихся симптомов?
Что такое туберкулез?
Туберкулез (ТБ) инфекционное заболевание, возбудителем которого является микробактерия туберкулеза (МБТ). Эти микроорганизмы достаточно распространены в воде, почве, среди животных и людей – в силу своей относительной устойчивости к воздействию внешних факторов. Наиболее благоприятная для МБТ среда обитания – помещения с недостаточной освещенностью.
Заразиться микробактерией туберкулеза можно:
· воздушно-капельным путем от больного с открытой формой заболевания
· через свежее молоко больных животных.
Если иммунная система человека функционирует нормально, то при попадании в организм возбудитель переходит в неактивную форму и может оставаться в таком состоянии довольно длительное время, сохраняя при этом жизнеспособность.
Сегодня почти треть населения планеты инфицировано МБТ, но само заболевание у них не развивается, благодаря хорошо действующим защитным силам организма. О туберкулезе же свидетельствует появление клинической симптоматики указывающей на поражение одного или нескольких органов.
Проявляется заболевание внелегочными и легочными формами, последние из которых считаются наиболее опасными. У ВИЧ-инфицированных взрослых в большинстве случаев развиваются внелегочные формы ТБ:
ВИЧ-инфицированные дети, чаще заболевают:
Почему туберкулез опасен для людей с ВИЧ-инфекцией?
Как известно, вирус иммунодефицита человека поражает Т-хелперы, на поверхности которых находиться антиген CD4+, за счет чего клеточный иммунитет значительно снижается и перестает полноценно отвечать на активность тех или иных микроорганизмов. Следовательно, если ВИЧ-инфицированный человек является носителем неактивных МБТ или заражается ими при неблагоприятных условиях, то в 50% случаев происходит развитие туберкулеза. Это зависит от степени иммунодепрессии, чем она больше, тем выше риск развития ТБ. Именно поэтому ВИЧ-инфицированным следует тщательно следить за своим иммунным статусом, чтобы столь коварное заболевание, как туберкулез, не смогло проявиться внезапно.
Туберкулез опасен для ВИЧ-инфицированного своим воздействием на вирус иммунодефицита человека, который начинает более активно реплицироваться (размножаться) создавая угрозу прогрессирования основного заболевания – ВИЧ в СПИД. Именно по этой причине человеку живущему с ВИЧ-инфекцией находиться в одном помещении с больным ТБ очень не желательно. По степени риска передачи возбудителя на первом месте стоит бациллярная легочная форма заболевания, на втором – абациллярная легочная форма, на третьем – внелегочная форма ТБ.
Туберкулез можно вылечить!
Чем раньше будет выявлен туберкулез, тем больше шансов на его успешное излечивание. Именно поэтому, многие ученые работают, сегодня созданием наиболее точных алгоритмов и скринингов, благодаря которым станет возможным выявление ТБ на ранних стадиях.
На основе восьми ВИЧ-клиник Вьетнама, Таиланда и Камбоджи было проведено исследование (Massachusetts Medical Society, 2010) по выявлению клинических симптомов-предикторов туберкулеза у ВИЧ-инфицированных людей. Результаты исследования показали, что чаще всего для ТБ характерны:
· длительно протекающий кашель (2-3 недели).
Также достоверными симптомами-предикторами является одновременное наличие у больного кашля, лихорадки и ночного пота. Именно поэтому к подобным симптомам нужно относиться крайне внимательно.
На ранних стадиях, ТБ у ВИЧ-инфицированных достаточно эффективно лечиться современными противотуберкулезными препаратами. Лечение проходит под наблюдением фтизиатра, инфекциониста, а при необходимости специалиста по ВИЧ-инфекции.
По времени, лечение ВИЧ-ассоциированного туберкулеза может занять 6-8 месяцев. При этом очень важно придерживаться точно предписанной схемы приема противотуберкулезных препаратов, которые, как правило, назначаются на фоне проведения высоко активной антиретровирусной терапии (ВААРТ).
Взаимодействие противотуберкулезной терапии с ВААРТ препаратами
Главный противотуберкулезный препарат – рифампицин – действует на некоторые ферментные системы печени таким образом, что начинается активное разрушение препаратов ВААРТ. Из-за этого концентрация в крови противовирусных препаратов заметно снижается. Также на рифампицин могут воздействовать ферменты печени, благодаря усилению или угнетению их работы препаратами ВААРТ. В связи с этим применяются определенные схемы лечения ВИЧ-ассоциированного туберкулеза, использование которых дает возможность улучшить здоровье больного.
Если у ВИЧ-инфицированного, туберкулез впервые выявлен в активной форме, то его лечение проводиться в первую очередь. В случае значительного снижение иммунитета противотуберкулезная терапия и ВААРТ осуществляется одновременно.
Наиболее благоприятная схема лечения представляет собой проведение интенсивного лечения туберкулеза, и только потом присоединение ВААРТ. Подобное возможно при нормальном уровне лимфоцитов в крови и предотвращает развитие синдрома иммунной реконструкции. Правильное аккуратное лечение делает возможным излечение ТБ у ВИЧ-инфицированного даже на поздних стадиях СПИДа.
Необходимость регулярной диспансеризации
После лечения туберкулеза в стационаре, пациент направляется под наблюдение врачей в противотуберкулезный диспансер, где осуществляется амбулаторное лечение и дальнейшая диспансеризация. Также возможно направление больного к фтизиатру центра СПИД, для проведения необходимых обследований выявляющих рецидивы.
Обследуя пациентов на наличие у них первичного или вторичного туберкулеза, сегодня используют рентгенографию органов грудной полости и туберкулиновую пробу Манту. В случае необходимости исследуются выделения больного – мокрота, моча, плевральный выпот – для выявления в них МБТ.
Взаимодействие врача и пациента дает максимально эффективные результаты лечения.
Источник
Болезнь, не думавшая сдаваться
12 сентября 2018
Болезнь, не думавшая сдаваться
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Во многих странах его долго считали побежденным, оставшемся лишь на страницах учебника истории. И тем не менее, он «восстал из пепла» и вновь начал угрожать людям: в 2016 году, по статистике ВОЗ, в мире насчитывалось 10,4 млн больных, из которых около 2 млн умерли. Установлено также, что около четверти мирового населения (а это ни много ни мало — 1,7 млрд человек) болеет скрытой формой этого заболевания, которая до поры до времени не проявляет себя, но в любой момент может активизироваться [1]. Если вы играли в Plague Inc., то вы помните, что лучшим способом откатить прогресс в создании лекарства против инфекции является выработка у возбудителя резистентности, то есть устойчивости, к нему. Реальные бактерии действуют так же, как и виртуальные, и возбудитель, о котором пойдет речь, — не исключение. Форма этого заболевания с широкой лекарственной устойчивостью не реагирует почти на все существующие антибиотики, и больные ею есть уже в 117 странах [2]. Поэтому необходимо создать принципиально новое средство от этой известной всем болезни, имя которой — туберкулез.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2018.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Воздух дает нам жизнь, он же приносит и болезни.
Аристотель
В 2008 году в ежемесячном издании «Бюллетень ВОЗ» и на сайте организации было опубликовано интервью с Бриджитт Жикель, профессором из Института Пастера в Париже. Она рассказала о лабораториях по всему миру, занятых передовыми разработками в сфере фтизиатрии, и о неприятных особенностях туберкулеза. Так, с палочкой Коха (Mycobacterium tuberculosis или просто Mtb), вызывающей эту болезнь, очень трудно работать, так как она относится к медленнорастущим микобактериям. Из-за этого на проведение экспериментов нужны немалые деньги и время, а результаты исследований появляются такими малыми порциями, что продвижение к конечной цели — идеальному лекарству от туберкулеза — идет очень медленно. Профессор приводит читателя к выводу, что в борьбе с туберкулезом много сложностей, и лишь совместными усилиями ученых из всех стран он может быть побежден [3]. Излечение человечества от «архаичной» инфекции затянулось до сих пор, и фтизиатрия сегодня является одним из передовых (и вместе с тем одним из наиболее изученных) направлений в биомедицине.
Но наука развивается. С 2008 года прошло уже десять лет, и человечество стало прогрессивнее и в техническом плане, и в плане владения необходимой информацией. Сегодня мы входим в такой период, когда рамки невозможного стираются, и излечение человечества от инфекций, которые привели к миллионам смертей, просто неизбежно. Так что же делают ученые для этого? Помогут ли новые технологии человечеству в победе над палочкой Коха? И главное — как скоро мы сможем заявить, что туберкулез действительно побежден? В этом мы и попытаемся разобраться. Но начнем с начала.
Несколько слов о туберкулезе
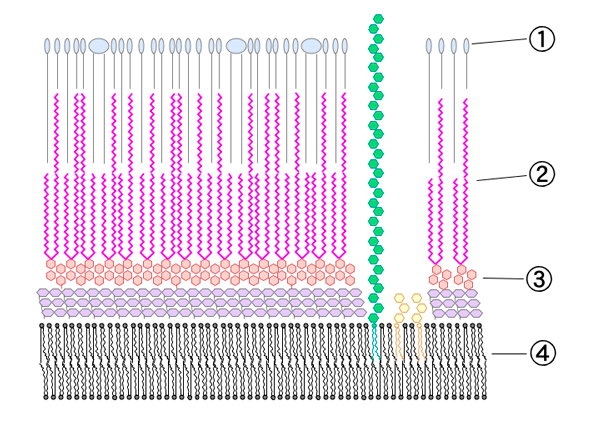
Палочка Коха, вызывающая туберкулез, относится к роду Mycobacterium. Сегодня науке известно более 74 видов микобактерий, широко распространенных в почве, воде, воздухе, среди людей и животных. Приставка «мико» в названии микобактерий переводится с латыни как «воск». Она была дана этим бактериям неспроста: в их клеточной стенке (рис. 1) содержатся длинные воскообразные молекулы — миколовые кислоты. Вместе с огромными полисахаридами арабиногалактанами, которые также есть только у микобактерий, они составляют прочную оболочку, защищающую бактерию от кислот, щелочей, спирта и других веществ.
Рисунок 1. Клеточная стенка микобактерии: 1 — внешние липиды; 2 — миколовые кислоты; 3 — арабиногалактан; 4 — билипидный слой.
Если инфекция становится активной, то в 90% случаев она поражает легкие, хотя может развиться также и в любой другой части тела. Общие признаки туберкулеза включают в себя лихорадку, озноб, потерю аппетита и усталость. Легочный туберкулез проявляется также болью в груди и длительным кашлем с мокротой или даже с кровью [4].
Бактерии попадают в организм воздушно-капельным путем. Сначала они окажутся в легких, где будут медленно делиться, и, пока их немного, останутся почти незаметными для иммунитета. Mtb не выделяют токсинов, поэтому при инфицировании яркие симптомы сразу не возникают. В течение инкубационного периода, который длится от 4 до 12 недель, палочка Коха привлекает внимание исключительно клеток врожденного иммунитета — фагоцитов. Первыми на место являются нейтрофилы, но их возможности уничтожать микобактерий ограниченны, и тогда за дело берутся макрофаги — самые древние иммунные клетки.
Фагоцитоз происходит так: сначала клетки фиксируют микобактерий на мембране, затем этот участок мембраны погружается в цитоплазму фагоцита и образует фагосому — пузырек с бактерией. Затем фагосома сливается с лизосомами, наполненными ферментами, переваривающими бактерии. Если вирулентность возбудителя невысока, его существование в организме на этом заканчивается. Однако микобактерии со значительной вирулентностью синтезируют много так называемого липоарабиноманнана (также известного как корд-фактор) — вещества, мешающего лизосомам сливаться с фагосомами, и бактерии беспрепятственно размножаются внутри макрофага. В результате зараженный макрофаг погибает, а микобактерии оказываются на воле. Когда макрофаги погибают, из них вытекают ферменты, повреждающие ближайшие клетки. В этом случае начинается патология: в легких наблюдают очаги распадающейся ткани, гной, воспаление и каверны. Но возможен и третий вариант. Если иммунитет и вирулентность сбалансированы, то бактерии остаются в макрофагах, и организм изолирует очаг инфекции, образуя гранулемы — окруженные плотной капсулой упорядоченные скопления макрофагов, Т-лимфоцитов и соединительной ткани [5]. Но внутри зарубцевавшейся гранулемы в течение всей жизни по-прежнему живут микобактерии. Удалить попавшие однажды в организм палочки почти невозможно, а это таит в себе риск активации туберкулеза на любом этапе жизни при ухудшении ее условий, старении или заражении ВИЧ. О распространенности этого вида поражения свидетельствует тот факт, что зажившие гранулемы встречаются у 97% всех умерших взрослых людей (рис. 2) [6]. Этим, отчасти, объясняется несостоятельность ликвидации туберкулеза в ближайшее время.
Рисунок 2. Судьба Mycobacterium tuberculosis в организме хозяина. Бактерию, попавшую в организм, заглатывают фагоциты. Бактерия или погибнет в этих клетках, или сама погубит клетку-хозяина, или годами будет существовать в изолированных гранулемах.
Первые шаги
Туберкулез — одна из древнейших болезней. Его обнаружили даже у египетской мумии, найденной археологами сто пятьдесят лет назад [7]!
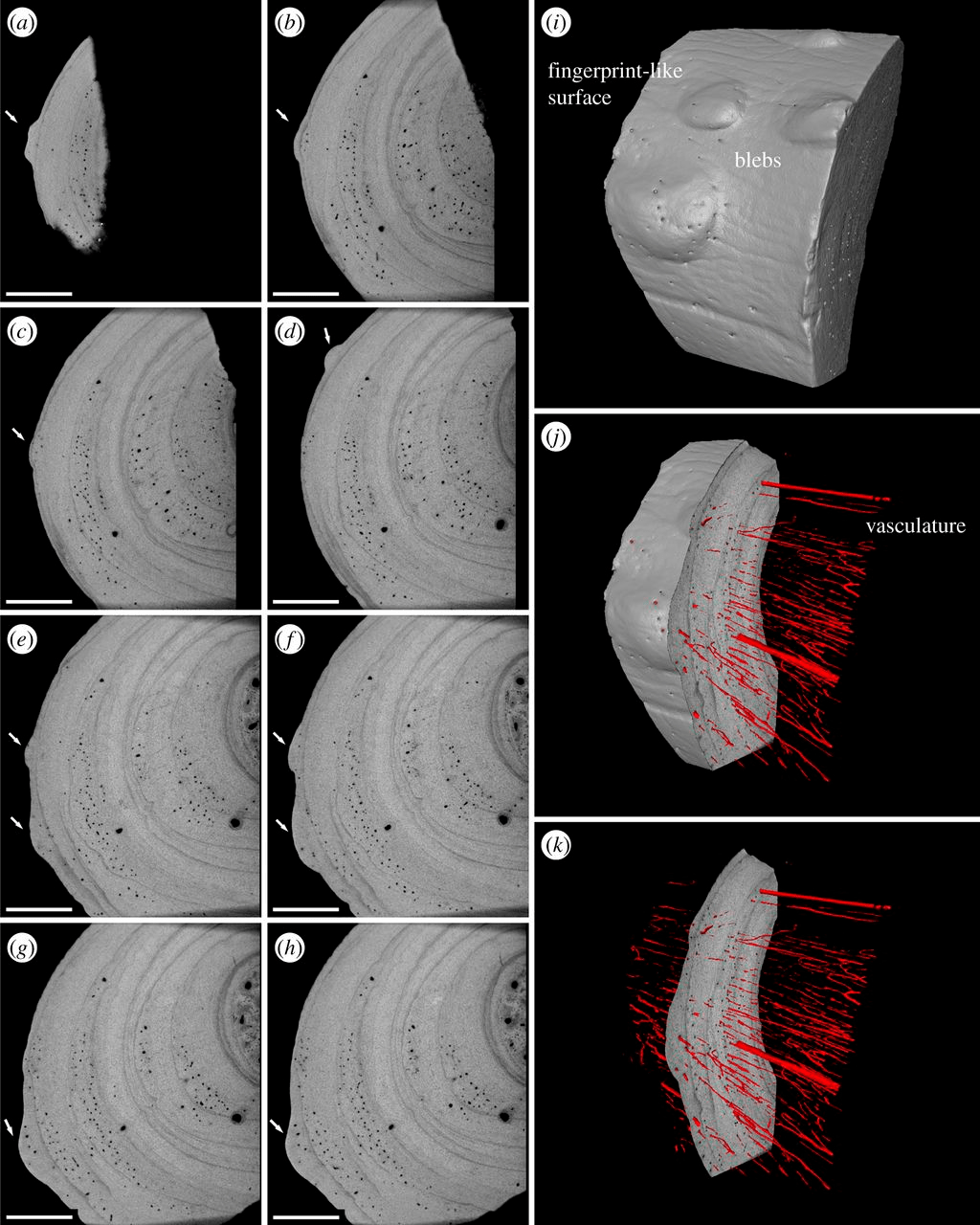
В 2018 году стало ясно, что животные болели туберкулезом еще в триасовом периоде. Такой вывод помогла сделать страдавшая туберкулезом морская рептилия возрастом 245 миллионов лет, скелет которой нашли в Польше более века назад. Ученых заинтересовали ребра рептилии, на которых обнаружили пузырькообразные выросты (рис. 3), похожие на те, что характерны для костей больных тяжелой формой туберкулеза. Но прежде чем ставить диагноз, ученые провели рептилии томографию и ряд гистологических исследований, при которых отмели ряд заболеваний, которые могли бы оставить такие же следы на скелете. Так они поняли, что рептилия, скорее всего, погибла от пневмонии, которая была одним из осложнений туберкулеза. При этом характер аномалий говорит о том, что болезнь длилась месяцами, если не годами. К сожалению, попавшие в руки ученых окаменелости оказались настолько древними, что нет никакой возможности извлечь из них хоть какой-то генетический материал, который мог бы дать больше информации о возбудителе заболевания [8].
Рисунок 3. Патологические изменения в костной ткани ребер древней рептилии, свидетельствующие о том, что она была больна туберкулезом
В Древней Греции уже знали о существовании этой болезни и назвали ее словом phtisis (истощение), подчеркивая резкое ослабление организма больного. От этого слова впоследствии произошло название науки о туберкулезе — фтизиатрии. Об этой болезни писали также древнегреческие мыслители Геродот, Исократ и Аристотель, а описание ее симптомов находили на Ближнем Востоке, в Индии, Египте, Междуречье и многих других странах.
Чахотка по Гиппократу
Не обошел стороной эту проблему и отец медицины, древнегреческий врач Гиппократ. В своем знаменитом труде «О внутренних страданиях» он подразделил туберкулез на три вида и подробно их описал.
По Гиппократу, при чахотке (так называли туберкулез до начала XX века) «наступает лихорадка и дрожь; в груди и спине боль; иногда удручает острый кашель, и больной выделяет обильное водянистое и соленое отхаркивание. тело худеет, исключая голени, ибо они опухают, ногти загибаются; горло наполняется чем-то вроде пуха. жажда сильна. сильная слабость охватывает тело. когда дело так обстоит, больной погибает в течение года».
Если больной заболел другим видом чахотки, возникающим из-за тяжелого труда, а не из-за «гнилости внутренних соков», больной испытывает то же, но «болезнь представляется более тихой и летом дает ремиссии. больной умирает за 3 года».
В третьем же случае «человек становится тотчас черным и опухшим. отхаркиванье желто, и, когда оно наступает, больной задыхается и иногда не может кашлять, хотя и хочет; иногда нужда в откашливании вызывает рвоту. Когда вырвет, ему кажется лучше; по прошествии незначительного времени он лежит в тех же самых страданиях. Болезнь тянется 9 лет до полного истощения».
Лечить чахотку Гиппократ советовал травами, вареным молоком, «прочихиваньем» (оно «выгоняет» из организма слизь, которая, по мнению древних, чаще всего была причиной болезни), прогулками и особой диетой, включавшей в себя еду без резкого вкуса и запаха, а также очень старое вино. Однако при использовании этого всего можно лишь легче перенести болезнь, но никак не избавиться от нее — от первых двух видов чахотки тогда излечивались лишь единицы, а от третьей вылечиться было можно, но это, как предполагается, не туберкулез.
Из-за сходства симптомов чахотки с признаками лихорадок и катаров (бронхитов) диагностика заболевания вплоть до начала XX века часто запаздывала на несколько месяцев. Со временем, чахоткой стали называть только первый ее вид по Гиппократу. Большинство пациентов переходило в категорию чахоточных, когда вылечить их было уже невозможно, либо когда врачи не могли понять, чем они болеют.
К началу XIX века подходы к лечению мало изменились со времен Гиппократа. Для лечения туберкулеза применяли всевозможные средства, однако, большинство из них были малоэффективны, поскольку болезнь очень хитроумна — она плохо поддается даже современному лечению. В качестве противокашлевой процедуры использовали кровопускание, а мокроту разжижали специальными пилюлями из смеси кардамона, морского лука и аммониака (эта смола и сейчас входит в состав отхаркивающих средств). Когда болезнь уже запущена, врачи решались и на более серьезные меры. Так как в кровохаркании винили нарыв легких, врачи старались его прорвать и очистить, накладывая на спину нарывный пластырь или создавая между ребрами искусственную язву с нагноением. Оговаривалось, что средства, причиняющие наименьшую боль, наименее полезны.
Врачи считали, что одними лекарствами и процедурами хворь из организма не выгонишь. Их следовало сочетать с прогулками, размеренным образом жизни и диетой, исключающей спиртное и еду с выраженным вкусом и запахом. Видели пользу в воздухе с «испражнениями животных», которые, якобы, выгоняют хворь из организма, а также в посещении санаториев.
Так как чахотка считалась незаразной, ни о какой технике безопасности при уходе за больными речи тогда не шло. Грязное белье больных отдавали в прачечную, палаты подметали, вздымая в воздух пыль с бактериями, а в моменты облегчения чахоточные выходили в свет.
Основными причинами заболевания считались всяческие излишества, «неумеренность» — как физическая (обжорство, алкоголизм, малоподвижный образ жизни, излишнее перенапряжение), так и эмоциональная (сильные страсти, беспокойство и др.) Считалось даже, что чахотка в основном одолевает утонченные, романтические и творческие натуры, склонные к высоким и сильным чувствам, меланхолии, философии, неприятию низменного, способные глубоко переживать реальные и воображаемые события, — и потому, как ни смешно покажется в наши дни, — многие не хотели вовсе избавляться от нее. Чахотку называли также болезнью аристократов.
Женщина с начальной стадией туберкулеза легких — это практически идеал красоты XIX века: худая, с бледной кожей, румянцем, блестящими выразительными глазами и, само собой, глубокими думами. Чтобы добиться такого же эффекта многие здоровые женщины капали в глаза белладонну и натирали кожу разными средствами, в том числе с мышьяком, и даже пили уксус. От чахотки мечтал умереть Байрон, и умерли Шопен и Чехов.
Рисунок 4. Роберт Кох
Позже выяснилось, что большинство жертв чахотки — не аристократы, а фабричные рабочие и заключенные. Тогда от нее в России умирал каждый десятый. В эту эпоху главными причинами чахотки считали спертый воздух и пыль всякого рода [9].
Все изменилось после 24 марта 1882 года, когда Роберт Кох (рис. 4) объявил об открытии туберкулезной палочки, или бациллы (bacillus — «палочка» по латыни; не путать с названием класса и рода совсем других бактерий! — Ред.) [40], и это открытие было принято врачами. Впервые же гипотезу о том, что чахотку вызывают мельчайшие существа, за 160 лет до Коха выдвинул англичанин Бенджамин Мартин, но тогда ученые эту мысль не поддержали. Открытие Коха стимулировало поиск препаратов, действующих конкретно на палочку Коха. Теперь 24 марта, в день открытия палочки Коха, ежегодно отмечается всемирный день борьбы с туберкулезом, учрежденный ВОЗ.
Диагностика туберкулеза
Вскоре ученые предприняли первые шаги для изобретения средства диагностики заболевания. В 1890 году Кох сообщил об открытии им туберкулина, который представляет собой глицериновый экстракт из туберкулезных бацилл M. tuberculosis и M. bovis (первая из них вызывает туберкулез у людей, а вторая — у животных). И тогда ученые предположили, что при помощи этой жидкости, на которую будет реагировать иммунитет, можно проверить человека на то, болен ли он.
В 1907 году австрийский педиатр Клеменс Пирке заинтересовался этой идеей и предложил наносить туберкулин на кожу, специально поцарапанную скарификатором (это пластинка с острыми зубчиками, которой очень часто пользуются при заборе крови из пальца). Через год француз Шарль Манту предложил вводить туберкулин не на, а под кожу и по прошествии трех дней измерять размер «пуговки». Как оказалось, если вводить туберкулин подкожно, то тест более чувствителен [10]. Впоследствии Шарль Манту разработал тест на основе туберкулина, которым можно проверять домашних животных на наличие инфекции.
Эти гипотезы не остались незамеченными. Немецкий врач Феликс Мендель в 1908 году их учел и разработал тест с использованием туберкулина, который он назвал в честь Манту. Так была введена в практику туберкулиновая проба. Кстати, в англоязычных странах ее в знак признательности Менделю сегодня называют пробой Менделя—Манту.
Принцип действия пробы Манту основан на проверке реакции приобретенного иммунитета человека на туберкулин.
Если человек хотя бы один раз имел контакт с туберкулезными бактериями, то организм начинает вырабатывать специальные клетки, которые отвечают за распознавание и уничтожение врага в случае повторного вторжения — Т-лимфоциты.
При введении туберкулина Т-лимфоциты в лимфатических сосудах неподалеку обнаруживают, что в организм проникли обломки туберкулезных бактерий, и стекаются к месту, куда введена проба. Скопление Т-лимфоцитов, знакомых с палочкой Коха, в этом месте вызывает воспаление. То есть, если в организме побывала настоящая палочка, таких лимфоцитов будет больше, воспаление интенсивнее, и реакция станет положительной.
Подробнее о работе иммунной системы и о Т-лимфоцитах можно прочитать в статье «Т-лимфоциты: путешественники и домоседы» [41].
Проба Манту получила всеобщее признание, как наиболее простой метод диагностики туберкулеза, несмотря на то, что ее критикуют за низкую точность, необходимость выжидать несколько дней (пока болезнь прогрессирует) и возможные аллергии.
Поначалу тест был совершенно ненадежен из-за ненужных примесей в туберкулине — продуктов жизнедеятельности бактерий и части питательной среды, которые вызывали ложные результаты. Такой туберкулин получил маркировку ATK (Alt Tuberculin Koch, с немецкого — «старый туберкулин Коха»). Американский биохимик Флоренс Зайберт решила прекратить это безобразие и несколько лет занималась разработкой метода очистки белков из микобактерии, в результате чего получила белок PPD (purified protein derivative, с английского — «производственно очищенный белок»), на основе которого удалось создать более надежный тест. Первая публикация Зайберт появилась в 1934 году, а в 1940-м этот белок стал международным стандартом [11].
Кстати, главный российский фтизиатр Ирина Васильева, наконец, разрешила россиянам мочить Манту! На самом же деле утверждение, гласящее, что Манту нельзя мочить — миф, оставшийся со времен повсеместного применения пробы Пирке, которую нельзя было мочить, чтобы попросту не смыть препарат в раковину. Проба Манту же, вводимая внутрикожно, не меняет результат от попадания воды, но это не означает вседозволенности: все же следует избегать химических и физических процессов над «пуговкой» (например, не стоит ее тереть, чесать, царапать или мазать кремами).
В 1897 году врач из Бостона Фрэнсис Уильямс обнаружил, что инфекция в легких заметна в рентгеновских лучах, а в 1904 году российский ученый Алексей Абрикосов подробно описал картину состояния больных легких на рентгенограмме (рис. 5). В частности, на снимке, в зависимости от запущенности туберкулеза, можно увидеть затемнения, каверны (полости, оставшиеся после распада ткани легкого, где сидит больше всего бактерий) и фиброзные участки. Так был заложен еще один классический метод диагностики туберкулеза — рентгенография.
Рисунок 5. Туберкулез на рентгеновском снимке легких
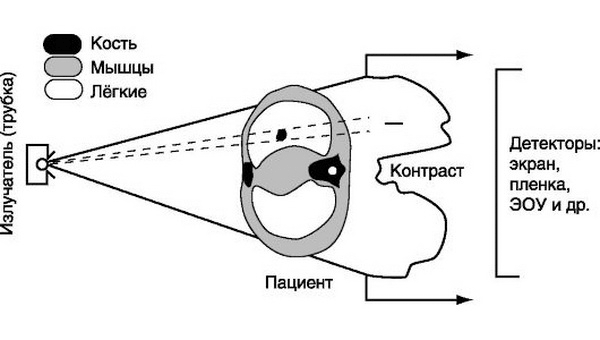
Вскоре появился метод, очень похожий на предыдущий — флюорография. Первоначально флюороскоп пытались использовать для самых разных целей — начиная от поиска оружия у людей (это тот самый аппарат, который просвечивает багаж в аэропортах) и заканчивая обувным делом. По сути, это тот же самый рентген, только изображение получается не вследствие химических процессов на пленке, происходящих при попадании рентгеновских лучей, а проецируется на специальный флюоресцентный экран, где энергия рентгеновского излучения преобразуется в видимый свет (общий принцип действия лучевых методов диагностики изображен на рисунке 6). С экрана же изображение переносится на небольшую фотопленку или камеру. Для диагностики туберкулеза первым начал использовать флюорографию бразильский пульмонолог Мануэль Диаз де Абреу в 1918 году [12].
Рисунок 6. Принцип методов лучевой диагностики — рентгенографии и флюорографии
Сегодня рентген и флюорография являются основным оружием в борьбе против туберкулеза, хотя у них есть немало противников, поскольку они, опять же, имеют свои минусы. Во-первых, для некоторых пациентов, таких как беременные женщины, больные в тяжелом состоянии и люди с открытым кровотечением, существуют противопоказания. Во-вторых, здоровым людям флюорографию можно делать только раз в год (в связи с тем, что рентгеновское излучение способно вызывать мутации). Поэтому велик шанс, что туберкулез будет диагностирован слишком поздно. И поэтому ученые все равно ищут альтернативный вариант диагностики туберкулеза на ранней стадии.
Говоря о методах лучевой диагностики туберкулеза — рентгенографии и флюорографии, — следует рассказать о вредном воздействии рентгеновского излучения на организм человека, а также дать сравнительную характеристику этих двух процедур по безопасности.
В самом начале применения рентгена оказалось, что новое излучение может вызвать что-то вроде сильного солнечного ожога (эритему), сопровождающегося глубоким и стойким повреждением кожи. Появлявшиеся язвы нередко превращались в рак. Во многих случаях приходилось удалять пораженные органы, случались и смертельные исходы. Впоследствии установили, что поражения кожи можно избежать, уменьшив время и дозу облучения, а также применяя специальные экраны из свинца. Но постепенно выявились и другие, более долговременные последствия облучения.
Эксперименты на мышах показали, что даже малые дозы систематического облучения приводят к генетическим изменениям — мутациям. Они могут быть как относительно безвредными, так и очень опасными, вызывающими необратимые изменения в составе крови, рак и преждевременное старение.
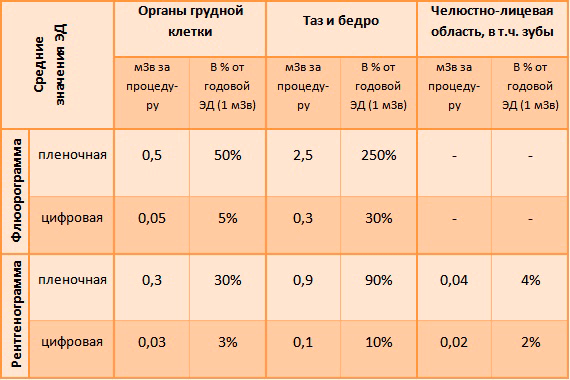
Лучевая нагрузка от рентгено- и флюорографии измеряется в процентах от некоторой величины, которая является максимальной дозой облучения за год, не вызывающей ощутимых последствий — годовой эффективной дозы (ЭД). [13] Для численного представления поглощенного организмом излучения используется специальная единица — зиверт (Зв). Один зиверт равен количеству энергии, поглощенному килограммом биологической ткани, при котором возникает лучевая болезнь. Годовая эффективная доза же равна одному проценту от зиверта — одному миллизиверту (мЗв).
Рассмотрим таблицу, где представлены средние значения индивидуальной эффективной дозы в мЗв за процедуру и в процентах от годовой ЭД (рис. 7). Из таблицы видно, что при цифровой рентгенографии доза облучения является минимальной, составляя в случае обследования легких 0,03 мЗв, или 3% от рекомендуемой годовой эффективной дозы. Максимальные дозы облучения наблюдаются при пленочной флюорографии, составляя в случае обследования легких около 0,5 мЗв, или 50% от годовой ЭД [14]. Однако пленочные варианты методов лучевой диагностики уже начали вырождаться в связи с появлением современных цифровых аппаратов, которые оказывают значительно меньшее влияние на организм. Следует подчеркнуть, что это именно средние значения. В реальности они могут колебаться как в бóльшую, так и меньшую сторону.
Рисунок 7. Лучевая нагрузка от рентгено- и флюорографии
Почему же тогда врачи отправляют в первую очередь на флюорографию, которая менее информативна и более опасна с точки зрения облучения? Потому что как массовое обследование населения в государственных медицинских учреждениях флюорография обходится государству в несколько раз дешевле, чем более информативный рентген. Так, при флюорографии размеры получаемого снимка крайне малы, меньше 10 см сторона. Учитывая, что снимок легких рекомендуют делать каждый год, флюорография позволяет сэкономить огромное количество расходных материалов в масштабах страны. Рентгенопленка же содержит серебро и является слишком дорогим удовольствием для столь широкого использования. Кроме того, флюорографию можно провести буквально «не отходя от станка» — аппарат достаточно компактен для того, чтобы вмонтировать его в кузов грузовика.
Необходимо отметить, что человек и в быту все время находится под действием радиации . В первую очередь, это рассеянное радиационное излучение, генерируемое многими электроприборами в качестве побочного продукта. Помимо этого, существует так называемый естественный радиационный фон — доза излучения, создаваемая космическим излучением и излучением природных радиоактивных нуклидов, распределенных в земле, воде, воздухе и даже в организме человека. Естественной радиационный фон колеблется в пределах 0,05–0,25 мкЗв/ч. Получаем, что в год доза облучения от естественного радиационного фона может достигать 2,4 мЗв, а это в два с половиной раза больше годовой эффективной дозы [15]. Именно поэтому даже цифровым технологиям лучевой диагностики туберкулеза необходимо искать замену.
Еще один неплохой вариант диагностики — бактериологический анализ мокроты — нашли в середине прошлого века с развитием микроскопии. Суть этого метода заключается в рассмотрении специально окрашенного мазка и поиска в нем палочек Коха. Если их там не нашли, то анализ проводят несколько раз, чтобы проверить результат [16].
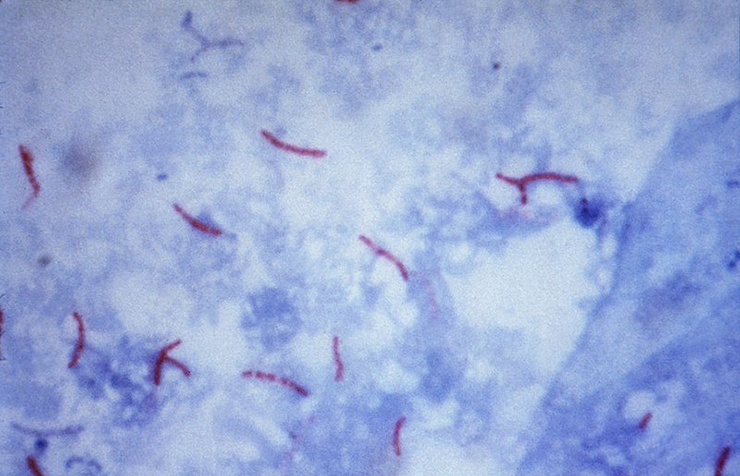
Чаще всего мазок окрашивают по Цилю—Нильсену. В этом случае выявляют так называемые КУМ — кислотоустойчивые микобактерии (как понятно из названия, они не погибают в кислотах, в отличие от прочих бактерий), к которым относится палочка Коха. Бактерии окрашивают разными красителями (сначала карболовым фуксином Циля, потом метиленовым синим), причем между окрашиваниями их обрабатывают кислотой. Все выжившие бактерии окрашиваются в красный цвет, а прочие — в голубой. Палочки Коха в препарате выглядят как тонкие палочки малинового цвета, имеющие длину 1–10 мкм, а ширину — до 0,6 мкм (рис. 8).
Рисунок 8. Микобактерии, окрашенные методом Циля-Нильсена
Если лаборант нашел в мокроте микобактерии в достаточном количестве, то следующим этапом диагностики становится посев образца в питательную среду — берут отдельную колонию в образце, поддевают ее специальным инструментом и перемещают на чашку Петри с питательной средой. Будучи помещенными в оптимальные условия, микроорганизмы быстрее растут, что позволяет уточнить их вид и оценить чувствительность к разным антибиотикам.
В качестве стандарта для выделения возбудителя болезни рекомендуется среда Левенштейна—Йенсена. Это плотная яичная среда, на которой рост микобактерий получают на 20–25-й день после посева [17]. В нашей стране широкое распространение получила также яичная среда Финн-II. Она отличается тем, что вместо аминокислоты L-аспарагина в ней используют глутамат натрия, запускающий иные пути синтеза аминокислот микобактерий. Рост появляется на этой среде раньше, а частота выделения бактерий на 6–8% выше.
Бактериоскопический метод является крайне чувствительным. При однократном обследовании чувствительность составляет около 85%, а если пробы исследуют три раза, то анализ покажет чувствительность 98%. Но не стоит забывать об этих 2%.
Если бактериоскопия не показала наличие у человека палочек Коха, но врачи считают, что «этого быть не может», то тогда производят флотацию. В биомедицину этот термин перекочевал из горнодобывающей промышленности, где он обозначает один из методов обогащения полезных ископаемых, при котором их обрабатывают жидкостями с разной плотностью, в результате чего нужный материал оказывается на границе их раздела. В биомедицине дело обстоит так же, только вместо полезных ископаемых — образец мокроты, откуда выделяются бактерии. В результате бактерий становится больше на единицу объема, и их становится проще визуализировать. Метод этот также получил название «метод Поттенджера» [18].
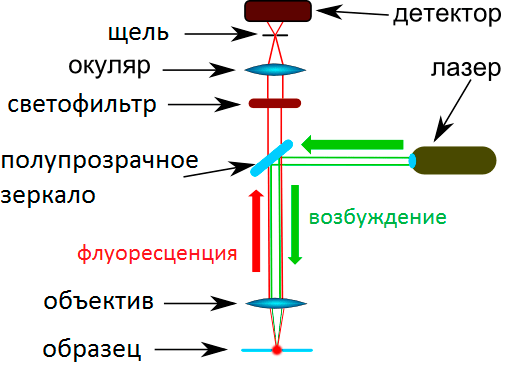
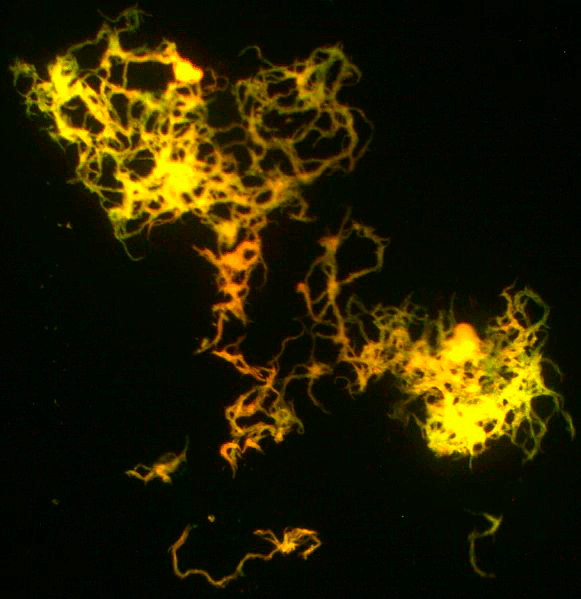
В 1930-х для выявления кислотоустойчивых микобактерий (КУМ) впервые использовали метод флуоресцентной микроскопии — еще один метод диагностики по мазку. Как известно, все молекулы способны поглощать кванты света и переходить в электронно-возбужденные состояния. Возвращение молекулы в «обычное» состояние, сопровождающееся излучением света, называют флуоресценцией. Различные молекулы, флуоресцируют в разной степени — многие из них излучают так мало света, что этого даже не видно. Метод оказался очень ценным для биологии благодаря применению ярких флуоресцентных красителей оранжевого цвета, которые добавляются перед процедурой в мазок и там прикрепляются к воскообразным структурам в клеточной стенке, которые характерны только для микобактерий. Затем этот мазок изучают через специальный микроскоп, устройство которого показано на рисунке 9. Он подсвечивает образец возбуждающим источником света, из-за чего краситель начинает светиться, и бактерии становятся видны (рис. 10). Большой контраст способствует более комфортному распознаванию бактерий по сравнению с методом окраски по Цилю—Нильсену, в связи с чем можно исследовать образцы с меньшим увеличением и, благодаря этому, намного быстрее. Метод этот очень понравился многим оснащенным лабораториям, но он не стал популярен по нескольким причинам. Во-первых, следует помнить о поговорке, придуманной учеными: «Не все то КУМ, что блестит». А во-вторых, недостатком являются большие расходы, связанные с обслуживанием специального микроскопа. Поэтому ученые решили не переходить к новому методу диагностики [19].
Рисунок 9. Устройство флуоресцентного микроскопа
Рисунок 10. Культура микобактерий под люминесцентным микроскопом
В 2008 году ввели в массовое употребление еще одну пробу, напоминающую Манту и, по заверениям изобретателей, способную ее заменить — диаскинтест. Это аллерген, комбинация двух белков, которые есть у палочки Коха, и нет у бактерии, используемой в прививках от туберкулеза — Mycobacterium bovis. Поэтому после перенесенной вакцины диаскинтест, в отличие от пробы Манту, не показывает ложноположительные результаты. Это различие определяет высокую чувствительность препарата в сравнении с туберкулином [20].
Лечение туберкулеза
Люди понимали, что нарывные пластыри и кровопускания — не самые действенные методы лечения туберкулеза. С начала XX века для увеличения эффективности лечения начали применять ингаляции разными импровизированными препаратами (по сути, давали больным все подряд, в надежде на то, что хоть что-то из этого поможет, но тщетно) и введение их непосредственно в легкое. Но самым лучшим решением тогда была операция. Именно благодаря попыткам укротить туберкулез скальпелем торакальная хирургия (то есть хирургия органов грудной клетки) достигла своего расцвета, и сейчас мы можем гордиться всем тем, что мы умеем и имеем в данной области, в том числе и для оперативного лечения других болезней.
Как «чистили» легкие от туберкулеза пока не было таблеток?
Война с легочным туберкулезом — это повесть о зарождении и становлении торакальной хирургии.
Первую в мире торакальную операцию — открытый дренаж плевральной эмпиемы (скопления гноя в грудной клетке), возникшей из-за туберкулеза — выполнил Гиппократ. Операция заключалась в том, что он просто-напросто выкачал весь жидкий гной из плевральной полости.
В первой половине XX века открытие аэробности Mtb привело к быстрому развитию торакальной хирургии. Были распространены такие виды операций, как искусственный пневмоторакс, экстраплевральный пневмолиз и т.п., которые до изобретения антибиотиков оставались единственной надеждой для больных.
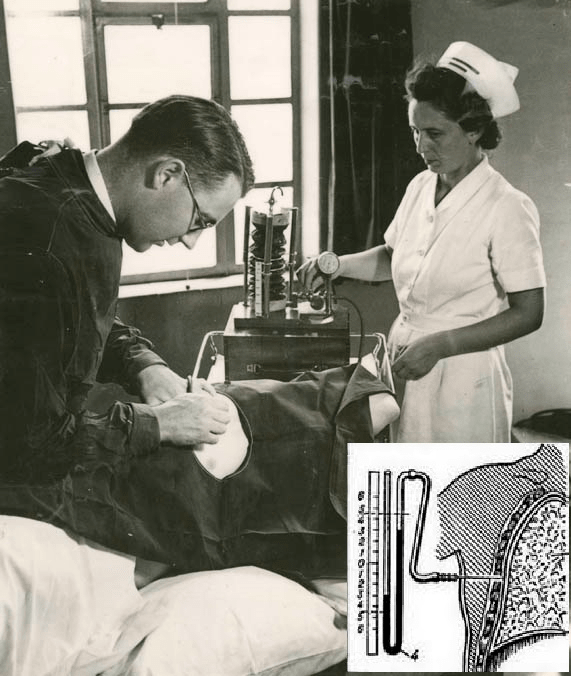
Особое место среди методов оперативного вмешательства при туберкулезе занимает искусственный пневмоторакс, при котором вводят воздух в плевральную полость, в результате чего на длительное время создается воздушная прослойка между листками плевры. В старину пациент ходил с воздушным мешком более трех лет, но потом, с развитием техники, этот период сократился до полутора лет. В результате процедуры происходит коллапс пораженного легкого — уменьшается напряжение легочной ткани, меняется кровообращение в легком и создаются благоприятные условия для заживления туберкулеза. Введение воздуха осуществляют специальными аппаратами, в которых использован принцип сообщающихся сосудов. Аппарат представляет собой U-образную трубку, заполненную водой (рис. 11). С каждой стороны от воды находится по баллону с воздухом. Когда в плевральную полость втыкается игла, с ее стороны создается пониженное давление в одном из баллонов. Атмосферное же давление его перевешивает и начинает действовать на свободный конец трубки, в результате чего вода поднимается по трубке в сторону иглы и толкает воздух перед собой в плевральную полость. Так как воздух из плевральной полости мало-помалу уходит, пациенту периодически делают поддувания, сохраняя оптимальный размер мешка годами. Впервые так лечить больных начал итальянский врач Форланини в 1882 году.
Рисунок 11. Искусственный пневмоторакс
Когда начали появляться хирургические методы лечения, люди задумались над тем, что же мешает вылечить болезнь. Так, они поняли, что при этом недуге в легких образуются небольшие полости — каверны, где интенсивнее всего размножаются палочки Коха. В результате болезнь прогрессирует, распространяется на другие отделы легких.
Операция экстраплеврального пневмолиза заключается в том, чтобы избавиться от каверн. Тогда у бактерий не будет места для размножения, и туберкулез пойдет на спад. Впервые эту операцию провел в 1891 году французский хирург Тюффье. Он отслоил кусочек легкого с каверной и попытался заполнять эту полость воздухом, но потом он понял, что это слишком долго и решил заполнить ее жировой тканью, которую он взял у самого больного. В результате состояние больного значительно улучшилось.
Разработанные в середине XX века противотуберкулезные препараты радикально изменили прогноз заболевания, и торакальная хирургия, казалось бы, перестала быть нужна, но из-за увеличения заболеваемости раком легких торакальные хирурги вскоре нашли применение своим навыкам, разработанным в течение многих лет хирургического лечения туберкулеза.
Сегодня роль хирургии в борьбе с туберкулезом снова высока в связи с появлением туберкулеза с лекарственной устойчивостью. Старые средства усовершенствовали, но в целом суть осталась та же. Кроме того, врачи научились удалять туберкуломы — пузырьки с бактериями в легких. И кто знает, возможно, путь к излечению от туберкулеза лежит именно через операционную [21].
Важным оружием в борьбе с туберкулезом является вакцинация. В 1908 году французы Альбер Кальметт и Камиль Герен работали над получением культур туберкулезной палочки и исследованием разных питательных сред. Как оказалось, на среде на основе глицерина, желчи и картофеля вырастают палочки наименьшей вирулентности. И тогда коллеги решили выяснить, нельзя ли посредством повторяющегося культивирования вырастить ослабленный штамм для вакцинации. Через два года они создали на основе своих научных изысканий бациллу Кальметта—Герена (БЦЖ), применяемую на людях по сей день [22].
Следующей важнейшей вехой в истории борьбы с туберкулезом стало лето 1943 года. В то время на птичьих дворах среди кур распространилась какая-то странная болезнь, источник которой, как предполагалось, находился в почве. Студенты под руководством профессора почвенной микробиологии Зельмана Ваксмана [42] изымали больных кур с птичьих дворов для выявления причины заболевания. Тогда один из студентов, Альберт Шатц, нашел в горле нескольких птиц комочки почвы, обросшие плесневыми грибками, и обнаружил в них стрептомицин. Он стал его основательно изучать и, протестировав воздействие стрептомицина на различные бактерии, Шатц узнал, что это вещество убивает палочки Коха, против которых недавно открытый пенициллин был бессилен. Во время клинических испытаний состояние пациентов, дни которых были сочтены, улучшилось, и они пошли на поправку. В 1952 году Ваксман получил за открытие своего студента Нобелевскую премию по физиологии или медицине, а Шатц стал обладателем «правового и научного статуса сооткрывателя стрептомицина». Кстати, термин «антибиотик» впервые предложил сам Ваксман [23].
Первые несколько лет стрептомицин обладал крайне высокой активностью: можно было даже налить воду во флакон, где до этого был препарат, и выпить ее — это все равно давало эффект. Но всего лишь через 10 лет эффективность снизилась, а сейчас действие и вовсе ничтожно.
Как бактерия смогла выработать резистентность к стрептомицину? А вот как. Стрептомицин убивает бактерии одним из самых классических способов. Он связывается с метильной группой в рРНК на одной из субъединиц рибосомы и не дает рибосоме синтезировать различные белки, за счет чего бактерия гибнет. Этот метил к рРНК добавляет специальный фермент, кодируемый у микобактерий в особом гене под названием gidB. Если в этом гене произойдет мутация и он выключится, то добавлять метил к рРНК будет некому. А без этого стрептомицин не может связываться с рРНК и убивать бактерии, что приводит к резистентности [24].
Совершенно новый подход к контролю туберкулеза был создан благодаря стараниям голландского доктора Карела Стибло, который в 1974 году предложил принципы стратегии DOTS — диагностики бактериоскопическим методом, терапии специальными препаратами, регулярных поставок этих препаратов и системы отчетности, которая позволяет оценивать результаты лечения каждого больного. В 1994 году эту стратегию рекомендовала ВОЗ для применения в странах, для которых проблема туберкулеза актуальна. DOTS до сих пор является основополагающей схемой лечения, хотя современные медики отчасти модифицировали ее.
Но туберкулез и не думал сдаваться. В 80-е появились лекарственно-устойчивые штаммы туберкулеза — грозные супербактерии, не реагирующие ни на рифампицин, ни на другие антибиотики. В 2006 году появилась бактерия, которая не реагирует почти ни на какие лекарства — возбудитель туберкулеза с широкой лекарственной устойчивостью (ШЛУ-ТБ). Бушует эта бактерия сейчас в Прибалтике, России, Украине и Китае. Сегодня в разных регионах России к антибиотикам устойчивы от 10 до 40% штаммов Mtb. Лекарственная устойчивость у бактерий появилась, в основном, из-за легкомысленного обращения несознательных граждан с антибиотиками, которые, занимаясь бесконтрольным самолечением, принимают их слишком часто, без особой необходимости и без назначения врача, не соблюдая правильные схемы лечения, что влечет за собой приспосабливаемость бактерий к лекарствам и, грубо говоря, теперь в отношении бактерий можно применить известное выражение «То, что нас не убивает — делает сильнее» .
Подробнее о развитии устойчивости к антибиотикам рассказывает спецпроект «Биомолекулы» «Антибиотики и антибиотикорезистентность». — Ред.
В 1993 году ВОЗ провозгласила ситуацию с туберкулезом «глобальной чрезвычайной ситуацией в области здравоохранения», а в 2006 году организация разработала глобальный план «Остановить туберкулез», который направлен на искоренение заболевания до 2015 года. Цели организации так и не были достигнуты за счет роста ВИЧ-ассоциированного туберкулеза и появления лекарственно-устойчивых его форм [25]. И тогда ВОЗ поставила перед собой новый план — победить туберкулез к 2030 году. Надеемся, эта проблема, наконец, будет решена.
Самая современная на сегодняшний день тактика лечения впервые выявленного туберкулеза легких такова. Сначала пациент пьет одновременно шесть месяцев так называемые препараты первой линии — терапия при туберкулезе всегда комбинированная.
- Рифампицин. Его механизм действия связан с подавлением фермента ДНК-зависимой РНК-полимеразы, в результате чего клетка перестает синтезировать РНК и погибает. Рифампицин хорошо проникает в ткани и жидкости организма и обнаруживается в терапевтических концентрациях в мокроте и содержимом каверн. Однако рифампицин нельзя пить людям с ВИЧ-положительным статусом.
- Изониазид. Механизм действия его связан с угнетением синтеза миколовых кислот в клеточной стенке бактерий. Также препарат применяют и в ветеринарии для лечения кожного туберкулеза у собак и кошек, но у них нередко возникают тяжелейшие побочные эффекты. У человека же при его применении может возникнуть гепатит. Несмотря на это, изониазид, благодаря своей феноменальной активности, остается одним из самых крепких оплотов в борьбе с туберкулезом.
- Пиразинамид. Вещество, которое оказывает бактерицидное действие на палочку Коха. Он сохраняет активность только в кислой среде — именно такова она в очагах ранних туберкулезных поражений. В ходе лечения очень быстро может возникнуть резистентность, вероятность которой снижает сочетание с другими препаратами.
- Этамбутол. Препарат, который может помочь в случае устойчивости бактерии к предыдущим четырем. Он быстро проникает внутрь бактериальной клетки, нарушает структуру рибосом, синтез РНК и белка, липидный обмен, связывает ионы магния и меди, а также уничтожает ферменты, участвующие в синтезе клеточной стенки микобактерий, в результате чего бактерии погибают, а выжившие могут быть легко уничтожены другими средствами. Однако микобактерии и к этому препарату вырабатывают устойчивость, блокируя пути поступления этамбутола в клетку.
Вместе эти четыре средства применяют в течение первых двух месяцев, а потом пиразинамид и этамбутол пить прекращают, и следующие четыре месяца принимают только рифампицин и изониазид. Существуют даже специальные препараты с содержанием четырех и двух антибиотиков.
Но при некоторых обстоятельствах может развиться туберкулез с множественной лекарственной устойчивостью, не реагирующий на лечение препаратами первой линии. В этом случае пациенту назначают препараты второй линии — циклосерин, офлоксанцин, амикацин, канамицин и другие препараты. Это антибиотики, отличающиеся высокой стоимостью и большим количеством побочных эффектов, которые назначают только в случае крайней необходимости.
Но иногда и эти препараты оказываются бессильны, и тогда возникает туберкулез с широкой лекарственной устойчивостью. И так как на него не действуют препараты первой и второй линий, выбор терапии в этом случае сильно ограничивается [26]. Что же делать? На этот вопрос пытаются дать ответ ученые по всему миру.
Ноу-хау против чахотки
В поисках точной диагностики
За последние 2–3 года в сфере нахождения новых, приемлемых способов диагностики туберкулеза было сделано очень многое. За это время ученые создали новые методы диагностики, которые далеко ушли вперед по простоте и надежности.
Например, в декабре 2017 года международная группа ученых разработала методику диагностики туберкулеза по анализу мочи, напоминающую обычный тест на беременность. В этом исследовании главным инструментом служит тест-полоска с покрытием на основе комплексного соединения меди, меняющая цвет в присутствии гликолипида липоарабиноманнана (LAM), который есть только в клеточной стенке палочки Коха и нужен ей для обеспечения ее выживания внутри макрофагов. Данный тест имеет высокую чувствительность — он показывает наличие LAM даже на самых ранних стадиях заболевания. Методику уже опробовали на 48 добровольцах c ранее диагностированным туберкулезом, и ее чувствительность превысила 95%. Когда этот метод диагностики поступит в продажу, провериться на наличие палочек Коха можно будет не выходя из дома [27].
Известно, что туберкулезу сопутствует характерный запах, и Кристиан Малдерути вместе с коллегами из Танзании предположил, что его могут почувствовать специально обученные животные с острым нюхом, даже если запах очень слабый. Он и его коллеги знали, что, чтобы вынюхивать мины по запаху взрывчатки, используют хомяковых крыс, и в эксперименте решили обучить крысу по такой же технике, но только с запахом бактерии. После обучения крысам дали понюхать образцы мокроты, взятые у 982 детей в возрасте до пяти лет. У 34 из них ранее был найден туберкулез, и крысы диагноз подтвердили — но попутно они обнаружили его еще у 23 детей, которые считались здоровыми. В дальнейшем оказалось, что и у этих 23 детей туберкулез тоже был, просто бактериоскопическим методом бациллы увидеть не удалось. И когда после крыс образцы мокроты проверили более сложным микроскопом, бактерий там все-таки нашли. Очевидно, хомяковые крысы могли бы помогать медикам обнаруживать туберкулез на ранних стадиях, особенно когда нет возможности использовать сложные и дорогие методы диагностики [28].
К прямым методам обнаружения микобактерий можно отнести и бурно развивающиеся в последние годы подходы, сущность которых состоит в выявлении в образце специфических фрагментов ДНК возбудителя. Среди применяемых для этого молекулярно-биологических методик наиболее распространенным стал метод полимеразной цепной реакции (ПЦР), в основе которого лежит многократное увеличение числа копий специфического участка ДНК: 20 циклов ПЦР приводят к увеличению исходной ДНК в миллион раз, что позволяет визуализировать результаты методом электрофореза в агарозном геле [43]. Очень высокий уровень чувствительности (95% и более), являющийся главным достоинством метода, достигается за счет того, что в результате многократного копирования уровень специфической олигонуклеотидной последовательности в реакционной пробе увеличивается в 106 раз. ПЦР-диагностика туберкулеза строится на использовании последовательностей ДНК, специфичных для всех подвидов туберкулезной микобактерии. Часто для этих целей используют праймеры IS-элементов (это мигрирующие элементы генома, нужные для переноса информации внутри клетки), например, IS-986 или IS-6110, поскольку данные элементы характерны только для видов микобактерий туберкулезной группы [29].
Много десятков лет в медицине для определения инфекций применяют модификации иммуноферментного анализа (ИФА) [44]. Этот метод основан на связывании антигенов с антителами — белками, которые образуются в организме в ответ на вторжение. Стандартный иммуноанализ занимает 3–4 часа, а для визуализации связанных антител обычно используют флуоресцентные метки. Проблема в том, что для работы с образцами с низким содержанием антител у стандартного иммуноанализа не хватает чувствительности.
В лаборатории наноструктур и нанотехнологий ИТЭБ РАН под руководством Виктора Морозова несколько лет назад стали разрабатывать совершенно новый метод иммуноанализа, основанный на электрофорезе. Они усовершенствовали экспресс-иммуноанализ, добившись большой точности для образцов с малой концентрацией маркера инфекции, что позволит выявлять туберкулез, когда болезнь еще не проявилась. Для визуализации связывания молекул антител они использовали магнитные метки. В новой работе им удалось существенно повысить точность метода, установив условия, при которых количество связанных с микрочипом магнитных меток линейно зависит от концентрации анализируемых антител. На целлофановую мембрану ученые наносили пятна секретируемых антигенов туберкулеза и антител к этим антигенам. Получившийся микрочип они помещали в самодельное устройство для электрофореза (проточную ячейку, рис. 12) и пропускали через него плазму крови. Чтобы не ждать, пока молекулы антитела случайно наткнутся на антигены на микрочипе, ученые прикладывали электрическое поле в ячейке так, что отрицательно заряженные антитела смещались из потока в сторону мембраны и концентрировались на микрочипе. Таким образом связывание антител с антигенами происходило очень быстро — этот метод позволяет за 5–10 минут определять сразу несколько антител или антигенов. Далее через ячейку пропускали суспензию магнитных частиц, несущих антитела, которые также буквально за секунды попадали на микрочип. Образцы анализировали под микроскопом, подсчитывая с помощью специального софта число магнитных частиц и сравнивая их с положительным контролем. Количественная оценка в иммуноанализе необходима, чтобы соотносить результаты с показателями неинфицированного человека и так выявлять патологию [30].
Рисунок 12. Проточная ячейка для иммуноферментного анализа на основе электрофореза
На следующем этапе группа Виктора Морозова попыталась диагностировать туберкулез, проанализировав внутрилегочную жидкость. Раньше сделать это было непросто, но исследователи сконструировали простое и дешевое устройство с капроновым фильтром, на котором при выдохе собираются микрокапли легочной жидкости. Испытывали аппарат в Центральном научно-исследовательском институте туберкулеза: 42 пациента из тех, кто еще не проходил лечение, 10 минут дышали в устройство. После этого ученые при помощи того самого микрочипа определяли, есть ли в собранном материале специфические биомаркеры. Оказалось, что живых микобактерий в выдыхаемом воздухе нет, зато там есть антитела, вырабатываемые в организме в ответ на активно размножающуюся палочку Коха. Но у определения антител к микобактериям в выдыхаемом воздухе по сравнению с анализом мокроты есть один минус: точность нового метода составляет лишь 70%. Повысить этот показатель пока не получается из-за того, что у части здоровых людей, долго контактировавших с больными, в легких нарабатываются такие же антитела. В дальнейшем, ученые хотят решить эту проблему, дополнив анализ проверкой на еще один признак инфекции — воспаление в легких, которое можно определить по наличию в выдыхаемом воздухе особых белков [31].
В погоне за инновационным лечением
За последние десять лет достигнут большой прогресс не только в сфере диагностики, но и в области разработки лекарств от туберкулеза.
Чтобы изобрести новое лекарство от инфекции, сначала необходимо найти подходящую мишень — например, какой-нибудь необходимый фермент, который сильно различается в бактериях и в человеке (это нужно, чтобы молекула, блокирующая бактериальный белок, не блокировала ее человеческий аналог) и который можно химически заблокировать.
В середине 2000-х была предложена такая мишень для блокировки — аминоацил-тРНК-синтетаза (АРСаза). АРСаза — это фермент, который ускоряет образование связки аминокислоты с тРНК перед встраиванием последней в синтезируемый белок. АРСазы обеспечивают правильность дальнейшего считывания информации с мРНК при синтезе белков на рибосомах. Для каждой аминокислоты существует своя аминоацил-тРНК-синтетаза. При этом некоторые бактериальные АРСазы зачастую довольно сильно отличаются от эукариотных аналогов, что нам только на руку.
К туберкулезу искатели антибиотиков-ингибиторов АРСазы до сих пор не подобрались потому, что пока не получены трехмерные структуры этих ферментов и не ясно, как определять потенциальные лекарства. Однако первичная структура у некоторых туберкулезных АРСаз, в частности у лейцил-тРНК-синтетазы (ЛРСазы) известна, как и то, какие аминокислоты находятся в активном центре.
Ученые из Украины и Канады решили использовать эту информацию оригинальным образом. Трехмерная структура и точное строение активного центра известны у другой бактериальной ЛРСазы, принадлежащей бактерии Thermus thermophilus. Непосредственно в активном центре сходство их аминокислотных последовательностей равно 95%, в то время как с человеческой ЛРСазой сходство минимально. Используя структуру ЛРСазы T. thermophilus как шаблон, исследователи построили модель ЛРСазы M. tuberculosis.
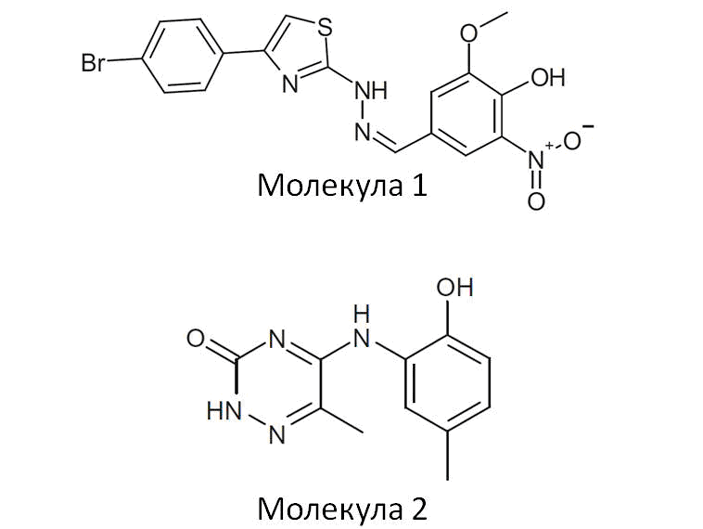
Теперь в бой вступила хемоинформатика. Ученые взяли базу из 100 000 разных молекул и протестировали их виртуально на предмет взаимодействия с активным центром модели несколькими алгоритмами, часть которых разработали они сами. Это дало возможность сократить список кандидатов до 270, чтобы затем протестировать их экспериментально. Тесты показали, что сильными ингибирующими свойствами обладают шесть молекул, принадлежащие к двум разным классам, которые для простоты обозначили как «молекула 1» и «молекула 2» (рис. 13).
Рисунок 13. Представители двух обнаруженных классов молекул, ингибирующих ЛРСазу M. tuberculosis. Молекула 1: <[4-(4-Bromo-phenyl)-thiazol-2-yl]hydrazonomethyl>-2-methoxy-6-nitro-phenol. Молекула 2: 5-(2-Hydroxy-5-methylphenylamino)-6-methyl-2H-[1,2,4]triazin-3-one.
Впоследствии были созданы компьютерные модели молекул 1 и 2, встроенных в активный центр ЛРСазы палочки Коха, с помощью которых можно понять, как именно молекулы взаимодействуют с патогенным ферментом. Используя эти знания, можно оптимизировать структуру молекулы так, чтобы она еще крепче связывалась с активным центром туберкулезной ЛРСазы. Таким образом синтезировали шесть аналогов молекулы 1 и два аналога молекулы 2, которые показали отличные результаты при тестировании их эффективности.
Кроме этого, все молекулы протестировали на предмет ингибирования человеческой ЛРСазы, и во всех случаях их активность к патогенному белку была как минимум в 10 раз выше, что делает их безопасными для человека. Поэтому найденные молекулы являются хорошими кандидатами на роль антитуберкулезных антибиотиков [32].
В число инновационных средств против микобактерий входит также препарат под техническим названием SQ109. Он обладает уникальным многокомпонентным механизмом действия, который заключается в угнетении транспортного фермента mMpl3, участвующего в синтезе корд-фактора — главного оружия палочек Коха. Помимо этого, SQ109 влияет на ферменты, влияющие на транспорт электронов, затрудняя микобактерии дыхание, а также нарушает градиент рН и мембранный потенциал, необходимые для поддержания внутриклеточного транспорта. Результатом такого многостороннего воздействия является мощное угнетение роста микобактерий и низкие показатели лекарственной устойчивости. Препарат одинаково хорошо эффективен как в отношении чувствительных к лекарствам бактерий, так лекарственно-устойчивых штаммов, а также в отношении латентной формы туберкулеза. Кроме того, этот препарат хорош тем, что он безопасен и хорошо переносится пациентами, что немаловажно в случае длительной терапии [33].
Ученые из Каролинского института в Стокгольме выяснили, что комбинация совершенно доступных и неплохо изученных лекарств тоже помогает организму бороться с туберкулезом. Эти лекарства стимулируют организм самостоятельно бороться с бактериями, что снижает риск резистентности. В комплекс входит фенилбутират, используемый для лечения нарушения обмена веществ и помогающий организму вырабатывать «естественные антибиотики» — пептиды. Ученые выяснили, что в сочетании с витамином D препарат позволяет бороться с инфекцией. Кроме теории эти исследователи приводят примеры из практики: экспериментальная комбинация дала эффект при лечении больных в маленькой азиатской стране с населением больше российского — Бангладеш [34].
Одним из самых важных в XXI веке открытий в сфере лечения туберкулеза является изобретение бедаквилина, который синтезировали американские ученые в 2012 году. Его принцип действия основан на совершенно новом принципе, нежели у рифампицина, изониазида, этамбутола и пиразинамида. Это действие (называемое ионофорическим) включает в себя блокирование движения ионов через микобактериальную мембрану, что приводит к превышению критических отметок градиента ионов, необходимых для роста и выживания бактерии. Биоэлектричество, которое создают эти ионы, является ключом к выработке энергии и целой серии других невероятно важных клеточных процессов у бактерии. Нарушение этих ионных градиентов является смертельным для палочки Коха, но до того, как появился бедаквилин, не было лекарств, которые могут сделать это и быть при этом безопасными для человека. Наиболее перспективным аспектом препарата является его способность сокращать сроки лечения до восьми недель, что очень сильно упрощает лечение. Кроме того, бедаквилин используют уже сейчас в некоторых новейших тактиках лечения в качестве препарата первой линии [35].
Команда из нескольких научных центров в США предложила просто натравить микроорганизмы друг на друга (видео 1). План этих исследователей красив и прост: конкурирующие патогены не станут объединяться против лекарства. Вместо этого они начнут убивать друг друга, а врачам затем останется лишь провести зачистку выживших на «поле боя». Таким образом, существующие препараты, к которым патогены уже выработали резистентность, могут вновь стать эффективными. Или же бактерии будут слишком заняты врагами, чтобы развивать устойчивость к лекарствам.
Видео 1. Обращение патогенов друг против друга для предотвращения антибиотикорезистентности
Как же столкнуть между собой микроорганизмы? Чтобы найти способ, исследователи провели несколько испытаний на мышах. Грызуны, впрочем, были заражены малярией, а не бактериальной инфекцией, но для бактерий действуют те же законы природы, что и для остальных организмов. Зато ученые использовали сразу две линии малярийных плазмодиев — поддающийся лечению штамм и устойчивый к существующим лекарствам. Сначала животным, зараженным чувствительной к лекарствам малярией, вместе с водой давали питательное для паразита вещество. Причем «подкормка» содержалась в разных количествах: кому-то досталось больше «удобрения», кому-то меньше. Затем мыши прошли курс терапии при помощи одних и тех же лекарств. Когда грызуны получали питательное вещество, лечение проваливалось в 40% случаев. Тесты подтвердили, что это происходило из-за появления устойчивых к терапии штаммов. Но, когда ученые ограничили объем питательного раствора, выздоровели все мыши, то есть ученые предотвратили появление резистентности.
Затем команда убедилась, что положительные результаты были вызваны именно конкуренцией среди паразитов, а не каким-либо другим эффектом ограничения еды. Ученые заразили часть мышей только устойчивыми к лечению паразитами, а другую группу — устойчивыми и чувствительными. Оказалось, что, когда мышей инфицировали только устойчивыми штаммами, а питательное вещество было ограничено, резистентные паразиты выживали. Но если животные были инфицированы как чувствительными к лечению, так и устойчивыми штаммами, число резистентных паразитов не росло. Даже если их при этом в организме животных было гораздо больше, чем обычно на первоначальных этапах, когда происходит заражение. Судя по всему, между линиями паразитов развивалась конкуренция за корм, поступавший в ограниченных количествах. Иными словами, естественная конкуренция — это и есть слабое место возбудителей инфекций.
Для возбудителей различных болезней (например, туберкулеза) предстоит определить свой «лакомый кусочек» — то самое питательное вещество, за которое они начнут бороться. Кроме того, исследователям нужно суметь выбрать наилучший момент для того, чтобы начать эту борьбу [36].
В следующем исследовании использовали этионамид — один из препаратов второй линии, который назначают в случае неудачи при лечении классическими четырьмя антибиотиками. Как известно, сам он не активен до того, как вступит в реакцию с бактерией и перейдет в активную форму. Эта активация происходит с помощью специального гена ethA, который кодирует фермент, превращающий этионамид в токсин, и обычно лекарство сопровождают еще специальные вещества, стимулирующие работу этого гена. Ученые ранее описали соединения, которые могут стимулировать активность ethA, но они не влияют на штаммы с мутацией в этом гене, делающей их устойчивыми к этионамиду. В этот раз исследователи обнаружили новый ген, который также превращает этионамид в активную форму даже тогда, когда ethA — мутант. Этот ген, получивший название ethA2, у Mtb обычно неактивен. Но ученые нашли вещество, SMARt-420, которое удивительным образом увеличило активность ethA2, сделав этионамид настоящим киллером бактерий, причем даже тех, у кого есть устойчивость к этионамиду из-за мутации ethA. Раз SMARt-420 увеличивает эффективность этионамида, то можно снизить его количество, а значит и побочные эффекты можно будет минимизировать.
Конечно, есть вероятность, что у бактерий возникнет устойчивость и к SMARt-420. Чтобы этого не случилось, следует использовать это вещество с перерывами: если в популяции и появятся клетки с новой устойчивостью, их сначала будет слишком мало, так что потом, когда SMARt-420 временно исчезнет, их вытеснят обычные микробы. Впрочем, как именно использовать SMARt-420, станет ясно после клинических испытаний, которые должны начаться уже очень скоро [37].
На конференции по ретровирусам и оппортунистическим инфекциям, прошедшей в Сиэтле, авторы еще одного интересного исследования из объединения TB Alliance рассказали об успешных испытаниях сразу двух терапий лекарственными препаратами. Новые методы, которые сделают лечение проще и эффективнее, получили названия BPaMZ и BPaL — по сокращенным названиям уже известных антибиотиков, которые ранее не пробовали сочетать.
Первый метод включает в себя прием четырех препаратов (уже знакомого нам бедаквилина, а также претоманида, моксифлоксацина и пиразинамида) раз в сутки. BPaMZ прошел испытания с участием 240 человек в десяти странах Африки. В течение четырех месяцев эта терапия помогла излечить почти все случаи обычного заболевания, а на борьбу с устойчивым видом болезни ушло шесть месяцев. Чаще всего основная часть бактерий выходила с мокротой в течение первых двух месяцев.
Второй метод — BPaL — сочетает три антибиотика (бедаквилин, претоманид и линезолид), которые принимаются раз в день. Из 69 пациентов, которых лечили при помощи этой методики, в 40 случаях испытания прошли успешно: через шесть месяцев терапии болезнь отступила, причем речь шла о самой сложной форме с широкой лекарственной устойчивостью.
По словам авторов новых методов, первый вид терапии имеет потенциал лечения до 99% пациентов с разными формами туберкулеза. Оставшийся 1% «берет на себя» второй вид лечения. Однако еще необходимо провести более масштабные испытания и провести официальное утверждение новых методов, поскольку препарат претоманид все еще является экспериментальным. Все это может занять не менее трех лет, но результат того стоит.
Индийские исследователи недавно обнаружили, что Pranlukast — препарат, который используется для лечения астмы, также может бороться и с туберкулезом. Оказалось, что, когда этот препарат используется сам по себе или, что еще лучше, вместе с рифампицином, он лечит от туберкулеза намного лучше, чем комбинированные препараты первой линии. Препарат борется с бактериями туберкулеза так, чтобы не наносить вреда хорошим бактериям, и поэтому не вызывает побочных эффектов — он подавляет синтез фермента орнитинацетилтрансферазы (ArgJ), который есть только у палочки Коха и некоторых других болезнетворных микробов и не обнаружен у людей. Этот фермент является ключевым предшественником аргинина, который необходим для выживания и патогенеза бактерии [38].
Также людям необходимы новые, более эффективные вакцины для профилактики туберкулеза, которые в состоянии заменить «старушку» БЦЖ, являющуюся далеко не универсальным средством — ведь штаммы туберкулезной палочки невероятно разнообразны. Единственной альтернативной вакциной, которую сейчас могут предложить ученые, является Н4:IC31. Она содержит рекомбинантный белок TB10. Ученые оценили безопасность и иммуногенность H4:IC31 у взрослых на практическом опыте: они применяли вакцину в Южной Африке в условиях эпидемии туберкулеза, наблюдая за привитыми. Как оказалось, самым неблагоприятным побочным эффектом оказалась лишь общая усталость, зато у вакцины хорошо получилось отпечатать рекомбинантный белок в клеточной памяти, в результате чего до самого конца наблюдений иммунитет справлялся с туберкулезом [39].
Проект EteRNA
Очень интересно подошли к делу ученые из медицинской школы Стэнфордского университета. Они создали новую версию браузерной компьютерной игры EteRNA Medicine, которая будет использовать творческие способности тысяч игроков, чтобы создать спасительное средство для диагностики туберкулеза.
EteRNA — это «игра с целью», которая привлекает пользователей к решению головоломок, связанных со складыванием различных молекул РНК, необходимых в тех или иных исследованиях. Этот проект поддерживается Фондом Билла и Мелинды Гейтс, Стэнфордским университетом и Национальными институтами здравоохранения.
Смысл игры заключается в том, чтобы сложить нить РНК, которая будет соответствовать поставленному условию задачи. Игрок может изменить последовательность, помещая любой из четырех нуклеотидов РНК в разные положения. РНК, в зависимости от последовательности нуклеотидов, может самопроизвольно сгибаться в мириады всевозможных форм. И от того, как сложится РНК, может зависеть очень многое, в том числе и то, как она может связываться с другими молекулами РНК. На этом и основан новый тест, разрабатываемый учеными из Стэнфорда.
Специалисты намерены с помощью игроков разработать молекулу РНК, которая будет главным героем в новом тесте, анализирующем образец крови. Эту искомую молекулу уже заочно назвали OpenTB. Тест «высчитывает» соотношение в образце трех молекул РНК, принадлежащих палочке Коха и больному. Две из них в большом количестве можно найти в образце, когда человек болен. Третий же вид РНК служит порогом — если молекул первых двух видов больше, чем третьего, то это и является признаком заражения. OpenTB сможет связаться с этими тремя молекулами, и на основании того, как это произошло, можно сделать вывод, болен ли человек (видео 2).
Видео 2. Молекула OpenTB
Хотя OpenTB будет одной молекулой РНК, она будет иметь три части, каждая из которых связывается с одной из трех связанных с туберкулезом молекул РНК. OpenTB должна также принимать различные формы в зависимости от пропорций трех видов РНК. Если у больного много молекул РНК первых двух видов (присущих больным людям), то OpenTB сложится в форму 1. Но если представителей этих двух видов молекул меньше, чем третьего, то OpenTB сложится в форму 2. Форма 1 также должна быть в состоянии связаться с флуоресцентным тегом, в то время как форма 2, наоборот, не должна. Поэтому молекулы с формой 1 будут излучать свет, а с формой 2 — нет. Измеряя яркость свечения, можно сделать вывод, болен ли человек или нет: если она выше некоторого порога, то пациент имеет активный туберкулез.
За полтора года после запуска проекта биологи получили десятки тысяч конструкций, из которых они выбрали несколько действительно многообещающих проектов. Проверив их, они синтезировали РНК в лаборатории для дальнейших проверок и исследований. По состоянию на 2018 год, тестирование продолжается с помощью реальных образцов крови, взятых у пациентов.
Если это исследование окажется успешным, оно поможет спасти миллионы жизней. Ведь на данный момент все еще не существует простого анализа крови, который может обнаружить активную инфекцию, и который можно сдавать больше одного раза в год, чтобы с бóльшей долей вероятности диагностировать туберкулез на ранней стадии.
Первую версию игры Eterna запустили 7 лет назад для того, чтобы позволить обыкновенным людям, не имеющим отношения к миру науки, создать потенциально полезные биомолекулы. Такие молекулы должны быть достаточно стабильны, чтобы функционировать внутри клеток. За прошедшие годы вчерашние простые геймеры все больше узнавали эту область, становясь параллельно экспертами в построении сложных молекул. Более того, некоторые из них стали даже соавторами научных работ в области молекулярной биологии.
Заключение
К сожалению, несмотря на всю вышеописанную работу ученых, и активный поиск решения проблемы борьбы с туберкулезом, на сегодняшний день эта болезнь все еще не побеждена. Но, из всего сказанного мы можем прийти к выводу: несмотря на то, что палочка Коха пока что успешно сопротивляется, ученые придумали и продолжают придумывать новые средства, которые должны стать стеной на страже нашего здоровья, заменить уже знакомые нам. Помогут ли новые технологии в борьбе против туберкулеза? Безусловно, да. Все говорит о том, что ученые медленно, но верно приближаются к тому, чтобы выполнить программу ВОЗ по искоренению туберкулеза. И когда эти и другие средства выйдут за пределы лабораторий, то можно будет с полной уверенностью сказать: «Туберкулез побежден!». Это лишь вопрос времени.
Источник