Народные средства лечения метаплазии желудка
Рак желудка остается одним из самых распространенных заболеваний в мире. Ежегодно регистрируется почти 800 тыс. новых случаев и 628 тыс. смертей от этого заболевания. В числе стран-«лидеров» находится и Россия. Заболеваемость данным видом новообразований значительно возрастает в возрасте после 50 лет, т.е. у лиц пожилого и старческого возраста. Вероятность возникновения опухоли у мужчин в 2 раза выше, чем у женщин [1–3, 5].
Проведенными клиническими исследованиями было достоверно доказано, что риск возникновения злокачественного образования в здоровом желудке крайне низок. Более 99% больных с раком желудка до постановки этого диагноза имели различные предраковые заболевания. Наиболее распространенные предраки – это хронический атрофический гастрит, язва желудка , полипы желудка. Кроме того, к предопухолевым заболеваниям желудка относят метаплазии и дисплазии II, III степеней. Все эти заболевания, постепенно развиваясь, повышают риск развития злокачественного образования [6, 7].
Лечение рака желудка на сегодняшний день основывается на комплексном подходе. Наряду с хирургической тактикой и лучевой терапией используется консервативное ведение больных с предраковыми заболеваниями желудка и раком желудка. При этом социальное положение людей пожилого возраста не позволяет приобретать дорогие препараты, а также использовать дорогостоящие эндоскопические операции.
Цель работы
Разработать эффективный и безопасный фитотерапевтический метод лечения больных пожилого и старческого возраста, способствующий регрессии предраковых и ранних стадий злокачественных образований желудка; на примере состояния липидного метаболизма доказать отсутствие отрицательного его влияния на организм в целом.
Материалы и методы исследования
Клинико-лабораторные исследования проведены у 58 больных возрастом от 60 до 89 лет с различными предраковыми заболеваниями желудка. Больные были разделены на 2 группы. Первая группа (группа сравнения) – больные (n=16), которым после обнаружения изменений в слизистой оболочке желудка проводилась симптоматическая терапия (они отказывались от какого-либо другого лечения). Пациентам второй группы (основная группа) (n=42) назначалось комбинированное терапевтическое лечение. Средний возраст обследуемых в первой группе составлял 62,3±5,4 лет, во второй – 63,7±4,9 года. Полипы желудка в первой группе больных диагностированы у 7 мужчин (из них аденоматозные – у 2, гиперплазиогенные – у 5 больных) и 3 женщин (из них аденоматозные – у 1, гиперплазиогенные – у 2 больных), дисплазии III степени – у 4 больных (1 мужчина, 3 женщины), доброкачественные подслизистые опухоли – у 2 пациентов (1 мужчина, 1 женщина). Полипы желудка во второй группе больных диагностированы у 11 мужчин (из них аденоматозные – у 3, гиперплазиогенные – у 8 больных) и 22 женщин (из них аденоматозные – у 13, гиперплазиогенные – у 9 больных), дисплазии III степени – у 5 больных (3 мужчины, 2 женщины), ранние раки – у 4 больных (4 женщины).
При подтверждении предракового заболевания желудка (метаплазии, дисплазии) больным предлагалось комбинированное лечение в несколько этапов.
I этап направлен на ликвидацию раздражающего фактора, эрадикацию геликобактер пилори, состоял из двух антибактериальных препаратов: кларитромицина 500 мг 2 раза в день и метронидазола 250 мг 3 раза в день с добавлением препарата висмута – викаира по 1 т. 3 раза в день (предпочтение викаиру отдавалось из-за дешевизны: он дешевле Де-Нола в десятки раз). С целью эрадикации геликобактер пилори длительность лечения составляла 7–8 дней. Микроорганизмы в ряде случаев по-прежнему оставались на слизистой оболочке, но количество их значительно уменьшалось. Это отмечалось визуально по интенсивности окраски геликотест-полосок, а также при микроскопическом исследовании. При дуоденогастральном рефлюксе назначали антирефлюксные препараты, в частности церукал, мотилиум в таблетированном или в инъекционном виде. Одновременно с антибактериальными препаратами назначался настой чистотела большого по 2 ст. л. 3 раза в день за 40 мин до еды лежа 15 мин 7 дней.
II этап: настойка золотого уса по 1 ч. Л. 3 раза в день за 40 мин до еды 18–20 дней.
III этап: настой чистотела большого по 2 ст. л. 3 раза в день за 40 мин до еды 3 недели.
IV этап: настойка золотого уса по 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели.
Настой чистотела большого и настойка золотого уса приготавливались по рецепту, их дозировка была щадящей для организма человека (патент на изобретение № 2467758 от 27.11.2012 г.) [4].
Научные исследования проводились при информированном согласии больного согласно международным требованиям ВОЗ (правила GCP – Good Clinical Practice), предъявляемым к медицинским исследованиям с участием человека (Женева, 1993).
Больным проводилось эндоскопическое обследование верхних отделов желудочно-кишечного тракта. Использовалось эндоскопическое оборудование: эзофагогастрофиброскопы японских фирм «Olympus»-Gif-E и «Pentax» PG-29P, для взятия биопсийного материала применялись биопсийные щипцы. При подозрении на предраковое заболевание желудка обязательно производилась биопсия. Биоптат помещался в 10%-ный раствор формалина. Также производился забор (биопсия) тканей на микрофлору желудка биопсийными щипцами. Для оценки микрофлоры в момент эндоскопии брались два кусочка тканей со слизистой оболочки средней трети и антрального отдела желудка. Определяли геликобактер пилори (Нр) и дрожжеподобный мицелий. Нр оценивался и по геликотесту с помощью специальных тест-полосок. Гистологические исследования проводились в патологоанатомических отделениях Республиканской клинической больницы № 4 г. Саранска и в Республиканском онкологическом диспансере.
Методы исследования
Больным выполняли общеклинические и биохимические исследования. Биохимические анализы крови больным проводились до и после комбинированного лечения в динамике с целью определения возможного токсического воздействия разработанной лечебной схемы на организм.
Оценивали состояние липидного обмена в плазме крови. Липиды из плазмы крови экстрагировали хлороформметаноловой смесью (Хиггинс Дж. А., 1990). Липиды фракционировали методом тонкослойной хроматографии (Хиггинс Дж. А., 1990; Vaskovsky V.E. et al., 1975). Молекулярный анализ проводили на денситометре Model GS-670 (BIO-RAD, США) с соответствующим программным обеспечением (Phosphor Analyst/PS Sowtware). Контрольные сроки оценки биохимических показателей и показателей липидного обмена: до лечения, 5-е, 10-е, 15-е, 30-е сутки в процессе лечения.
Полученные цифровые экспериментальные данные обработаны методом вариационной статистики с использованием t-критерия Стьюдента и χ2.
Результаты исследования и их обсуждение
Проведенные исследования показали, что чаще предраковые заболевания локализуются в антральном отделе желудка (31 (73,8%) больной), реже (11 (26,2%) больных) – в верхней трети тела или свода желудка по данным эндоскопической диагностики. Макровизуальная эндоскопическая картина слизистой оболочки желудка определялась в виде ее истончения, на фоне которой могли быть гиперплазии разных оттенков или разной высоты, протрузии, полипы, дефекты в виде эрозий или язвенных поражений.
У всех обследованных больных, как в основной группе, так и в группе сравнения, на тест-полосках определялся геликобактер пилори. При микроскопическом исследовании же Нр не всегда (12 (28,6%) больных) регистрировался визуально. В ряде случаев (19 (42,5% больных) геликобактер пилори в пищеводе в количественном отношении определялся больше, чем в желудке.
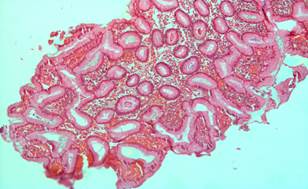
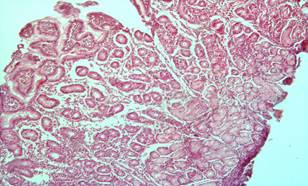
По данным эндоскопических исследований желудка после первого сеанса комбинированного терапевтического лечения в 32 (76,2%) наблюдениях у больных основной группы полипы исчезали полностью, в остальных – уменьшались в размерах. Дисплазии тяжелой степени (III степени), а также ранние стадии злокачественных образований регрессировали после одного сеанса лечения. Это подтверждалось и при гистологических исследованиях. В биоптатах микроскопически не обнаруживалась патологическая картина в виде аденоматозных или гиперпластических полипов, дисплазий, а также аденокарцином. Подчеркнем, что после трех сеансов комбинированной терапии полипы до 2,0 см высотой полностью регрессировали (рис. 1, 2).
Клинические примеры приведены ниже.
Больная П., 62 лет. 4.05.07г. жалобы на тяжесть в эпигастрии, отрыжку воздухом. ЭГДФС: Полушаровидный полип (0,8×0,8см) большой кривизны середины тела желудка. Смешанный гастрит. Дуоденит. НР (+++). Микроскопия от 7.05.2007 г.: аденоматозный полип слизистой желудка с признаками полиморфизма желез, осклизнением эпителия, очагами поверхностных эрозий и элементами грубой интестинальной перестройки. Лечение: I этап — Пилобакт 1 полоска утр., 1 полоска на ночь 7 дней, чистотел большой по 2 ст. л. 3 раза в день за 40 мин до еды 7 дней. II этап — золотой ус 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели. III этап — чистотел большой по 2 ст. л. 3 раза в день за 40 мин до еды 3 недели; IV этап – золотой ус 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели.ЭГДФС: Регрессия полипа. Субатрофический гастрит. НР (+) с антрального отдела желудка. Микроскопия от 9.08.2007 г.: слизистая желудка с признаками очаговой атрофии желёз, слабовыраженной полиморфноклеточной инфильтрацией в строме.
Больная М., 60 лет. Жалобы на тошноту после еды и тяжесть в эпигастрии. 12.05.2009 г. ЭГДФС: Афтозные гиперплазии антрального отдела (эрозии до 0,2 см, гиперемированные гиперплазии до 0,7 см) желудка. Смешанный гастрит. Поверхностный дуоденит. Дуоденогастральный рефлюкс. НР (+++). Микроскопия от 17.05.2009 г.: картина гиперпластического полипа желудка. Лечение: I этап — Викаир по 1 таб. 3 раза в день, метронидозол по 1 таб. 3 р. за 30 мин. до еды 7 дней, Чистотел большой по 2 ст. л. 3 раза в день 7 дней. II этап — золотой ус 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели. III этап — чистотел большой по 2 ст. л. 3 раза в день за 40 мин до еды 3 недели; IV этап – золотой ус 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели. 16.10.2009 г.: жалоб нет. ЭГДФС: Полная регрессия полипа. Атрофический гастрит. Микроскопия от 16.10.2009 г.: фрагмент слизистой желудка с диффузной умеренно выраженной воспалительной инфильтрацией в строме.
Рис. 1. Фрагменты гиперпластического (аденоматозного) полипа слизистой желудка (до лечения).
Окраска гематоксилин эозином. × 200
Рис. 2. Фрагменты слизистой желудка с признаками гиперплазии отдельных желёз, участками атрофии желёз, полиморфноклеточной инфильтрацией в строме (после лечения). Окраска гематоксилин эозином. × 200
Эндоскопический контроль в отдаленном периоде (до 5 лет) удалось провести 34 (81,0%) больным. Рецидивов не выявлено ни в одном случае.
Положительный эффект терапии выражался и в том, что на ее фоне не отмечались существенные расстройства гомеостаза, подтвержденные биохимическими исследованиями. В биохимических показателях крови до лечения и после проведенного комбинированного лечения по специальной схеме не было значительных отклонений от нормы. Общее состояние больных при проведении терапии и после нее не страдало, а в конце терапии субъективно отмечалось улучшение состояния.
В патогенезе различных заболеваний, в том числе и предопухолевой патологии, значительную роль играют нарушения липидного обмена, что обусловлено важностью липидов в молекулярной организации и функционировании живых структур. Проведенные нами исследования показали, что предопухолевые заболевания желудка тесно сопряжены с липидными дестабилизациями в плазме крови (табл. 1).
Содержание некоторых липидов в плазме крови (M±m)
Источник
Абляция очагов при пищеводе Барретта
Пищевод Барретта – это патологическое состояние, при котором плоский эпителий нижней трети пищевода замещен метапластическим цилиндрическим эпителием. Пищевод Барретта является серьезным осложнением гастроэзофагеальной рефлюксной болезни (ГЭРБ), официально доказанным предраковым состоянием, которое может приводить к развитию злокачественной опухоли пищевода.
Диагностировать данное заболевание можно при эндоскопическом исследовании с проведением биопсии.
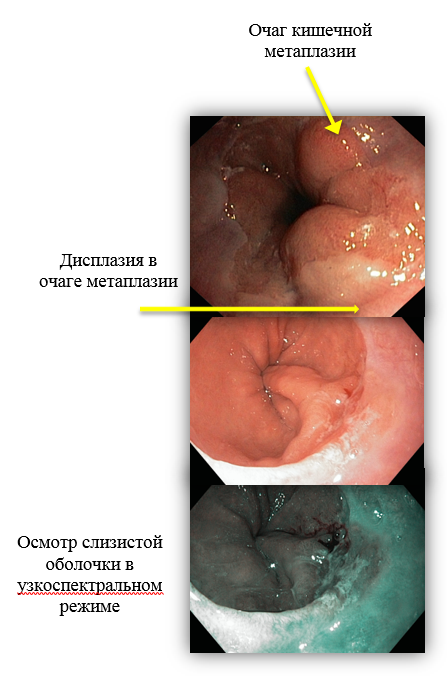
Специалисты отделения эндоскопии НИИ онкологии им. Н.Н.Петрова придерживаются позиции, согласно которой для постановки диагноза «пищевод Барретта» необходимо обнаружение кишечной метаплазии в биоптатах, т.к. только неполная кишечная метаплазия в дистальном отделе пищевода предрасполагает к развитию дисплазии и повышает риск возникновения рака пищевода в 30-125 раз.
При обнаружении очагов метаплазии перед врачами-эндоскопистами ставится важная диагностическая задача – выполнить тщательный прицельный осмотр слизистой для выявления участков с нерегулярным рельефом и сосудистым рисунком, которые свидетельствуют о возникновении дисплазии различной степени тяжести или аденокарциномы. Такой подход позволяет произвести забор биоптатов прицельно, а не случайным образом, что повышает диагностическую ценность и снижает вероятность ошибки в обнаружении рака.
Для решения этих задач требуется оснащение эндоскопического отделения современным оборудованием и применение современных уточняющих методик осмотра слизистой оболочки.
- На отделении эндоскопии НИИ онкологии им. Н.Н.Петрова обследование пациентов выполняется с использованием эндоскопических стоек Olympus Evis Exera серии II и III, эндоскопов Olympus H-180AL и HJ-180AL.
- В качестве уточняющих методик осмотра слизистой мы используем хромоскопию (прижизненное окрашивание слизистой) с 1,5% р-м уксусной кислоты, а также виртуальную хромоскопию, которая заключается в осмотре слизистой в особом узкополосном световом режиме (NBI). Это позволяет детализировать структуру слизистой и увидеть изменения рельефа размером менее 1 мм.
- Мы используем общепринятый стандартизованный международный протокол описания этого патологического состояния, используя Пражские критерии. Забор биоптатов мы проводим в соответствии с официально принятым Сиетловским протоколом: слепая 4-х-квадрантная биопсия через каждый 1 см поверхности цилиндроклеточной метаплазии, а также прицельная биопсия из всех видимых патологически измененных участков слизистой.
Лечение пациентов с пищеводом Барретта
Принятая в НИИ онкологии им. Н.Н.Петрова тактика лечения и последующего динамического наблюдения пациентов с цилиндроклеточной метаплазией основана на рекомендациях Британского общества гастроэнтерологов по диагностике и лечению пищевода Барретта (2014 г) и Американской Гастроэнтерологической Ассоциации.
Все пациенты с метаплазией в нижней трети пищевода получают курс комплексной антирефлюксной терапии длительностью 4-8 недель, включающий в себя:
- регламентацию образа жизни (исключение физических перегрузок, последний прием пищи не позднее, чем за 3 часа до сна, частое дробное питание)
- диету (исключение острой, солёной, жареной пищи, газированных напитков и т.д.)
- медикаментозную антисекреторную терапию (ингибиторы протоновой помпы по 20 мг 2 раза в день), прокинетики и обволакивающие препараты.
Тактика лечения зависит прежде всего от результатов гистологического исследования материала, взятого из участков метаплазии, а также от протяженности сегмента метаплазии:
- Пациентам с цилиндроклеточной метаплазией протяженностью менее 3 см, без кишечной метаплазии и дисплазии рекомендуется курсовое медикаментозное лечение для коррекции причины заболевания – желудочно-пищеводного рефлюкса. Наблюдение не требуется. ЭГДС проводится с периодичностью 1 раза в 2-3 года.
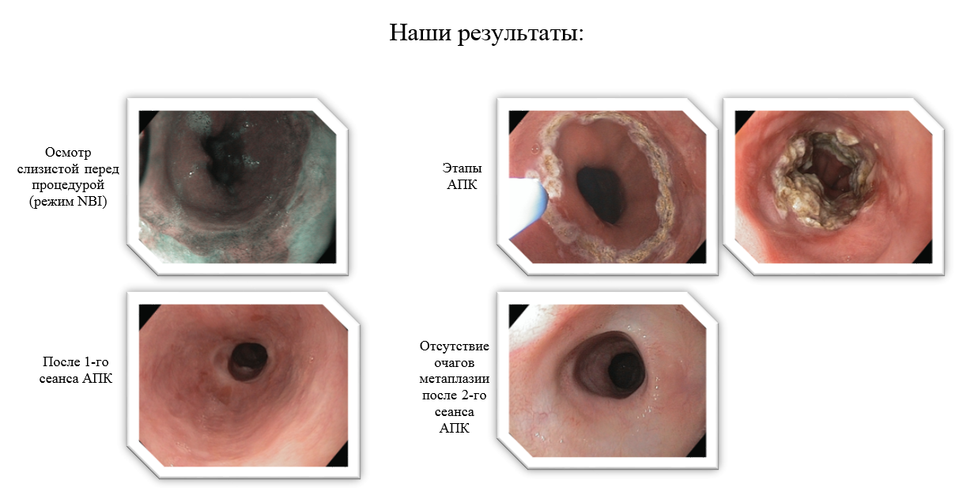
- Пациентам с цилиндроклеточной метаплазией (без кишечной метаплазии) протяженностью сегмента 3 см и более, а также пациентам с доказанным пищеводом Барретта (без дисплазии по результатам двухкратной биопсии) вне зависимости от протяженности сегмента, мы рекомендуем выполнить аргоноплазменную абляцию очагов метаплазии.
- В отношении пациентов с пищеводом Барретта и выявленной дисплазией низкой степени тяжести мы применяем активную тактику лечения, которая заключается в эндоскопической резекции метаплазированного участка слизистой. Это позволяет снизить риск развития дисплазии высокой степени и аденокарциномы пищевода на 25% по сравнению с эндоскопическим наблюдением за 3-летний период.
- Пациенты с пищеводом Барретта и дисплазией высокой степени рассматриваются как пациенты с подтвержденным ранним раком кардиоэзофагеального перехода и подлежат оперативному лечению методом эндоскопической диссекции в подслизистом слое.
Аргоноплазменная абляция очагов метаплазии
Это метод разрушения участков изменённой слизистой оболочки с помощью тока высокой частоты, который передается на слизистую бесконтактным способом — через ионизированный электропроводящий газ аргон, а точнее, аргоновую плазму.
Аргоноплазменная абляция может осуществляться 2-мя способами:
- Традиционным способом является аргоноплазменная коагуляция очагов метаплазии слизистой с помощью стандартного АПК-зонда. Выходящая из отверстия зонда струя плазмы образует на дистальном конце аргоновое облако, которое ионизируется подаваемым высокочастотным напряжением в несколько тысяч вольт до возникновения между наконечником зонда и поверхностью ткани аргоноплазменной дуги. По этой дуге энергия тока высокой частоты бесконтактно передается на подлежащий коагуляции участок ткани. Контролируемая глубина проникновения тепловой энергии составляет не более 3 мм, что исключает риск повреждения глубоких слоев стенки пищевода. При необходимости данная процедура выполняется несколько раз до достижения полной абляции очагов метаплазии.
- В европейских клиниках всё более распространённым становится гибридный метод аргоноплазменной коагуляции. С 2015 года он успехом стал применяться и на отделении эндоскопии НИИ онкологии им. Н.Н.Петрова.
С помощью гибридного водоструйного зонда (HybridAPC, «ERBE», Германия) выполняется инъекция физиологического раствора в подслизистый слой, далее этим же инструментом выполняется абляция метаплазированного эпителия. С помощью пластикового колпачка, предварительно монтированного на дистальном конце эндоскопа, выполняется очищение поверхности от образовавшегося струпа. При этом более отчетливо выявляются участки метаплазии, не подвергшиеся абляции. После чего производится дополнительная абляция этих очагов. Преимущество комбинированного метода перед стандартным в том, что вводимая в подслизистый слой жидкость защищает мышечный слой от термического воздействия. Это позволяет проводить аргоноплазменную коагуляцию на достаточно глубоком уровне и при большей мощности. Дальнейшее повреждение мышечной ткани, а также риск стриктуры будут исключены. Процедура может выполняться несколько раз, пока не будет достигнуто полное удаление очагов метаплазии.

Эндоскопическое лечение сопровождается антисекреторной терапией с помощью ингибиторов протоновой помпы для эффективного и быстрого заживления дефектов слизистой оболочки и создания условий для появления в этих зонах многослойного плоского эпителия пищевода.
Подготовка к процедуре
Процедура аргоноплазменной абляции очагов метаплазии проводится строго натощак, полностью исключается прием пищи за 12 часов и жидкости за 6 часов до начала процедуры
Необходима отмена пероральных антикоагулянтов (препаратов для разжижения крови) накануне исследования, пауза п/к введения гепарина за 4-6 часов до процедуры
Процедура абляции может быть выполнена под внутривенной анестезией. Если исследование будет проводиться под наркозом, прием любого количества жидкости до процедуры строго воспрещен. Управление транспортным средством после окончания исследования является нежелательным и может представлять угрозу для жизни и здоровья.
Источник