Народные обезболивающие средства при онкологии 4 стадии
Интенсивность боли определяет больной, а не его родственники.
Для оценки эффективности лечения рекомендуется ведение дневника боли с фиксированием даты, времени приема, дозы, пути введения, продолжительности действия и побочных эффектов.
Ступень 1. Лечение слабой боли начинают с нестероидных противовоспалительных средств, которые продаются в любой аптеке без рецепта врача. Препараты подбираются с учетом противопоказаний и индивидуальной переносимости больного. Чем эффективнее лекарство снимает боль, тем вреднее оно для желудка, поэтому при высоком риске гастропатии одновременно рекомендуется омепразол или нольпаза.
Ступень 2. Лечение боли умеренной интенсивности.
На этом этапе к максимальной дозе нестероидного противовоспалительного препарата добавляется минимально эффективная доза трамадола в таблетках. Постепенно доза трамадола увеличивается до 400 мг в сутки (по 50 мг до 8 раз в день или по 100 мг 3-4 раза в день), а таблетки меняются на внутримышечные инъекции по 100 мг 4 раза в сутки каждые 6 часов. Обезболивающее действие наступает через 30-40 минут после приема таблетки или через 5-10 минут после внутримышечной инъекции. Длительность действия от 4 до 6 часов.
Побочные действия. Трамадол часто вызывает тошноту с рвотой, запоры и сонливость. При тошноте и рвоте таблетки можно заменить на инъекции.
Медикаментозная коррекция побочных эффектов такая же, как и при обезболивании на 3 ступени (см. ниже).
Взаимодействие с другими препаратами:
Транквилизаторы, седативные средства взаимно потенцируют эффекты.
Осторожность необходима при одновременном назначении с нейролептиком, антидепрессантом, карбамазепином. Нельзя вводить в одном шприце с диклофенаком, реланиумом.

Комбинации снижают болевой синдром меньшей дозой трамадола и позволяют как можно дольше задержаться на 2 ступени обезболивающей лестницы. При грамотном обезболивании потребность в наркотических анальгетиках можно значительно отсрочить.
При умеренной боли вместо трамадола врач может назначить пластырь дюрагезик 12,5 мкг/час или таргин в таблетках в дозе 2,5 мг/5 мг
Ступень 3. Лечение сильной боли.
На наркотическую ступеньку следует переходить только при неэффективной комбинации 400 мг трамадола с адъювантными анальгетиками. Опиоидные анальгетики намного сильнее по обезболивающему действию, но и страшнее по побочным эффектам. А вот обратно вернуться на 2 ступень будет невозможно!
Промедол или морфин выписываются на специальных рецептурных бланках строгой отчетности. С 1 июля 2015 года законодательно изменился порядок выписки таких рецептов:
- Выписать рецепт имеет право участковый терапевт, а не только онколог.
- Не нужна справка из онкодиспансера о необходимости симптоматической терапии.
- Рецепт действителен не 5, а 15 дней.
- В одном рецепте можно выписать в 2 раза большее количество препарата перед длинными праздниками или при отъезде онкобольного.
- Врач имеет право выписать рецепт на дому, в поликлинике лично больному или его родственнику.
- Не нужен полный возврат пустых ампул и других использованных упаковок для выписки нового рецепта.
Источник
Народные обезболивающие средства при онкологии 4 стадии
Снятие боли — чрезвычайно важный аспект лечения рака. Раковая боль может возникать внутри, тогда она нередко плохо локализована и изменчива; в костях и конечностях (например, при костных метастазах),тогда она постоянна и локализована; и нередко обостряться ночью, или «стрелять», при нервных расстройствах. Чаще всего пациенты имеют более чем одну причину боли.
Первый шаг в лечении — сделать аккуратную клиническую оценку боли, которую пациент испытывает, и определить ее очаг, степень и продолжительность. При определении главных проблем и наблюдении прогрессирования боли во времени полезно использовать график оценки боли.
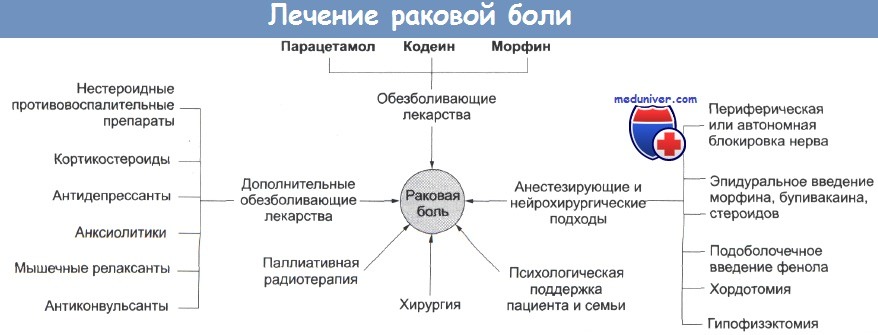
Не существует идеального анальгетика, и большинству пациентов в течение болезни требуются лекарства разной силы и дозы. Довольно удобно разделять анальгетики на три класса, в соответствии с силой их действия.
1. Легкие анальгетики. В эту группу входят аспирин, парацетамол и нестероидные противовоспалительные препараты. Они полезны для лечения в длительные периоды времени. Аспирин и нестероидные противовоспалительные препараты (такие как индометацин, ибупрофен) особенно полезны при боли в костях.
Побочные эффекты включают в себя диспепсию (расстройство пищеварения) и внутренние кровотечения в желудочно-кишечном тракте. Анальгетики этой группы комбинируют с веществами из более сильнодействующих классов (например, аспирин в комбинации с таблетками папаверетума (омнопона)). Недавно стали доступны внутривенные введения парацетамола, приводящие к более высокой пиковой концентрации этого препарата в плазме по сравнению с пероральным приемом и более ярко выраженному обезболивающему эффекту, сравнимому, как утверждается, с эффектом 10 мг морфина, введенного внутримышечно.
2. Умеренные анальгетики включают кодеин, оксикодон, пентазоцин и дипипанон. Эти вещества более эффективны, чем легкие анальгетики, но обладают большими побочными действиями, в частности вызывают запор. Декстропропоксифен иногда используется в комбинации с парацетамолом, но этот препарат (копроксамол) недавно был снят с рынка в Великобритании.
Оксикодон чрезвычайно ценен, так как доступен в виде свечей. Пентазоцина следует избегать — он часто вызывает галлюцинации. Частично его эффект ослабляет действие морфина, и поэтому он не рекомендуется к применению в комбинации с опиатами.
3. Сильные анальгетики. Эти вещества, включающие в себя морфин и синтетические аналоги (синтетические и полусинтетические производные), обладают мощным болеутоляющим действием и являются главной опорой обезболивающей терапии для пациентов с беспрестанной болью. Они повторяют действие эндогенных медиаторов в мозге, известных как опиоидные пептиды.
Почти все пациенты с серьезной раковой болью требуют регулярного приема анальгетиков этого типа. Полезные агенты включают в себя аналоги морфина, такие как диаморфин, морфин и кодеин; производные фенилпиперидина, такие как метадон, петидин, фентанил и экстропропоксифен; производные тебаина, такие как бупренорфин; и бензоморфаны, например пентазоцин. Обычный морфин и диаморфин активны только в течение четырех часов и должны приниматься каждые четыре часа, но сейчас уже стали доступны таблетки морфин сульфата долгого действия.
Выбор и дозирование опиоидных анальгетиков должны определяться из потребностей пациента. Например, многие больные чувствуют себя комфортно и избавляются от боли при регулярных малых дозах (10-20 мг каждые 4 ч) морфина или диаморфина, в то время как другим требуется доза в 20 раз выше. Существуют другие препараты с широким диапазоном применяющихся доз, что является следствием различной степени фармакологической толерантности, которая очень быстро развивается.
Для большинства пациентов пероральный прием лекарств является подходящим и эффективным, хотя абсорбция проходит медленно, и различается для разных лекарств. Для пациентов с, например, полным разрушением от рака глотки или пищевода подойдет альтернативный прием лекарств. Подъязычный бупренорфин может быть полезной альтернативой, но он ухудшает влияние морфина и поэтому не должен ни внезапно заменяться морфином, ни приниматься с ним совместно. Лечение ректальными свечами оксикодона или морфина может быть высокоэффективным.
В очень редких случаях, если и пероральный, и ректальный прием лекарств недоступны, свечи могут даваться вагинально.
Изредка необходимо регулярное внутривенное лечение опиатами. Подкожные или внутривенные введения диаморфина полезны, если введение препарата другими способами оказывается неудовлетворительным. Диаморфин предпочтительнее благодаря своей высокой растворимости, что позволяет использовать малые объемы при инъекции. Использование анальгетиков «по требованию» может позволить пациенту легче контролировать снятие боли. Очень редко регулярное эпидуральное применение морфина может быть необходимо для снятия серьезной, локализованной боли, но такое лечение не должно рассматриваться как длительное до тех пор, пока другие способы регулярного приема опиатов не будут опробованы.
Длительный прием морфина, доступного в таблетках, — очень важное пополнение семейства опиатов. Так как и морфин, и диаморфин должны приниматься часто в течение дня, доступность морфина длительного действия имеет большое значение, особенно для активного пациента. Когда в лечении происходит переход от диаморфина к морфину длительного действия, соотношение доз диаморфина к морфину должно быть 2:3, поэтому пациенту, принимающему, скажем, диаморфин 20 мг каждые 4 ч (полная ежедневная доза составляет 120 мг), будет требоваться ежедневно 180 мг морфина или морфина длительного действия 90 мг дважды в день. Гидроморфон НС1, полусинтетическое опиоидное производное, может быть полезным при лечении пациента с аллергией на морфин, и доступен в виде препаратов, которые долго высвобождаются (принимать каждые 12 ч).
Трансдермальные наклейки фентанила (полусинтетического опиоида) при начальной дозе 25 мг/ч (для пациента, который раньше не принимал опиоиды) или соответствующей дозе для пациентов, принимающих морфин, могут предложить хороший контроль над болью с меньшей вероятностью запора, тошноты и сонливости в течение дня, а также более полезны для пациентов с тошнотой.
Все пациенты, которые лечатся регулярным приемом опиоидов, нуждаются в советах, как избежать запоров. Регулярный прием слабительных обычно (но не всегда) необходим в данной ситуации, и такие лекарства могут даваться в дозах, превышающих нормальные. Довольно эффективен регулярный прием дантрона в комбинации с долоксамером (или капсул). Стандартная ежедневная доза, составляющая 10-15 мл (или от одной до трех капсул), в разделенных ежедневных дозах, может быть недостаточной для пациентов, принимающих большие дозы морфина, и в таком случае допустима более сильная смесь. К другим важным, но менее стойким побочным действиям опиоидных анальгетиков относятся тошнота, рвота и безразличие.
Хотя безразличие обычно исчезает со временем, тошнота может сохраняться и требует лечения. Галоперидол также эффективен, как циклизин, хотя фенотиазины обладают большим успокаивающим эффектом.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Эффективное обезболивание в онкологии
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
МГМСУ им. Н.А. Семашко
Е жегодно в мире от злокачественных опухолей умирает 7 млн. человек, из них более 0,3 млн. – в России. Считается, что около 40% больных с промежуточными стадиями процесса и 60–87% с генерализацией заболевания страдают от болевого синдрома различной выраженности. У значительной части этих пациентов болевой синдром отчетливо проявляется лишь на поздних стадиях заболевания, когда специфическое лечение невозможно. Несмотря на однозначный прогноз, больной нуждается в адекватном обезболивании с целью предотвращения действия боли на физическое, психическое и моральное состояние пациента и как можно более долгого сохранения его социальной активности.
Боль у онкологического больного может быть обусловлена непосредственным распространением опухоли (75% случаев), противоопухолевым лечением (20% случаев), в остальных случаях она вообще не связана с опухолевым процессом или противоопухолевым лечением. К настоящему времени достигнут значительный прогресс в обезболивании онкологических больных, однако даже на терминальной стадии они нередко не получают адекватной помощи.
Трудности ведения этих пациентов обусловлены сложностью оценки боли, нежеланием больных принимать обезболивающие препараты, недостаточной доступностью наркотических анальгетиков, а также отсутствием у медицинских работников навыков по купированию болевого синдрома у онкологических больных. Пациенты, находящиеся на амбулаторном лечении, нуждаются в постоянном контроле для коррекции обезболивающей терапии, профилактики и устранения побочных эффектов анальгетиков. В каждом конкретном случае должны определяться и, при необходимости, корректироваться оптимальные дозы препаратов и интервалы между их введением, обеспечивающие стабильное, непрерывное обезболивание.
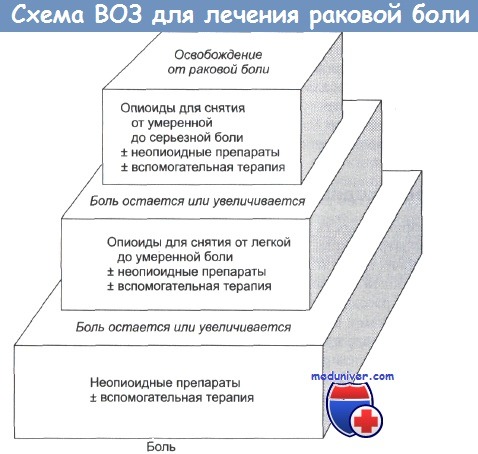
Фармакотерапию нарастающего хронического болевого синдрома начинают с ненаркотических анальгетиков и переходят, при необходимости, сначала к слабым, а затем к сильным опиатам по трехступенчатой схеме, рекомендованной Комитетом экспертов ВОЗ в 1988 г.:
1. Ненаркотический анальгетик + адъювантные средства.
2. Слабый опиоид типа кодеина + ненаркотический анальгетик + адъювантные средства.
3. Сильный опиоид (опиаты) группы морфина + ненарктотический анальгетик + адъювантные средства.
Известно, что использование 3–х ступенчатой схемы ВОЗ позволяет достигнуть удовлетворительного обезболивания у 90% пациентов (Enting R.H. et al., 2001). Болевой синдром малой или умеренной интенсивности обычно устраняется ненаркотическими анальгетиками и их комбинацией с адъювантными средствами, в то время как для купирования сильной и нестерпимой боли используют наркотические анальгетики.
При проведении обезболивающей терапии важно соблюдение следующих основных принципов:
1. Дозу анальгетика подбирают индивидуально в зависимости от интенсивности и характера болевого синдрома, добиваясь устранения или значительного облегчения боли.
2. Назначать анальгетики строго «по часам», а не «по требованию», вводя очередную дозу препарата до прекращения действия предыдущей для предупреждения появления боли.
3. Анальгетики применяют «по восходящей», то есть от максимальной дозы слабодействующего опиата к минимальной дозе сильнодействующего.
4. Предпочтительно применение препаратов внутрь, использование подъязычных и защечных таблеток, капель, свечей, пластыря (фентанил).
Лечение начинают с применения ненаркотических анальгетиков. Применяют анальгетики–антипиретики (парацетамол) и нестероидные противовоспалительные средства (НПВП) – салицилаты (ацетилсалициловая кислота), производные пропионовой кислоты (ибупрофен, напроксен), производные индол/инден уксусных кислот (индометацин, диклофенак), оксикамы (пироксикам, мелоксикам, лорноксикам) и др. (Ladner E. et al., 2000). Ненаркотические анальгетики действуют путем подавления синтеза простагландинов; при их использовании имеется потолок анальгезии – максимальная доза, при превышении которой не происходит усиления анальгезирующего эффекта. Препараты используются для устранения легкой боли, а также в комбинации с наркотическими анальгетиками при умеренной и сильной боли. НПВП особенно эффективны при боли, вызванной метастазами в кости. У пациентов с высоким риском осложнений со стороны желудочно–кишечного тракта (возраст старше 65 лет, заболевания желудочно–кишечного тракта в анамнезе, сочетанный прием НПВП и глюкокортикоидов и др.) применяют мизопростол в дозе 200 мг 2–3 раза в сутки или омепразол в дозе 20 мг в сутки.
К адъювантным средствам относят препараты, обладающие собственными полезными эффектами (антидепрессанты, глюкокортикоиды, противовоспалительные средства), препараты, корректирующие побочные эффекты наркотических анальгетиков (например, нейролептики при тошноте и рвоте), усиливающие их анальгетическое действие – например, клонидин, антагонисты кальция (Goldstein F.J. 2002, Mercadante S. et al., 2001). Эти лекарственные средства назначают по показаниям: в частности, трициклические антидепрессанты и антиконвульсанты показаны при нейропатической боли, дексаметазон – при повышенном внутричерепном давлении, боли в костях, прорастании или сдавлении нервов, компрессии спинного мозга, растяжении капсулы печени. Следует, однако, отметить, что эффективность адъювантных средств еще должна быть доказана. Так, Mercadante S. et al. (2002) не выявили влияния амитриптилина на интенсивность болевого синдрома, потребность в наркотических анальгетиках и качество жизни у 16 онкологических пациентов с нейропатической болью.
На второй ступени для устранения нарастающей боли используют слабые опиаты – кодеин, трамадол (разовая доза 50–100 мг каждые 4–6 ч; максимальная суточная доза 400 мг). К преимуществам трамадола относят наличие нескольких лекарственных форм (капсулы, таблетки–ретард, капли, свечи, раствор для инъекций), хорошую переносимость, небольшую по сравнению с кодеином вероятность возникновения запоров, наркологическая безопасность. Применяют также комбинированные препараты, представляющие собой комбинацию слабых опиоидов (кодеин, гидрокодон, оксикодон) с ненаркотическими анальгетиками (ацетилсалициловая кислота). Комбинированные препараты имеют потолочный эффект, привносимый их ненаркотическим компонентом. Прием препаратов осуществляют каждые 4–6 часов.
На третьей ступени лестницы, в случае сильной боли или боли, не отвечающей на предпринимаемые меры, назначают наркотические анальгетики, способные обеспечить эффективную анальгезию, – пропионилфенилэтоксиэтилпиперидин гидрохлорид, морфин, бупренорфин, фентанил. Эти препараты действуют на ЦНС, они активируют антиноцицептивную систему и подавляют передачу болевого импульса.
При использовании нового отечественного анальгетика пропионилфенилэтоксиэтилпиперидин гидрохлорида в виде защечных таблеток эффект развивается через 10–30 минут, продолжительность анальгезии колеблется от 2 до 6 часов. Начальная суточная доза пропионилфенилэтоксиэтилпиперидин гидрохлорида составляет 80–120 мг (4–6 таб.), спустя 2–3 недели ее увеличивают в 1,5–2 раза. Пропионилфенилэтоксиэтилпиперидин гидрохлорид рекомендуют использовать при неэффективности трамадола.
Морфина сульфат позволяет контролировать интенсивную боль в течение 12 часов. Начальную дозу – 30 мг каждые 12 часов – при необходимости увеличивают до 60 мг каждые 12 часов. При переводе с парентерального приема морфина на пероральный прием дозировка должна быть увеличена. Возможно, применение морфина улучшает у онкологических больных не только качество жизни: определенный интерес вызывают результаты исследования Kuraishi Y. (2001), показавшего в эксперименте, что применение морфина не только улучшает качество жизни, но и тормозит рост опухоли и метастазирование.
Бупренорфин – полусинтетический агонист–антагонист опиатных рецепторов превосходит по анальгетической активности морфин, побочные эффекты менее выражены. При сублингвальном приеме действие начинается через 15 минут и достигает максимума к 35–й минуте, продолжительность анальгезии – 6–8 часов, периодичность приема – через 4–6 ч. Побочные эффекты выражены незначительно, особенно если больной не глотает слюну до полного рассасывания таблетки и в начале терапии соблюдает постельный режим в течение 1 часа после приема разовой дозы. Анальгетический эффект не возрастает после достижения суточной дозы свыше 3 мг.
При возникновении боли на фоне проводимой обезболивающей терапии используют быстродействующие анальгетики. Самым быстрым действием по сравнению с другими препаратами для лечения раковых больных с хроническим болевым синдромом обладает фентанил. Этот препарат отличается достаточно сильным, но кратковременным анальгезирующим эффектом; он не обладает анальгетическим потолком – прогрессивное повышение дозы приводит к дополнительному анальгетическому эффекту.
Помимо внутривенного введения, используют также пластыри с фентанилом, обеспечивающие постепенное высвобождение препарата в течение 3 суток (Muijsers R.B. et al., 2001). Анальгетический эффект развивается через 12 ч после наложения первого пластыря, при выраженном болевом синдроме для обезболивания в этом промежутке времени возможно внутривенное введение фентанила (Kornick C.A. et al., 2001). Стартовая доза фентанила обычно составляет 25 мкг/час. Дозировка подбирается с учетом предшествующих назначений других анальгетиков и возраста пациента – пожилым людям, как правило, требуется меньшая доза фентанила, чем более молодым.
Применение пластырей с фентанилом особенно оправдано у больных с затрудненным глотанием или с плохими венами; иногда пациенты предпочитают пластырь, считая эту лекарственную форму наиболее удобной. Обычно трансдермальный фентанил применяют в тех случаях, когда для купирования болевого синдрома пациенту приходится часто принимать высокие дозы морфина внутрь. В то же время, по данным некоторых авторов, пластыри с фентанилом можно применять и у пациентов с недостаточным эффектом кодеина, т.е. при переходе от второй к третьей ступени обезболивания. Так, Mystakidou K. et al. (2001) применяли с хорошим эффектом пластыри с фентанилом у 130 пациентов, получавших по поводу болевого синдрома 280–360 мг кодеина в сутки и нуждавшихся в назначении сильных наркотических анальгетиков. Начальная доза препарата составила 25 мкг/ч, на третий день пациенты получали в среднем 45,9 мкг/ч, на 56 день – 87,4 мкг/ч. Интенсивность болевого синдрома уменьшилась к третьему дню лечения с 5,96 до 0,83. Только у 9 пациентов лечение пришлось прекратить в связи с недостаточным обезболивающим действием или развитием побочных эффектов.
Самые частые побочные эффекты трансдермального фентанила – запоры (возникающие, однако, реже, чем на фоне перорального приема морфина), тошнота и рвота; наиболее серьезное – гиповентиляция – наблюдается примерно в 2% случаев (Muijsers R.B. et al., 2001).
В таблице 1 представлены препараты, применяемые для лечения болевого синдрома у некурабельных онкологических больных.
К сожалению, болевой синдром, осложняющий онкологическое заболевание, является трудной клинической задачей, и его устранение не всегда укладывается в рамки схемы, разработанной ВОЗ для терапии больных с болевым синдромом. При неэффективности проводимой терапии для достижения адекватного обезболивания возможна смена наркотического анальгетика (эффективна у 50–70% пациентов), перевод пациента на парентеральный путь введения анальгетиков (эффективен у 70–95% больных), при необходимости возможно длительная подкожная инфузия морфина (Enting R.H. et al., 2001).
1. Enting RH, van der Rijt CC, Wilms EB, Lieverse PJ, de Wit R, Smitt PA. [Treatment of pain in cancer with systemically administered opioids]. Ned Tijdschr Geneeskd. 2001, 19;145 (20): 950–4.
2. Goldstein FJ. Adjuncts to opioid therapy. J Am Osteopath Assoc. 2002, 102 (9 Suppl 3):S15–21.
3. Kornick CA, Santiago–Palma J, Khojainova N, Primavera LH, Payne R, Manfredi PL. A safe and effective method for converting cancer patients from intravenous to
transdermal fentanyl. Cancer. 2001, 15; 92 (12): 3056–61.
4. Kuraishi Y. [Effects of morphine on cancer pain and tumor growth and metastasis]. Nippon Rinsho. 2001, 59(9): 1669–74.
5. Ladner E, Plattner R, Friesenecker B, Berger J, Javorsky F. [Non–opioid analgesics –irreplaceable in cancer pain therapy?] Anasthesiol Intensivmed Notfallmed Schmerzther. 2000, 35(11):677–84.
6. Mercadante S, Portenoy RK. Opioid poorly–responsive cancer pain. Part 3. Clinical strategies to improve opioid responsiveness. J Pain Symptom Manage. 2001, 21(4): 338–54.
7. Muijsers RB, Wagstaff AJ. Transdermal fentanyl: an updated review of its pharmacological properties and therapeutic efficacy in chronic cancer pain control. Drugs. 2001, 61(15): 2289–307.
8. Mystakidou K, Befon S, Kouskouni E, Gerolymatos K, Georgaki S, Tsilika E. Vlahos L. From codeine to transdermal fentanyl for cancer pain control: a safety and
efficacy clinical trial. Anticancer Res. 2001, 21(3C): 2225–30.
9. Опухолевые боли – поэтапная схема ВОЗ. Pharmedicum. –1995, Vol.1: 9–11.
Источник





