- Мониторинг побочных лекарственных реакций
- Фармакомониторинг
- Лекарственные средства
- Счетчик обращений граждан и организаций
- Лекарственные средства
- Мониторинг эффективности и безопасности лекарственных препаратов
- Методы повышения выявляемости и структура нежелательных реакций на лекарственные препараты на примере Астраханской области
- Введение
- Материал и методы
- Результаты исследования и их обсуждение
- Выводы
Мониторинг побочных лекарственных реакций
Известно, что лекарства, создаваемые с целью лечения заболеваний, имеют также побочные эффекты, которые могут иногда представлять угрозу для жизни. Не бывает абсолютно безопасных лекарств! Более того, при использовании лекарств в широкой экспозиции могут проявиться различные побочные реакции лекарств (ПРЛ), которые не были зарегистрированы в ходе клинических испытаний, т.к. последние проводятся на ограниченном контингенте больных. Выявление, регистрация и систематический анализ ПРЛ (ФАРМАКОНАДЗОР) необходимы для последующего уточнения показаний, противопоказаний, побочных эффектов, режимов дозирования лекарств и пр.
Согласно статье 17 «Закона о лекарствах» РА «Лечебно-профилактические учреждения, аптеки и учреждения и организации, осуществляющие потребление и применение лекарств, обязаны незамедлительно информировать уполномоченный правительственный орган обо всех случаях развития неизвестных побочных реакций».
Согласно поручению Министерства Здравоохранения, который является уполномоченным правительственным органом, постоянный мониторинг ПРЛ в РА осуществляет Научный центр экспертизы лекарств и медицинских технологий, который с 1997 г. является членом Международной программы ВОЗ по мониторингу ПРЛ (Уппсала, Швеция).
С целью осуществления мониторинга ПРЛ в центре разработана форма карты-сообщения для регистрации ПРЛ с учетом международных требований и рекомендаций, которая активно распространяется среди работников здравоохранения.
• карта очень проста в заполнении, что достигнуто применением вопросов типа «да/нет». Это сводит к минимуму время, затрачиваемое на заполнение карты.
• личные данные, указываемые в карте являются конфиденциальными;
• карта, как следует из ее названия, касается не только «чистых» побочных эффектов, но и производственных дефектов;
• карта трехязычная и предполагает возможность заполнения как на армянском, так и на русском и английском языках;
• карта допускает сообщение даже в тех случаях, когда врач не уверен в достоверности сообщаемой информации или эта информация неполная
Карта состоит из четырех секций:
А. Сведения о больном. Эта секция включает в себя анкетные данные о больном:
• фамилия, имя и отчество (в целях конфиденциальности могут быть закодированы);
• возраст или дата рождения;
Б. Побочное действие лекарства или производственный дефект.
Эта секция предназначена для описания побочного действия или производственного дефекта и включает следующие данные:
• указание на побочное действие или производственный дефект;
• дату обнаружения (число, месяц, год);
• дату сообщения (число, месяц, год);
• причину сообщения (смерть, угроза жизни, госпитализация, инвалидность, врожденный порок, потеря трудоспособности, прочее);
• Описание побочного действия или производственного дефекта (производственные дефекты включают загрязненность продукта, дефектные компоненты, плохую упаковку, сомнительную стабильность, неправильную маркировку и прочее);
• использованные методы диагностики;
• краткое описание и особенности заболевания;
В. Подозреваемое лекарство (лекарства).
В этой секции указывается подозреваемое лекарство или лекарства, с которыми связывается возникновение побочной реакции. Секция предусматривает заполнение следующей информации:
• название лекарства, лекарственная форма, производитель, серия;
• показание к назначению;
Г. Сведения о сообщающем. Эти сведения должны быть представлены полностью, в связи с возможной необходимостью связаться с сообщающим лицом для выяснения подробностей случая. Эта секция включает следующие сведения:
• фамилия, имя и отчество сообщающего, место работы, телефон;
На карте указываются также адрес, по которому должны отправляться заполненные карты, а также номера телефонов и факсов, по которым можно сообщить в экстренных случаях.
Вы поможете тысячам больных, если сделаете одну простую вещь: сообщите нам о подозреваемых побочных реакциях на лекарства.
Горячая линия: (+374 10) 20-05-05, (+374 96) 22-05-05
Источник
Фармакомониторинг

Для преодоления этих проблем был разработан достаточно универсальный клинический подход, под названием терапевтический лекарственный мониторинг — комплекс мероприятий по определению концентрации лекарственных веществ в физиологических жидкостях пациентов, с целью подбора оптимальной схемы дозирования, наиболее эффективной для конкретного пациента, и минимизации нежелательных побочных эффектов лекарственного препарата.
Главная цель лекарственного мониторинга – фармакокинетический контроль лекарственной терапии. Согласно приказа № 4.94 МЗ РФ от 22.10.2003 г противоэпилептические препараты (антиконвульсанты) были отнесены к перечню препаратов, применение которых следует в обязательном порядке сочетать с мониторингом их концентрации в крови. Персонализация терапии эпилепсии – современная стратегия ведения таких пациентов, которая подразумевает выбор лекарственного препарата в зависимости от индивидуальных параметров больного и особенностей фармакодинамики и фармакокинетики противоэпилептических средств.
Международная противоэпилептическая лига в 2008 г. сформулировала некоторые общие показания для проведения терапевтического лекарственного мониторинга при использовании противоэпилептических препаратов:
- Применение при впервые установленной эпилепсии (определение концентрационных значений верхней и нижней границы терапевтического коридора),
- Определение постиктального концентрационного уровня противоэпилептического препарата в плазме крови,
- При выраженных побочных эффектах (определение индивидуального «терапевтического диапазона» пациента и вместе с тем определение «индивидуального токсического порога», оценка индивидуального прогноза лечения)
- Сопровождение процесса отмены лекарственного препарата
- Для определения приверженности лечению (комплаентности)
- Для оптимизации режима дозирования у детей в период фазы роста или у пациентов с резко изменившимся, в силу различных причин, весом
- При колебании стационарной концентрации антиконвульсантов на фоне приема оральных контрацептивов
- При межлекарственных взаимодействиях
- Отсутствие терапевтического эффекта или неудовлетворительный эффект при стандартной терапевтической дозе,
- Выраженные побочные эффекты при стандартной терапевтической дозе препарата,
- При срыве ремиссии без изменения дозы,
- Индивидуальные генетические особенности
- Предполагаемые изменения фармакокинетики, например, у больных пожилого возраста, при риске межлекарственных взаимодействий, беременности;
- Замена противоэпилептического препарата на другую лекарственную форму, или на дженерик;
Существует отработанный метод взятия крови для лекарственного мониторинга под названием стратегия «пик-спад». По этой схеме кровь отбирают двукратно. Первый раз кровь забирают натощак, до приема препарата, во время максимального снижения его стационарной концентрации в крови, непосредственно перед очередным введением препарата. Считается, что остаточный уровень препарата отображает терапевтическую эффективность лекарственного средства. Второй отбор производится на концентрационном максимуме препарата, который измеряют как правило спустя 2-3 часа после перорального введения, спустя 1 час после внутримышечной инъекции и через 30 мин после внутривенного введения препарата. Предполагается, что по концентрации после приема можно судить о возможных токсических эффектах препарата.
В ФГБНУ «Научный центр неврологии» проводится терапевтический лекарственный мониторинг большинства противоэпилептических препаратов, применяемых в Российской Федерации. При необходимости, интерпретация данных лекарственного мониторинга и адекватная индивидуализация режима дозирования может быть осуществлена с привлечением высококвалифицированных врачей-эпилептологов Центра.
Ниже приведен перечень препаратов, для которых осуществляется процедура лекарственного мониторинга на базе ФГБНУ «Научный центр неврологии» с указанием цены за один анализ:
Терапевтический лекарственный мониторинг
противоэпилептических препаратов
| Фенитоин |
| Зонисамид (анализ одного образца) |
Все исследования осуществляются на современном поверенном хроматографическом и хроматомасс-спектрометрическом оборудовании. Используемые методы количественного анализа метрологически валидированны согласно рекомендациям «Руководства по экспертизе лекарственных средств МЗ РФ» и международному руководству «Guideline on bioanalytical method validation» Европейского агентства лекарственных средств (EMEA).
Источник
Лекарственные средства
Счетчик обращений граждан и организаций
Лекарственные средства
Мониторинг эффективности и безопасности лекарственных препаратов
В соответствии с п. 5.1.4.3. постановления Правительства Российской Федерации от 30.06.2004 № 323 «Об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения» на Росздравнадзор возложены полномочия по федеральному государственному надзору в сфере обращения лекарственных средств посредством проведения фармаконадзора.
В соответствии с п. 3 ст. 64 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» субъекты обращения лекарственных средств в порядке, установленном уполномоченным федеральным органом исполнительной власти, обязаны сообщать в уполномоченный федеральный орган исполнительной власти о побочных действиях, нежелательных реакциях, серьезных нежелательных реакциях, непредвиденных нежелательных реакциях при применении лекарственных препаратов, об индивидуальной непереносимости, отсутствии эффективности лекарственных препаратов, а также об иных фактах и обстоятельствах, представляющих угрозу жизни или здоровью человека при применении лекарственных препаратов и выявленных на всех этапах обращения лекарственных препаратов в Российской Федерации и других государствах.
Кроме того, в соответствии с приказом Минздравсоцразвития России от 26.08.2010 № 757н «Об утверждении порядка осуществления мониторинга безопасности лекарственных препаратов для медицинского применения, регистрации побочных действий, серьезных нежелательных реакций, непредвиденных нежелательных реакций при применении лекарственных препаратов для медицинского применения», в рамках проведения мониторинга безопасности лекарственных средств Росздравнадзор проводит анализ периодических отчетов по безопасности лекарственных препаратов, поступающих от производителей и разработчиков лекарственных препаратов.
Источник
Методы повышения выявляемости и структура нежелательных реакций на лекарственные препараты на примере Астраханской области
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
В современном динамически развивающемся мире проведение мониторинга безопасности лекарственных препаратов (ЛП) можно назвать стратегической целью национальной безопасности в сфере здравоохранения. Серьезные нежелательные реакции вследствие приема ЛП могут наносить ущерб здоровью населения вплоть до инвалидизации, что ведет к дополнительным расходам на госпитализацию либо ее продление, а также на реабилитацию и лечение пациентов, приводит к большим экономическим потерям. В этой работе рассмотрены различные аспекты данной проблемы на примере Астраханской области. Проводится анализ извещений о неблагоприятных побочных реакциях (НПР) на ЛП, поступивших за 2018 г. в региональный центр мониторинга безопасности лекарственных средств. Анализ свидетельствует об увеличении выявления случаев НПР ЛП на территории Астраханской области. Повышение частоты нежелательных реакций на ЛП обусловлено учащением случаев самолечения, а также доступностью сильнодействующих ЛП (НПВС, анальгетики, антибактериальные препараты и др.). Изучена структура выявленных НПР в 2018 г. в Астраханской области.
Эффективность выявления НПР ЛП можно повысить путем организации центра мониторинга лекарственных средств.
Ключевые слова: мониторинг безопасности лекарственных средств, неблагоприятные побочные реакции, лекарственные препараты.
Для цитирования: Филиппова О.В., Умерова А.Р., Каштанова О.А. и др. Методы повышения выявляемости и структура нежелательных реакций на лекарственные препараты на примере Астраханской области. РМЖ. 2019;8(I):70-72.
Structure analysis of manifested adverse events in the drug use in the Astrakhan region
O.V. Filippova 1 , A.R. Umerova 2 , O.A. Kashtanova 1 , O.O. Kirilochev 2 , O.R. Buzina 3
1 Department for Expertise, Accounting and Circulation of Medicinal Products, Astrakhan
2 Astrakhan State Medical University
3 Alexander Mariinsk Regional Clinical Hospital, Astrakhan
Nowadays, monitoring drug safety can be called a tactics goal of national security in the field of health care and the health of the whole nation. Serious adverse events due to medication may cause damage up to disability to the population health, which leads to additional costs for hospitalization or its extension, as well as rehabilitation and treatment of patients, leading to large economic losses. This article discusses various aspects of this problem on the example of the Astrakhan region. It also considers the analysis of the received notifications for 2018 on the basis of the Regional Center for Safety Monitoring of Medicinal Products. The analysis shows the activation of drug manifested cases of adverse events in the Astrakhan region. Self-medication plays a huge role in the frequency of increased adverse events to drugs, as well as t he availability of potent drugs (NSAIDs, analgesics, antibacterial drugs, etc.). The revealed adverse events structure in 2018 in the Astrakhan region is shown. The manifestation effectiveness of drug adverse events can be improved by the organization of the medicinal products monitoring center.
Keywords: safety monitoring of medicinal products, adverse events, drugs.
For citation: Filippova1 O.V., Umerova A.R., Kashtanova O.A. et al. Structure analysis of manifested adverse events in the drug use in the Astrakhan region. RMJ. 2019;8(I):70–72.
Статья посвящена проблеме повышения выявляемости и структуре нежелательных реакций на лекарственные препараты. Рассмотрены различные аспекты данной проблемы на примере Астраханской области.
Введение
При проведении лекарственной терапии всегда есть риск развития неблагоприятных побочных реакций (НПР). Любой лекарственный препарат (ЛП) может стать причиной развития НПР, даже в тех случаях, если его назначают в соответствии со стандартами лечения.
Проблеме возникновения НПР как в России, так во всем мире уделяется огромное внимание. В первую очередь это связано с тем, что прием лекарственных средств (ЛС) может стать причиной развития серьезных побочных реакций, а также привести к инвалидизации, что ведет к дополнительным расходам на госпитализацию либо ее продление, а также на реабилитацию и лечение пациентов.
Для решения данной проблемы в настоящее время в России активно работает система мониторинга безопасности ЛС в соответствии с основными регламентирующими документами: Федеральным законом № 61-ФЗ «Об обращении лекарственных средств» [1] и приказом Минздравсоцразвития РФ № 757н «Об утверждении порядка осуществления мониторинга безопасности лекарственных препаратов для медицинского применения» [2].
Данные статистики НПР на ЛП анализируются и в других странах мира, такой анализ является неотъемлемой частью производства лекарственных препаратов, что подтверждает актуальность данной проблемы.
На территории Российской Федерации во многих регионах функционируют центры мониторинга безопасности ЛС. Данная система позволяет систематически получать информацию о выявленных НПР и анализировать сложившуюся ситуацию в том или ином регионе страны.
В Астраханской области функции регионального центра мониторинга возложены на ГБУ АО «Управление по экспертизе, учету и анализу обращения средств медицинского применения», где функционирует горячая линия по вопросам качества ЛС. Следует отметить, что одновременное выполнение других функций помогает анализировать поступающие сообщения об НПР:
проведение лабораторных испытаний ЛС, реализуемых населению Астраханской области, с целью установления соответствия их качества требованиям государственных стандартов и содействие предотвращению поступления в обращение ЛП, не отвечающих требованиям безопасности и качества;
информирование населения о наличии, ценах, побочных действиях и особенностях применения ЛС, находящихся в розничной продаже в аптечных организациях.
Одной из основных задач регионального центра является организация работы по эффективному выявлению НПР в регионе, что включает координацию работы с учреждениями здравоохранения и аптечными учреждениями, консультирование больных с целью рационализации проводимой фармакотерапии.
При регулярном, систематическом проведении мониторинга безопасности ЛС осуществляется сбор, обработка и анализ полученной информации о выявленных НПР и особенностях взаимодействия ЛС. Сведения об НПР ЛС поступают в виде извещений об НПР в центр мониторинга, далее в виде ежемесячного отчета направляются в Министерство здравоохранения Астраханской области, а также территориальный орган Росздравнадзора по Астраханской области.
Выявляются НПР при применении ЛП в региональном центре с помощью методов спонтанных сообщений и активного мониторинга.
Цель спонтанного мониторинга заключается в получении и анализе всей информации по стране, однако сбор необходимых данных необходимо проводить во всех регионах для получения более качественной информации. Если же активность извещения низкая и заполнение карт осуществляется некачественно, то сигнал об НПР поступает с задержкой, что приводит к недооценке масштабов проблемы.
Крайне важен тот факт, что анализ структуры спонтанных сообщений позволяет выявлять реакции, которые могут быть связаны с проблемами качества ЛС.
Задачами осуществления мониторинга безопасности ЛС являются: оценка риска и пользы ЛС, рациональное и безопасное применение ЛС, информирование о возможных рисках, обучение и информирование медициков и фармацевтов, а также пациентов.
Цель исследования: проанализировать структуру и частоту выявленных и зарегистрированных НПР на ЛП, а также проследить динамику выявления НПР на ЛП на примере Астраханской области за 2018 г.
Материал и методы
Для оценки эффективности и безопасности фармакотерапии использовали метод «спонтанных сообщений», поступивших от субъектов обращения ЛС на территории Астраханской области. Были проанализированы карты-извещения за 2018 г., проведен анализ показателей причинно-следственной связи с использованием алгоритмов, утвержденных Всемирной организацией здравоохранения, и алгоритма Наранжо [3].
Результаты исследования и их обсуждение
С момента начала функционирования регионального центра мониторинга безопасности ЛС отмечается увеличение числа выявленных НПР.
По результатам ретроспективного анализа по выявлению НПР в Астраханской области отмечается увеличение числа сообщений, что связано с проведением разъяснительной работы с врачами в регионе, а также улучшением информированности о необходимости регистрации случаев выявления НПР.
За 2018 г. поступило 577 сообщений об НПР на ЛП, в 2017 г.— 464 сообщения, в 2016 г.— 468 сообщений.
За 2018 г. выявлено 157 серьезных нежелательных реакций.
К серьезным НПР на ЛП относятся такие нежелательные реакции, которые:
создают угрозу для жизни (42 НПР за 2018 г.);
приводят к смерти (1 НПР);
являются причиной госпитализации или приводят к ее удлинению (113 НПР);
приводят к инвалидности, стойкой утрате трудоспособности, врожденным аномалиям или порокам развития (1 НПР).
Клинически значимых случаев выявлено 96, непредвиденных (не внесенных в инструкцию по применению) — 17, сообщений об отсутствии ожидаемого терапевтического эффекта — 37. Структура сообщений об отсутствии ожидаемого терапевтического эффекта по профилю препаратов представлена на рисунке 1.
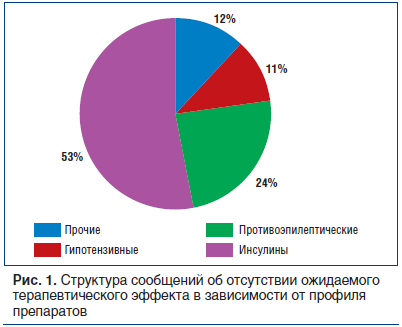
Сроки предоставления информации установлены приказом Федеральной службы по надзору в сфере здравоохранения от 15.02.2017 г. № 1071 — не позднее 15 календарных дней со дня поступления соответствующей информации. Не позднее 3 рабочих дней необходимо сообщать о серьезных нежелательных реакциях с летальным исходом или угрозой жизни.
За 2018 г. выявлено 577 сообщений об НПР, в т. ч. от: врачей — клинических фармакологов — 386, врачей других специальностей — 150, провизоров — 15, среднего медперсонала — 26. Структура источников информации об НПР представлена на рисунке 2.

Причинно-следственную связь удалось выявить для 464 реакций, из которых к числу определенных отнесено 135, вероятных — 168, возможных — 138, сомнительных — 5, условных — 1, неклассифицируемых — 17.
Характеристика нежелательных реакций:
НПР, индивидуальная непереносимость ЛП —
244 сообщения;
аллергические реакции — 220 сообщений, из них: шок анафилактический — 16, отек ангионевротический — 21, токсикодермия — 6, синдром Стивенса — Джонсона — 1, другие кожные проявления — 176.
Из приведенных данных видно, что чаще регистрируются именно аллергические реакции на применение ЛС (рис. 3).

Выводы
Эффективность выявления НПР ЛП во многом зависит от внимания к мониторингу врачей и фармацевтических работников, их готовности информировать о выявленных нежелательных реакциях.
Таким образом, в результате проведенного анализа выявлено, что чаще сообщается именно об аллергических реакциях. При этом упускаются из виду такие важные аспекты, как индивидуальная непереносимость, отсутствие эффективности ЛП, нежелательные реакции после применения ЛП (не связанные с проявлением аллергической реакции организма).
Также стоит отметить, что с момента начала функционирования регионального центра мониторинга лекарственных средств на базе ГБУ АО «УЭУАОСМП» повысилось количество и качество поступающих извещений. В настоящее время увеличилось количество ЛПУ, регистрирующих карты-извещения. Также активизируются в процессе мониторинга аптечные организации.
При анализе карт-извещений отмечается недостаточное качество их оформления (не отмечаются торговые наименования, производитель, номер серии, заболевание, для лечения которого использовался ЛП, и др.), что затрудняет определение причинно-следственной связи.
Для исключения в дальнейшем перечисленных ошибок осуществляется организационная работа с сотрудниками медицинских учреждений Астраханской области — клиническими фармакологами, ответственными за выявление нежелательных реакций при применении ЛП и выявление неблагоприятных событий при применении медицинских изделий в медицинских организациях.
Также оказывается консультативная помощь медицинским работникам учреждений здравоохранения Астраханской области в анализе и классификации НПР (встречи со специалистами, консультирование по телефону, письма по электронной почте).
Только для зарегистрированных пользователей
Источник


