Комбинированный препарат в терапии болевого синдрома
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
Статья посвящена видам и механизмам болевого синдрома, современному дифференцированному подходу к его терапии. Дается определение боли согласно классификации Международной ассоциации по изучению боли, рассматриваются основные понятия, такие как первично возникающая, хроническая, ноцицептивная (соматогенная, соматическая), нейропатическая (нейрогенная), дисфункциональная боль. Обсуждаются группы препаратов, применяющиеся при разных типах боли, с различными механизмами действия: на воспалительный компонент, мышечный спазм, периферическую или центральную сенситизацию, дезингибицию. Подчеркивается, что выбор анальгетической терапии должен основываться на нескольких факторах: причине боли, ее механизме и безопасности применения препаратов с учетом индивидуальных свойств организма пациента. В статье представлен обзор фармакокинетических и биофармацевтических свойств лекарственных веществ: ибупрофена и парацетамола, а также нового готового комбинированного препарата, содержащего данные лекарственные вещества, – Нурофен Лонг, таблетки, покрытые пленочной оболочкой. Приведены особенности фармакокинетики данного препарата, отличающиеся от фармакокинетики входящих в него действующих веществ при их совместном приеме в виде монопрепаратов, выявленные в первую очередь на стадии абсорбции. Описаны влияние приема пищи на фармакокинетику препарата, а также изменение динамики концентрации активных компонентов при многократном введении.
Ключевые слова: боль, терапия боли, Нурофен Лонг, нестероидные противовоспалительные препараты, парацетамол.
Для цитирования: Раменская Г.В., Пилипович А.А. Комбинированный препарат в терапии болевого синдрома. РМЖ. Медицинское обозрение. 2017;25(14):1006-1013.
Сombination medication in the therapy of pain syndrome
Ramenskaya G.V., Pilipovich A.A.
First Moscow State Medical University named after I.M. Sechenov
The article is devoted to the types and mechanisms of the pain syndrome, the modern differentiated approach to its therapy. The definition of pain is given according to the International Association for the Study of Pain, the basic concepts such as primary arising, chronic, nociceptive (somatogenic, somatic), neuropathic (neurogenic), dysfunctional pain are considered. The article discusses the groups of drugs used for different types of pain with different mechanisms of action: on the inflammatory component, muscle spasm, peripheral or central sensitization, disinhibition. It is emphasized that the choice of analgesic therapy should be based on several factors: the cause of the pain, its mechanism and the safety of the drugs, taking into account the individual features of the patient. The article presents a review of pharmacokinetic and biopharmaceutical properties of medicinal substances: ibuprofen and paracetamol, as well as a new ready-made combination medication containing these medicinal substances — Nurofen Long, coated tablets. Distinctive pharmacokinetic features of this drug are given in comparison to the pharmacokinetics of its active substances when they are taken together in the form of monopreparations, which were detected primarily at the absorption stage. The influence of food intake on the pharmacokinetics of the preparation, as well as the change in the dynamics of the concentration of active components with repeated administration, is described.
Key words: pain, pain therapy, Nurofen Long, non-steroidal anti-inflammatory drugs, paracetamol.
For citation: Ramenskaya G.V., Pilipovich A.A. Сombination medication in the therapy of pain syndrome // RMJ. 2017. № 14. P. 1006–1013.
Представлены возможности применения комбинированного препарата в терапии болевого синдрома
Боль – пожалуй, самая распространенная жалоба, с которой пациент обращается к врачам самых разных специальностей: неврологам, травматологам, ортопедам, ревматологам, семейным и участковым терапевтам, физиотерапевтам и др. Болевой синдром может возникнуть в любом возрасте, как у пожилых, так и у молодых, трудоспособных людей, нередко встречается среди студентов и школьников. Примерно треть от всех острых и хронических болевых синдромов составляют скелетно-мышечные боли, местами их излюбленной локализации являются нижняя часть спины, шея и надплечья [1]. По результатам крупных эпидемиологических исследований, годовая заболеваемость только болями поясничной локализации составила 4–5%, а годовая распространенность – 40–80% [2], боль в шее хотя бы однажды в жизни испытывали около 2/3 населения [3], ежегодно ею страдают 30–50% взрослых людей [4], распространенность болей в плече доходит до 26% общей популяции [5]. Страдающие болями пациенты ощущают постоянное ограничение двигательной активности, что резко снижает качество их жизни, ухудшается профессиональная и бытовая деятельность.
Международная ассоциация по изучению боли [6] определяет боль как «неприятное ощущение и эмоциональное переживание, возникающее в связи с настоящей или потенциальной угрозой повреждения тканей или описываемое терминами такого повреждения». Таким образом, боль прежде всего является защитной функцией организма, предупреждающей об опасности, вредных воздействиях окружающей среды, патологических процессах, происходящих в организме.
Первично возникающая боль обычно бывает острой, резкой, интенсивной, она проходит при устранении раздражителя и восстановлении поврежденной ткани или органа. Такая боль выполняет сигнальную функцию и обеспечивает активацию систем организма, направленных на устранение повреждающего фактора. Однако боль не всегда бывает ответом на повреждение, часто оно уже устранено, а боль остается, являясь уже не защитным, а повреждающим фактором в организме. Это так называемая «патологическая боль», ее компонент обязательно присутствует у пациентов, страдающих хроническими болями, и заслуживает отдельного внимания и специфической терапии.
Хроническая боль – неприятное ощущение и эмоциональное переживание (определяемое сенсорной информацией, аффективными реакциями и когнитивной деятельностью больного), которое связано с действительным или возможным повреждением тканей или описываемое в терминах такого повреждения, которое продолжается сверх нормального периода заживления – более 3 мес. и которое не поддается обычному медикаментозному лечению, эффективному при острой боли [7]. В какой момент времени происходит хронизация, понять пока не удалось, нет единого временного критерия «хронической боли». Например, по данным Международной ассоциации по изучению боли, хроническая боль – это боль, длящаяся не менее 3 мес., а в соответствии с критериями DSM-IV болевой синдром должен длиться более 6 мес. Хроническая боль часто становится самостоятельной болезнью, являясь единственным симптомом, длительно беспокоящим пациента, и зачастую причину этой боли определить так и не удается, т. е. хроническому болевому синдрому свойственно отсутствие прямой связи с органической патологией. Хронической болью страдают в среднем 15–20% общей популяции населения. По большей части это пожилые люди, имеющие несколько заболеваний, которые провоцируют развитие болевого синдрома комплексной этиологии. По частоте таких болей лидируют боли, связанные с мышечно-скелетными проблемами [8].
Другой характеристикой болевого синдрома является его интенсивность. Общепринято выделять «слабые», «умеренные» и «сильные» боли. Эта характеристика также учитывается при выборе анальгетической терапии.
Для подбора терапии болевого синдрома важно представлять первичную локализацию боли, ее длительность и наличие хронизации, вид боли, ее качественную характеристику. В этом врачу может помочь клиническое разделение боли на ноцицептивную, нейрогенную и дисфункциональную [9].
Ноцицептивная боль (соматогенная, соматическая) возникает вследствие активации болевых рецепторов при травме, воспалении, ишемии, отеке (например, боли при воспалении суставов, миофасциальные боли). При повреждении поверхностных тканей боль, как правило, острая, хорошо локализованная, патология внутренних органов дает глубокие, схваткообразные боли без четкой локализации. Чаще всего ноцицептивная боль является защитной реакцией и проходит после исчезновения повреждения. Однако при хроническом воспалении, например при ревматоидных болях, адаптивное значение боли утрачивается. Ноцицептивный тип боли может контролироваться состоянием поврежденного органа, терапевтически чувствителен к морфину и другим анальгетикам, в т. ч. нестероидным противовоспалительным препаратам (НПВП).
Нейропатическая боль (нейрогенная) – это группа болей, являющихся следствием первичного повреждения или дисфункции нервной системы и не объясняющихся повреждением болевых рецепторов. Примерами нейрогенной боли могут служить боли при поражении нервов, диабетической невропатии, постгерпетической невралгии, травме мозга, постинсультная центральная боль. Основные механизмы, лежащие в основе данного типа болей, – периферическая сенситизация (избыточная активность натриевых каналов), центральная сенситизация (гипервозбудимость центральных сенсорных нейронов) и дезингибиция (недостаточность нисходящих антиноцицептивных влияний). Нейропатическая боль не является сигналом о повреждении и не имеет защитной функции. Общими характеристиками невропатической боли являются персистирующий характер, большая длительность, неэффективность анальгетиков, многообразие сенсорных проявлений (гиперестезия, гипералгезия, аллодиния, выпадение разных видов чувствительности), сочетание с вегетативными расстройствами (снижение кровотока, гипер- и гипогидроз в болевой области) и двигательными нарушениями. Невосприимчивость невропатической боли к морфину и другим опиатам в обычных анальгетических дозах свидетельствует об отличии в патогенетических механизмах возникновения от опиоид-чувствительной ноцицептивной боли и о необходимости другого терапевтического подхода [2].
Дисфункциональная боль – еще один вид болей, который часто присутствует в структуре болевого синдрома и про который нельзя забывать при подборе терапии. Эта боль обусловлена изменением функционального состояния отделов ЦНС, участвующих в контроле боли (так называемый «синдром центрального усиления боли»). Основными механизмами ее развития считаются дезингибиция и центральная сенситизация. Главное отличие дисфункциональной боли от двух первых типов болей – невозможность выявить ее причину либо органическое заболевание, объясняющее ее появление. Основными факторами, влияющими на развитие дисфункциональной боли, являются эмоциональные, социальные и психологические. Они приводят к дисфункции нисходящих норадренергических и серотонинергических систем, в результате чего обычные, неболевые стимулы начинают восприниматься как болевые. Примерами такой боли являются фибромиалгия, головная боль напряжения, психогенная боль при соматоформных расстройствах.
Большинство болей имеют смешанный характер, и в них могут сосуществовать ноцицептивный, нейрогенный и психогенный компоненты, тем не менее определить их наличие в структуре болевого синдрома необходимо для правильного подбора терапии.
Какой бы ни была боль – острой или хронической, нестерпимой или тупой, изнуряющей – она часто доводит человека до исступления. В данном случае в ход идут без разбора все обезболивающие препараты. Такой бесконтрольный прием лекарств, особенно при длительных хронических болях, не может не привести к возникновению побочных эффектов и страданию внутренних органов (печени, желудка, почек и пр.). Стоит отметить, что все анальгетики имеют свои побочные действия и свои показания и противопоказания к применению.
Принципы терапии боли основаны на использовании фармакологических и нефармакологических методов [10]. Последние имеют большое значение в борьбе с психогенным компонентом боли, плохо поддающимся лекарственной терапии. Методики биологической обратной связи, релаксационный тренинг, поведенческая терапия и гипноз могут оказаться полезными в некоторых рефрактерных к лечению случаях. Современная медикаментозная терапия имеет в своем арсенале массу различных по механизму действия анальгетиков:
– средства, подавляющие синтез и выделение альгогенов в поврежденных тканях (ненаркотические анальгетики и НПВП);
– препараты, уменьшающие поступление болевой импульсации из зоны повреждения в ЦНС (местные анестетики);
– активаторы структур противоболевой системы организма (наркотические анальгетики, агонисты α2-адренорецепторов, антидепрессанты, бензодиазепины);
– препараты, восстанавливающие контроль возбудимости болевых нейронов (антиконвульсанты, бензодиазепины);
– средства, подавляющие генерацию эктопических импульсов в периферических нервах;
– средства, устраняющие мышечное напряжение (миорелаксанты);
– психотропные препараты.
Для того чтобы выбрать противоболевое средство из всего перечисленного многообразия, необходимо руководствоваться характером болевого синдрома (табл. 1) [11]. Так как очень часто болевой синдром имеет комплексный характер и включает в себя несколько типов боли, перечисленные средства комбинируются индивидуально для каждого пациента. 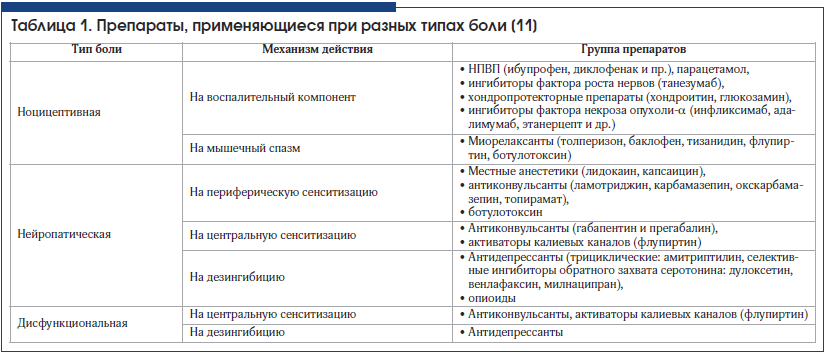
Группа НПВП – пожалуй, одна из наиболее часто применяемых, особенно среди пациентов, страдающих острыми и хроническими болями скелетно-мышечного характера. Анальгетический эффект НПВП проявляется прежде всего в отношении ноцицептивных болей воспалительного генеза слабой и умеренной интенсивности, а также в комплексной терапии интенсивной боли. Без НПВП невозможно обойтись при терапии артритов и артрозов, миотонических синдромов. Эта группа препаратов широко назначается для купирования острого или хронического болевого синдрома, связанного с дегенеративными заболеваниями позвоночника. НПВП входят в состав множества многокомпонентных лекарственных средств.
Многокомпонентные лекарственные средства достаточно широко представлены на фармацевтическом рынке, их список постоянно пополняется. Это связано, с одной стороны, с удобством приема для пациента, вынужденного применять несколько лекарственных препаратов, а также с возможным положительным влиянием компонентов комбинированного препарата друг на друга. Говоря о лекарственном взаимодействии, принято выделять его виды: фармацевтическое, фармакокинетическое и фармакодинамическое. При этом каждый вид взаимодействия, как правило, приводит к изменению эффективности и безопасности комбинированного лекарственного препарата по сравнению с применением входящих в него компонентов в виде монопрепаратов.
Среди широкого спектра многокомпонентных болеутоляющих лекарственных средств встречаются препараты, содержащие как два компонента, так и три и даже пять. Некоторые из них относятся к безрецептурным лекарственным средствам, предназначенным для самостоятельного приема, другие содержат сильнодействующие (наркотические) вещества и назначаются только врачом. Основная цель создания многокомпонентного препарата из двух или более анальгетиков – усиление болеутоляющего действия готовой комбинации по сравнению с действием одновременного приема в виде монопрепаратов, что достигается в первую очередь улучшением их фармакокинетических свойств [12].
При анализе рынка зарегистрированных лекарственных средств можно отметить, что среди ненаркотических анальгетиков наиболее распространенными являются ацетилсалициловая кислота, метамизол, парацетамол, ибупрофен, диклофенак и некоторые другие НПВП. В комбинированных болеутоляющих препаратах чаще других встречаются ибупрофен, парацетамол, метамизол. Так, по данным Государственного реестра лекарственных средств [13], на начало июля 2017 г. зарегистрированы 30 лекарственных средств, содержащих ибупрофен в различной комбинации и представленных разными лекарственными формами, при этом 13 из них содержат комбинацию ибупрофена с парацетамолом. Среди них встречаются таблетки (400 мг + 325 мг) и таблетки, покрытые оболочкой (400 мг + 325 мг, 400 мг + 200 мг, 200 мг + 500 мг), суспензии (100 мг + 125 мг / 5 мл, 100 мг + 162,5 мг / 5 мл), таблетки диспергируемые для детей (100 мг + 125 мг).
Ибупрофен
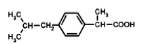
В доклинических фармакокинетических исследованиях у крыс, кроликов и собак после однократного приема и после повторного введения [17] показано, что результаты сопоставимы с результатами исследований фармакокинетики у человека. Ибупрофен имеет короткий период полураспада в плазме у животных и взрослых людей. Ибупрофен окисляется и выделяется в основном с мочой в виде конъюгатов. Все метаболиты определяются у человека и животных и являются фармакологически неактивными. Ибупрофен является рацемическим соединением. Как и прочие производные пропионовой кислоты, подвергается метаболической инверсии, когда неактивный R-изомер преобразуется в активную S-форму. Ибупрофен метаболизируется путем окисления и карбоксилирования изобутиловой боковой цепи и последующей конъюгации метаболитов.
Большинство клинически значимых лекарственных взаимодействий обусловлено способностью НПВП подавлять активность циклооксигеназы, тем самым снижая биосинтез простагландинов. Некоторые аспекты лекарственного взаимодействия НПВП обусловлены тем, что они в высокой степени связываются с белками плазмы и, следовательно, могут конкурировать с другими препаратами, чей механизм также предполагает связь с белками плазмы.
Парацетамол (ацетаминофен)

Парацетамол исследовали в дозах 5 мг/кг у верблюдов и 10 мг/кг у коз при внутривенном и внутримышечном путях введения. Парацетамол имел значительно более низкий клиренс (21,9 ± 1,4 мл/мин•кг против 52,8 ± 7,3 мл/мин•кг) у верблюдов, чем у коз (р 0,05) и 55 мин для парацетамола (p Литература
Только для зарегистрированных пользователей
Источник



