- федеральное бюджетное учреждение здравоохранения «Центр гигиены и эпидемиологии в Республике Марий Эл»
- Контроль качества биотехнологических продуктов
- Контроль качества биотехнологических продуктов
- Биспецифические антитела
- Что такое качество лекарственного препарата?
- Показатели качества
- Подлинность
- Вестерн-блоттинг
- Чистота
федеральное бюджетное учреждение здравоохранения «Центр гигиены и эпидемиологии в Республике Марий Эл»
Проблема микробной загрязненности лекарственных препаратов одна из наиболее важных в медицинской практике. Инфицирование лекарств может происходить на всех этапах их приготовления, в процессе получения из лекарственного сырья, через используемую воду, недостаточно стерильную лекарственную посуду, воздух производственных помещений, руки персонала, нарушения санитарных условий хранения, особенно температурно-влажностного режима. Поэтому необходим тщательный микробиологический контроль на всех этапах получения и хранения препаратов.
Инфицированные препараты могут вызвать заболевания человека, тяжелые пирогенные и аллергические реакции. Микроорганизмы значительно изменяют и свойства самого препарата. Может происходить накопление микробных токсинов и ферментов, расщепление химических структур, появление новых ядовитых свойств.
По технологии получения и санитарным нормам лекарственные препараты могут быть разделены на 3 группы:
1). Стерильные (для парентерального введения, капли в глаза, нос, мази для применения на рану, ожоговую и обмороженную поверхность и все препараты для новорожденных детей).
2). Нестерильные препараты без антимикробного действия.
3). Препараты обладающие антимикробным действием.
Для соблюдения санитарного режима изготовления лекарственных препаратов проводят санитарно-микробиологический контроль объектов окружающей среды предприятия и каждой серии выпускаемой лекарственной формы.
Лекарственные средства для парентерального введения в виде инъекций, глазные капли, мази, пленки и иное, в отношении которых имеются соответствующие указания в нормативно-технической документации, должны быть стерильными. Контроль стерильности лекарственных средств проводят путем посева на тиогликолевую среду для выявления различных бактерий, в том числе анаэробов.При посеве на среду Сабуро выявляют грибы, главным образом рода Candida . Стерильность лекарственных средств с антимикробным действием определяют путем мембранной фильтрации: фильтр после фильтрации исследуемого препарата делят на части и вносят для подращивания задержанных микроорганизмов в жидкие питательные среды. При отсутствии роста препарат считается стерильным.
Лекарственные средства, не требующие стерилизации, обычно содержат микроорганизмы, поэтому их испытывают на микробиологическую чистоту. Для этого проводят количественное определение жизнеспособных бактерий и грибов в 1г или 1 мл препарата, а также выявляют микроорганизмы, которые не должны присутствовать в нестерильных лекарственных средствах. В 1г или 1мл лекарственного сырья для приема внутрь должно быть не более 1000 бактерий и 100 дрожжевых и плесневых грибов. В случаях местного применения количество микроорганизмов не должно превышать 100 микробных клеток на 1г или 1мл препарата. В таблетированных препаратах не должно быть патогенной микрофлоры, а общая обсемененность не должна превышать 10 тысяч микробных клеток на таблетку.
Источник
Контроль качества биотехнологических продуктов
28 декабря 2018
Контроль качества биотехнологических продуктов
Качество биотехнологических продуктов, в частности антител, отслеживается на всех этапах производства
иллюстрация Дарьи Боголюбовой-Кузнецовой
Автор
Редакторы
Заключительная статья спецпроекта о биспецифических антителах посвящена контролю качества этого класса биотехнологических продуктов. В ней рассмотрены особенности обеспечения качества антител по сравнению с молекулами, полученными путем химического синтеза, вопросы определения подлинности и чистоты, рассказано о новых подходах к контролю качества и о методах, которые при этом используются.
Биспецифические антитела
Спецпроект о биспецифических антителах, особенностях их строения, свойств, получения и применения в современной медицине.
Партнер спецпроекта — компания Cytiva, занимающаяся оснащением научно-исследовательских лабораторий, фармацевтических и биотехнологических производств приборами, расходными материалами и реактивами.
Качество лекарственных продуктов вообще и биотехнологических продуктов, которые используют как лекарственные средства, в частности — это их важнейшая характеристика, поскольку речь идет о здоровье и жизни людей. Поэтому неудивительно, что обеспечению и контролю качества уделяется первостепенное внимание в процессе производства антител, о котором мы рассказали в предыдущей статье спецпроекта о биспецифических антителах (биспецификах) [1]. Там уже говорилось, что этот процесс на всех этапах строго регламентирован. В этой статье мы подробнее обсудим методы контроля качества и современные подходы к его обеспечению.
Что такое качество лекарственного препарата?
Обеспечение качества производства биотехнологических продуктов в целом базируется на системе менеджмента качества ISO 9001. В ней качество определяется как степень соответствия совокупности присущих характеристик объекта требованиям. То есть сначала человек субъективно задает какие-то требования к объекту — продукту или процессу. А качество — это то, насколько объективные характеристики этого продукта удовлетворяют сформулированным ранее субъективным требованиям.
Что же такое фармацевтическое качество? Это пригодность действующего вещества и лекарственного препарата для своего целевого назначения. Разберем это определение. Целевое назначение лекарства — это, упрощенно говоря, популяция пациентов и болезнь, которую нужно лечить, то есть субъективная сторона в определении качества. А объективная сторона — это лекарственный продукт со всеми его характеристиками. Подлинность, дозировка и чистота — основные показатели качества лекарственного продукта, от которого, в свою очередь, ключевым образом зависят эффективность и безопасность лекарства.
Качество препарата закладывается и контролируется в ходе всей фармацевтической разработки, то есть при создании процесса производства лекарства. Это понятие неразрывно связано с препаратом уже на этапах доклинической и клинической разработки (подробнее — в статье «Наработка антител для доклинических и клинических испытаний» [1]). Так, данные доклинических и клинических исследований дают информацию о том, насколько стабильно качество продукта, и какие именно его характеристики следует контролировать в процессе производства.
Биспецифики и прочие антитела относятся к биотехнологическим продуктам, то есть веществам, полученным с помощью методов биотехнологии (в том числе и генной инженерии). Биологические продукты включают все биотехнологические плюс другие продукты биологического происхождения — клетки, белки плазмы крови и другие. Мы будем использовать термины «биологический» и «биотехнологический» как эквивалентные, потому что в рамках нашей статьи между ними существенных различий нет. Дальше мы будем говорить в основном об антителах, иногда упоминая биспецифики, но бόльшая часть информации будет относиться ко всем биотехнологическим продуктам.
Обеспечивать и контролировать качество биотехнологических продуктов гораздо сложнее, чем продуктов, полученных химическим синтезом — так называемых малых молекул (таблица). Это связано с их размерами, сложностью химической структуры и способом получения. Так, если малая молекула обладает массой 100–1000 Да , то антитело имеет массу около 150 000 Да и содержит больше тысячи аминокислотных остатков [2]. Из-за таких размеров подобные продукты получают не химическим синтезом, а в клетках — как правило, бактерий или животных. Методами генной инженерии (они описаны в статье «12 методов в картинках: генная инженерия. Часть II: инструменты и техники» [3]) в клетку вводят ген, кодирующий нужный белок, и другие генетические элементы, необходимые для продукции белка в конкретной клеточной системе. Эти манипуляции описаны в статьях «Биотехнология антител» [4] и «Разработка биспецифических антител для применения в клинике» [5]. Поскольку тонко контролировать процессы, происходящие в живых клетках, мы пока не научились, свойства получающихся продуктов варьируют, и для них требуются специальные меры обеспечения качества и свои методы контроля.
Да (дальтон) — обозначение атомной единицы массы, которое чаще применяется к макромолекулам.
По сравнению с малыми молекулами, качество биотехнологических продуктов гораздо сильнее завязано на процесс их получения. Небольшие изменения в процессе культивирования клеток могут привести, например, к изменению профиля гликозилирования белка, а это грозит снижением эффективности или появлением иммуногенности. Кроме того, биотехнологические продукты обычно менее устойчивы к воздействиям среды, чем малые молекулы, и потому требуют специальных усилий по разработке стабильного конечного продукта.
| Требования на серию активного фармацевтического ингредиента* | Низкомолекулярное соединение | Биологический продукт |
|---|---|---|
| Продолжительность производства, дни | 6 | 62 |
| Сырье, кол-во наименований | 2 | 35 |
| Внутрипроизводственные образцы, кол-во | 8 | 350 |
| Критические технологические стадии, число | 5 000 | |
| Число вводимых данных | 60 000 | |
| * — Активный фармацевтический ингредиент (лекарственная субстанция) — вещество, которое войдет в состав готового лекарственного продукта и которое оказывает фармакологический эффект. К производству и контролю качества субстанций и готовых продуктов предъявляют разные требования, но мы здесь не будем делать акцент на этих различиях. | ||
Как уже говорилось в статье «Наработка антител для доклинических и клинических испытаний» [1], разработка и производство лекарств строго регулируются законодательством. Международный совет по гармонизации технических требований к регистрации лекарственных средств для медицинского применения (The International Council for Harmonisation, ICH) разработал свод руководств, которые легли в основу европейских и американских регуляторных требований к разработке лекарств. Качеству лекарственных средств посвящена целая серия рекомендаций под буквой Q (от слова quality). Некоторые руководства применимы исключительно к биотехнологическим продуктам — например, серия ICH Q5A-Q5E, посвященная вирусной безопасности, анализу экспрессионных конструкций, проверке стабильности, описанию клеточных линий и проверке сопоставимости. А руководство ICH Q6B посвящено спецификациям биотехнологических продуктов, о которых мы дальше и поговорим.
Спецификации — это перечень испытаний, ссылок на аналитические методики и критерии приемлемости (допустимые нормы) [6]. Соответствие спецификациям — критическая часть стратегии обеспечения качества. Производитель обосновывает перечень спецификаций, опираясь на результаты доклинических и клинических исследований, а также исследований стабильности, о которых мы поговорим ниже (см. главу «Стабильность»). В ходе изучения характеристик продукта выбирают наиболее полезные параметры, критически влияющие на качество.
У биологических препаратов, в отличие от малых молекул, нет полной зависимости между их структурными и функциональными свойствами. Кроме того, аналитическими методами невозможно изучить все параметры биопрепарата, значимые с точки зрения безопасности и эффективности. Поэтому спецификация — менее универсальный инструмент обеспечения качества биопрепаратов по сравнению с малыми молекулами. Для биопрепаратов особенное значение приобретают другие элементы обеспечения качества: контроль исходных материалов, контроль сырья, но особенно — контроль критичных показателей и валидация процесса производства . Весь комплекс мер по обеспечению качества лекарственного продукта называют стратегией контроля качества (см. видео).
Валидация процесса — это документальное доказательство того, что процесс надежно приводит к желаемому результату. Подробнее разобрана в статье «Наработка антител для доклинических и клинических испытаний» [1].
Рассмотрим теперь, как именно реализуются различные стороны стратегии контроля качества и что собой представляют главные параметры биотехнологических продуктов: подлинность, чистота, иммуногенность, биологическая активность и стабильность.
Показатели качества
Подлинность
Подлинность (identity) — это характеристики вещества, отличающие его от других веществ [7]. В случае антител дело осложняется тем, что не существует единственного теста, который бы позволил определить подлинность вещества, поэтому нужно проводить сразу много тестов [8].
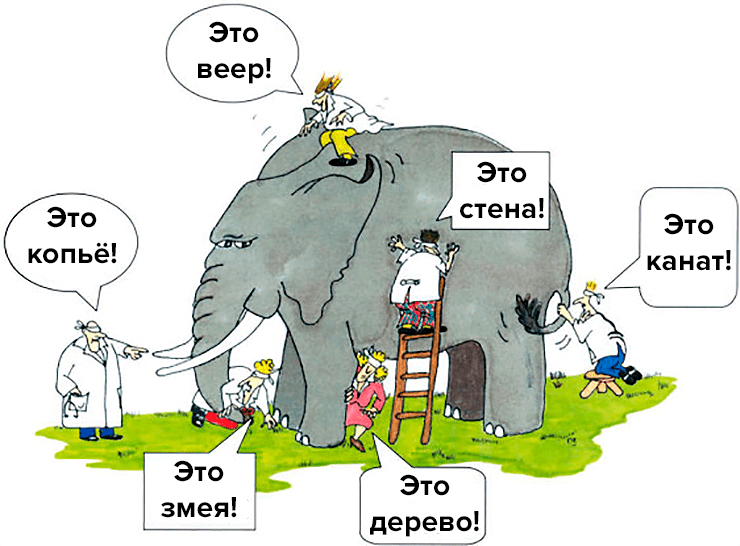
При аналитической характеристике белков часто вспоминают древнеиндийскую притчу о слепых мудрецах, которые ощупывали слона и спорили, потому что одному он напоминал змею, другому — сосну, третьему — стену, и так далее (рис. 1). Каждый аналитический метод дает фрагментарную информацию о свойствах продукта, но их совокупность позволяет в достаточной мере контролировать получение лекарства требуемого качества.
Рисунок 1. Слон и слепые мудрецы
Подлинность доказывают, изучая физико-химические свойства белка и его биологическую активность (см. главу «Биологическая активность»). В случае антител чаще всего используют такие физико-химические методы :
- колориметрические методы определения белка — например, метод Лоури, метод с бицинхониновой кислотой, метод Бредфорда (для определения общей концентрации белка) ;
- поглощение в УФ-области (для определения общей концентрации белка) [9];
- вестерн-блоттинг (для определения массы и иммунохимической подлинности) [10];
- иммуноферментный анализ, ИФА (для определения иммунохимической подлинности) [10];
- различные виды хроматографии (для определения молекулярной массы, профиля заряженных вариантов, профиля посттрансляционных модификаций и других вариантов) [11];
- масс-спектрометрию (для определения молекулярной массы, профиля гликозилирования, правильности образования дисульфидных связей) [12];
- N- и С-терминальное секвенирование [12];
- пептидное картирование (для определения первичной последовательности) [12];
- электрофорез в нативных и денатурирующих условиях (для определения массы, агрегатов, профиля гликозилирования и заряженных вариантов) [11];
- изоэлектрофокусирование (для определения заряженных вариантов) [9];
- динамическое рассеяние света (для определения гидродинамического радиуса молекулы). С использованием титрования этим методом можно определить истинную изоэлектрическую точку белка, что способствует подбору оптимальных условий стабилизации биомолекулы [13].
Колориметрические методы определения общего белка основаны на цветных реакциях белков с хромоген-образующими реактивами (восстановление меди при взаимодействии с пептидными связями и ее реакция с реактивом Фолина в методе Лоури или с бицинхониновой кислотой) или на неспецифическом связывании красителя (кумасси с аргинином и гидрофобными кислотами в методе Бредфорда).
ИФА (ELISA, enzyme-linked immunosorbent assay) подробно описан в статье того же спецпроекта «Иммунологические технологии» [10].
Вестерн-блоттинг
Лазерные сканеры Cytiva (например, Cytiva Typhoon FLA 9500; рис. 2) предназначены для широкого круга применений, таких как вестерн-блоттинг, флуоресцентные, хемилюминесцентные и радиоизотопные анализы. Разрешение до 10 мкм и линейность сигнала в диапазоне пяти порядков позволяют количественно регистрировать образцы в гелях, блотах, срезах тканей и микрочипах. Нижний предел обнаружения белка составляет 25 пг.
Рисунок 2. Лазерный сканер Cytiva Typhoon FLA 9500
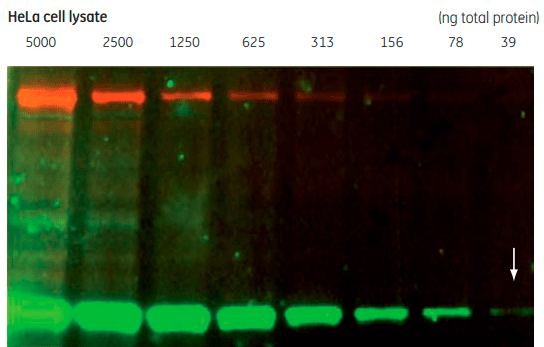
Наборы для вестерн-блота Cytiva Amersham ECL Plex, состоящие из первичных и вторичных флуоресцентно меченных антител, PVDF-мембраны Hybond , маркеров и реагентов, позволяют одновременно определять несколько белков (рис. 3).
PVDF (поливинилиденфторид) — инертный полимер, из которого, благодаря неспецифическому сродству к белкам, изготавливают мембраны для вестерн-блоттинга.
Рисунок 3. Одновременное определение трансферрина (красный) и GAPHD (зеленый) методом вестерн-блоттинга. Лизат клеток HeLa в различном разбавлении регистрировали с помощью вторичных антител, конъюгированных с флуоресцентными красителями красного (Cy5) и зеленого (Cy3) цветов.
Возможна установка и валидация Typhoon FLA 9500 в лабораториях, работающих по GCP, GLP и GMP .
Материал предоставлен партнёром — компанией Cytiva
Подлинность определяют на всех стадиях фармацевтической разработки, а часть методов используют для рутинного контроля серий при коммерческом производстве.
Чистота
При получении биофармацевтического препарата невозможно полностью удалить все примеси, поэтому их нужно тщательно охарактеризовать. Кроме того, важно доказать, что они не влияют на профиль эффективности и безопасности препарата.
Примеси могут быть как вариантами целевого продукта (образовавшимися в ходе его производства или деградации), так и веществами, привнесенными в процессе производства и очистки. Например, в случае антител обязательно контролируют наличие белка А, который используется на первой стадии очистки (см. статью «Биотехнология антител» [4]).
Не менее важно контролировать отсутствие вирусов и других патогенов. Их обнаружение в образце может привести к закрытию производства на 1–2 года, пока не будет проведена полная дезинфекция помещений и оборудования [6].
Клетки млекопитающих, в которых обычно производят антитела, как правило, содержат эндогенные ретровирусы. К тому же, вирусы могут попасть в препарат из внешней среды в процессе производства. Поэтому вирусная безопасность обеспечивается тремя способами [14]:
- проверкой исходных материалов на наличие вирусов;
- валидацией процесса производства на способность снижать количество вирусных частиц;
- тестированием продукта на наличие вирусов на разных стадиях производства.
Как было рассказано в статье «Наработка антител для доклинических и клинических испытаний» [1], очистку от вирусов или их инактивацию производят с помощью хроматографии, химической инактивации (детергентами, кислотами) и фильтрации. Регуляторные требования устанавливают предельное содержание вирусов на уровне не более одной частицы на миллион доз. Как правило, для этого необходимо снижать суммарное содержание вирусных частиц на 12–18 порядков. Контроль качества вирусной очистки проводят так: перед очередным этапом к промежуточному продукту добавляют вирусные частицы в известной концентрации. После очистки определяют остаточную концентрацию вируса и рассчитывают, на сколько порядков она снизилась [15]. Для такого исследования выбирают около десятка вирусов, которые с высокой вероятностью могут оказаться в продукте. Общее снижение подсчитывают, суммируя снижения на каждом этапе [14].
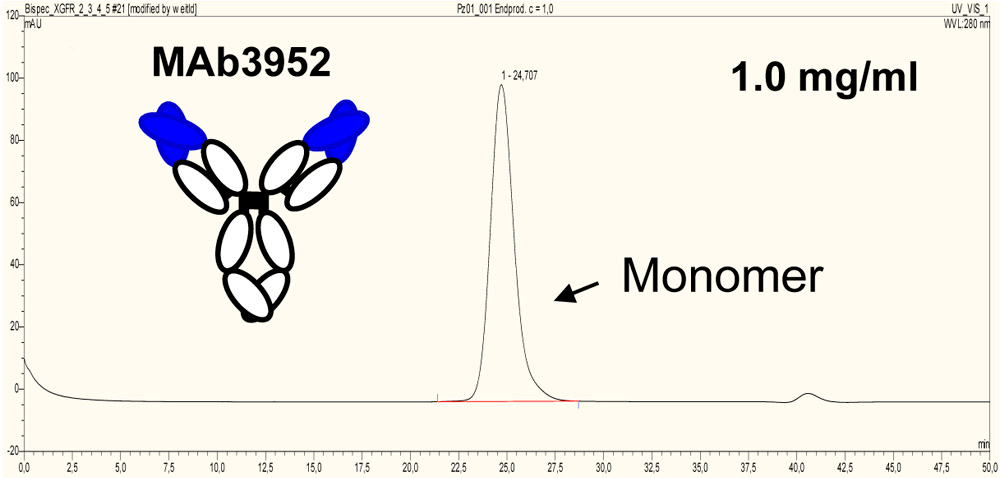
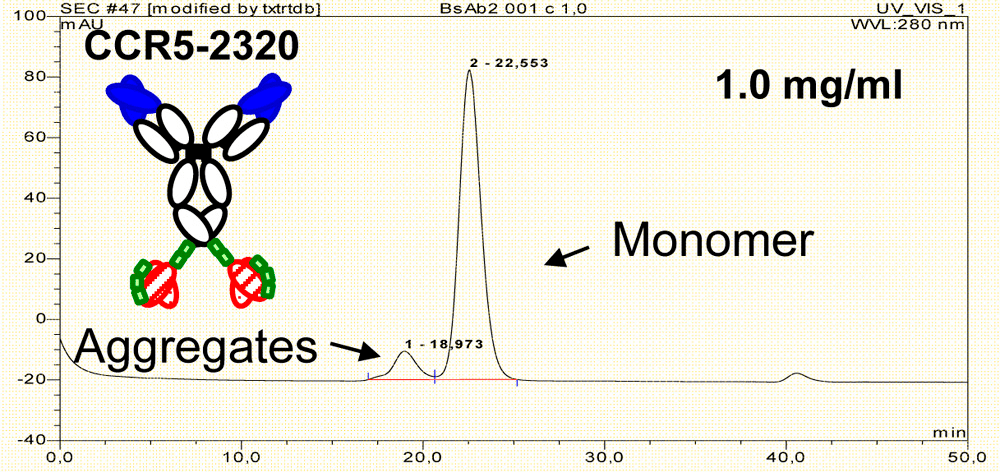
Агрегаты — еще одна примесь, которую обязательно контролируют в ходе производства антител. В одном из исследований было показано, что биспецифики более склонны к агрегации, чем антитела, на основе которых они получены. Однако предотвратить образование агрегатов можно введением в структуру биспецифика дополнительной дисульфидной связи (рис. 4).
Рисунок 4а. Профиль эксклюзионной хроматографии исходного антитела
Рисунок 4б. Профиль эксклюзионной хроматографии биспецифика
Источник