- Тестовые задания по аналитической химии
- Дистанционное обучение как современный формат преподавания
- Химия: теория и методика преподавания в образовательной организации
- Биология и химия: теория и методика преподавания в образовательной организации
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Общая информация
- Похожие материалы
- Презентация урока на тему «Гидролиз»
- Конспект урока на тему : «Строение атома»
- Практическая работа «Приготовление раствора соли с определенной массовой долей растворенного вещества «
- Урок-игра по теме «Типы химических реакций».
- Презентация по химии на тему «Азот и его соединения»
- Роль смыслового чтения в естественно – научном цикле обучения в средней школе.
- Презентация урока»Чистые вещества и смеси»
- Презентация по химии «Её величество Вода»
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Подарочные сертификаты
- Тесты по фармхимии. Общие методы и приемы анализа
Тестовые задания по аналитической химии
Новые аудиокурсы повышения квалификации для педагогов
Слушайте учебный материал в удобное для Вас время в любом месте
откроется в новом окне
Выдаем Удостоверение установленного образца:
Тестовые задания по аналитической химии.
I. Качественный анализ
1. Катион калия окрашивает пламя в:
б) оранжевый цвет
в) фиолетовый цвет
2. Катион серебра можно обнаружить:
а) раствором FeCl 3
б) раствором нитрата натрия
в) реакцией «серебряного зеркала»
г) раствором сульфата меди
3. Допишите уравнение, укажите эффект реакции:
4. Установите соответствие:
группа катионов групповой реактив
1) 2 группа а) Na OH
2) 3 группа б ) NH3
3) 4 группа в ) HCl
5. Групповой реактив I группы анионов:
6. Борноэтиловый эфир окрашивает пламя в цвет:
7) Хлорид серебра с раствором аммиака образует комплекс:
г) все нижеперечисленное верно
8) Групповой реактив на галогениды ( Cl — , Br — , J — ):
а) раствор хлорида железа ( III )
б) раствор перманганата калия
в) раствор нитрата натрия
г) раствор нитрата серебра
II . Количественный анализ
9) Среда более щелочная при рН, равном:
10) К методам осаждения относится:
11) Фенолфталеин в щелочной среде изменяет свой цвет на:
г) малиновый (розовый)
12) К кислотно-основным индикаторам относятся все, кроме:
б) метилового оранжевого
в) метилового красного
г) хромового темно-синего
13) Методом нейтрализации можно определить содержание всех лекарственных средств, кроме:
а) кислоты хлороводородной
б) натрия гидрокарбоната
в) натрия салицилата
г) натрия бромида
14) Установите соответствие:
перманганатометрии б) К MnO 4
2) рабочие вещества метода в) Na 2 C 2 O 4
15) Окислительно-восстановительным методом является:
16) Индикатор метода Фольгарда:
б) железо-аммонийные квасцы
в) эозинат натрия
17) Титрат прямого метода Фольгарда:
а) раствор нитрата ртути ( II )
б) раствор нитрата серебра
в) раствор роданида аммония
г) раствор нитрата ртути ( I )
18) Методом Фольгарда (прямое титрование) определяют содержание:
а) хлоридов, иодидов
б) хлоридов, бромидов
в) нитрата серебра
г) бромидов, йодидов
19) К адсорбционным индикаторам относятся:
б) метиловый оранжевый
в) эозинат натрия
20) Комплексонометрическим методом можно определить содержание всех лекарственных средств, кроме :
а) сульфата цинка
б) сульфата магния
в) хлорида кальция
г) хлорида калия
21) Титр соответствия рассчитывают по формуле:
N раб.р-ра Э опред.р-ра
б) Т = _________________________________
в) Т = ________________
г) Т = ________________________________
22) Титрант – это раствор:
а) исследуемого вещества
б) реагента с точной концентрацией
в) раствор стандартного вещества
г) все перечисленное верно
23) Для определения точки эквивалентности применяют:
а) раствор исследуемого вещества
б) раствор титранта
г) все перечисленное верно
24) Методом перманганатометрии можно определить:
25) Методом алкалиметрии можно определить:
а) из фиксаналов готовят растворы с К …
б) титр показывает содержание массы вещества в … раствор
27) Из 2,5000 г Na 2 CO 3 приготовлено 500 см 3 раствора. Вычислить для этого раствора.
28) Какие количества 80%-ного и 10%-ного раствора серной кислоты нужно взять для приготовления 1400 г 40%-ного раствора?
29) Вычислить массу КОН, содержащегося в навеске, если на ее титрование было израсходовано 19,44 см 3 раствора H 2 SO 4 с молярной концентрацией эквивалента 0,1410 моль/дм 3 .
Ответы к тестовым заданиям по аналитической химии.
3. BaSO 4 (белый нерастворимый в кислотах и щелочах)
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Химия: теория и методика преподавания в образовательной организации
Курс профессиональной переподготовки
Биология и химия: теория и методика преподавания в образовательной организации
Международная дистанционная олимпиада Осень 2021
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
также Вы можете выбрать тип материала:
Общая информация
Похожие материалы
Презентация урока на тему «Гидролиз»
Конспект урока на тему : «Строение атома»
Практическая работа «Приготовление раствора соли с определенной массовой долей растворенного вещества «
Урок-игра по теме «Типы химических реакций».
Презентация по химии на тему «Азот и его соединения»
Роль смыслового чтения в естественно – научном цикле обучения в средней школе.
Презентация урока»Чистые вещества и смеси»
Презентация по химии «Её величество Вода»
Не нашли то что искали?
Воспользуйтесь поиском по нашей базе из
5140635 материалов.
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Российские вузы начали усиливать охрану после стрельбы в Перми
Время чтения: 2 минуты
Игры со взрослыми полезнее для развития детей, чем игры со сверстниками
Время чтения: 2 минуты
В пяти регионах России протестируют новую систему оплаты труда педагогов
Время чтения: 2 минуты
Большинство учителей считают, что поступить на бюджет без репетитора не получится
Время чтения: 1 минута
Около 50% россиян поддерживают использование цифровых технологий в школе
Время чтения: 1 минута
Студент устроил стрельбу в Пермском государственном университете
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник
Тесты по фармхимии. Общие методы и приемы анализа
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
ТЕСТЫ ПО ФАРМХИМИИ
ТЕМА 1. Общие методы и приемы анализа качества лекарственных средств
1. Хлорид-ионы обнаруживают:
а) раствором серебра нитрата водным;
б) раствором серебра нитрата в присутствии аммиака;
+ раствором серебра нитрата в присутствии кислоты азотной;
г) раствором серебра нитрата в присутствии кислоты серной.
2. Один из перечисленных ионов дает белый осадок с раствором бария хлорида в присутствии кислоты хлороводородной:
а) нитрат-ион;
+ сульфат-ион;
в) фосфат-иои;
г) сульфид-ион.
3. Синее окрашивание раствора в присутствии аммиака дает:
а) ион серебра;
б) ион цинка;
в) ион железа;
+ ион меди.
4. Розовая окраска кадия перманганата исчезает:
а) в присутствии кислоты азотной;
б) в присутствии кислоты серной;
в) в присутствии натрия сульфата и кислоты серной;
+ в присутствии натрия нитрита и кислоты серной.
5. Из перечисленных лекарственных веществ проявляют как окислительные, так и восстановительные свойства:
а) калия перманганат;
+ водорода пероксид;
в) натрия нитрит;
г) кадия йодид.
6. Ион аммония можно обнаружить:
а) раствором бария хлорида;
+ реактивом Несслера;
в) раствором калия йодида;
г) раствором кадия перманганата.
7. Кислую реакцию среды имеет раствор;
а) натрия гидрокарбоната;
б) кальция хлорида;
+ цинка сульфата;
г) натрия хлорида.
8. Одно из лекарственных веществ темнеет при действии восстановителей;
а) кадия иодид;
+ серебра нитрат;
в) натрия бромид;
г) фенол.
9. Одно из лекарственных веществ при хранении розовеет вследствие окисления:
+ резорцин;
б) натрия хлорид;
в) серебра нитрат;
г) бария сульфат для рентгеноскопии.
10. Внешний вид «резорцина» изменился при хранении вследствие окисления. Метод для определения допустимого предела изменения данного лекарственного вещества:
а) определение pH;
б) определение степени мутности;
+ определение окраски;
г) определение золы.
11. Одним из перечисленных реактивов можно определить примесь йодидов в ЛС калия бромид, основываясь на различной способности этих двух веществ к окислению:
а) калия перманганат;
+ железа (III) хлорид;
в) раствор йода;
г) серебра нитрат.
12. Одно из перечисленных лекарственных веществ при хранении изменяет внешний вид вследствие потери кристаллизационной воды:
а) кальция хлорид;
+ меди сульфат;
в) натрия йодид;
г) калия хлорид.
13. Одним из перечисленных реактивов можно открыть примесь броматов в ЛС калия бромид;
а) серебра нитрат;
+ кислота серная;
в) бария хлорид;
г) аммония оксалат.
14. ГФ требует определять цветность Л С калия бромид, так как данное вещество может:
а) восстанавливаться;
+ окисляться;
в) подвергаться гидролизу;
г) взаимодействовать с углекислотой воздуха с образованием окрашенных продуктов.
15. Одним из перечисленных реактивов можно открыть примесь йодатов в ЛС калия йодид:
а) аммония оксалат;
б) натрия гидроксид;
в) раствор аммиака;
+ кислота хлороводородная.
ТЕМА 2. Анализ лекарственных средств неорганической природы. Препараты водорода пероксида. Производные галогенов. Натрия нитрит. Натрия тиосульфат
Тестовые задания
1. Окрашенным лекарственным веществом является:
+ йод;
б) калия хлорид;
в) натрия хлорид;
г) натрия йодид,
2. При добавлении к раствору лекарственного вещества кислоты азотной разведенной и раствора серебра нитрата образуется белый творожистый осадок, растворимый в растворе аммиака:
а) натрия йодид;
б) калия йодид;
+ натрия хлорид;
г) раствор йода спиртовый 5%.
3. При добавлении к раствору лекарственного вещества раствора хлорамина в присутствии кислоты хлороводородной и хлороформа (при взбалтывании) хлороформный слой окрашивается в желто-бурый цвет:
а) калия йодид;
б) натрия хлорид;
в) натрия фторид;
+ натрия бромид.
4. При взаимодействии кислоты хлористоводородной разведенной с марганца (IV) оксидом выделяется:
а) кислород;
+ хлор;
в) хлора (I) оксид;
г) хлора (VII) оксид.
5. Примесь йодидов в препаратах калия бромид и натрия бромид определяют реакцией с:
а)серебра нитратом;
б) хлорамином;
в) кислотой серной концентрированной;
+ железа (III) хлоридом.
6. В химических реакциях проявляют свойства как окислителя, так и восстановителя:
а) калия йодид;
+ натрия нитрит;
+ раствор водорода пероксида;
г) натрия хлорид.
7. При добавлении растворов ализаринсульфоната натрия и циркония нитрата к раствору какого лекарственного вещества возникает красное, переходящее в желтое, окрашивание:
а) натрия хлорида;
б) калия хлорида;
+ натрия фторида;
г) натрия йодида.
8. При добавлении растворов кислоты виннокаменной и натрия ацетата к раствору какого лекарственного вещества постепенно выпадает белый кристаллический осадок, растворимый в разведенных минеральных кислотах и щелочах:
+ калия хлорида;
б) натрия фторида;
в) кислоты хлористоводородной разведенной;
г) натрия бромида.
9. От прибавления к подкисленному раствору калия бромида нескольких капель раствора железа (III) хлорида и раствора крахмала появляется синее окрашивание. Это свидетельствует о наличии в лекарственном средстве примеси:
а) сульфатов;
+ йодидов;
в) броматов;
г) хлоридов.
10. От прибавления к раствору натрия бромида кислоты серной концентрированной раствор окрашивается в желтый цвет. Это свидетельствует о наличии примеси:
+ броматов;
б) йодидов;
в) сульфатов;
г) хлоридов.
11. От прибавления к раствору калия хлорида кислоты серной разведенной наблюдается помутнение. Это свидетельствует о наличии в ЛС следующей примеси:
+ солей бария;
б) солей железа;
в) солей аммония;
г) хлоридов.
12. К раствору ЛС прибавляют раствор йодида калия и титруют раствором натрия тиосульфата до обесцвечивания без индикатора. Это метод количественного определения:
+ раствора йода спиртового 10%;
б) кислоты хлористоводородной разведенной;
в) натрия хлорида;
г) натрия бромида.
13. К раствору лекарственного вещества добавляют уксусный ангидрид, кипятят, охлаждают и титруют кислотой хлорной. Это метод количественного определения:
а) натрия хлорида;
+ натрия фторида;
в) натрия бромида;
г) натрия йодида.
14. Необходимым условием титрования лекарственных веществ группы хлоридов и бромидов методом Мора является:
а) кислая реакция среды;
б) щелочная реакция среды;
в) присутствие кислоты азотной;
+ реакция среды близкая к нейтральной.
ТЕМА 3. Анализ натрия гидрокарбоната, лития карбоната, солей магния и кальция, бария сульфата, производных бора
1. Щелочную реакцию среды водного раствора имеют:
а) натрия хлорид;
б) магния сульфат;
+ натрия тетраборат;
г) натрия гидрокарбонат.
2. Кислую реакцию среды водного раствора имеют:
а) натрия тетраборат;
+ кислота хлористоводородная;
в) кальция хлорид;
+ кислота борная.
3. Выделение пузырьков газа наблюдают при добавлении кислоты хлороводородной к:
+ лития карбонату;
б) магния сульфату;
в) натрия тетраборату;
г) раствору водорода пероксида,
4. Примесь минеральных кислот в кислоте борной можно определить по:
а) фенолфталеину;
б) лакмусу красному;
+ метиловому оранжевому;
+ лакмусу синему.
5. Количество примеси карбонатов в натрия гидрокарбонате устанавливают:
а) титрованием кислотой;
б) по реакции с насыщенным раствором магния сульфата;
в) по окраске фенолфталеина;
+ прокаливанием,
6. Бария сульфат для рентгеноскопии:
а) растворим в кислоте хлороводородной;
б) растворим в щелочах;
в) растворим в аммиаке;
+ нерастворим в воде, кислотах и щелочах.
7. Количественное определение натрия гидрокарбоната проводят методом:
а) алкалиметрии;
+ ацидиметрии (прямое титрование);
в) ацидиметрии (обратное титрование);
г) комплексонометрии.
8. При растворении в воде подвергаются гидролизу:
+ натрия нитрит;
б) кальция хлорид;
в) натрия гидрокарбонат;
+ натрия тетраборат.
9. Количественное определение ацидиметрическим методом (обратное титрование) проводят для:
а) натрия тетрабората;
б) натрия гидрокарбоната;
+ лития карбоната;
г) натрия нитрита.
10. В препаратах кальция катион Са2+ можно доказать по:
+ окрашиванию пламени;
б) реакции с аммиакаом;
+ реакции с аммония оксалатом;
г) реакции с кислотой хлороводородной.
11. Общими реакциями на препараты бора являются:
+ образование сложного эфира с этанолом;
б) реакция с кислотой хлороводородной:
+ реакция с куркумином;
г) реакция с аммония оксалатом.
12. При неправильном хранении изменяют свой внешний вид:
+ натрия тетраборат;
+ калия йодид;
+ кальция хлорид;
+ магния сульфат.
13. В виде инъекционных растворов применяются:
+ магния сульфат;
+ кальция хлорид;
+ натрия хлорид;
г) натрия тетраборат.
14. С помощью метода комплексонометрии количественно определяют:
+ магния сульфат;
+ кальция хлорид;
в) лития карбонат;
г) натрия тетраборат.
15. Завышенный результат количественного определения вследствие неправильного хранения может быть у:
а) кальция хлорида;
+ натрия тетрабората;
в) магния сульфата;
г) кислоты борной.
16. При количественном определении кислоты борной для усиления кислотных свойств добавляют:
+ глицерин;
б) спирт этиловый;
в) раствор аммиака;
г) хлороформ.
17. Не пропускает рентгеновские лучи и применяется при рентгенологических исследованиях:
а) лития карбонат;
б) натрия тетраборат;
+ бария сульфат;
г) кислота борная.
18. Доказательство иона лития проводят реакцией с:
а) сульфат-ионом;
б) фосфат-ионом в кислой среде;
в) фосфат- ионом в щелочной среде;
+ фосфат-ионом в нейтральной среде.
19. Общей реакцией на натрия гидрокарбонат и лития карбонат является реакция с:
+ кислотой хлороводородной;
б) раствором натрия гидроксида;
в) раствором аммиака;
г) реакция окрашивания пламени в желтый цвет.
20. В отличие от натрия гидрокарбоната, используемого для приема внутрь, натрия гидрокарбонат, используемый в инъекционных растворах, должен:
а) не содержать примеси хлоридов;
+ быть бесцветным;
+ быть прозрачным;
г) иметь нейтральную реакцию среды.
21. Для доказательства бария сульфата для рентгеноскопии препарат предварительно:
а) растворяют в кислоте;
б) растворяют в щелочи;
в) кипятят с кислотой;
+ кипятят с натрия карбонатом.
22. Характерную окраску пламени дают:
+ кальция хлорид;
+ натрия гидрокарбонат;
+ лития карбонат;
г) магния сульфат.
23. Осадки гидроксидов с аммиаком дают:
+ мантия сульфат;
б) кальция хлорид;
в) лития карбонат;
г) бария сульфат.
24. С кислотой хлороводородной реагируют:
+ натрия тиосульфат;
+ натрия гидрокарбонат;
в) бария сульфат;
+ лития карбонат.
25. Примесь фосфатов в бария сульфате для рентгеноскопии определяют с:
а) молибдатом аммония;
б) молибдатом аммония в щелочной среде;
+ молибдатом аммония в азотнокислой среде;
г) сульфатом магния.
ТЕМА 4. Анализ соединений висмута, цинка, меди, серебра, железа, комплексных соединений железа, платины и гадолиния
Тестовые задания
1. Кислую реакцию среды водного раствора имеют препараты:
+ цинка сульфат;
+ серебра нитрат;
в) натрия гидрокарбонат;
г) кальция хлорид.
2. В химическом отношении продуктом гидролиза является:
а) натрия тиосульфат;
+ висмута нитрат основной;
в) бария сульфат;
г) натрия тетраборат.
3. Перечисленные лекарственные вещества, кроме одного, могут проявлять в химических реакциях свойства восстановителя:
а) водорода пероксид;
б) железа (II) сульфат;
в) калия йодид;
+ серебра нитрат.
4. С раствором аммиака комплекс синего цвета образует лекарственное вещество:
а) серебра нитрат;
б) цинка сульфат;
в) висмута нитрат основной;
+ меди сульфат.
5. С калия йодидом в водном растворе образует осадок, растворяющийся в избытке реактива:
+ висмута нитрат основной;
б) серебра нитрат;
в) меди сульфат;
г) железа сульфат.
6. Для проведения испытания подлинности и количественного определения препарата требуется предварительная минерализация:
а) висмута нитрата основного;
+ протаргола;
в) цинка оксида;
г) бария сульфата.
7. При количественном определении железа сульфата, цинка сульфата, натрия тетрабората, меди сульфата, натрия тиосульфата завышенный результат может быть получен из-за:
а) поглощения влаги;
+ потери кристаллизационной воды;
в) гидролиза;
г) поглощения оксида углерода (IV).
8. Методом комплексонометрии в кислой среде количественно определяют:
а) цинка оксид;
б) магния оксид;
в) магния сульфат;
+ висмута нитрат основной.
9. Метолом комплексонометрии в присутствии гексаметилентетрамина количественно определяют:
а) магния сульфат;
+ цинка оксид;
в) кальция хлорид;
г) висмута нитрат основной.
10. По списку А хранят:
а) бария сульфат;
б) цинка сульфат;
+ серебра нитрат;
г) натрия тетраборат.
11. Серебра нитрат по НД количественно определяют методом:
а) меркуриметрии;
б) аргентометрии;
в) йодометрии,
+ тиоцианатометрии.
12. Метолом перманганатометрии можно количественно определить все лекарственные вещества, кроме:
а) железа сульфата;
б) натрия нитрита;
+ серебра нитрата;
г.) раствора пероксида водорода.
13. Заниженный результат при количественном определении железа (II) сульфата был получен в результате:
а) восстановления препарата;
+ окисления препарата;
в) гигроскопичности препарата;
г) выветривания препарата.
14. Для цинка оксида, магния сульфата, висмута нитрата основного, кальция хлорида общим методом количественного определения является:
а) гравиметрия;
б) перманганатометрия;
в) йодометрия;
+ комплексономстрия.
15. Описание свойств: «белый аморфный или кристаллический порошок; практически нерастворимый в воде: смоченный водой окрашивает синюю лакмусовую бумагу в красный цвет» соответствует лекарственному веществу:
а) магния сульфату;
б) колларголу;
+ висмута нитрату основному:
г) цинка оксиду.
16. В химических реакциях проявляют свойства как окислителя, так и восстановителя ЛС:
а) калия йодид;
+ натрия нитрит;
+ раствор водорода пероксида;
г) серебра нитрат.
17. При количественном определении меди сульфата, магния сульфата, натрия тетрабората, цинка сульфата завышенный результат может быть получен в следствие:
а) поглощения влаги;
+ потери кристаллизационной воды;
в) гидролиза;
г) поглощения диоксида углерода.
18. Одно из лекарственных веществ не может быть использовано в качестве и ЛС, и реактива, и титрованного раствора:
а) кислота хлороводородная;
б) калия перманганат;
+ раствор аммиака;
г) натрия нитрит.
ТЕМА 5. Анализ лекарственных средств группы алифатических алканов, их галогено- и кислородсодержащих соединений
Тестовые задания
1. Формальдегид легко вступает в реакции:
+ присоединения;
+ окислительно-восстановительные:
в) замещения;
г) обмена.
2. Все лекарственные вещества представляют собой белые кристаллические порошки, кроме:
а) лактозы;
б) хлоралгидрата;
+ фторогаяа;
г) гексаметилентетрамина.
3. Наличие перекисных соединений как недопустимой примеси в эфире для наркоза определяют по реакции с:
а) калия перманганатом в кислой среде;
б) натрия гидроксидом;
+ калия йодидом;
г) кислотой хромотроповой.
4. И соли аммония, и параформ определяют в одном из ЛС:
а) спирте этиловом;
б) растворе формальдегида;
+ гесаметилентетрамине;
г) глюкозе.
5. Реакцию образования йодоформа нельзя использовать для определения:
а) подлинности этанола;
б) примеси хлоралкоголята в хлоралгидрате;
в) подлинности лактат-иона
+ примеси метанола в спирте этиловом
6. Формула для расчета концентрации раствора С = n-n0 / F применяется при использовании:
+ рефрактометрии;
б) поляриметрии;
в) полярографии;
г) спектрофотометрии
7. Удельный показатель поглощения это:
+ оптическая плотность раствора, содержащего 1 г вещества в 100 мл раствора при толщине слоя 1 см;
б) показатель преломления раствора;
в) угол поворота плоскости поляризации монохроматического света на пути длиной в 1 дм и условной концентрации 1 г/мл;
г) фактор, равный величине прироста показателя преломления при увеличении концентрации на 1%.
8. Для обнаружения альдегидов как примеси в других ЛС используют наиболее чувствительную реакцию с:
а) реактивом Фелинга;
б) реактивом Толленса;
в) кислотой салициловой в присутствии кислоты серной;
+ реактивом Несслера.
9. При хранении раствора формальдегида в нем образовался белый осадок. Это обусловлено:
а) хранением препарата при температуре выше 9 °С;
+ хранением при температуре ниже 9 °С;
в) хранением при доступе влаги;
г) хранением в посуде светлого стекла.
10. Натрия гидрокарбонат и натрия метабисульфит одновременно добавляют для стабилизации раствора для инъекций:
+ кислоты аскорбиновой;
б) магния сульфата;
в) гексаметилентетрамина:
г) глюкозы.
11. С реактивом Фелинга не реагирует:
а) глюкоза;
б) раствор формальдегида;
в) лактоза;
+ калия ацетат.
12. В реакцию Малапрада вступает лекарственное вещество:
а) хлоралгидрат;
б) калия ацетат;
в) гексаметилентетрамин;
+ глицерин.
13. Количественное определение кислоты аскорбиновой можно
проводить методами:
а) ацидиметрии;
+ алкалиметрии;
+ йодометрии;
+ йодатометрии.
14. Количественное определение калия ацетат можно проводить методами:
а) йодометрии;
б) нитритометрии;
+ кислотно-основного титрования в неводной среде;
+ ацидиметрии.
15. Значение величины М (1/z) кислоты аскорбиновой при йодатометрическом количественном определении равно:
а) 1 М кислоты аскорбиновой;
+ 1/2 М кислоты аскорбиновой;
в) 1/3 М кислоты аскорбиновой;
г) 1/4 М кислоты аскорбиновой.
ТЕМА 6. Анализ лекарственных средств группы алифатических карбоновых кислот и оксикислот, кислоты аскорбиновой, алифатических аминокислот и их производных
Тестовые задания
1. Комплексонометрическим методом определяют лекарственные вещества:
а) кислоту аскорбиновую;
б) калия ацетат;
+ кальция глюконат;
+ магния сульфат.
2. Выражеными восстановительными свойствами обладают ЛС:
+ калия йодид;
+ кислота аскорбиновая;
в) натрия хлорид;
+ раствор формальдегида.
3. Кислота аскорбиновая образует соль с реактивом:
а) железа (III) хлоридом;
б) серебра нитратом;
в) железа (II) сульфатом;
+ натрия гидрокарбонатом.
4. Методом кислотно-основного титрования количественно определяют:
+ калия ацетат;
б) серебра нитрат;
+ аминалон;
г) раствор тетацина кальция.
5. Для консервирования крови используют:
а) кислоту глутаминовую;
б) кальция хлорид;
+ натрия цитрат для инъекций;
г) калия ацетат.
6. Витаминным средством является:
а) аминалон:
б) пирацетам;
в) кислота глутаминовая;
+ кислота аскорбиновая.
7. Для количественного определения аминалона можно использовать:
+ метод кислотно-основного титрования в неводных средах;
б) комплексонометрию;
+ алкалиметрию в присутствии формальдегида;
г) аргентометрию.
8. С раствором меди сульфата в определенных условиях реагируют:
+ кислота глутаминовая;
+ глюкоза:
+ калия йодид;
г) магния сульфат.
9. Кислоту аскорбиновую количественно можно определить:
+ алкалиметрически;
б) аргентометрически;
+ йодометрически;
+ йодатометрически.
10. Щелочную реакцию среды водного раствора имеет;
а) натрия хлорид;
б) калия бромид;
+ калия ацетат;
г) натрия гидрокарбонат.
11. Кислую реакцию среды водного раствора имеют:
+ кислота аскорбиновая;
б) аминалон;
+ кислота глутаминовая;
г) кальция лактат.
12. С раствором железа (III) хлорида реагируют:
+ кислота аскорбиновая;
+ кальция глюконат;
+ калия ацетат;
+ калия йодид.
13. Амфолитами являются:
+ цинка оксид;
+ аминалон;
в) кислота аскорбиновая;
г) калия ацетат.
14. Реакции окисления используют в анализе лекарственных веществ:
+ калия йодида;
+ глюкозы;
+ хлоралгидрата;
+ кислоты аскорбиновой.
15. Метод йодометрии используют для количественного определения:
а) натрия бромида;
+ метионина;
+ цистеина;
+ кислоты аскорбиновой.
16. Серосодержащими аминокислотами являются:
а) кислота аскорбиновая;
б) аминалон;
+ метионин;
+ цистеин.
17. Метод Кьельдаля используют для количественного определения:
а) нитроглицерина;
+ пирацетама;
в) раствора формальдегида:
+ аминалона.
18. Гидроксамовую реакцию дают:
а) кальция лактат;
б) аминалон;
+ пирацетам:
г) калия ацетат.
19. Кислотные свойства кислоты аскорбиновой обусловлены наличием в структуре:
а) фенольных гидроксилов;
б) одного енольного гидроксила;
+ 2 енольных гидроксилов;
г) лактонного кольца.
20. При количественном определении метионина йодометрическим методом образуется:
а) сероводород;
б) дисульфид метионина;
+ сульфоксид метионина;
г) сульфат метионина.
21. Оптически активными веществами являются:
+ кислота глутаминовая;
+ метионин;
+ кислота аскорбиновая;
г) калия ацетат.
22. Щелочному гидролизу подвергаются:
а) калия ацетат;
+ нитроглицерин;
в) кислота аскорбиновая;
+ пирацетам.
23. При сплавлении со щелочью меркаптаны образует:
а) аминалон;
+ метионин;
в) кислота глутаминовая;
г) раствор тетацина кальция для инъекций.
24. Значение удельного вращения определяют у:
+ метионина;
б) калия ацетата;
в) спирта этилового;
+ кислоты глутаминовой.
25. Двухосновной аминокислотой является:
а) аминалон;
б) пирацетам;
+ кислота глутаминовая;
г) метионин.
ТЕМА 7. Анализ производных б-лактамидов и аминогликозидов
Тестовые задания
1. Солью азотсодержащего органического основания является:
+ стрептомицина сульфат;
б) феноксиметилпенициллин;
в) оксациллина натриевая соль;
г) цефалотина натриевая соль.
2. По химическому строению гликозидом является:
а) цефалексин;
б) феноксиметилпенициллин;
+ амикацина сульфат;
г) карбенициллина динатриевая соль.
3. К группе б-лактамидов относится:
а) канамицина сульфат:
+ цефалексин;
в) амикацина сульфат;
г) гентамицина сульфат,
4. Полусинтетическим пенициллином не является:
а) оксациллина натриевая соль;
+ феноксиметилпенициллин;
в) клоксациллина натриевая соль;
г) ампициллин.
5. Лекарственное вещество белого цвета, растворимо в воде, при взаимодействии с I-нафтолом и натрия гипохлоритом дает красное окрашивание. Это;
а) цефалотина натриевая соль;
б) оксациллина натриевая соль:
+ стрептомицина сульфат;
г) феноксиметилпенициллин,
6. Лекарственное вещество белого цвета, растворимо в воде, при нагревании с натрия гидроксидом и последующем добавлении кислота хлороводородной и железа (III) хлорида образуется фиолетовое окрашивание. Это:
+ стрептомицина сульфат;
б) амоксициллина тригидрат;
в) бензилпенициллина натриевая соль;
г) карбенициллина динатриевая соль.
7. Амфотерный характер проявляют лекарственные вещества:
а) бензилпенициллина натриевая соль;
+ феноксиметилпенициллин;
в) стрептомицина сульфат;
г) цефалексин,
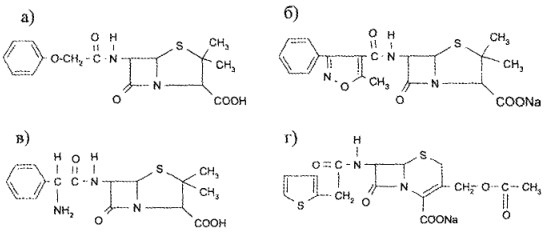
8. На основании приведенных химических структур лекарственных веществ укажите те, которые дают реакцию с нингидрином: ответ В
9. Получение гидроксаматов железа (III) или меди (II) возможно для:
+ оксациллина натриевой соли;
+ цефалексина;
+ бензилпенициллина;
+ феноксяметилпенициллина.
10. Изменение химической структуры под действием щелочей происходит у лекарственных веществ:
а) канамицина сульфата;
+ цефалексина;
+ феноксиметилпенициллина;
г) стрептомицина сульфата.
11. Феноксиметилпенициллин можно отличить от бензилпенициллина натриевой соли по:
+ реакции с кислотой хромотроповой;
б) внешнему виду;
в) растворимости в воде;
г) гидроксамовой реакции.
12. Укажите лекарственные вещества, в анализе которых используется метод УФ-спектроскопии:
+ феноксиметилпенициллин;
+ цефалексин;
+ бензилпенициллина калиевая соль;
+ оксациллина натриевая соль.
13. Для количественного определения бензилпенициллина натриевой соли можно применить методы:
+ гравиметрический;
+ йодиметрический;
+ микробиологический;
г) нитритометрический.
14. Для количественного определения оксациллина натриевой соли можно применить методы:
а) нейтрализации;
б) УФ-спектрофотометрии;
в) ФЭК;
г) нитритометрии.
15. Бензилпенициллина калиевая соль несовместима в водных растворах с:
а) натрия хлоридом;
б) натрия гидрокарбонатом;
в) новокаином;
+ адреналина гидрохлоридом.
Источник