Стимуляторы эритропоэза ( по материалам статьи David Goldsmith )
Опубликовано пн, 24/02/2020 — 10:29
Эпоэтины были впервые использованы в 1986 году у человека для повышения гематокрита. В то время пациенты, находящиеся на почечном диализе (заместительной почечной терапии) обычно были очень анемичными (с типичными уровнями гемоглобина 4–8 г / дл), часто получавшими переливания крови (с сопутствующими хроническими опасностями перегрузки железом, вирусными инфекциями и аллосенсибилизацией) и определенной симптоматикой (усталость, недостаток выносливости и легкая усталость). Эпоэтины — одни из самых ранних успешно используемых биофармацевтических препаратов, должны были, по-видимому, значительно помочь в клиническом лечении пациентов с хроническим заболеванием почек, что действительно (и остается) имело место.В те первые дни резкое сокращение (но никогда не отмена) необходимости регулярных переливаний крови и способность лечить пациентов со значительно более высоким гематокритом оказали огромное влияние на пациентов и всех тех, кто был связан с их хроническим лечением.
Первоначальный энтузиазм в отношении этого нового подхода почти полностью основывался на демонстрации предотвращения переливания крови и на ограниченных наборах данных, показывающих улучшение толерантности к физической нагрузке, пройденного расстояния, качества жизни и улучшение размеров и производительности левого желудочка. Профиль побочных эффектов искусственной инженерии более высокого гематокрита с использованием эпоэтина был очевиден с самого начала.
Один из первых уроков, еще не полностью освоенных, заключается в том, что хроническое заболевание почек — это не состояние абсолютного недостатка циркулирующего эритропоэтина, а часто состояние постоянной и очень вариабельной резистентности к эритропоэтину. Основной причиной этого является дефицит железа ( ab initio или вследствие стимулированного эритропоэза), хотя существует много других потенциальных причин устойчивости к эндогенному эритропоэтину, а также к эпоэтинам. Однако, мы не знаем как лучше всего использовать эти биологически мощные и плейотропные синтетические гормоны — эпоэтины — в клинической практике. Сейчас много написано о взлетах и падениях эпоэтинов . Недавняя работа McFarland и его коллег, использующая многолетние данные, полученные из DOPPS , рассказывает замечательную историю о быстром усвоении эпоэтинов, о быстром увеличении уровней гемоглобина у субъектов и огромное увеличение доз различных используемых эпоэтинов и эритропоэз-стимулирующих агентов (ESAs) (и, конечно, за счет увеличения стоимости их медицинского обслуживания, если это не компенсируется улучшением клинических результатов). Сегодня возникает подозрение, что не все хорошо с нашим нынешним понимание того, как и когда пытаться изменить гематокрит с помощью ESA у субъектов с хроническим заболеванием почек. Риск начала использования эпоэтина у пациентов с хроническим заболеванием почек является значительным, и, что особенно важно, без информации на уровне пациента, которая может нам помочь, баланс между риском и вредом для каждого пациента достаточно размыт. Нацеливание на более высокие уровни гемоглобина при хроническом заболевании почек повышает риск развития инсульта, гипертонии и тромбоза сосудов и, вероятно, повышает риск смерти, серьезных сердечно-сосудистых событий и терминальной стадии почечной недостаточности.
Вероятно, лечение пациентов с хроническим заболеванием почек эпоэтинами только для «коррекции» уровня гемоглобина или для соблюдения рекомендаций не является хорошим лекарством, так же как и решение о необходимости диализа для пациента на основе исключительно измерений СКФ. Некоторые исследователи утверждает, что нижний предел для гемоглобина потенциально может быть установлен на таком уровне, который не приводит к заметному увеличению связанной с переливанием аллосенсибилизации. Конечно, эпоэтины не отменяют, а значительно снижают показатели переливания крови. Тем не менее, некоторые оговорки должны быть введены. Во-первых, влияние лейкодеплированной крови на иммунологическую систему является комплексным: донор-специфическое переливание или одно несоответствующее переливание HLA-DR может быть безвредным или полезным, и этот эффект может варьироваться между мужчинами и женщинами. Беременность / аборт остаются самым большим фактором риска аллосенсибилизации. Во-вторых, в Великобритании только
50% пациентов, находящихся на диализе, попадают в лист ожидания по пересадке почки, и из них только 25% или около того перенесли пересадку через 2 года после включения в список ожидания.
Возникает ряд вопросос , на которые следует ответить. Что такое «эффект взаимодействия между целевым гемоглобином, достигнутым гемоглобином и дозой эпоэтина»? На это можно частично ответить путем рандомизации пациентов с эпоэтином «низкой дозы» по сравнению с эпоэтином «высокой дозы» (со строгими мерами безопасности). Что такое «идеальная парадигма лечения анемии»? Является ли она тщательным пополнением запасов железа и устранением других причин резистентности к эритропоэтину, а также ожиданием того, как это повлияет на концентрации гемоглобина, по сравнению с ранним одновременным применением железа и эпоэтинов? Что такое «идеальная продолжительность фазы коррекции» и «максимальная скорость роста гематокрита» (при любом вмешательстве)? Если мы возьмем пример гипонатриемии на мгновение, более важно избежать быстрого повышения уровня натрия в плазме с течением времени, чем стремиться к какому-либо конкретному целевому уровню натрия в плазме. Каковы патомеханизмы и маркеры «сосудистого повреждения, вызванного эпоэтином»? Нам нужны подробные исследования о влиянии эпоэтина на эндотелий сосудов, на конкретные сосудистые русла (например, мозг и сердце) и особенно на количество и функцию тромбоцитов. Нам также необходимо понять, способствует ли одновременное применение высоких доз внутривенных добавок железа с высокими дозами внутривенного эпоэтина неблагоприятным изменениям в количестве и функции тромбоцитов, количестве и функциях эндотелиальных клеток и показателях окислительного стресса. «Идеальный гематокрит может варьироваться» от пациента к пациенту и даже у одного и того же пациента в зависимости от клинической ситуации. Это может означать, что кому-то, кто проходил лечение по одному значению гемоглобина, может потребоваться новое целевое значение, если клиническая ситуация изменяется, например, после инсульта или инфаркта миокарда, или с интеркуррентными заболеваниями. Что является непростой задачей, так это то, что в наше время мы можем быть уверены только в том, что уровни гемоглобина 13 г / дл могут быть вредными, но клиническое влияние того, что находится между… где
75–85% показателей гемоглобина у современных пациентов с хронической болезнью почек далеко не ясно. Все нефрологи наверняка согласятся, что повышение гемоглобина с 6 до 9 г / дл будет иметь реальную пользу для пациентов , даже , если оно достигается реальными различными способами, это одно, но двигаться вверх еще на 3 г / дл от исходного гемоглобина 9 г / дл. до 12 г / дл (который требует гораздо больше эпоэтина и железа) дает в лучшем случае лишь скромную выгоду.
Источник
Средства, влияющие на эритропоэз
Из стимуляторов эритропоэза, применяемых при гипохромной анемии, основную роль играют препараты железа.
Основой развития гипохромной анемии является недостаточная продукция гемоглобина эритробластами костного мозга в связи с дефицитом железа или с нарушением его метаболизма.
Железо содержится в организме в количестве 2—5 г. Основная его часть (2/3) входит в состав гемоглобина. Остальная часть находится в тканевых депо (в костном мозге, печени, селезенке). Железо входит также в состав миоглобина и ряда ферментов.
Из желудочно-кишечного тракта всасывается только ионизированное железо, причем лучше всего в виде двухвалентного иона (схема 18.1). В связи с этим наличие хлористоводородной кислоты (переводит молекулярное железо в ионизированную форму) и аскорбиновой кислоты (восстанавливает трехвалентное железо в двухвалентное) способствует всасыванию железа из пищеварительного тракта. Всасывание происходит главным образом в тонкой кишке (особенно в двенадцатиперстной кишке) за счет активного транспорта и, возможно, путем диффузии. Содержащийся в слизистой оболочке кишечника белок апо-ферритин связывает часть всасывающегося железа, образуя с ним комплекс — ферритин. После прохождения кишечного барьера железо в сыворотке крови вступает в связь с Р,-глобулином — трансферрином. В виде комплекса с транс-феррином железо поступает к различным тканям, где вновь высвобождается. В костном мозге оно включается в построение гемоглобина. Что касается тканевых депо, то в них железо находится в связанном состоянии (в виде ферритина или гемосидерина).
Интенсивность всасывания железа в значительной степени зависит от степени насыщения им белков, участвующих в его транспорте и депонировании (апо-ферритина слизистой оболочки кишечника, трансферрина плазмы крови, апо-ферритина тканевых депо).
Выводится железо пищеварительным трактом (невсосавшаяся часть; с эпителием слизистой оболочки, который подвергается десквамации; с желчью), почками и потовыми железами.
Применяют препараты железа при железодефицитнои гипохромной анемии (например, при хронических кровотечениях, нарушениях всасывания железа, при беременности). Внутрь назначают железа закисного сульфат (FeS04-7H20).
Принимают этот препарат в таком виде, чтобы избежать контакта железа с полостью рта (например, в капсулах, драже с соответствующим покрытием). Такая необходимость обусловлена тем, что при взаимодействии железа с сероводородом (образуется при кариесе зубов и других заболеваниях полости рта) выделяется сульфид железа, который окрашивает зубы в черный цвет.
Применяют также комбинированные препараты железа, например драже «Ферроплекс» (содержит железа закисного сульфат и кислоту аскорбиновую), ферамид (комплексное соединение железа с никотинамидом). Создан также препарат пролонгированного действия ферро-градумет (таблетки, покрытые оболочкой и содержащие железа закисного сульфат в полимерной губкообразной массе — градумете; последняя обеспечивает постепенное всасывание железа).
Препараты железа могут приводить к развитию запора. Объясняется это связыванием сероводорода кишечника, который является физиологическим стимулятором его моторики.
Если всасывание железа из пищеварительного тракта нарушено, используют препараты для парентерального введения, например ферковен (содержит железа сахарат, кобальта глюконат и раствор углеводов), феррум Лек (комплекс железа с мальтозой для внутримышечного введения и железа сахарат для внутривенного введения) и др. При передозировке ферковена появляются гиперемия кожи лица, шеи, боли в пояснице, ощущение сдавления в области груди. Введение анальгетиков и атропина сульфата устраняет эти явления.
‘ Спру — это хроническое заболевание, проявляющееся диареей, глосситом, анемией, общим истощением и гипофункцией эндокринных желез.
При гипохромной анемии применяют также некоторые препараты кобальта. Одним из них является коамид. По химической структуре представляет собой комплексное соединение кобальта с амидом никотиновой кислоты. Кобальт стимулирует эритропоэз и способствует усвоению железа для образования гемоглобина. Вводят коамид подкожно.
За последние годы арсенал противоанемических средств пополнился человеческим рекомбинантным эритропоэтином, являющимся фактором роста, регулирующим эритропоэз (табл. 18.1). По химической структуре это глико-протеин. В организме эритропоэтин в основном образуется в перитубулярных интерстициальных клетках почек (90%) и в печени (10%). Стимулирует пролиферацию и дифференцировку красных кровяных клеток. Соответствующие препараты выпускаются под названием эпоэтин альфа (эпоген, эпрекс) и эпоэтин бета (рекормон).
Применяют их при анемии, связанной с хронической недостаточностью почек, с ревматоидным артритом, злокачественными опухолями, СП ИДом, при анемии у недоношенных детей.
Эффект развивается через 1—2 нед, нормализация кроветворения наступает через 8—12 нед. Если имеется дефицит железа, эпоэтин следует применять с препаратами железа. Вводят препарат внутривенно и подкожно (в пищеварительном тракте он разрушается). т|/2 = 9,3 ч. Переносится хорошо. Из побочных эффектов возможны головная боль, артралгия, гиперкалиемия.
При гиперхромной анемии применяют цианокобаламин и кислоту фолие-вую (см. главу 21), участвующие в синтезе нуклеиновых кислот.
Цианокобаламин (витамин В|2) назначают при злокачественной (перници-озной) анемии.
При дефиците иианокобаламина эритропоэз протекает по мегалобластичес-кому типу: эритробласт -» гиперхромный мегалобласт —> мегалоцит.
Возникновение пернициозной анемии связано с нарушением всасывания цианокобаламина, поскольку у таких больных отсутствует внутренний фактор Касла (по химической структуре — гликопротеин). В обычных условиях он вырабатывается слизистой оболочкой желудка и обеспечивает всасывание цианокобаламина в тонкой кишке.
Цианокобаламин при злокачественной анемии нормализует картину крови, а также устраняет или ослабляет неврологические нарушения и поражения слизистой оболочки языка. Ахлоргидрия желудочного сока сохраняется.
Кислоту фолиевую (витамин Вс) назначают при макроцитарной анемии.
При дефиците кислоты фолиевой образуются макроциты: эритробласт —> гиперхромный макронормобласт -> макроцит.
В организме кислота фолиевая превращается в фолиниевую, которая и обладает физиологической активностью.
Кислоту фолиевую используют при алиментарной и медикаментозной макроцитарной анемии, спру 1 , анемии беременных. Для лечения злокачественной анемии кислоту фолиевую отдельно не назначают, так как она не только не устраняет патологические изменения со стороны нервной системы, но даже усиливает их. Нормализуется лишь картина крови. В связи с этим при злокачественной анемии кислота фолиевая комбинируется с цианокобаламином.
Средства, угнетающие эритропоэз, используют при полицитемии (эрит-ремии). Одним из таких средств является раствор натрия фосфата, меченного фосфором-32 (Na2H 32 P04). Применение его приводит к снижению числа эритроцитов, тромбоцитов. Вводят препарат внутрь или внутривенно. Дозируют в милликюри (мКи).
Источник
21. Лекарственные средства, стимулирующие эритропоэз
Для нормального эритропоэза необходимы ионы железа, витамин В,; и фолиевая кислота, дефицит которых приводит к развитию анемии. Эритропоэз регулируется эритропоэтином — гормоном, образующимся преимущественно в почках (в антс-натальном периоде синтезируется также в печени). При хронических заболеваниях почек из-за сниженной продукции эрит-ропоэтина часто наблюдается развитие анемии.
Железо необходимо для синтеза гемоглобина. Дефицит железа в организме приводит к образованию эритроцитов с малым содержанием гемоглобина (т.е. к развитию микроцитар-ной гипохромной анемии). При гипохромной анемии, связанной с хронической кровопотерсй, беременностью (плод забирает железо у матери), различными заболеваниями кишечника (уменьшается всасывание железа из кишечника), у недоношенных детей (малые запасы железа в организме при рождении) применяют препараты железа (показаны в верхней части рисунка справа).
Основными побочными эффектами перорального применения препаратов железа являются частые желудочно-кишечные расстройства. Лечение железодсфицитной анемии продолжают до нормализации уровня гемоглобина в крови, затем в течение нескольких месяцев применяют препараты железа в меньших дозах для восстановления его запасов в депо. Дети высоко чувствительны к токсическому действию железа, ребёнок может погибнуть даже при введении такой небольшой дозы, как 1 г железа сульфата. При псрсдозировкс препаратов железа пе-рорально или парентерально вводят дефероксамин (дссферал), который образует с железом хслатные комплексы.
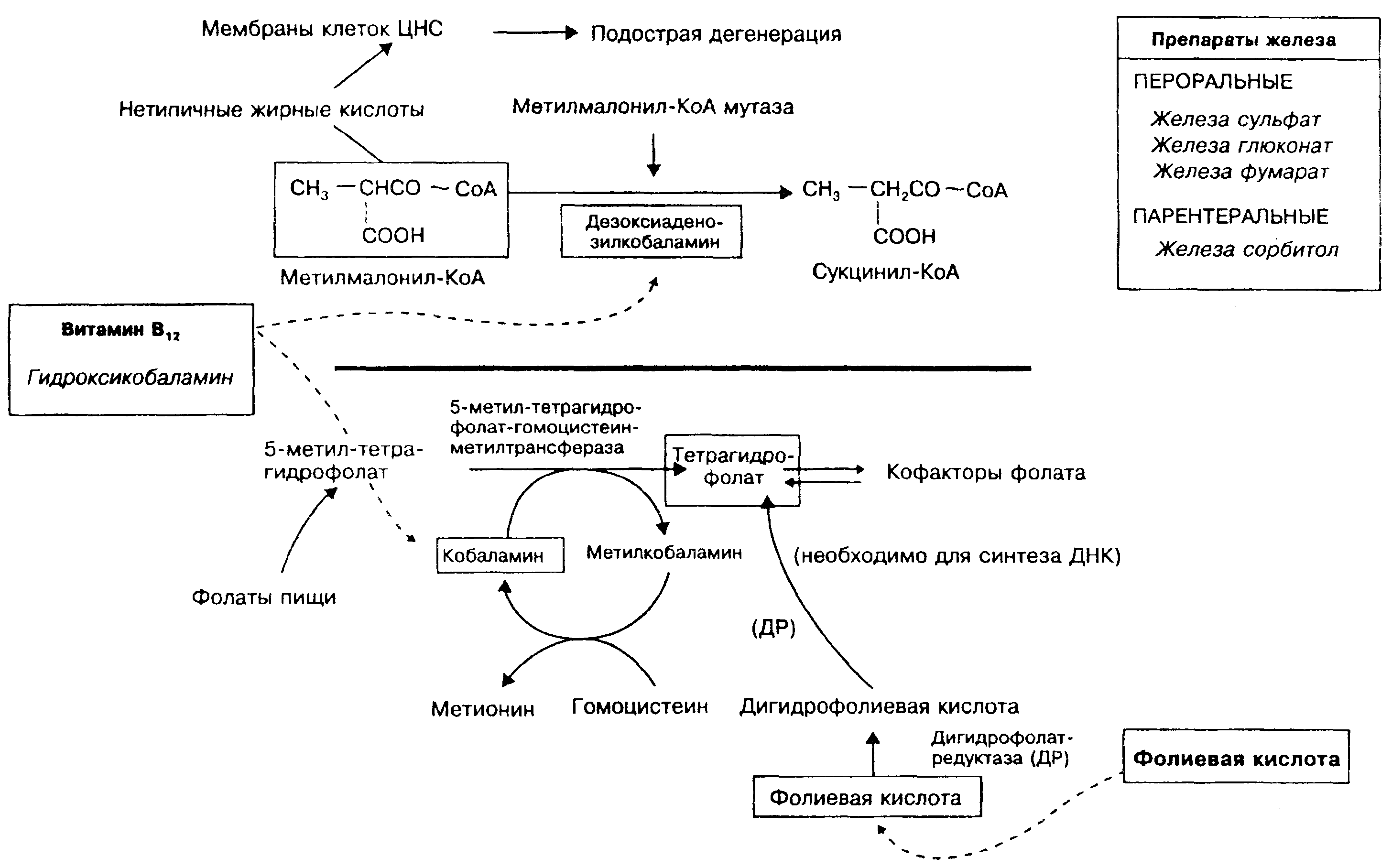
Витамин В |2 и фолиевая кислота необходимы для синтеза в организме ДНК. Дефицит любого из этих витаминов в организме может нарушать эритропоэз (приводить к развитию мегалобластной анемии). Дефицит витамина В\^ в организме вызывает также дегенеративные изменения в центральной нервной системе. Развитие В^-дефицитной анемии связано с нарушением синтеза тетрагидрофолиевой кислоты (показано в нижней части рисунка), а дегенеративные изменения в центральной нервной системе при дефиците витамина В|2 возникают вследствие накопления в клетках головного мозга мстилмало-нил-коэнзима А (показано в верхней части рисунка).
Дефицит витамина b|^ (В^-дефицитная анемия, псрниии-озная анемия, анемия Аддисона-Бирмсра) в организме наблюдается при нарушении его всасывания в желудочно-кишеч-ном тракте вследствие пониженной (или при отсутствии) секреции внутреннего фактора Касла (например, после резекции желудка), а также при различных заболеваниях тонкого кишечника. При В12-дефицитной анемии нарушен синтез ДНК. угнетаются процессы деления клеток, но синтез РНК и белка продолжается, в результате образуются крупные хрупкие эритроциты. При пернициозной анемии витамин В^ применяют и качестве средства заместительной терапии пожизненно инъек-ционно (на рисунке слева). Пероральное применение препарата эффекта не дает. Препаратом выбора для проведения заместительной терапии является оксикобаламин, поскольку он дольше сохраняется в крови, так как более прочно связывается i;
белками плазмы и медленнее выделяется с мочой, чем циано-кобаламин.
Дефицит фолиевой кислоты, который может возникать при беременности (вследствие повышения потребности вфолатах), а также при синдроме малабсорбции (например, при стеатор-рее или спру), приводит к развитию макроцитарной анемии. При фолиеводсфицитной анемии используют пероральное введение фолиевой кислоты.
Гем, содержащий в своём ядре железо, в комбинации с соответствующими глобиновыми цепями образует протеин — гемоглобин. В составе гемоглобина находится более 90% недепонированного железа (около 2,3 г). Меньшее количество железа (около 1 г) в форме ферритина и гемосидерина депонируется в макрофагах, в селезёнке, печени и костном мозге.
Абсорбция. Железо всасывается в двенадцатиперстной кишке и в проксимальном отделе тощей кишки. В норме всасывается только 5-10% принятого с пищей железа (около 0,5-1 мг в день), но при снижении запасов железа в организме абсорбция его возрастает. Абсорбции подвергаются лишь ионы Fe 2 ^ за счёт активного транспорта. В плазме крови железо находится в комплексе с трансферрином, являющимся р-глобулином. Специального механизма экскреции железа из организма нет — его баланс регулируется только процессами абсорбции.
Перорально применяют только препараты двухвалентного железа (Fe ), поскольку соединения трёхвалентного железа (Fe^) из кишечника практически не всасываются. При железодефи-цитных состоя ниях для синтеза гемоглобина требуется 50—100 мг железа ежедневно. Поскольку при пероральном применении препаратов железа абсорбироваться может только около 25% принятой дозы, то для быстрой коррекции недостатка железа в организме его необходимо применять в дозе 200—400 мг вдень. При появлении желудоч но-кишечных расстройств (тошнота, боли в животе, понос или запор) возможно снижение дозы железа, однако в этом случае дефицит железа в организме устраняется медленнее.
При невозможности перорального применения препаратов железа их назначают парентерально, однако это обычно не ускоряет повышение уровня гемоглобина в крови.
Фербитол (железа сорбитол) — это комплекс сорбитола, железа и лимонной кислоты. Препарат вводят глубоко внутримышечно, чтобы не вызвать окрашивания кожи (внутривенно фербитол не используют). Парентеральное применение препаратов железа может привести к развитию анафилактической реакции.
Токсичность железа. Острое отравление железом может наблюдаться у детей при приёме большого количества таблеток, содержащих железо. Отравление препаратами железа характеризуется некротическим гастроэнтеритом с болью, рвотой, кровянистым поносом, позднее возможно развитие коматозного состояния. Даже после видимого улучшения состояния при отравлении железом может развиться ацидоз, кома и возможен летальный исход.
Витамин В ]2 (внешний фактор Касла) всасывается из кишечника только в комплексе с внутренним фактором Касла (гли-копротеином, секретируемым париетальными клетками слизистой оболочки желудка). Всасывание витамина b)? происходит в дистальном отделе подвздошной кишки при участии высоко специфичной транспортной системы; в крови витамин В^ транспортируется в связи с транскобаламином II (гликопроте-ином плазмы крови). При пернициозной анемии дефицит внутреннего фактора Касла возникает вследствие продукции ауто-антител к самому гликопротеину или к париетальным клеткам желудка (развивается атрофический гастрит). В центре молекулы витамина В^ находится атом кобальта, который ковалентно связывается с различными лигандами, образуя кобаламины. Активными формами витамина В^ являются метлтобаламин и дезоксиаденоэилкобаламин.
Метилмалонил-КоА-мутаза. Этот фермент при участии де-зоксиаденозилкобаламина способствует превращению метил-малонил-коэнзим А в сукцинил-коэнзим А. При отсутствии витамина В)з эта реакция не идет, поэтому накапливается ме-тилмалонил-коэнзим А. В результате происходит синтез аномальных жирных кислот, которые встраиваются в мембраны нервных клеток и вызывают нарушения их функции, что ярко проявляется при дефиците витамина Bi2.
5-метил-тетрагидрофолат-гомоцистеин метилтрансфераза превращает 5-метил-тетрагидрофолат и гомоцистеин соответственно в тетрагидрофолат и метионин. Одновременно в этой реакции происходит превращение кобаламина в метилкобаламин. При дефиците витамина Bi2 эта реакция угнетается, в результате не происходит превращение 5-метилтетрагидрофолиевой кислоты (основного пищевого и эндогенного фолата) в тетрагидро-фолиевую кислоту, необходимую для синтеза ДНК. Эта реакция связывает метаболизм фолиевой кислоты и витамина В ^ и объясняет тот факт, что применение фолиевой кислоты в больших дозах при дефиците витамина Bi2 может уменьшить выраженность анемии, но не влияет на дегенеративные изменения в нервной системе.
Запасы фолатов в организме относительно невелики (5-20 мг), тогда как суточная потребность в них высока, поэтому при нарушении поступления в организм фолиевой кислоты анемия развивается достаточно быстро (в течение 1—6 месяцев). Фоли-евая кислота полностью абсорбируется в проксимальном отделе тощей кишки. Фолаты пищи представлены в основном по-лиглутаматами 5-метилтетрагидрофолиевой кислоты. Попиглу-таматы перед всасыванием подвергаются гидролизу с образованием моноглутаматов 5-метилтетрагидрофолиевой кислоты.
Дефицит фолиевой кислоты в организме наиболее часто связан с недостаточным поступлением фолатов с пищей (в отличие от дефицита витамина Bi2, связанного с нарушением его абсорбции). Приём контрацептивов, фенитоина, изониазида и других препаратов может снижать всасывание фолиевой кислоты из кишечника и вызывать её недостаточность в организме.
Фолиевая кислота и витамин Bi2 не оказывают токсического действия. Следует отметить, что при В^-дефицитной анемии нельзя применять только фолиевую кислоту, так как при этом выраженность анемии уменьшается, но усиливаются неврологические нарушения (могут приобрести необратимый характер).
Синтез гемоглобина и выход эритроцитов в кровеносное русло стимулируют гипоксия или кровопотеря. Эти процессы приводят к повышению содержания в крови эритропоэтина (гликопротеина, содержащего 166 аминокислотных остатков). Эритропоэтин связывается с рецепторами на мембранах стволовых клеток-предшественников эритропоэза в красном костном мозге и повышает транскрипцию фермента, участвующего в синтезе гема. Рекомбинантный Эритропоэтин (эпоэтин) используют внутривенно или подкожно при анемии, связанной с нарушением выработки эритропоэтина при хронической почечной недостаточности.
7-аминомасляная кислота (ГАМК) присутствует во всех образованиях центральной нервной системы, в основном в тормозных промежуточных нейронах. ГАМК вызывает быстрое торможение центральных нейронов, воздействуя на постсинапти-ческие ГАМКд-рсиепторы, которые блокируются бикукулли-ном (судорожным ядом). Некоторые ГАМК-рецепторы (ГАМКв) не блокируются бикукуллином, но избирательно активируются баклофеном (парахлорфенил-ГАМК). Многие ГАМКв-рецеп-торы расположены на пресинаптических мембранах нервных окончаний, их активация приводит к уменьшению выделения медиаторов (например, глутамата или самой ГАМК). Баклофен уменьшает высвобождение глутамата в спинном мозге и оказывает антиспастическое действие, что используется для уменьшения спастичности при рассеянном склерозе.
Высвобождаясь из пресинаптических нервных окончаний, аминокислотные неиромелиаторы инактивируются в основном путём обратного захвата.
К ГАМК-ергическим средствам относятся бензодиазепины. барбитураты (см. главу 24). противосудорожные препараты ви-габатрин и. возможно, вальпроаты (см. главу 25).
Глицин — это тормозной медиатор промежуточных нейронов спинного мозга. Глициновые рецепторы блокируются стрихнином, а высвобождение глицина и^ нервных окончаний угнетается столбнячным токсином. Оба вещества вызывают судороги.
Глутамат возбуждает практически все центральные нейроны, взаимодействуя с аминокислотными рецепторами различных типов. Эти рецепторы подразделяются на АМРА (активируются а-амино-3-гидрокси-5-мегил-4-изоксазолпропионовой кислотой), NMDA (активируются ^’-метил-О-аспартатом) и каинатныс (активируются каиновой кислотой). Существует также группа метаботропных рецепторов (связаны с G-белками). Антагонисты NMDA-реиспторов (например, 2-аминофосфоно-валерат) обладают противоэпилептической активностью ^ эксперименте на животных и оказывают благоприятное действие при судорожном синдроме, связанном с нсйрональными нарушениями вследствие значительного высвобождения глутамата. Ламотриджин является противоэпилептическим средством, механизм действия которого связан с угнетением высвобождения глутамата из пресинаптических мембран нейронов (см. главу 25).
Аиетилхолин является в основном возбуждающим медиатором LIHC. Он высвобождается из нервных окончаний мотонейронов нервно-мышечных синапсов и в синапсах коллатеральных аксонов с клетками Реншоу в спинном мозге (это примеры н-холинергичсских синапсов). Возбуждающие эффекты ацетилхолина на центральные нейроны в основном опосрсду-ются через м-холинорецепторы. активация которых приводит к угнетению потенциалзависимого К^тока в мембранах не-овных клеток. Это способствует возбуждению нервных клеток и облегчению формирования их ответа на тонические возбуждающие импульсы.
Холинергических нейронов особенно много в базальных ганглиях. Они принимают участие в проведении восходящих кортикальных импульсов и в процессах формирования памяти. М-холиноблокаторы (атропиноподобные средства) могут вызывать нарушения памяти (амнезию). Скополамин (гиосцин) используют в анестезиологии для премедикации в качестве средства, вызывающего амнезию и оказывающего успокаивающее действие (см. главу 23). Центральные эффекты препаратов этой группы используют при морской болезни и паркинсонизме (см. главу 26). При болезни Альцхаимера (форма сенильной демен-ции, лечение которой в настоящее время практически не эффективно) отмечается снижение числа холинергнческих нейронов и ухудшение памяти. Такрин — это антихолинэстеразное средство, которое оказывает благоприятное действие при болезни Альцхаймера (у 15% пациентов), но обладает выраженной гепатотоксичностью.
Катехоламины (при локальном нанесении на центральные нейроны) оказывают преимущественно тормозной эффект.
Дофаминергические пути проецируются от субстанции «ниг-ро» в средний мозг к базальным ганглиям и из среднего мозга в лимбическую кору и другие лимбические структуры. Тубсро-инфундибулярный дофаминергический путь участвует в регуляции высвобождения пролактина, а нигростриатный путь — в управлении произвольными движениями, его поражение приводит к развитию паркинсонизма. Мезолимбический дофаминергический путь чрезмерно активируется при шизофрении. однако причины этого неизвестны. Агонисты аофамина используют при паркинсонизме (см. главу 26), а антагонисты (нейро-лептики) применяют при шизофрении (см. главу 27). Дофами-новые рецепторы находятся в хсморсцепторной триггсрной (пусковой) зоне, поэтому антагонисты дофаминовых рецепторов оказывают противорвотное действие (см. главу 30).
Норадреналинергические нейроны встречаются в нескольких образованиях ствола головного мозга. Больше всего этих нейронов находится в голубом пятне (locus coeruleus) в мосту, от которого аксоны нейронов проецируются на всю дорсальную часть переднего мозга, особенно в кору головного мозга и гип-покамп. Большое количество норадрснергических волокон находится в гиппокампе. Норадрсналин и дофамин в лимбичес-ких структурах переднего мозга (особенно nucleus accumbens) могут участвовать в формировании чувства «удовольствия», что имеет значение в развитии лекарственной зависимости (см. главу 31). Нарушение адренергических функций может быть причиной развития депрессии (см. главу 28).
Серотонин (5-гидрокситриптамин, 5-НТ) находится в основном в телах нейронов ядер шва ствола мозга, которые посылают волокна в передний мозг, а также к вентральным и дорсальным рогам спинного мозга. Последние могут модулировать болевые импульсы (см. главу 29). Нарушения в ссротонинерги-ческой системе, также как и в норадреналинергической системе, могут приводить к возникновению депрессии. 5-НТз-рсцеп-торы локализованы п триггерной зоне рвотного центра, поэтому антагонисты этих рецепторов обладают антиэметическим (противорвотным) действием. 5-НТ]о-рецепторы находятся в сосудах головного мозга, агонист этих рецепторов суматриптан облегчает течение мигрени, суживая сосуды головного мозга. чрезмерно расширенные во время приступа.
Неиропептиды образуют самую многочисленную группу центральных нейромедиаторов, функция которых малоизвестна. Субстанция Р и энксфалины предположительно участвуют в проведении болевых импульсов (см. главу 29).
Оксид азота (NO). Синтез NO осуществляется в 1—2% нейронов многих областей головного мозга — таких, как кора головного мозга, гиппокамп и стриатум. Образование NO происходит совместно с выделением других нейромедиаторов: глутамата, ГАМК, соматостатина, нейропептида Y. NO влияет на процессы высвобождения некоторых нейромедиаторов. Физиологическая роль NO в головном мозге не ясна, однако существуют сведения, что NO может регулировать синаптическую пластичность.
Источник