- 1С:МДЛП
- 1С:МДЛП подходит:
- Функциональные возможности приложения
- Поддержка регистраторов выбытия
- Смартфон в качестве терминала сбора данных
- Оборудование для считывания средств идентификации
- Мониторинг движения лекарственных препаратов (маркировка лекарств)
- Человеческий ресурс
- Места хранения
- Финансовый ресурс
- Время
- Прямой порядок
- Обратный порядок
1С:МДЛП
Приложение позволяет регистрировать приемку, отгрузку и вывод из оборота лекарственных препаратов для медицинского применения в соответствии с федеральным законом 61-ФЗ «Об обороте лекарственных средств» в редакции от 28.12.2017 с помощью:
- Регистратора выбытия.
- Отправки сведений во ФГИС МДЛП с помощью УКЭП участника оборота.
1С:МДЛП подходит:
- медицинским организациям, оказывающие медицинскую помощь, в том числе с обособленными подразделениями (филиалами), оказывающими медицинскую помощь (места осуществления деятельности);
- аптекам, аптечным пунктам, аптечным киоскам и индивидуальным предпринимателям, осуществляющих отпуск лекарственных препаратов бесплатно;
- организациям, осуществляющим наряду с основной (уставной) деятельностью медицинскую деятельность (образовательные организации, учреждения науки, учреждения социального обслуживания, учреждения уголовно-исполнительной системы и иные организации).
Функциональные возможности приложения
«1С:МДЛП» обеспечивает следующие функции работы с «Системой мониторинга движения лекарственных препаратов для медицинского применения»:
- настройка подключения;
- работа с документами;
- отправка/получение документов;
- хранение и просмотр истории обмена;
- ведение журнала операций с упаковками;
- учет товарных запасов упаковок;
- ведение справочника номенклатуры лекарственных препаратов в объеме, предоставляемом оператором ФГИС «Мониторинг движения лекарственных препаратов».
Поддерживаются следующие операции:
- отгрузка и приемка товаров;
- расформирование транспортной упаковки;
- внутреннее перемещение лекарственных препаратов;
- выдачи товара по льготному рецепту;
- передача лекарственных препаратов на уничтожение;
- выдача товаров для оказания медицинской помощи.
Поддержка регистраторов выбытия
Информация о выводе лекарственных препаратов, отправленная через регистратор выбытия, находящегося в автономном режиме, поступает непосредственно во ФГИС МДЛП. Приложение 1С:МДЛП получает подтверждение о выводе препаратов от ФГИС МДЛП.
Поддерживается работа с регистраторами выбытия, подключенных в локальную вычислительную сеть организации, следующих производителей:
Порядок использования регистраторов выбытия в медицинских учреждениях и аптеках опубликован на сайте ЧестныйЗнак.РФ.
Для использования приложения с регистраторами выбытия, подключенными в локальную сеть организации, необходимо использовать тонкий клиент 1С:Предприятия. Инструкция по установке и запуску тонкого клиента.
Смартфон в качестве терминала сбора данных
Использование смартфона позволит отказаться от покупки штрих-код сканеров или терминалов сбора данных и начать работу с ФГИС МДЛП сразу после подключения к «1С:МДЛП».
Приложения для Android:
Оборудование для считывания средств идентификации
Считывание средств идентификации лекарственного препарата (двумерных штрихкодов) требуется в двух случаях:
- При регистрации приемки товаров.
- При регистрации вывода лекарственных препаратов из оборота непосредственно в подразделениях (отделениях) медицинской организации (по решению главного врача и при наличии сетевого подключения к регистратору выбытия, установленному в локальной вычислительной сети медицинской организации).
Для считывания штрихкодов может применяться оборудование, поддерживающие считывания Data Matrix и имеющее поддержку в 1С:Библиотеке подключаемого оборудования:
Источник
Мониторинг движения лекарственных препаратов (маркировка лекарств)
Правительством Российской Федерации в числе основных направлений определена работа по модернизации процесса движения лекарственных препаратов в соответствии с лучшими международными практиками, в том числе по унификации и упрощению процедур вывода лекарств на рынок без ущерба качеству, проведению мониторинга ассортиментной политики и цен на лекарственные препараты, совершенствованию методики регистрации предельных отпускных цен производителей на жизненно необходимые лекарственные препараты, мониторингу движения лекарственных препаратов для медицинского применения от производителя до конечного потребителя с использованием средств идентификации.
25 октября 2016 г. президиумом Совета при Президенте Российской Федерации по стратегическому развитию и приоритетным проектам утвержден паспорт приоритетного проекта «Внедрение автоматизированной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя для защиты населения от фальсифицированных лекарственных препаратов и оперативного выведения из оборота контрафактных и недоброкачественных препаратов». Краткое наименование — «Лекарства. Качество и безопасность».
Ключевые участники приоритетного проекта:
- Минздрав России;
- Росздравнадзор;
- ФНС России;
- Минпромторг России;
- Минфин России;
- Минкомсвязи России.
Субъекты обращения лекарственных препаратов:
- российские производители;
- российские и иностранные держатели регистрационных удостоверений и их представительства;
- организации оптовой и розничной торговли лекарствами;
- медицинские организации.
Цель приоритетного проекта:
- Защита населения от фальсифицированных, недоброкачественных и контрафактных лекарственных препаратов и предоставление неограниченному кругу потребителей (граждан) возможности проверки легальности зарегистрированных лекарственных препаратов, находящихся в гражданском обороте. Обеспечение прозрачности и развития справедливой конкуренции на фармацевтическом рынке.
Основными ресурсами, освещающими реализацию проекта МДЛП, являются официальные сайты Минздрава России, Росздравнадзора, Национальной системы цифровой маркировки «Честный знак». Информации в соответствующих разделах много, но в сегменте вопросов, касающихся медицинских организаций, она крайне дозированная и отвечает далеко не на все вопросы. При этом важно разобраться, что находится в силах и компетенции самой медицинской организации, и к чему придется тщательно готовиться, особенно к тем аспектам процесса лекарственного обеспечения, на которые система МДЛП влияет опосредованно, без регуляторного или технического воздействия.
Система мониторинга движения лекарственных препаратов будет внедряться с 01.07.2020 одномоментно по всей стране, вовлекая огромное число субъектов обращения лекарственных препаратов. По официальным оценкам в системе будут зарегистрированы около тысячи производителей и держателей регистрационных удостоверений на лекарственные препараты, порядка 2,5 тысяч оптовых фармацевтических организаций и 350 тысяч медицинских и аптечных организаций, не говоря о том, что эта система коснется всех без исключения конечных потребителей — пациентов, а это, без преувеличения, всё население Российской Федерации.
Эксперимент по внедрению системы маркировки лекарств в соответствии с Постановлением Правительства РФ от 24.01.2017 № 62 «О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения» (вместе с «Положением о проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения») стартовал в начале 2017 года и закончится непосредственно перед переходом к промышленной эксплуатации в конце 2019 года. Промежуточные результаты и опыт добровольных участников эксперимента уже сегодня объективно показывают, что задачи, стоящие перед субъектами оборота лекарственных препаратов, далеко не простые и требуют серьезной подготовки, как организационной, так и финансовой.
При подготовке к внедрению системы МДЛП руководству медицинской организации необходимо самым тщательным образом подойти к оценке готовности и достаточности всех видов её ресурсов.
Человеческий ресурс
Трудоёмкость приемки товара при внедрении системы маркировки неизбежно возрастает, особенно, если мест приемки и выбытия лекарств из гражданского оборота в организации несколько. Частично решить этот вопрос можно при применении автоматизированных средств оптимизации считывания кодов с упаковок, но на рынке пока нет доступных решений, которые бы подходили для данных целей.
Места хранения
С 29.11.2019 ст. 67 Федерального закона от 12.04.2010 № «Об обращении лекарственных средств» дополняется ч. 7.1 в следующей редакции «Лекарственные препараты для медицинского применения, введенные в гражданский оборот до 1 января 2020 года, подлежат хранению, перевозке, отпуску, реализации, передаче, применению без нанесения средств идентификации до истечения срока их годности.». Это значит, что с 1 января 2020 года поток медикаментов разделится на маркированный подтвержденный, маркированный неподтвержденный и немаркированный, что потребует увеличения площадей и мест хранения препаратов, так как совместное хранение этих групп товаров может привести к нарушению требований системы мониторинга движения.
С учетом вышеописанных возможных проблем с увеличением длительности проведения закупочных процедур необходимо пересмотреть в сторону увеличения нормативы складских запасов лекарств, которые смогут обеспечить непрерывность лечебно-диагностического процесса в случае непредвиденных обстоятельств.
Финансовый ресурс
Вышеуказанный прирост численности работников требует увеличения фонда оплаты труда. Потребуются затраты на организацию новых рабочих мест, оснащенным специальным оборудованием, оптимизацию систем хранения, увеличение объемов складских запасов, а также на закупку или развитие информационных систем. Это существенные затраты для любой организации, их надо планировать и своевременно изыскивать.
Время
Временные затраты на администрирование всех этапов движения лекарственных препаратов также вырастут, этот фактор крайне важно заложить в систему управления производственными процессами.
Одним из важнейших аспектов внедрения системы МДЛП для медицинского учреждения является необходимость перенастройки порядка взаимодействия с поставщиками лекарственных препаратов. В соответствии с п. 44 Положения о системе мониторинга движения лекарственных препаратов для медицинского применения, утвержденного Постановлением Правительства Российской Федерации от 14.12.2018 № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения» (далее — Положение) при передаче лекарственных препаратов между субъектами обращения внесение информации в ФГИС МДЛП может происходить двумя способами:
При этом решение о выборе типа порядка предоставления сведений принимается субъектами обращения лекарственных препаратов, предоставляющими данные сведения, самостоятельно. Это решение необходимо закрепить в контракте на поставку лекарственных препаратов.
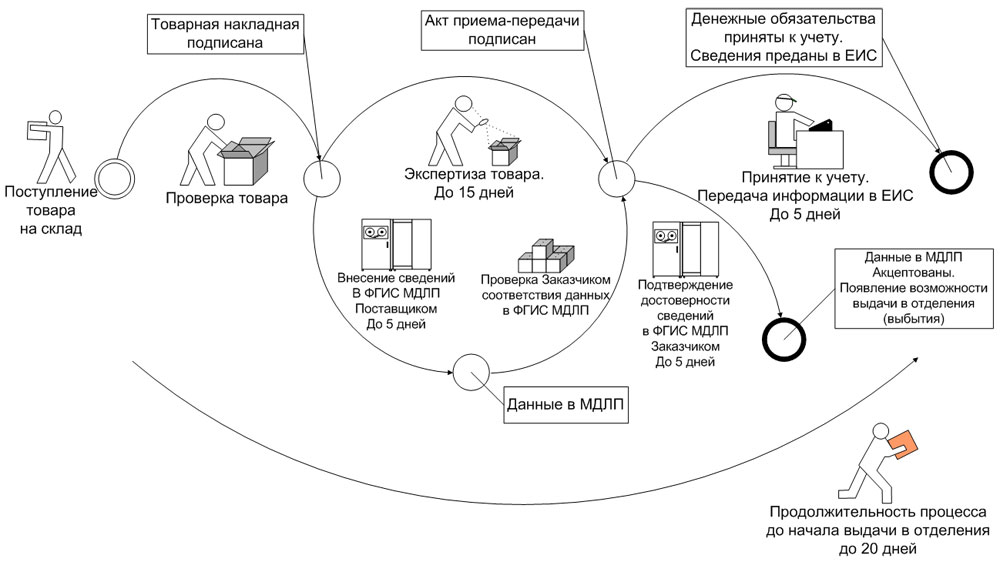
Прямой порядок
В случае выбора прямого порядка предоставления сведений субъект обращения, осуществляющий передачу лекарственных препаратов другому субъекту обращения в рамках гражданско-правовых отношений (поставщик), предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты отгрузки лекарственных препаратов предоставляет об этом в ФГИС МДЛП сведения, предусмотренные пунктом 2 приложения № 6 к Положению.
При этом субъект обращения, осуществляющий приемку лекарственных препаратов от другого субъекта обращения ЛП в рамках гражданско-правовых отношений (заказчик, медицинская организация), предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты приемки лекарственных препаратов и регистрации в ФГИС МДЛП сведений об отгруженных медикаментах, но до предоставления сведений о дальнейших операциях с данными препаратами, подтверждает достоверность сведений, содержащихся в ФГИС МДЛП о принимаемых лекарственных препаратах, предоставляя об этом сведения в ФГИС МДЛП, предусмотренных пунктом 4 приложения № 6 к Положению (рис. 1).
Рис. 1. Прямой способ внесения информации в ФГИС МДЛП
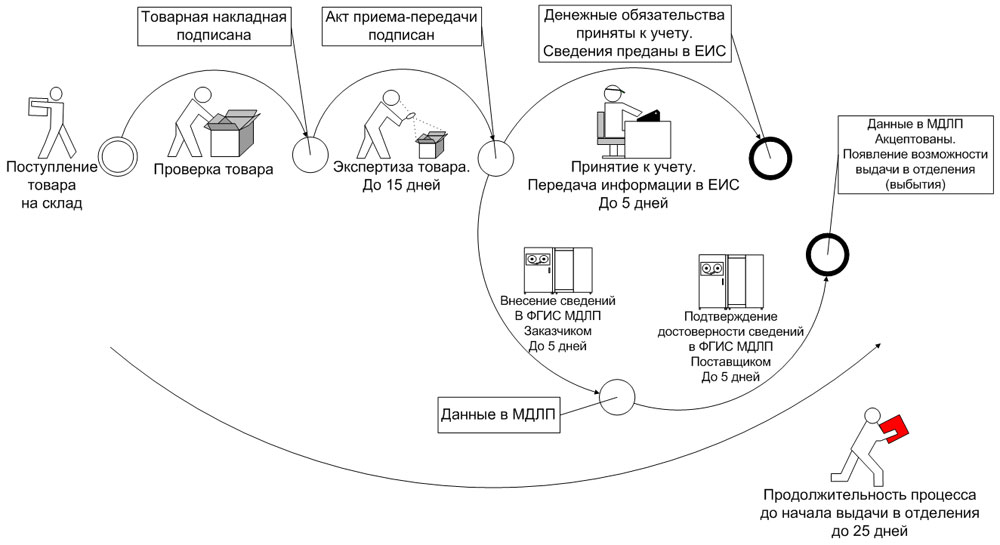
Обратный порядок
В случае выбора обратного порядка предоставления сведений субъект обращения, осуществляющий приемку медикамента от другого субъекта обращения в рамках гражданско-правовых отношений, предусматривающих переход права собственности на ЛП, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты приемки ЛП предоставляет в ФГИС МДЛП сведения о принятых ЛП, предусмотренные пунктом 3 приложения № 6 к Положению.
При этом субъект обращения, осуществивший передачу лекарства другому субъекту обращения в рамках гражданско-правовых отношений, предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты регистрации в ФГИС МДЛП сведений о принятом товаре, но до предоставления сведений о дальнейших операциях с данными препаратами, подтверждает достоверность сведений, содержащихся в ФГИС МДЛП о переданных лекарственных препаратов, предоставляя об этом сведения в ФГИС МДЛП, предусмотренные пунктом 4 приложения № 6 к Положению (рис. 2).
Рис. 2. Обратный способ внесения информации в ФГИС МДЛП
В ходе подготовки к работе в новых условиях системы МДЛП важно учесть особенности медицинской организации в части её системы финансирования, организационной структуры, наличию удаленных (обособленных) подразделений, организации закупок лекарственных препаратов, в том числе участие в централизованных поставках и иные аспекты деятельности, обусловливающие многочисленные внутренние и внешние взаимосвязи, необходимые для бесперебойной работы системы лекарственного снабжения, и проводить внедрение новой системы в контексте данных качественного анализа деятельности организации.
* На заседании рабочей группы Росздравнадзора было принято решение о внесении изменений в Положение, предусматривающих сокращение сроков регистрации операций в ИС МДЛП по передаче лекарственных препаратов всеми участниками до 1 рабочего дня, в целях соблюдения приоритета интересов пациента и предоставления медицинской организации возможности выполнения требований законодательства в сфере охраны здоровья, обращения лекарственных препаратов и закупок (контрактной системы) без нарушений.
Источник