- Медицинские интернет-конференции
- Языки
- Изучение фармакокинетических свойств липофильных и гидрофильных производных тиамина
- Липофильные лекарственные вещества легко выводятся через почки
- Пути выведения лекарственных веществ (экскреция)
- Фармакокинетические параметры (фкп)
- Фармакодинамика
- Как устроена система детоксикации?
Медицинские интернет-конференции
Языки
Изучение фармакокинетических свойств липофильных и гидрофильных производных тиамина
Таширова О.А., Раменская Г.В.
Липофильность и гидрофильность веществ оказывает сильное влияние на фармакокинетику лекарственных средств. Гидрофильные вещества по своим фармакокинетическим свойствам уступают липофильным. Они обладают низкой биодоступностью, обычно не превышающей 10% от принятой дозы, высокой степенью метаболизма и быстрым выведением. В связи с перечисленными недостатками для достижения терапевтических концентраций необходимо введение больших доз препарата. Поэтому в настоящее время производители лекарственных препаратов стараются создавать на основе гидрофильных молекул лекарственных веществ их липофильные производные. Так, например, на фармацевтическом рынке существуют липофильные формы витамина В1 (тиамина), который обладает гидрофильными свойствами.
Целью нашей работы было изучить фармакокинетику гидрофильной формы витамина В1 – тиамина гидрохлорида и липофильной формы – бенфотиамина, и сделать вывод об эффективности использования данных препаратов. Для этого мы исследовали плазму крови здоровых добровольцев после однократного приема 100 мг тиамина гидрохлорида и бенфотиамина. Определение концентраций тиамина проводилось методом LC/MS. После обработки данных были получены следующие значения фармакокинетических параметров для тиамина гидрохлорида: Сmax=317,3 нг/мл, Тmax= 2,0 часа, AUC8h = 1335,0 нг*ч/мл, и для бенфотиамина: Сmax= 677,4 нг/мл, Тmax= 2,4 часа, AUC8h = 3202,8 нг*ч/мл. Из полученных данных видно, что максимальная концентрация и биодоступность бенфотиамина значительно выше, чем у тиамина гидрохлорида. Данное исследование и аналогичные ему позволяют оценить рациональность использования различных форм лекарственных препаратов и являются стимулом для проведения подобного рода исследований с целью оптимизации фармакотерапии.
Источник
Липофильные лекарственные вещества легко выводятся через почки
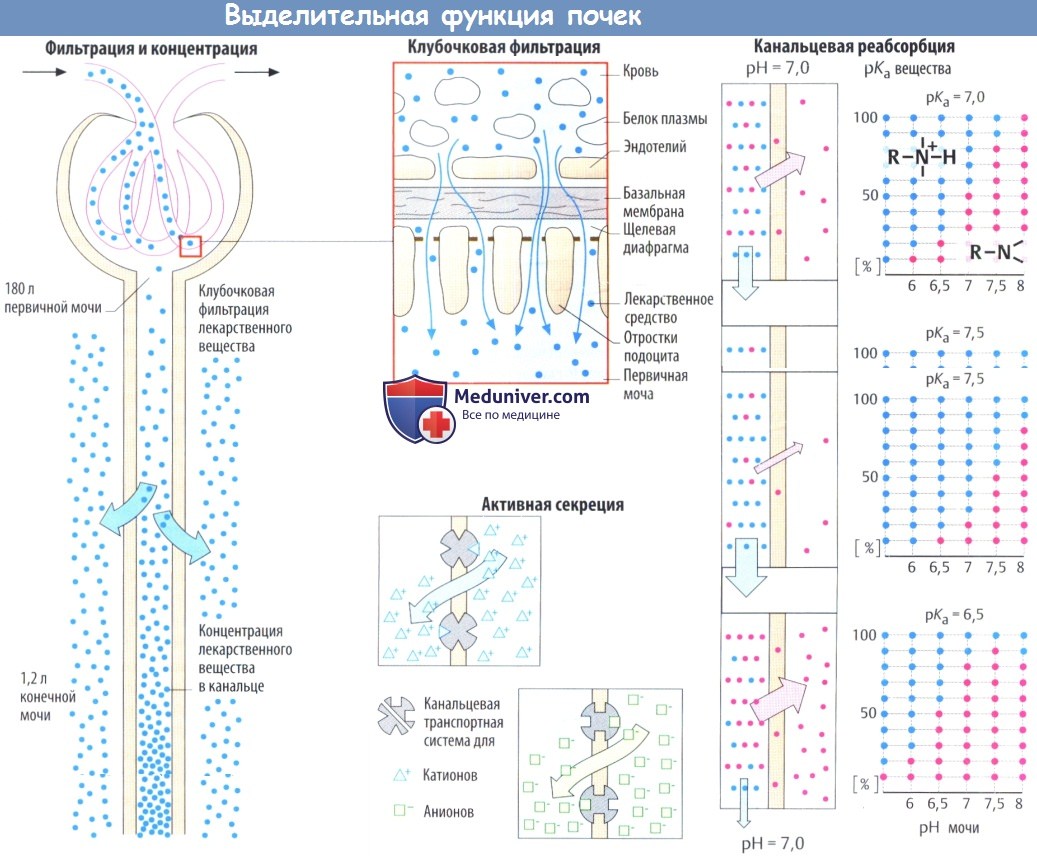
Большинство лекарственных средств выводятся с мочой как в химически не измененном виде, так и в виде метаболитов. Почки могут осуществлять выделительную функцию благодаря особому строению стенки клубочковых капилляров, которая позволяет растворенным в крови веществам с молекулярной массой менее 5000 беспрепятственно поступать в мочу.
Фильтрация ограничена молекулярной массой 50 000 и снижается при молекулярной массе более 70 000. За небольшим исключением, у используемых при лечении лекарственных средств и их метаболитов гораздо меньшая молекулярная масса, поэтому они подвергаются клубочковой фильтрации, т. е. поступают из крови в первичную мочу.
Разделяя эндотелий капилляров и эпителий канальцев, базальная мембрана содержит отрицательно заряженные макромолекулы и действует в роли фильтрационного барьера для высокомолекулярных веществ. Относительная плотность данного барьера зависит от электрического заряда молекул, которые пытаются проникнуть через него. Кроме того, в клубочковой фильтрации также участвуют диафрагмальные щели между отростками подоцитов.
Помимо клубочковой фильтрации, лекарственные средства, находящиеся в крови, попадают в мочу путем активной секреции. Некоторые катионы и анионы секретируются эпителием проксимальных канальцев в канальцевую жидкость специальными энергозависимыми транспортными системами. Эти транспортные системы имеют ограниченную емкость. При наличии нескольких субстратов они могут конкурировать за переносчик.
При движении вдоль почечного канальца объем первичной мочи сокращается примерно до 1%. Следовательно, уменьшается и концентрация профильтрованного лекарственного вещества или его метаболитов. Выходной градиент концентрации между мочой и интерстициальной жидкостью сохраняется в том случае, когда лекарственные средства не могут проникнуть через канальцевый эпителий.
Тем не менее градиент концентрации липофильных лекарственных средств будет поддерживать реабсорбцию профильтрованных молекул. В данном случае реабсорбция не является активным процессом, а наоборот, происходит в результате пассивной диффузии. Следовательно, у протонированных веществ величина реабсорбции зависит от pH мочи или степени диссоциации. Степень диссоциации пропорциональна pH мочи и рKa, последний показатель соответствует величине pH, при которой половина веществ существует в протонированном (или непротонированном) виде.
Эта взаимосвязь изображена графически (D) с примером протонированного амина с рKa = 7. В данном случае при pH мочи 7,0 50% амина будут находиться в протонированной гидрофильной мембрано-непроницаемой форме (голубые точки), тогда как другая половина, представленная незаряженным амином (красные точки), может покидать просвет канальца по результирующему градиенту концентрации. При высоком (рKa = 7,5) или низком (рKa = 6,5) рKa амина соответственно большая или меньшая часть амина будет находиться в незаряженном реабсорбируемом виде. Уменьшение или повышение pH мочи на 1/2 единицы вызывают аналогичные изменения.
Аналогичные закономерности характерны для кислых молекул с таким важным различием, что подщелачивание мочи (повышение pH) приведет к стимуляции депротонизации групп -СООН и, следовательно, к нарушению реабсорбции. pH мочи целенаправленно изменяют при интоксикациях протон-акцепторными веществами, чтобы ускорить выведение токсина (подщелачивание при отравлении фенобарбиталом, окисление при отравлении метамфетаминами).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Пути выведения лекарственных веществ (экскреция)
Л.В. выводятся из организма либо в неизменном виде, либо в виде метаболитов и конъюгатов.
Основной путь – выведение через почки с мочой
А) полярные, водорастворимые вещества легко фильтруются в клубочках и быстро выводятся;
Б) неполярные, липофильные вещества после фильтрации возвращаются опять в кровь. Затем поступают в печень и подвергаются БТ. Образовавшиеся водорастворимые метаболиты выводятся через почки. Полярные вещества плохо реабсорбируются, а неполярные вещества хорошо
Через почки выводится только свободная фракция лекарства, не связанная с белками. Имеет значение рН мочи, см.выше.
При заболевании почек их способность выводить лекарственные вещества снижается.
а) через кишечник – выводятся вещества, которые не всасываются в ЖКТ (фталазол, активизированный уголь);

Некоторые вещества выделяющиеся с желчью, могут повторно всасываться в кровь и в дальнейшем вновь выделяться в кишечник и так несколько раз (кишечно-печеночная циркуляция)
в) через эпителий ЖКТ может идти секреция веществ из плазмы крови в просвет кишечника (тяжелые металлы, сенна)
Через легкие– газообразные или летучие вещества (средства для наркоза,NH4OH,C2Н5ОН).
Через секреты желез
со слюной – эритромецин, иодиды, ампициллин, Bi;
с потом – пенициллины, гриозеофульвин;
со слезами – рифампицин;
через кожу – соли тяжелых металлов;
с молоком матери – седативные, снотворные, анальгетики, алкоголь, никотин, противомикробные средства, глюкокортикоиды и др.
Фармакокинетические параметры (фкп)
ФК-ие процессы характеризуются ФКП, которые отражают различные этапы ФК ЛВ (отдельное направление).
Биодоступность – кол-во ЛВ (часть вводимой дозы), поступающая в общий кровоток. Выражается в % от введения дозы.
Для оказания лечебного действия ЛВ должно быть доставлено с места введения к месту действия.
При в/в вещество полностью поступает в кровяное русло. При других путях введения вещество должно пройти различные барьеры, и только часть его попадет в системный кроваток. Сила эффекта зависит от величины этой части (нитроглицерин – БД=15%).
БД зависит от пути введения, ЛФ, особенностей организма (нарушение всасывания).
Т1/2 – период полувыведения. Время в течении которого концентрация ЛВ в плазме крови уменьшится на 50% от ее начальной величины (печень).
Клиренс– характеризует способность организма к элиминации ЛВ (к очищению организма). Этот показатель отражает объем плазмы крови, который очищается от ЛВ за единицу времени.
Различают клиренс: почечный, печеночный, общий.
Элиминация – это удаление чужеродного вещества из организма. Складывается из биотранформации и экскреции.
Фармакодинамика
Под влиянием ЛВ в тканях происходят физические и биохимические изменения, приводящие к лечебному или побочному действию = Ф.эффект.
ФД изучает ФЭ (какой, где, как, от чего зависит)
Фармакологический эффект – физические и биохимические изменения приводящие к терапевтическому или побочному действию
Гипотензивный, обезболивающий, мочегонный, снотворный, спазмолитический, слабительный, противомикробный, противокашлевой и т.д.
ЦНС (кора, подкорка, гипоталамус, спинной мозг), ЖКТ (желудок, кишечник, печень …), кашлевой центр, слизистые оболочки, сосудистая стенка и т.д.
См. «Типовые механизмы действия»
От чего зависит
Доза, курс, возраст, пол, индивидуальные особенности (сопутствующие заболевания, аллергия, диосинкразия, состояние ЦНС…), взаимодействие с другими средствами, ЛФ (ампулы таблетки, гель суппозитории)
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Источник
Как устроена система детоксикации?
Токсины, которые присутствуют в нашем организме, имеют различное происхождение. Одни поступают извне, другие образуются в ходе нормального метаболизма в организме. Основными экзогенными источниками являются воздух, которым дышит человек, потребляемая пища и вода, лекарственные препараты. По статистике более 75 000 синтетических химических веществ, среди которых — лекарственные препараты, канцерогенные вещества химической природы, пестициды и гербициды, выхлопные газы и прочее, воздействуют на организм современного человека, и все они проходят через систему детоксикации.
Продукты, которые образуются в результате пищеварения, энергетического обмена, регенерации тканей и превращений гормонов, побочные продукты жизнедеятельности микроорганизмов — составляют эндогенный пул токсинов. До 90 % веществ, образующихся внутри организма, требуют детоксикации. Это нейромедиаторы и гормоны, эйкозаноиды, жирные кислоты и ретиноиды.
В процессе филогенеза сформировалась система, которая отвечает за процесс преобразования и удаления потенциально вредных продуктов, тем самым, обеспечивая химическую резистентность и постоянство внутренней среды организма.
Система детоксикации — это слаженная работа нескольких систем сразу:
- иммунная система крови: белки и форменные элементы;
- очищающая система печени;
- система экскреторных органов: желудочно-кишечный тракт, почки, легкие, кожа.
В процессе работы происходит обезвреживание токсических веществ экзогенного и эндогенного происхождения (ксенобиотиков). На процесс преобразования или биотрансформации веществ влияет не только тип токсикантов, но и индивидуальные особенности человека. Они включают возраст, пол, наличие сопутствующих заболеваний и дефицитных состояний, генетическую предрасположенность, диетические предпочтения, факторы окружающей среды (домашняя среда и профессиональные факторы), принимаемые лекарства.
Ферменты реакций биотрансформации встречаются во многих тканях тела, но сосредоточены в печени, являющейся основным детоксицирующим органом. Другие ткани включают почки, легкие, кишечник и кожа.
Обезвреживание и выведение ксенобиотиков в организме проходит в несколько стадий:
1 стадия — обезвреживание ксенобиотика и перевод его в форму, удобную для выведения из организма.
Для этого печень переводит ксенобиотики в водорастворимые соединения, обладающие меньшей молекулярной массой. Эти вещества легче, чем исходное вещество, выводятся из организма экскреторными органами.
Метаболизм в печени протекает в две фазы с участием ферментов:
- 1 фаза. Гидроксилирование
Ферменты фазы I нейтрализуют химические вещества, преобразовывают в промежуточные соединения, которые затем обрабатываются ферментами Фазы II.
Ферментная система фазы I в основном состоит из супергенного семейства цитохрома P450 (CYP или CYP450). «P» обозначает пигмент и «450» — длина волны поглощения света. Фаза I представлена группой ферментов, представленной 50–100 ферментами цитохрома. Столь большое разнообразие обусловлено тем, что организм сталкивается с большим количеством токсинов. В дополнение к детоксикации, цитохромы принимают участие в процессах синтеза стероидов, холестерина и витамина D.
Фаза I добавляет или раскрывает реакционноспособную группу токсина, делая его более полярным, однако не полностью растворимым в воде. Образующиеся промежуточные токсины, могут быть химически активными (реактивные промежуточные метаболиты и/или активные формы кислорода) и, следовательно, более токсичными. Фаза I реакции состоит из окисления, восстановления, дегалогенирования и гидролиза. Во всех реакциях участвует кислород.
Активность цитохромных ферментов может отличаться из-за генетических полиморфизмов. С клинической точки зрения, различия могут иметь серьезные последствия при назначении фармацевтических препаратов, биологических и пищевых добавок.
Большинство токсинов должны пройти вторую фазу, чтобы их структура стала доступной для выведения вместе с мочой или желчью.
- 2 фаза. Реакция конъюгации и синтеза
Фаза детоксикации II включает 6 видов реакций:
- конъюгация с участием глютатиона;
- конъюгация с участием аминокислот;
- метилирование;
- сульфатирование;
- ацетилирование;
- глюкуронизация.
Все эти реакции требуют энергии АТФ и кофакторов для нормального протекания.
2 стадия — выведение токсина из организма через почки, печень, желудок, кишечник, легкие, потовые железы, сальные железы.
Активность ферментов, участвующих в детоксикации, либо индуцируется, либо ингибируется рядом факторов, которые включают генетику, диету, токсины окружающей среды, лекарства и состояние питания.
Некоторые вещества могут вызывать повышенную регуляцию ферментов фазы I без соответствующей повышенной активации ферментов фазы II. Если ферменты фазы I активируются или индуцируются без увеличения активности фазы II, результатом будет увеличение окислительного стресса из-за того, что промежуточные метаболиты могут быть более токсичными, чем исходное соединение, которое активировало ферменты фазы I. Примером этого являются полициклические углеводороды из сигаретного дыма, которые индуцируют CYP1A2. Другим примером является препарат фенобарбитал, который индуцирует CYP2B6.
Вещества, которые индуцируют фазу I:
- лекарственные препараты: фенобарбитал, стероиды, сульфаниламиды; никотин, алкоголь;
- продукты питания: капуста брокколи, высокобелковая диета,
- экологические токсины: выхлопные газы, пары краски, диоксиды, пестициды; мясо, приготовленное на углях;
- питательные вещества: см. список ниже.
Вещества, которые индуцируют фазу II(специфические питательные вещества для фазы II (индукторы и ингибиторы)):
- Конъюгация глутатиона — глутатион, витамин B6, ацетилцистеин. Семейство индукторов — брассика, укроп, тмин;
- Аминокислотная конъюгация — глицин. Индукторы — глицин;
- Метилирование — S-аденозил-метионин. Индукторы — липотропные питательные вещества — холин, метионин, бетаин, фолиевая кислота, витамин В12;
- Сульфатирование — цистеин, метионин, молибден. Индукторы — цистеин, метионин, таурин;
- Ацетилирование — ацетил-КоА, витамин В5;
- Глюкуронидация — глюкуроновая кислота (индукторы — рыбий жир).
Семейство Брассика (брокколи, обычная и брюссельская капуста) стимулируют фазу I и фазу II одновременно.
Ингибиторы детоксикации
Ферментные системы Фазы I и Фазы II могут быть ингибированы несколькими механизмами, которые включают лекарства, продукты питания, дефицит питательных веществ и растительные препараты. Примером пищи, вызывающей угнетение детоксикации, является грейпфрут, который подавляет CYP3A4.
Вещества, которые ингибируют Фазу I:
- лекарственные препараты: бензодиазепины левомицетин, тетурам, силибор, антигистаминные препараты, блокаторы секреции желудочного сока;
- продукты питания: грейпфрут (нарингенин), куркумин (также стимулирует фазу II);
- дисбиоз кишечника.
Вещества, которые ингибируют Фазу II:
- Конъюгация глутатиона. Ингибиторы — дефицит селена, витамина B12, цинка и глутатиона;
- Аминокислотная конъюгация. Ингибиторы — низкобелковая диета;
- Метилирование — S-аденозил-метионин. Ингибиторы — дефицит витамина B12 или фолиевой кислоты;
- Сульфатирование. Ингибиторы — НПВП, дефицит молибдена, тартразин (желтый пищевой краситель);
- Ацетилирование. Ингибиторы — дефицит витаминов В2, В5 или С;
- Глюкуронидация. Ингибиторы — пробеницид, аспирин.
Процесс детоксикации чрезвычайно сложен. Взаимодействие между Фазой I и Фазой II, а также биохимическая уникальность человека является наиболее значимыми факторами при оценке способности к детоксикации. Оптимальное здоровье требует баланса между всеми фазами процесса, а также должной работы желудочно-кишечного тракта.
Источник



