- Липофильность
- Коэффициент липофильности
- См. также
- Ссылки
- Полезное
- Смотреть что такое «Липофильность» в других словарях:
- Медицинские интернет-конференции
- Языки
- Изучение фармакокинетических свойств липофильных и гидрофильных производных тиамина
- Липофильность лекарственных веществ это что
- Липофильность лекарственных веществ это что
- Прекорнеальные факторы
- Роговица
- Эпителий роговицы
- Транспортные системы роговицы
- Строма
- Эндотелий роговицы
Липофильность
Липофильность (буквально — сродство к жирам) — свойство вещества, означающее его химическое сродство к органическим веществам, является по сути синонимом гидрофобности. Величина, которая определяется экспериментально, а также может быть рассчитана при помощи таблицы инкрементов групп атомов для органических соединений.
Коэффициент липофильности
Экспериментально значение коэффициента липофильности определяется при помощи стандартной системы 1-октанол — вода. Логарифм коэффициента распределения незаряженных форм субстрата и есть искомая величина, стандартно обозначаемая как logP.
Замечательное свойство коэффициента липофильности в том, что его можно посчитать при помощи таблиц и правил. Также существуют электронные базы и программы для его расчёта.
| Вещество | log Pо/в | T (°C) | рассчитанное log P |
|---|---|---|---|
| Ацетамид | -1.16 | 25 | -1.23 ± 0.22 |
| Метанол | -0.82 | 19 | -0.72 ± 0.18 |
| Муравьиная кислота | -0.41 | 25 | -0.54 ± 0.19 |
| Диэтиловый эфир | 0.83 | 20 | 0.98 ± 0.21 |
| п-Дихлорбензол | 3.37 | 25 | 3.34 ± 0.22 |
| Гексаметилбензол | 4.61 | 25 | 4.98 ± 0.20 |
| 2,2′,4,4′,5-Пентахлорбифенил | 6.41 | 6.47 ± 0.37 |
Экспериментальное определение липофильности возможно, так же, с помощью обращеннофазной жидкостной хроматографии с использованием, к примеру, колонки с привитой фазой С18 или С9. Так как на обращенной фазе время выхода вещества прямо пропорционально его липофильности то зная время выхода и липофильность известных веществ (стандартов), в тех же условиях хроматографирования, можно рассчитать величину липофильности для данного соединения.
См. также
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое «Липофильность» в других словарях:
липофильность — липофильность … Орфографический словарь-справочник
Липофильность — (от греч. lípos жир и philéo люблю) проявление сродства к жирам, маслам и т. п.; то же самое, что олеофильность. Подробнее см. в ст. Лиофильность и лиофобность … Большая советская энциклопедия
Коэффициент липофильности — Липофильность (буквально сродство к жирам) свойство вещества, означающее его химическое сродство к органическим веществам, является по сути синонимом гидрофобности. Величина, которая определяется экспериментально, а так же может быть рассчитана … Википедия
Гемато-энцефалический барьер — Взаимоотношение клеток ткани мозга и капилляра: 1. Эпендима 2. Нейрон 3. Аксон 4. Шванновская клетка 5. Астроцит 6 … Википедия
МЕСТНОАНЕСТЕЗИРУЮЩИЕ СРЕДСТВА — подавляют возбудимость концевых аппаратов чувствит. нервов и (или) блокируют проведение импульсов по нервным волокнам. Относятся к сложным эфирам и амидам ароматич. карбоно вых к т (напр., анестезин, новокаин, дикаин и др.), амино кетонам… … Химическая энциклопедия
ФТОРФЕНАЗИН-ДЕКАНОАТ — ( Phthorphenazinum decanoatе ) . 2 Трифторметил 10 <3 [1 ( b каприноилоксиэтил) пиперазинил 4] пропил>фенотиазин. Синонимы: Фторменазин депо, Модитен депо, Модекейт, Миренил ретард, Flunazol, Fluphenazinum decanoate, Lyogen depo, Lyoridin depo,… … Словарь медицинских препаратов
Phthorphenazinum decanoate — ФТОРФЕНАЗИН ДЕКАНОАТ ( Phthorphenazinum decanoatе ) . 2 Трифторметил 10 <3 [1 ( b каприноилоксиэтил) пиперазинил 4] пропил>фенотиазин. Синонимы: Фторменазин депо, Модитен депо, Модекейт, Миренил ретард, Flunazol, Fluphenazinum decanoate, Lyogen… … Словарь медицинских препаратов
Парлазин — Действующее вещество ›› Цетиризин* (Cetirizine*) Латинское название Parlazin АТХ: ›› R06AE07 Цетиризин Фармакологическая группа: H1 антигистаминные средства Нозологическая классификация (МКБ 10) ›› H10.1 Острый атопический конъюнктивит ›› J30… … Словарь медицинских препаратов
Фторафур — Действующее вещество ›› Тегафур* (Tegafur*) Латинское название Ftorafur АТХ: ›› L01BC03 Тегафур Фармакологическая группа: Антиметаболиты Нозологическая классификация (МКБ 10) ›› C16 Злокачественное новообразование желудка ›› C18 Злокачественное… … Словарь медицинских препаратов
Бронхиальная астма — Различные ингаляторы, используемые при бронхиальной астме … Википедия
Источник
Медицинские интернет-конференции
Языки
Изучение фармакокинетических свойств липофильных и гидрофильных производных тиамина
Таширова О.А., Раменская Г.В.
Липофильность и гидрофильность веществ оказывает сильное влияние на фармакокинетику лекарственных средств. Гидрофильные вещества по своим фармакокинетическим свойствам уступают липофильным. Они обладают низкой биодоступностью, обычно не превышающей 10% от принятой дозы, высокой степенью метаболизма и быстрым выведением. В связи с перечисленными недостатками для достижения терапевтических концентраций необходимо введение больших доз препарата. Поэтому в настоящее время производители лекарственных препаратов стараются создавать на основе гидрофильных молекул лекарственных веществ их липофильные производные. Так, например, на фармацевтическом рынке существуют липофильные формы витамина В1 (тиамина), который обладает гидрофильными свойствами.
Целью нашей работы было изучить фармакокинетику гидрофильной формы витамина В1 – тиамина гидрохлорида и липофильной формы – бенфотиамина, и сделать вывод об эффективности использования данных препаратов. Для этого мы исследовали плазму крови здоровых добровольцев после однократного приема 100 мг тиамина гидрохлорида и бенфотиамина. Определение концентраций тиамина проводилось методом LC/MS. После обработки данных были получены следующие значения фармакокинетических параметров для тиамина гидрохлорида: Сmax=317,3 нг/мл, Тmax= 2,0 часа, AUC8h = 1335,0 нг*ч/мл, и для бенфотиамина: Сmax= 677,4 нг/мл, Тmax= 2,4 часа, AUC8h = 3202,8 нг*ч/мл. Из полученных данных видно, что максимальная концентрация и биодоступность бенфотиамина значительно выше, чем у тиамина гидрохлорида. Данное исследование и аналогичные ему позволяют оценить рациональность использования различных форм лекарственных препаратов и являются стимулом для проведения подобного рода исследований с целью оптимизации фармакотерапии.
Источник
Липофильность лекарственных веществ это что
В составе природных продуктов известно очень много полезных для здоровья человека веществ, а учеными создано немало лекарственных средств на их основе. Одним из ключевых моментов, определяющим эффективность их использования является метаболическая доступность этих продуктов и этих лекарственных препаратов. Природные вещества, поступающие в организм в составе пищи или лекарственных веществ, характеризуются разным уровнем их биодоступности, зависящим от их способности гидролизоваться под действием пищеварительных ферментов. Так вещества с низкой биодоступностью, определяемой их ограниченной способностью к ферментативному расщеплению, обладают и низкой метаболической доступностью а, следовательно, не способны оказывать эффективное биологическое действие. Однако эффективность ферментативного гидролиза различных веществ определяется не только свойствами субстрата, но и свойствами и количеством фермента. В случае недостатка гидролаз, или их низкой активности интенсивность фермент-субстратного взаимодействия будет низкой, а образовавшихся продуктов гидролиза будет недостаточно для последующего ресинтеза необходимого количества компонентов триглицеридов и фосфолипидов и их включения в метаболические процессы организма, в которые эти вещества попадают.
Исследуемые нами липофильные продукты растительного происхождения и фармпрепараты на основе эссенциальных фосфолипидов [1,2], поступая в организм человека или животных, подвергаются гидролизу с участием специфических липолитических ферментов. Продукты ферментативного расщепления триглицеридов и фосфолипидов всасываются в тонкой кишке, в стенке которой они включаются в процессы ресинтеза с образованием новых триглицеридов и фосфолипидов. Ресинтезированные триглицериды и фосфолипиды с помощью липопротеиновых частиц крови транспортируются к тканям и органам, где и оказывают свое биологическое действие [3,5].
Процессы гидролиза триглицеридов и фосфолипидов осуществляются в организме под действием на них липаз и фосфолипаз. Процесс липолиза и всасывания образующихся при этом веществ является ключевым моментом, определяющим эффективность включения компонентов триглицеридов и фосфолипидов в метаболические процессы организма и их последующее биологическое действие.
Цель настоящего исследования — изучить метаболическую доступность липидов, входящих в состав некоторых растительных масел, и фосфолипидов в составе ряда фармпрепаратов.
Материалы и методы. Среди исследованных нами продуктов были как широко распространенные масла (подсолнечное, оливковое, кукурузное), так и масла существенно реже используемые в качестве компонентов пищи (льняное масло и масло грецкого ореха). В таких же условиях эксперимента in vitro исследована интенсивность липолиза фосфолипидных концентратов в составе фармпрепаратов: «Эссливер форте», «Эссенциале форте» и «Фосфоглив».
О метаболической доступности изучаемых веществ судили по интенсивности их липолиза в модельных опытах in vitro с использованием специальной гидролизной установки [4] и препарата «Панинтестин», который содержит весь комплекс пищеварительных ферментов поджелудочной железы и двенадцатиперстной кишки крупного рогатого скота, из которой этот препарат изготавливался. Интенсивность липолиза оценивали по количеству свободных жирных кислот, высвободившихся в результате действия ферментов на исследуемые масла через различные интервалы времени от начала опыта – 1, 2, 3 часа. Количество жирных кислот определяли титрованием 0,05 н раствора NaOH в присутствии индикатора – 0,5% спиртового раствора фенолфталеина. Эмульсию тестируемого продукта с желчью, не содержащую препарата «Панинтестин», использовали в качестве контроля. Полученные результаты выражали в мл NaOH, пошедшего на титрование реакционной смеси.
Результаты и обсуждение. Результаты исследования способности природных триглицеридов и фосфолипидных концентратов подвергаться гидролизу под действием липолитических ферментов представлены на рис.1 и 2.
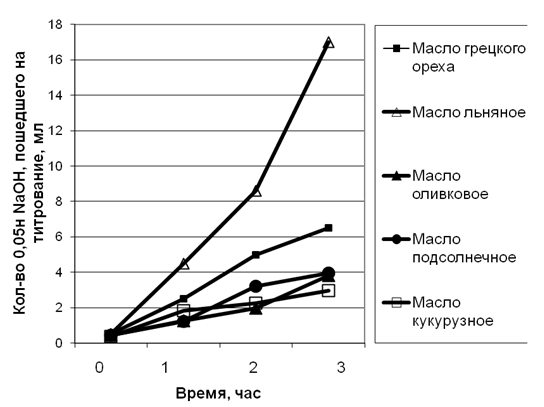
Рис. 1. Интенсивность липолиза исследуемых растительных масел под действием ферментного препарата «Панинтестин»
Анализ полученных данных позволил констатировать, что наиболее интенсивно происходил липолиз льняного масла, заметно ниже была скорость гидролиза масла из плодов грецкого ореха, подсолнечного и оливкового масел, а липолиз кукурузного масла был наименее эффективным. Липолиз льняного масла был в 5,75 раза интенсивнее липолиза кукурузного масла, в 2,5 раза – масла грецкого ореха, в 4,2 раза – подсолнечного и в 4,4 раза – оливкового масла.
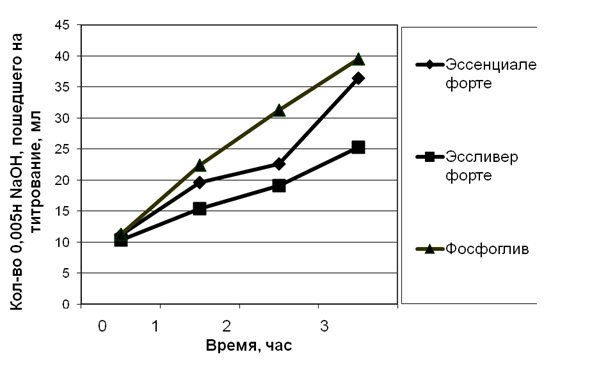
Рис. 2. Интенсивность липолиза исследуемых фосфолипидных концентратов в составе лекарственных препаратов под действием ферментного препарата «Панинтестин»
Анализ динамики высвобождения жирных кислот из фосфолипидных концентратов в составе исследуемых фармпрепаратов позволил установить, что наибольшая интенсивность липолиза отмечена у препарата «Фосфоглив», несколько меньшая у «Эссенциале форте» и наименьшая у препарата «Эссливер форте».
Выводы. Результаты проведенного изучения способности липофильных продуктов растительного происхождения, а также ряда фармпрепаратов, содержащих в качестве действующего начала эссенциальные фосфолипиды, гидролизоваться под действием липолитических энзимов позволяют сделать вывод о том, что в ряду исследованных растительных масел наибольшей способностью к ферментативному гидролизу и, соответственно, большей способностью включаться в метаболические процессы организма обладают масла льна и грецкого ореха, а среди фармпрепаратов – «Фосфоглив».
Рецензенты:
Павлюченко И.И., д.м.н., профессор, заведующий кафедрой клинической иммунологии, аллергологии и лабораторной диагностики ФПК и ППС, государственное бюджетное образовательное учреждение высшего профессионального образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Краснодар;
Быков И.М., д.м.н., профессор, заведующий кафедрой фундаментальной и клинической биохимии, государственное бюджетное образовательное учреждение высшего профессионального образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Краснодар.
Источник
Липофильность лекарственных веществ это что
Технологический Институт МАРА, Медицинский факультет, Малайзия (Universiti Teknologi MARA (UiTM), Faculty of Medicine, Sungai Buloh Campus, Jalan Hospital)
Технологический Институт МАРА, Медицинский факультет, Малайзия (Universiti Teknologi MARA (UiTM), Faculty of Medicine, Sungai Buloh Campus, Jalan Hospital); Технологический Институт МАРА, Медицинский факультет, Малайзия (Universiti Teknologi MARA (UiTM), R16 «Molecular Pharmacology and Advanced Therapeutics», Brain and Neuroscience Communities of Research); ФГБОУ ВПО «Волгоградский государственный медицинский университет» Минздрава России, НИИ фармакологии
Технологический Институт МАРА, Медицинский факультет, Малайзия (Universiti Teknologi MARA (UiTM), Faculty of Medicine, Sungai Buloh Campus, Jalan Hospital); Технологический Институт МАРА, Медицинский факультет, Малайзия (Universiti Teknologi MARA (UiTM), R16 «Molecular Pharmacology and Advanced Therapeutics», Brain and Neuroscience Communities of Research)
Транспорт лекарственных средств через роговицу глаза: перспективы применения липосомальных лекарственных форм
Журнал: Вестник офтальмологии. 2014;130(4): 117-122
Аляутдин Р. Н., Иежица И. Н., Агарвал Р. Транспорт лекарственных средств через роговицу глаза: перспективы применения липосомальных лекарственных форм. Вестник офтальмологии. 2014;130(4):117-122.
Технологический Институт МАРА, Медицинский факультет, Малайзия (Universiti Teknologi MARA (UiTM), Faculty of Medicine, Sungai Buloh Campus, Jalan Hospital)


Анатомические и физиологические барьеры глазного яблока определяют низкую биодоступность офтальмологических препаратов. Уникальная структура роговицы, состоящая из связанных плотными контактами эпителиальных клеток и гидрофильной стромы, ограничивает проникновение как гидрофильных, так и липофильных лекарственных средств при традиционных путях введения. Кроме того, слезная пленка, включающая белки и ферменты, также представляет собой барьер для транскорнеального транспорта лекарственных препаратов. Несмотря на то что в роговице имеются различные транспортные системы, принимающие участие в доставке некоторых лекарственных препаратов, проблемы повышения биодоступности офтальмологических препаратов являются актуальными. Одной из систем доставки лекарственных веществ через роговицу могут быть липосомы. Это средство доставки лекарственных веществ представляет собой везикулярные структуры, состоящие из внешнего бислоя липидов и внутреннего пространства, заполненного раствором лекарственного вещества. Эта особенность структуры липосом определяет условия для их проникновения через как гидрофильные, так и липофильные среды глаза, включая барьеры переднего и заднего сегментов глаза. Липосомы являются эффективным средством для целенаправленной доставки лекарственных веществ в переднюю камеру глаза. Эта статья представляет собой обзор литературы, посвященной взаимодействию лекарственных веществ с барьерами передней камеры глаза и перспективам использования липосом для транскорнеальной доставки лекарственных средств.
Технологический Институт МАРА, Медицинский факультет, Малайзия (Universiti Teknologi MARA (UiTM), Faculty of Medicine, Sungai Buloh Campus, Jalan Hospital)
Технологический Институт МАРА, Медицинский факультет, Малайзия (Universiti Teknologi MARA (UiTM), Faculty of Medicine, Sungai Buloh Campus, Jalan Hospital); Технологический Институт МАРА, Медицинский факультет, Малайзия (Universiti Teknologi MARA (UiTM), R16 «Molecular Pharmacology and Advanced Therapeutics», Brain and Neuroscience Communities of Research); ФГБОУ ВПО «Волгоградский государственный медицинский университет» Минздрава России, НИИ фармакологии
Технологический Институт МАРА, Медицинский факультет, Малайзия (Universiti Teknologi MARA (UiTM), Faculty of Medicine, Sungai Buloh Campus, Jalan Hospital); Технологический Институт МАРА, Медицинский факультет, Малайзия (Universiti Teknologi MARA (UiTM), R16 «Molecular Pharmacology and Advanced Therapeutics», Brain and Neuroscience Communities of Research)
Анатомические особенности расположения органа зрения создают иллюзию простоты лекарственной терапии офтальмологических заболеваний с помощью местного введения препаратов 3. Действительно, введение лекарственных препаратов в конъюнктивальный мешок имеет ряд преимуществ: локализация эффектов препарата, что позволяет избежать ненужных системных побочных эффектов; введение препаратов, не требующее специальных навыков, что трудно достичь при системном введении, возможность использования удобного, неинвазивного и безболезненного метода, что особенно важно при длительной терапии. Вместе с тем местное применение лекарственных веществ в офтальмологии, несмотря на кажущуюся простоту, имеет ряд ограничений 5.
К обстоятельствам, ограничивающим эффективность этого пути введения, относятся прекорнеальные факторы, физиологические и биохимические особенности строения роговицы, а также физико-химические свойства лекарственного вещества и его растворителя [7].
Прекорнеальные факторы
Офтальмологические лекарственные формы для местного применения быстро удаляются из конъюнктивального мешка, поэтому время поглощения лекарства составляет только несколько минут, определяя низкую биодоступность лекарственного препарата, обычно менее 5% [8]. Важную роль в этом процессе играет слезная жидкость (СЖ). Образуемая ею пленка имеет три слоя: внешний липидный слой, средний — гидрофильный и внутренний слизистый. Липидный слой предотвращает высыхание среднего слоя. Муцин за счет взаимодействия с поверхностью глаза обеспечивает более плотный контакт гидрофильной части СЖ.
СЖ по ряду причин является препятствием для вводимых местно лекарственных препаратов.
«Слезный» клиренс обеспечивает удаление препарата из прекорнеальной области и увеличивает всасывание препарата окружающими тканями. Кроме того, белки СЖ способны сорбировать лекарственные препараты, снижая биодоступность последних до 5% [9]. Связывание их с лекарственными веществами способно изменять биодоступность последних. Содержащиеся в СЖ белки структурно и функционально гетерогенны [10]. Общее число таких белков по разным данным составляет 60-500, в том числе протеазы и ингибиторы протеаз [11]. Основными белками являются лактоферрин, лизозим, липокалин, липофилин, белки комплемента и иммуноглобулины. Важный протеин СЖ липокаин имеет несколько мест связывания, что предполагает его взаимодействие с другими компонентами СЖ. Противотуберкулезный препарат рифампицин образует с липокаином прочный комплекс. Этот комплекс теряет стабильность в кислой среде, поэтому липокаин может рассматриваться как потенциальная транспортная система для доставки рифампицина в очаг специфического воспаления [12].
Лактоферрин, относящийся к мультифункциональным структурам, является компонентом иммунной системы и обладает нуклеазной активностью. Наряду с этим С-концевая часть лактоферрина может связываться с НПВС, блокаторами ЦОГ2, эторикоксибом, парекоксибом и нимесулидом, угнетая их активность при местном применении [13]. Лизозим, фермент с гликозид-гидролазной активностью, за счет гидрофобных взаимодействий способен связываться с пенициллинами и цефалоспоринами (цефрадин, цефуроксим, цефотаксим, цефтриаксон). Важным активным ферментом СЖ является кальцийзависимая фосфолипаза А2, в норме обеспечивающая бактерицидную активность в отношении грамположительных бактерий. Но фосфолипазная активность фермента увеличивает порозность мембран липосом, приводя к преждевременному выделению лекарственного препарата. В состав СЖ входят 12 ферментов, включающих альдолазу, пируваткиназу, амилазу, металлопротеиназы, которые способны оказать влияние на фармакокинетику офтальмологических препаратов [14, 15].
Наличие в СЖ белков, способных связывать лекарственные препараты, приводит к конкуренции последних за места связывания при комбинированном применении. Так, комбинированное применение тимолола и пилокарпина приводит к снижению концентрации бета-блокатора в тканях глаза за счет увеличения связывания с белками СЖ [16]. Пилокарпина нитрат повышал биологическую активность в 10 раз при его комбинировании с цетилпиридиния хлоридом, вытесняющим пилокарпин из связи с белками СЖ [17].
Роговица
Эпителий роговицы
Роговица является следующим существенным барьером на пути лекарственных препаратов. Эта структура глаза является уникальной, так как имеет гидрофильную часть, строму, покрытую, как сандвич, с двух сторон двумя липидными слоями (эпителия и эндотелия). В результате препараты, которые одновременно имеют как гидрофобную, так и гидрофильную природу, могут проникать через ткани роговицы свободно. Если же препараты являются полярными или высоколипофильными соединениями, они проникают в роговицу значительно менее эффективно. Пока лекарственное средство находится в контакте с внешней поверхностью глаза, градиент концентрации служит в качестве движущей силы проникновения в роговицу. В этом случае физико-химические свойства, такие как растворимость в воде и липофильность, являются двумя определяющими факторами, которые регулируют скорость проникновения препаратов через роговицу. Другие физические свойства молекул (например, рКа и коэффициент распределения) также могут оказать влияние на проницаемость роговицы глаза [18].
Роговица является не только барьером для механических повреждений, но также обеспечивает избирательную проницаемость для химических соединений с целью поддержания гомеостаза в тканях передней камеры глаза. Структурно и функционально в роговице можно выделить эпителиальный слой, строму и эндотелиальный монослой. Барьерные функции эпителия обеспечиваются развитой системой активного транспорта, регулирующего поступление в клетки и выведение гидрофильных и липофильных соединений, а также плотными контактами между телами эпителиальных клеток [19].
В процессе формирования поверхностного слоя эпителия роговицы эпителиоциты экспрессируют плотные контакты, которые не характерны для более глубоких слоев эпителия. Плотные контакты в значительной степени снижают парацеллюлярный транспорт, являющийся механизмом проникновения гидрофильных веществ. Таким образом, поверхностные слои эпителия роговицы представляют препятствие для проникновения гидрофильных веществ [20]. Этим фактором определяется низкая проницаемость ряда лекарственных веществ через роговицу. Через неповрежденную роговицу плохо проникают гидрофильный амикацин [21], циклоспорин А [22], липофильный дексаметазон [23], вариконазол [24], гатифлоксацин [25]. Повреждение эпителия перед инстилляцией лекарственного препарата значительно снижает защитные свойства роговицы [26].
Обеспечение доставки необходимых для жизни веществ определяет наличие в эпителии роговицы развитых систем облегченного и активного транспорта. Эти виды транспорта имеют большее значение для доставки гидрофильных соединений, нежели для проникновения липофильных лекарственных средств, что связано с низкой пассивной диффузией гидрофильных лекарственных средств через мембрану. Транспортные системы, экспрессированные на апикальной поверхности эпителиальных клеток роговицы, обеспечивают активную доставку гидрофильных соединений. Для липофильных соединений, легко проникающих через клеточные мембраны, существует обратный транспорт, осуществляемый специфическими транспортными системами.
Транспортные системы роговицы
Транспорт аминокислот в эпителии роговицы важен, потому что эпителий представляет собой интенсивно регенерирующую ткань c непрерывным синтезом белка. Основным источником питательных веществ в эпителии является водянистая влага и в меньшей степени лимбальное кровообращение. Аминокислоты активно поступают в эпителий роговицы из водянистой влаги, тогда как слезная сторона эпителия выступает в качестве диффузионного барьера [27]. Концентрация аминокислот в СЖ сопоставима с плазмой за исключением аспарагината, глутаминовой кислоты и таурина, которые присутствуют в СЖ в гораздо более высоких концентрациях, чем в плазме [28].
Транспортные системы аминокислот включают SLC1 (преимущественно глутамат и нейтральные аминокислоты), SLC6 (глицин, ГАМК). Система SLC7 LAT опосредует Na + -независимый транспорт больших нейтральных ароматических аминокислот. Субстратами для LAT1 являются лейцин, фенилаланин, метионин глутамин, глицин, серин. Эта транспортная система также участвует в доставке таких лекарственных препаратов, как L-ДОПА, метилдопа, габапентин и мелфалан [29], баклофен [30].
Транспортеры олигопептидов SLC15 принадлежат к суперсемейству протонассоциированных транспортеров олигопептидов (POT) [31]. PepT1 и PepT2 транспортируют ди- и трипептиды, а также β-лактамные антибиотики, ингибиторы АПФ, ингибиторы ренина и аналоги вирусных нуклеозидов (валацикловир, валганцикловир).
SLCO — органический анионный транспортер полипептидов участвует в переносе как эндогенных соединений (например, соли желчных кислот, стероидные конъюгаты, гормоны щитовидной железы), так и лекарственных препаратов (например, эналаприл, правастатин, фексофенадин, зидовудин, дексаметазон и дигоксин) [32].
Барьерная функция эпителия роговицы во многом определяется также наличием АВС — транспортеров, представляющих самое большое семейство белков, не только обеспечивающих барьерную функцию для ксенобиотиков, но также лимитирующих транспорт лекарственных веществ в глаз. Эти транспортеры относятся к мембранным белкам, состоящим из многих доменов и использующим энергию АТФ для транспорта веществ через клеточные мембраны у всех позвоночных [33]. В это семейство белков входят MDR1/ABCB1 (белки множественной лекарственной устойчивости; P-gp), белки множественной устойчивости MRP4/ABCC4, а также BCRP/ABCG2 (белок устойчивости опухоли молочной железы). В роговице субстратами для P-gp могут быть противоопухолевые средства этопосид, доксорубицин, винкристин; блокаторы кальциевых каналов верапамил и дилтиазем; ингибиторы ВИЧ протеазы индинавир и ритонавир; гормоны тестостерон, прогестерон; иммунодепрессанты такролимус, циклоспорин; эритромицин, дигоксин, хинидин, фексофенамид, лоперамид. Транспортер MRP4/ABCC4 имеет сродство к нуклеозидным аналогам, к числу которых относятся противоопухолевые средства 6-меркаптопурин и метотрексат, противовирусные препараты адефовир и тенофовир. Кроме того, этот фермент «выкачивает» диуретики фуросемид и трихлорметиазид, антибиотики цефазолин и цефтизоксим. Субстратами для BCRP/ABCG2 являются противоопухолевые средства метотрексат, митоксантрон, топотекан и иматиниб; статины розувастатин и питавастатин, а также дантролен, празозин, нитрофурантоин.
Строма
Строма — расположенный глубже слой гидратированного коллагена является препятствием для липофильных соединений 36. Для гидрофильных соединений строма, напротив, предпочтительнее, чем эпителий и эндотелий. В модели in vitro изолированная роговица кролика помещалась в двухкамерную систему, в которой роговица служила перегородкой между камерами. В раствор со стороны эндотелия роговицы добавляли гидрофильный краситель флуоресцеин. Краситель быстро проникал через эндотелиальный слой за счет транс- и парацеллюлярного транспорта. В конечном итоге концентрация гидрофильного флуоресцеина в строме была выше, чем в эндотелии и эпителии. В эпителии краситель появился со значительным латентным периодом [37].
Эндотелий роговицы
Эндотелий роговицы защищает строму от водянистой влаги. Эта структура представлена монослоем гексагональных клеток, образующих мозаичную поверхность. Основной функцией стромы является сохранение тургора стромы, что является гарантией сохранения прозрачности последней. Гидрофильные глюкозаминогликаны стромы определяют постоянный ток жидкости из передней камеры через эндотелий в строму. Несмотря на наличие плотных контактов эндотелий роговицы обладает порозностью, поэтому трансэндотелиальное сопротивление невелико и составляет 30 мОм [38, 39].
Источник