- Лекарственные средства
- Счетчик обращений граждан и организаций
- Лекарственные средства
- Контроль за проведением доклинических и клинических исследований лекарственных средств и лекарственных препаратов
- «Ненавредин». Почему мы пьем таблетки, которые не помогают?
- Как проверяют эффективность лекарств?
- Что такое препараты с недоказанной эффективностью?
- Как понять, что передо мной препарат с недоказанной эффективностью?
- по теме
- Лечение
- А это поможет? Насколько безопасен секс с антисептиками
- Но почему они до сих пор продаются, а врачи их выписывают?
- по теме
- Лечение
- Что такое БАДы и насколько они безопасны? Разбираемся, чем они отличаются от лекарств
- ЧТО ТАКОЕ КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ?
- Клинические исследования как необходимость научной точности
- Четыре фазы клинических испытаний
- Фармацевтические компании, исследователи, врачи и пациенты — все вовлечены!
- Обеспечение прозрачности результатов в строгих правовых рамках
- ВПЕРЕДИ НОВЫЕ ЗАДАЧИ
- Читайте также
Лекарственные средства
Счетчик обращений граждан и организаций
Лекарственные средства
Контроль за проведением доклинических и клинических исследований лекарственных средств и лекарственных препаратов
В соответствии с п. 5.1.4.1 постановления Правительства Российской Федерации от 30.06.2004 № 323 «Об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения» Росздравнадзор осуществляет федеральный государственный надзор в сфере обращения лекарственных средств посредством организации и проведения проверок соблюдения субъектами обращения лекарственных средств требований к доклиническим исследованиям лекарственных средств, клиническим исследованиям лекарственных препаратов, установленных Федеральным законом от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» и принятыми в соответствии с ним иными нормативными правовыми актами Российской Федерации.
В соответствии с п. 40 ст. 4 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» под доклиническим исследованием лекарственного средства подразумевается биологические, микробиологические, иммунологические, токсикологические, фармакологические, физические, химические и другие исследования лекарственного средства путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного средства.
В соответствии с п. 41 ст. 4 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» клиническим исследованием лекарственного препарата является изучение диагностических, лечебных, профилактических, фармакологических свойств лекарственного препарата в процессе его применения у человека, животного, в том числе процессов всасывания, распределения, изменения и выведения, путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного препарата, данных о нежелательных реакциях организма человека, животного на применение лекарственного препарата и об эффекте его взаимодействия с другими лекарственными препаратами и (или) пищевыми продуктами, кормами.
Источник
«Ненавредин». Почему мы пьем таблетки, которые не помогают?
Михаил Макматов-Рысь
В России есть серьезная проблема с неэффективными препаратами. Об этом много говорилось в СМИ и даже на заседании РАМН в 2007 году, но в реальности ситуация практически не меняется — полки аптек заставлены лекарствами с сомнительной эффективностью, о которой покупателей не предупреждают.
К тому же и врачи любят выписывать проверенные временем советские схемы лечения, укреплять иммунитет и бороться с дисбактериозом при помощи волшебных пилюль. Более того, препараты с сомнительной эффективностью встречаются даже в официальных клинических рекомендациях.
Статистика не даст соврать: по данным исследования DSM Group, на медикаменты с недоказанной эффективностью в 2016 году государство потратило 20 % всего бюджета (70 000 000 000 рублей), направленного на закупку лекарств. В 2018 году в топ-10 препаратов по объему продаж вошли 5 лекарств с сомнительной эффективностью и безопасностью.
Как проверяют эффективность лекарств?
Чтобы лекарственный препарат был признан эффективным и безопасным регулирующими органами в США и Европе, он проходит долгий и тернистый путь. Сначала вещество-кандидат тестируют на клетках (в пробирке/in vitro) и животных (in vivo), и если получают хорошие результаты, то начинают исследования на людях. Клинические исследования проходят в 4 фазы, включают сотни (для I и II фазы) и тысячи участников (для III и IV фазы), среди которых есть как здоровые добровольцы, так и пациенты с заболеваниями.
В этом видео от Общества по изучению рака Великобритании (Cancer Research UK) рассказывается о фазах клинических исследований.
(Осторожно, ролик на английском!)
В качественных исследованиях эффективность лекарства сравнивается с «пустышкой» (плацебо) или другим препаратом, признанным эффективным при данной болезни. Участники распределяются в группы случайным образом (рандомизация), при этом ни врач, ни пациенты не знают, какой группе досталось лекарство, а какой — плацебо. Такие исследования должны проводиться независимыми организациями, не связанными с компанией-производителем. Все это помогает бороться с ошибками и предвзятостью.
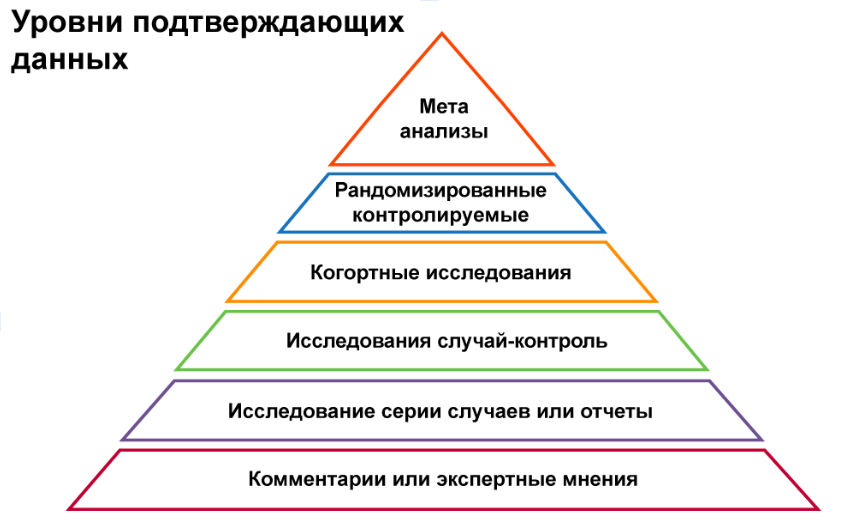
Далее несколько исследований по одной тематике анализируют в систематических обзорах и метаанализах — они являются вершиной доказательной медицины и дают самые точные данные об эффективности лекарств. На последнем этапе группа экспертов-врачей, опираясь на проведенные клинические исследования, принимает решение: включать ли лекарство в рекомендации по лечению конкретной болезни и какой уровень ему присвоить (от А до D).
Таблица уровней доказательности клинических исследований. На вершине — метаанализы и рандомизированные контролируемые исследования.
Препарат должен пройти все этапы: лекарства, проверенные только в пробирке и/или на животных, не могут считаться эффективными и безопасными без полноценных клинических исследований.
Все эти этапы требуют огромных временных и финансовых затрат. Кроме того, исследование нового лекарства — всегда риск, ведь препарат может оказаться неэффективным или токсичным и «вылететь» на любом из этапов.
В этой связи всегда хорошо бы помнить о талидомидовой катастрофе. В 1950-х в 46 странах мира появился талидомид — противорвотный и успокоительный препарат, эффективно помогавший при токсикозе беременным женщинам. По стандартам того периода, лекарство тестировалось на мышах и здоровых добровольцах, причем оно показало хорошую безопасность и незначительные побочные эффекты даже при многократном увеличении дозы. Выяснилось, что мыши (а не добровольцы), на которых изначально тестировали препарат, оказались нечувствительны к талидомиду — их потомство было здоровым. Однако специально на беременных женщинах его действие не изучалось. Позднее, в 1961 году, немецкие и австралийские врачи пришли к выводу, что прием талидомида во время беременности вызывает тяжелые врожденные дефекты. Препарат отозвали с рынка. Однако он успел навредить: с 1957 по 1961 год из-за талидомида родилось более 10 000 детей с пороками развития конечностей, лица и внутренних органов, почти 40 % младенцев погибли из-за тяжелых дефектов. Выяснилось, что испытуемые, на которых проводились первоначальные исследования, оказались нечувствительны к талидомиду, и их потомство было здоровым. После этой катастрофы требования к регистрации лекарств были пересмотрены.
Что такое препараты с недоказанной эффективностью?
Это лекарства, которые не прошли вышеописанный путь. Причин тому несколько: либо их эффективность и безопасность не проверялись в качественных исследованиях, либо в ходе них препараты были признаны неэффективными. Такие лекарства не встретить в международных базах данных и рекомендациях по лечению.
Небольшой (и далеко не полный) список популярных лекарств с сомнительной эффективностью:
иммуностимуляторы/иммуномодуляторы и некоторые противовирусные средства: амиксин, ингавирин, кагоцел, арбидол, полиоксидоний, панавир, галавит;
препараты, защищающие печень (гепатопротекторы): карсил, эссенциале, фосфоглив;
препараты для улучшения работы памяти и мозга (ноотропы): церебролизин, фенотропил, фенибут, пирацетам, глицин;
антиоксиданты и средства, «выводящие токсины» (детоксиканты): мексидол, милдронат, реамберин, ремаксол;
ферменты: вобэнзим, лонгидаза;
гомеопатия: анаферон, оциллококцинум, стодаль, импаза;
средства советской медицины: корвалол, валокордин, валидол, дибазол.
Подробный перечень препаратов с сомнительной эффективностью приведен на портале Encyclopatia. Он является наиболее полным в рунете и неплохо аргументирован, хотя редко обновляется, и в нем могут встречаться ошибки.
Конечно, медицина не стоит на месте, и можно предположить, что эффективность и безопасность сомнительных препаратов может быть доказана в качественных исследованиях годы спустя. Но это будет возможно только после ужесточения проверки исследований и регистрации лекарств в России. А тем временем такие препараты уже лежат на полках аптек и успешно продаются. Это плохо, потому что:
мы не можем быть полностью уверены в их безопасности (она специально не проверялась, и мы слепо верим «опыту многолетнего использования»);
несмотря на эффект плацебо, принимая неэффективные лекарства, мы откладываем настоящее лечение и можем «запустить» болезнь;
мы впустую тратим деньги, на которые можно было бы купить что-то эффективное или проконсультироваться у грамотного врача.
Как понять, что передо мной препарат с недоказанной эффективностью?
Придется запастись терпением и вооружиться онлайн-переводчиком. Если вы знаете название лекарства только на русском, переведите его через обычный google translate или multitran. Затем попробуйте поискать препарат в авторитетных базах данных лекарств Drugs.com, Rxlist, на сайте Medscape. Также стоит заглянуть на СlinicalTrials.gov, где собраны данные о клинических исследованиях, и на сайт Кокрановской библиотеки, которая выпускает качественные систематические обзоры. Если вы ничего не нашли, в эффективности и безопасности препарата можно смело сомневаться.
по теме
Лечение
А это поможет? Насколько безопасен секс с антисептиками
Наконец, можно поискать информацию на PubMed, но эта база данных требует продвинутых навыков поиска и критического отношения к результатам. Например, в ответ на запрос «arbidol» (или «umifenovir») поисковик может выдать сотни публикаций, но большинство из них — исследования в пробирке и на животных, которые ничего не говорят о клинической эффективности лекарства.
Достоверных источников на русском языке немного: например, сайты АЛГОМ или MedSpecial. Все-таки мировая наука официально говорит на английском языке, и без него сложно ориентироваться в массивах медицинской информации.
Но почему они до сих пор продаются, а врачи их выписывают?
К сожалению, в России пока нет строгих требований к регистрации новых лекарств. Исследования может проводить сама компания-производитель препарата, которая, безусловно, заинтересована в хорошем результате. Организация и качество этих исследований практически не контролируются, а их результаты приравниваются к эффективности лекарства и принимаются Минздравом.
Однако это не относится к международным клиническим исследованиям, в которых участвуют несколько стран и тысячи пациентов, — в них, напротив, все очень строго.
Например, производитель зарегистрированного в РФ иммуномодулятора Галавит подтверждает его эффективность при десятке различных заболеваний (от тонзиллита до простатита) исследованиями с сомнительным качеством, проведенными на десятках пациентов. При поиске в международных базах данных ничего (кроме тех же отечественных работ, переведенных на английский язык) найти не удается.
по теме
Лечение
Что такое БАДы и насколько они безопасны? Разбираемся, чем они отличаются от лекарств
Кроме того, многие лекарства с сомнительной эффективностью до сих пор включены в ЖНВЛП и активно рекламируются — это большой бизнес. Так, в списке жизненно необходимых препаратов встречаются сомнительные милдронат (мильдоний), церебролизин, цитиколин, тилорон (он же амиксин), меглюмина натрия сукцинат (реамберин), фосфолипиды + глицирризиновая кислота (фосфоглив, эссенциглив), пирацетам и многие другие.
Вопрос с врачами более сложный. С одной стороны, некоторые доктора попросту некомпетентны: они не хотят развиваться и читать современную литературу, верят мифам, рекламе, представителям фармкомпаний, кафедральным методичкам. Иногда руководители отделения, в котором работает врач, заставляют выписывать устоявшиеся схемы с неработающими лекарствами, следовать «традициям клиники» и «отечественной школе» и ругают за отсутствие назначений в медицинской карте.
Однако в ряде случаев даже грамотные врачи могут предложить принимать неэффективный препарат. Это возможно в случаях, когда:
все доказанные методы лечения оказались неэффективны или плохо переносились пациентом;
больному рекомендована травматичная операция или токсичный препарат, но он отказывается от них;
у пациента редкая болезнь, проведено мало (или не проведено вообще) рандомизированных клинических исследований, а рекомендации по лечению не разработаны.
Источник
ЧТО ТАКОЕ КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ?
Клинические исследования проводятся с участием людей и относятся к серии научных исследований, которые необходимо выполнить для разработки новых лекарств.
Они подлежат строгому регулированию и являются важнейшим этапом в процессе регистрации лекарственного средства и определении методов его оптимального применения для обеспечения терапевтического эффекта у пациентов.
Клинические исследования могут длиться несколько лет и должны быть организованы в строгом соответствии с протоколом исследования, который гарантирует безопасность участников.
Клинические исследования как необходимость научной точности
Под клиническими исследованиями понимаются все научные исследования с участием людей, которые проводятся с целью оценки эффективности и безопасности нового лекарственного препарата / изделия медицинского назначения или расширения показаний к применению существующего на рынке лекарственного препарата / изделия медицинского назначения. 1 Клинические исследования проводятся квалифицированными специалистами в области медицины на базе стационаров или амбулаторно.
Клинические исследования используются для оценки безопасности и эффективности новых методов лечения, и являются обязательным условием для вывода лекарственного препарата на рынок. Они требуют применения строгого научного подхода, чтобы гарантировать как терапевтический эффект, так и безопасность участников. Помимо терапевтического интереса, клинические исследования также вносят вклад в развитие медицины и биологии. 2
Четыре фазы клинических испытаний
До начала клинических исследований с участием человека в обязательном порядке проводятся доклинические исследования, которые включают в себя тестирование изучаемой молекулы на животных.
Разработка нового лекарственного препарата обычно состоит из четырех последовательных фаз клинических исследований, целью которых является изучение действия препарата в организме человека и оценка его эффективности.
Фаза I: соответствует первому применению исследуемого препарата у человека и может длиться несколько месяцев.Молекула обычно тестируется в группе от 20 до 100 человек (здоровых добровольцев) для оценки переносимости и фармакокинетики (изучение того, что происходит с лекарством в организме). На этом этапе также определяется самая высокая и безопасная доза для применения у пациентов.
Фаза II: оценка эффективности препарата в группе от нескольких десятков до нескольких сотен пациентов. На этом этапе проверяется, активна ли молекула в лечении целевого заболевания, определяется оптимальная доза и регистрируются побочные эффекты.
Фаза III: часто упоминается как «ключевое исследование». Молекула тестируется на большей группе пациентов, состав которой может достигать нескольких тысяч человек. На этом этапе можно определить соотношение польза / риск и выработать меры предосторожности при дальнейшем использовании молекулы. По завершении этого этапа в органы здравоохранения может быть подана заявка на получение регистрационного удостоверения (РУ).
Фаза IV: проводится после получения регистрационного удостоверения. На этом этапе изучается переносимость и эффективность лекарства в долгосрочной перспективе. Постмаркетинговый мониторинг важен, потому что даже после многочисленных исследований определенные эффекты препарата могут быть не полностью изучены. 4
На данный момент только одна молекула из десяти проходит все вышеописанные стадии 3 . Однако процесс клинической разработки лекарств для лечения онкологических или редких заболеваний может быть ускорен путем уменьшения количества участвующих в исследованиях пациентов и объединения определенных фаз.
Фармацевтические компании, исследователи, врачи и пациенты — все вовлечены!
Клинические исследования обычно занимают несколько лет, а иногда могут длиться до десяти лет, и требуют ежедневных усилий всех вовлеченных в них сторон, направленных на поиск новых, жизненно важных для пациентов методов лечения.
Клинические исследования чаще всего инициируются и финансируются фармацевтическими компаниями. Все клинические исследования проводятся квалифицированными специалистами в соответствующей области медицины, которых называют исследователями. Они несут ответственность за надлежащее проведение исследования, за включение пациентов в исследование и за их безопасность. Что касается участников, то они всегда привлекаются на добровольной основе.
Обеспечение прозрачности результатов в строгих правовых рамках
Чтобы начать клиническое исследование, требуются различные разрешения от компетентных органов каждой страны. Сроки получения разрешений варьируются в различных странах: от 30 до более чем 200 дней. В Российской Федерации этот срок составляет около 90-100 дней.
Каждый участник должен получить всю информацию об исследовании в письменной форме (включая все преимущества и риски, связанные с исследованием) и должен дать свое согласие, подписав форму информированного согласия, прежде чем он/она сможет начать участие в исследовании. Этические аспекты медицинских исследований во всем мире регулируются Нюрнбергским кодексом и Хельсинкской декларацией 1964 года, а также их последующими редакциями.
Публикация результатов клинических исследований представляет большой интерес для медицинского и научного сообществ, поскольку помогает обеспечить прозрачность результатов, независимо от их характера. Хельсинская декларация гласит: «Каждое исследование с участием людей в качестве субъектов исследования должно быть зарегистрировано в публично доступной базе данных прежде, чем в него будет включен первый субъект».
ВПЕРЕДИ НОВЫЕ ЗАДАЧИ
- Ускорение исследований и получения регистрационного удостоверения.Столкнувшись с пандемией COVID-19, многие фармацевтические компании ведут настоящую «гонку вакцин» и стремятся ускорить исследования, чтобы в срочном порядке предоставить эффективную вакцину, доступную для всех.
- Повышенная потребность в прозрачности:в контексте, когда широкая общественность выражает недоверие к фармацевтической промышленности, заинтересованные стороны мобилизуются для большей прозрачности. Поскольку в Европе публикуется только половина результатов исследований 5 , было принято несколько нормативных актов, способствующих публикации результатов клинических испытаний.
- Цифровизация клинических испытаний. Ускорение перехода к цифровому формату – важная задача для всех заинтересованных сторон в сфере здравоохранения. Использование цифровых технологий в клинических исследованиях может быть целесообразным, поскольку это облегчит участие пациентов, живущих далеко от исследовательских центров, повысит их приверженность лечению (например, посредством уведомлений) и обеспечит доступ к данным в режиме реального времени.
- Пациент в центре исследований: . Они могут лучше всех рассказать о своем заболевании / состоянии, его течении и эффективности лечения, которое они получают. Вовлечение пациентов на как можно более раннем этапе позволяет ускорить клинические исследования и разработать методы лечения, которые наилучшим образом соответствует их потребностям.
А как в Сервье?
Клинические исследования Группы проводятся командами экспертов с применением высоких и строгих стандартов. Надлежащее проведение исследований требует слаженной работы команд, ответственных за международную координацию, и локальных команд в 18 странах, что позволяет организовывать клинические исследования во всем мире. Таким образом, глобализация процесса разработки лекарственных препаратов в Сервье играет фундаментальную роль в формировании научного имиджа компании и позволяет разрабатывать инновационные лекарства, соответствующие различным потребностям пациентов.
Чтобы создавать лекарственные препараты, которые наилучшим образом отвечали бы потребностям пациентов, Сервье стремится привлекать их к разработке лекарственных препаратов напрямую или через ассоциации пациентов: сюда включают обсуждение протоколов клинических исследований, разработку форм информированного согласия и брошюр для повышения осведомленности пациентов, получение отзывов пациентов после исследования и предоставление им адаптированных резюме исследования.
Цифровые технологии и данные повышают гибкость, эффективность и продуктивность, ускоряя процесс разработки лекарственных средств, итеративный алгоритм идентификации молекул и проведение клинических исследований, а также помогают лучше понимать пациентов. Для внедрения цифровых технологий в клинические исследования используется программа SCORE: она обеспечивает удаленную связь между пациентами и медицинскими и научными специалистами, позволяя им получать доступ к данным исследований в режиме реального времени, тем самым упрощая принятие решений. Платформа FEDERATES, которая в настоящее время находится в стадии разработки, повысит качество передачи информации и данных в режиме реального времени и ускорит проведение исследования на разных этапах.
5 Goldacre Ben, DeVito Nicholas J, Heneghan Carl, Irving Francis, Bacon Seb, Fleminger Jessica et al. Compliance with requirement to report results on the EU Clinical Trials Register: cohort study and web resource BMJ 2018; 362 :k3218
Читайте также
САХАРНЫЙ ДИАБЕТ 2 ТИПА — БОЛЕЗНЬ ОБРАЗА ЖИЗНИ
Источник