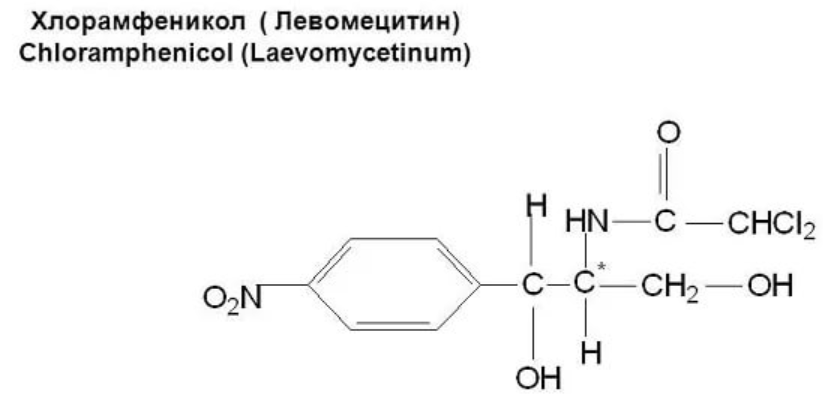
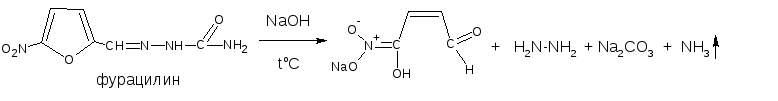
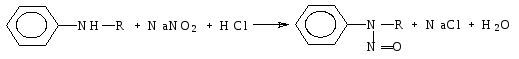- 6. Лекарственные вещества, содержащие ароматическую нитрогруппу
- 7. Лекарственные вещества, содержащие вторичную аминогруппу
- 6. Лекарственные вещества, содержащие ароматическую нитрогруппу
- АНТИМИКРОБНЫЕ ПРЕПАРАТЫ В РЯДУ ПРОИЗВОДНЫЗ СУЛЬФАНИЛАМИДА, ДИАМИНОПИРИМИДИНА, 5-НИТРОИМИДАЗОЛА, ДИ-N-ОКСИХИНОКСАЛИНА
6. Лекарственные вещества, содержащие ароматическую нитрогруппу
Ароматическая нитрогруппа – это группа NO2, связанная с ароматическим радикалом.
Нитрогруппа содержит элементы обладающие большим сродством к электрону, поэтому проявляют значительный электроноакцепторный эффект.
На основе свойств нитрогруппы, связанной с ароматическим радикалом, используются следующие реакции идентификации содержащих её лекарственных веществ:
— восстановление до аминогруппы;
— образование солей ациформы.
6.1. Восстановление до ароматической аминогруппы
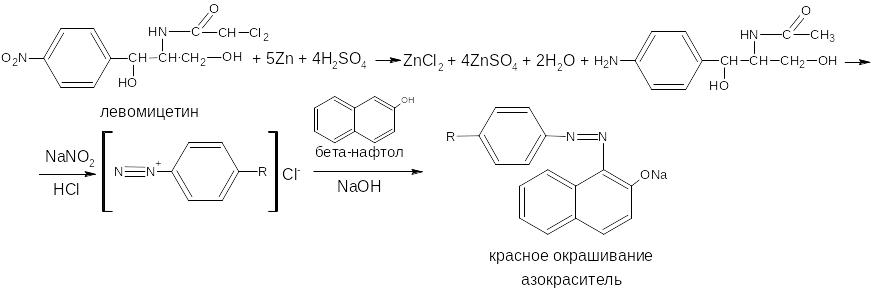
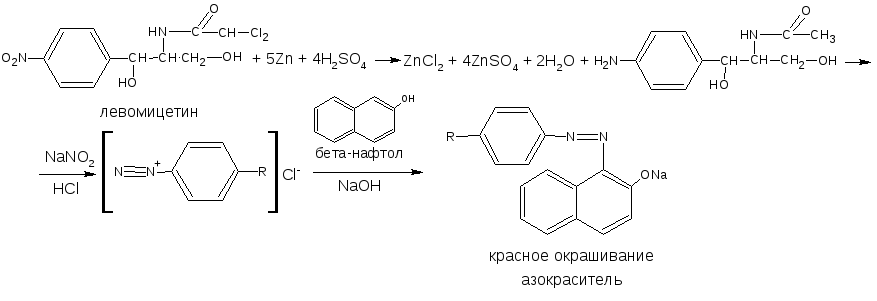
Ароматические нитросоединения обычно окрашены в бледно-жёлтый цвет (нитрогруппа – хромофор). При наличии других заместителей интенсивность и глубина окраски часто усиливаются. Все нитросоединения в кислой среде восстанавливаются до соответствующих аминосоединений, при этом жёлтая окраска препаратов исчезает. Реакция протекает по следующей схеме.
В качестве восстановителя используют, как правило, металлический цинк (в виде пыли) в кислой среде.
Образовавшиеся соединения с ПАА доказывают по реакции диазотирования с последующим азосочетанием или реакции конденсации с ароматическими альдегидами.
6.2. Образование аци-солей
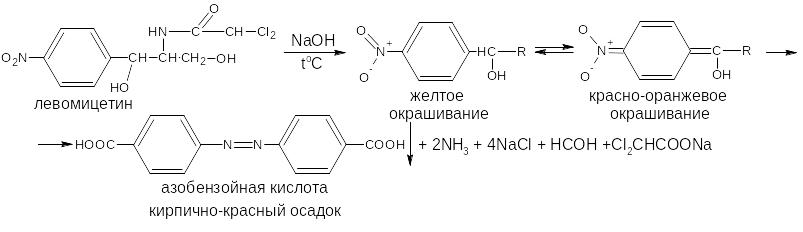
Ароматические нитросоединения, содержащие в о- и п-положениях группу с подвижным атомом водорода, при действии щелочей окрашиваются в жёлтый или оранжевый цвет вследствие образования солей аци-формы.
6.3. Нитритометрический метод
После восстановления нитрогруппы до аминогруппы. Метод рекомендован ГФ для количественного определения левомицетина, парацетамола и фенацетина (после предварительного гидролитического разложения).


6.4. Фотоколориметрия и спектрофотометрия
На основе реакции с раствором едкого натра (фармакопейные методики для фурадонина и фуразолидона).
7. Лекарственные вещества, содержащие вторичную аминогруппу
Вторичная и третичная аминогруппы – это ФГ, входящие в структуру вторичных и третичных аминов. Их можно рассматривать как производные аммиака, у которого два или три атома водорода замещены на углеводородные радикалы:
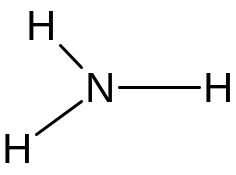
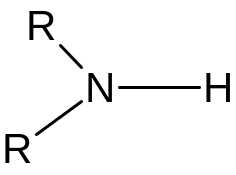
аммиак вторичный амин третичный амин
Вторичная и третичная аминогруппы могут быть представлены и гетероатомом азота (вторичным, третичным), входящим в состав цикла лекарственного соединения. Во всех вышеназванных случаях атом азота имеет неподелённую пару электронов и придаёт соединениям свойства оснований, сила которых зависит от природы радикалов и атомных групп, связанных с азотом.
В медицинской практике лекарственные соединения, содержащие рассматриваемые ФГ применяются в виде солей и реже оснований.
Примерами лекарственных соединений, содержащих вторичную аминогруппу, являются эфедрина гидрохлорид, адреналина гидротартрат, дикаин; третичную – новокаин, ксикаин, тримекаин, аминазин; вторичный гетероатом азота – дибазол, теофиллин; третичный – кодеин, морфина гидрохлорид, промедол, атропина сульфат, хинозол, папаверина гидрохлорид.
7.1. Реакции с осадительными (общеалкалоидными) реактивами
В соответствии с основными свойствами соединения данной группы могут образовывать в солянокислой среде, даже в сильно разбавленных растворах труднорастворимые в воде, чаще всего окрашенные соединения с кислотами, солями тяжелых металлов, комплексными йодидами.
Используемые для этих целей реактивы делят обычно на 2 группы:
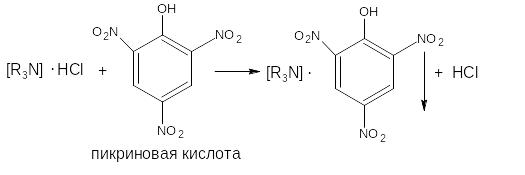
реактивы, дающие простые соли: хлорная (циклодол); марганцевая (кокаина гидрохлорид); тиоцианистая (дикаин); пикриновая кислоты (промедол, оксилидин); танин (кофеин) и др. Например:
реактивы, дающие комплексные соли:
раствор йода в йодиде калия (KI3) – реактив Люголя, Вагнера или Бушарда (отличаются концентрациями йода и калия йодида) – кофеин, дибазол; раствор йодида висмута в йодиде калия (K[BiI4]) – реактив Драгендорфа – для обнаружения азотсодержащих веществ основного характера при хроматографии в тонком слое сорбента; раствор йодида ртути в йодиде калия (K2[HgI4]) – реактив Майера – платифиллина гидротартрат, секуринина нитрат; фосфорномолибденовая кислота – реактив Зонненштейна H3PO4*12MoO3*3H2O; фосфорновольфрамовая кислота – реактив Шейблера H3PO4*12WoO3*3H2O и др.
Реакции с данными реактивами не являются специфичными, но специфичность их возрастает, если продукты реакции имеют кристаллическое строение и плавятся при определенной температуре. Так, пикраты аминов, чаще всего имеют желтую окраску, характерную форму кристаллов и четкий интервал температуры плавления (пикраты атропина, пахикарпина, стрихнина и др.).
Характерную форму кристаллов имеют также перманганат кокаина, перйодид морфина и др.
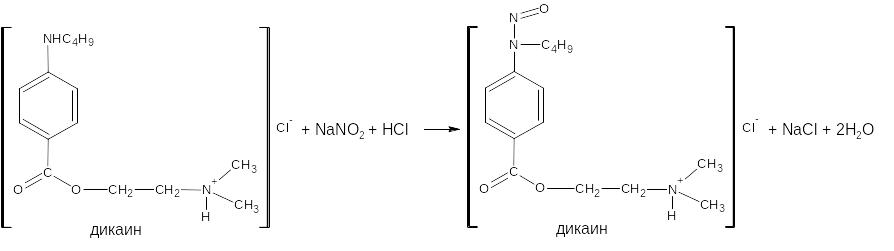
По температуре плавления определяют подлинность дикаина в виде роданида, циклодола в виде перхлората и др.
Вторичные ароматические амины с нитритом натрия в солянокислой среде образуют нитрозосоединения изумрудно-зеленого цвета.
7.2. Реакция выделения оснований
В связи с тем, что вторичные и третичные амины обладают слабыми основными свойствами, они могут быть выделены из водных растворов солей щелочными реагентами в виде маслянистой жидкости (новокаин) или осадка, у которого можно определить температуру плавления, например при фармакопейном анализе атропина сульфата, папаверина гидрохлорида.
7.9. Нитритометрический метод
Применяется для анализа лекарственных веществ, содержащих вторичную арил-, алкил- аминогруппу и способных под действием нитрита натрия в кислой среде образовывать нитрозосоединения. Титрантом является раствор нитрита натрия, индикатором нейтральный красный или тропеолин 00. Таким образом, по ГФ определяют дикаин.
7.10. Экстракционно-фотометрический метод
В основе данного метода лежат реакции взаимодействия лекарственных веществ основного характера с кислотными красителями (эозин, тимоловый синий, тропеолин 00, метиловый оранжевый, пикриновая кислота и др.). Образующиеся продукты реакции (ионные ассоциаты) экстрагируют органическим растворителем и у полученного окрашенного раствора измеряют оптическую плотность.
Экстракционная фотометрия является высокочувствительным методом и используется для количественного определения ЛВ в лекарственных формах с малым содержанием анализируемого компонента (например, атропина сульфата в лекарственных формах).
Источник
6. Лекарственные вещества, содержащие ароматическую нитрогруппу
Ароматическая нитрогруппа – это группа NO2, связанная с ароматическим радикалом.
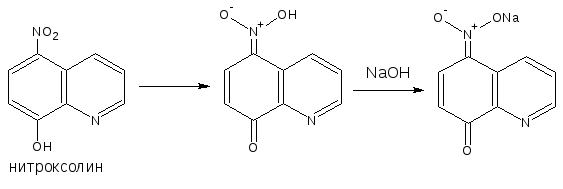
Её содержат производные нитрофенилалкиламина (левомицетин), 4-аминохинолина (трихомоноцид), 8-оксихинолина (нитроксолин), 5-нитрофурана (фурацилин, фурадонин, фуразолидон), бензодиазепина (нитрозепам).
Нитрогруппа содержит элементы обладающие большим сродством к электрону, поэтому проявляют значительный электроноакцепторный эффект.
На основе свойств нитрогруппы, связанной с ароматическим радикалом, используются следующие реакции идентификации содержащих её лекарственных веществ:
— восстановление до аминогруппы;
— образование солей ациформы.
6.1. Восстановление до ароматической аминогруппы
Ароматические нитросоединения обычно окрашены в бледно-жёлтый цвет (нитрогруппа – хромофор). При наличии других заместителей интенсивность и глубина окраски часто усиливаются. Все нитросоединения в кислой среде восстанавливаются до соответствующих аминосоединений, при этом жёлтая окраска препаратов исчезает. Реакция протекает по следующей схеме.
В качестве восстановителя используют, как правило, металлический цинк (в виде пыли) в кислой среде.
Образовавшиеся соединения с ПАА доказывают по реакции диазотирования с последующим азосочетанием или реакции конденсации с ароматическими альдегидами.
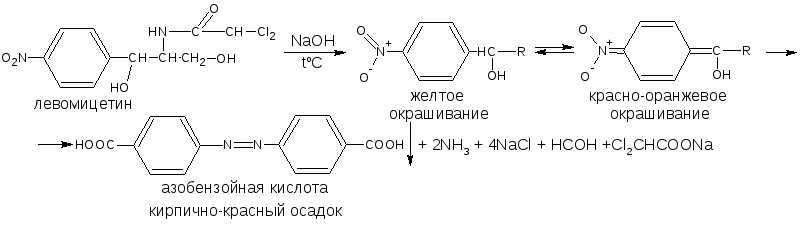
Следует отметить особенность производных 5-нитрофурана.
После их восстановления окраска исчезает, а образующееся соединение с первичной аминогруппой быстро разлагается с раскрытием фуранового цикла. По этой причине получение азокрасителя на основе вышеназванных соединений не удаётся.
6.2. Образование аци-солей
Ароматические нитросоединения, содержащие в о- и п-положениях группу с подвижным атомом водорода, при действии щелочей окрашиваются в жёлтый или оранжевый цвет вследствие образования солей аци-формы.
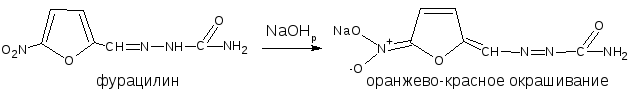
Аналогично ведут себя производные 5-нитрофурана. Как кислоты эти вещества реагируют со щёлочью, образуя окрашенные аци-соли.
При действии разбавленного раствора щёлочи происходит перераспределение электронной плотности, депротонирование гидразидной группы и увеличение цепи сопряжения. В результате чего происходит изменение окраски и увеличение её интенсивности.
При действии концентрированных растворов щелочей и при нагревании реакция идёт с раскрытием фуранового цикла.
При действии растворов щелочей в неводной среде нитропроизводные образуют аци-соли иной окраски, чем в водной. Например, фурацилин в водной среде образует аци-соль оранжево-красной окраски, в среде ДМФА – фиолетовой.
6.3. Нитритометрический метод
После восстановления нитрогруппы до аминогруппы. Метод рекомендован ГФ для количественного определения левомицетина, парацетамола и фенацетина (после предварительного гидролитического разложения).
6.4. Фотоколориметрия и спектрофотометрия
На основе реакции с раствором едкого натра (фармакопейные методики для фурадонина и фуразолидона).
Источник
АНТИМИКРОБНЫЕ ПРЕПАРАТЫ В РЯДУ ПРОИЗВОДНЫЗ СУЛЬФАНИЛАМИДА, ДИАМИНОПИРИМИДИНА, 5-НИТРОИМИДАЗОЛА, ДИ-N-ОКСИХИНОКСАЛИНА
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
Антибактериальные химиотерапевтические средства, кроме антибиотиков, представлены также препаратами других классов химических веществ с различным механизмом антимикробного действия. В статье рассматриваются четыре группы препаратов, которые давно применяются в клинической практике и заслуживают оценки с точки зрения их значимости в современной антибактериальной терапии.
Антибактериальные химиотерапевтические средства, кроме антибиотиков, представлены также препаратами других классов химических веществ с различным механизмом антимикробного действия. В статье рассматриваются четыре группы препаратов, которые давно применяются в клинической практике и заслуживают оценки с точки зрения их значимости в современной антибактериальной терапии.
Antibiotic chemicals, except for antibiotics, are represented as drugs from other classes of chemicals having a different mechanism of antimicrobial action. The paper covers 4 groups of drugs which have been long clinically used and are worthy of notice in the context of their significance in the present-day antibiotic therapy.
Профессор Е.Н. Падейская, Москва.
Prof. Ye.N. Padeyskaya, Moscow
А нтибактериальные химиотерапевтические средства, кроме большой группы природных или полусинтетических антибиотиков, хинолонов и фторхинолонов, представлены препаратами и других классов химических веществ с различным механизмом антимикробного действия. Из них в настоящей публикации рассматриваются четыре группы препаратов, которые давно применяются в клинической практике (некоторые в течение 30 — 50 лет) и заслуживают оценки с точки зрения значимости в современной антибактериальной терапии. Следует подчеркнуть, что производные сульфаниламида (СА), диаминопиримидина и 5-нитроимидазола, кроме антибактериальной, характеризуются и антипротозойной активностью.
1. Препараты группы ко-тримоксазола и производные сульфаниламида
Для этиотропной терапии различных инфекционных заболеваний в настоящее время достаточно широко применяются комбинированные препараты, которые выпускаются в фиксированных лекарственных формах. В их состав обычно входят два антимикробных средства, иногда — три. Выбор сочетаний предусматривает:
| 1) потенцирование активности по сравнению с действием одного препарата в монотерапии; 2) расширение спектра действия, включая активность и в отношении резистентных штаммов к тому или другому компоненту в сочетании; 3) возможность снижения частоты развития лекарственной устойчивости к определенной группе антимикробных препаратов; 4) улучшение переносимости лекарств, уменьшение частоты и тяжести побочных реакций, в первую очередь за счет снижения лечебных доз препаратов. |
В 1997 г. исполняется 30 лет с тех пор, как в клинической практике начал применяться препарат ко-тримоксазол (КТЗ), который представляет собой сочетание сульфаниламида — сульфаметоксазола (СМОЗ) с препаратом триметоприм (ТРМП), производным диаминопиримидина (ДАП) , потенцирующего действие СМОЗ. КТЗ до сих пор сохраняет свое значение в химиотерапии бактериальных и, в большей степени, некоторых протозойных инфекций. Принцип, на котором основана разработка КТЗ, привел к созданию ряда активных препаратов широкого спектра действия на основе производных СА и ДАП.
Производные СА являются «основоположниками» этиотропного лечения бактериальных инфекций, в том числе в монотерапии. В связи с огромными успехами по синтезу новых высокоэффективных (в том числе и малотоксичных) антимикробных препаратов в других классах химиотерапевтических веществ значение СА существенно уменьшилось, тем не менее ряд препаратов этой группы остаются в арсенале врача и при хорошей переносимости больными при легких и среднетяжелых формах инфекций , могут быть применены в монотерапии в соответствии с чувствительностью возбудителя инфекции. Недостатками производных СА являются достаточно быстрое развитие к ним лекарственной устойчивости бактерий по типу плазмидной, быстрое распространение лекарственно-устойчивых штаммов, перекрестная устойчивость в пределах данной группы препаратов, высокие лечебные дозы для СА короткого действия, ряд побочных реакций.
На основе препаратов системного действия синтезированы плохо растворимые и плохо всасывющиеся из кишечника СА, предназначенные для лечения некоторых кишечных инфекций бактериальной этиологии, а также лекарственные формы для местного применения при бактериальных инфекциях. Кроме того, синтезированы препараты (азокраски) для лечения неспецифического язвенного колита.
• СА продленного действия ( депо-СА) по механизму влияния на микробную клетку не отличаются от кратковременно действующих СА. Основное различие между препаратами состоит в особенностях выведения из организма почками. Медленное выведение депо-СА зависит от их способности обратно всасываться в кровь в дистальных отделах почечных канальцев после экскреции клубочками. СА длительного и сверхдлительного действия реабсорбируются на 80 — 70%. После однократного введения в лечебных дозах их терапевтическая концентрация определяется в крови в течение 24 — 48 ч и даже недели.
• СА средней длительности действия (к ним относится и компонент КТЗ — СМОЗ) реабсорбируются примерно на 50% и их необходимая концентрация определяется в крови в течение 12 ч после введения терапевтических доз.
• СА короткого действия практически не подвергаются обратному всасыванию и выводятся из крови через 4 — 6 ч.
Процесс реабсорбции связан с растворимостью препарата в липидах: чем больше растворимость в липидах, тем выше степень реабсорбции. Способность к реабсорбции в канальцах зависит только от физико-химических свойств соединения: продленное действие депо-СА не связано с введением в структуру препарата или добавлением к лекарственной форме какого-либо специального депонирующего вещества.
Растворимые формы депо-СA, введенные парентерально, так же медленно выводятся из организма, как и нерастворимые формы, введенные перорально. Степень связывания препарата с белками плазмы (иногда до 80 — 70%) не играет решающей роли в депо-эффекте: среди ультрапрологированных СА имеется препарат с относительно низкой степенью связывания (сульфален, связывание не более 40%); с другой стороны, некоторые препараты короткого действия могут характеризоваться очень высокой степенью связывания с белками — до 70 — 80% (сульфадимизин, сульфизоксазол). Степень связывания с белками плазмы имеет значение в первую очередь с точки зрения наличия свободного активного соединения в крови, так как связанный с белками плазмы препарат не оказывает антимикробного действия.
Депо-СА применяются в значительно меньших дозах, чем кратковременно действующие, и назначаются со значительно большими интервалами: через 12 — 24 — 72 ч или 1 раз в неделю. Эти препараты требуют строго соблюдения режима дозирования: превышение рекомендуемых доз легко может привести к резкому повышению концентрации в крови и к кумулятивному эффекту с развитием тяжелых побочных реакций. Нарушение клубочковой фильтрации замедляет выведение СА, что наиболее существенно для депо-СА, может быть причиной кумулятивного эффекта и требует коррекции доз. При почечной патологии, когда может быть нарушен процесс реабсорбции, возможно ускорение выведения депо-СА из организма.
В зависимости от способности всасываться из желудочное-кишечного тракта (ЖКТ), системного или местного действия и показаний к применению, СА можно разделить на четыре основные группы:
- СА общерезорбтивного действия для системного лечения бактериальных или протозойных инфекций, возбудители которых чувствительны к производным СА;
- СА, плохо всасывающиеся из желудочно-кишечного тракта и обеспечивающие очень высокие концентрации СА в содержимом кишечника, применяются при острой диарее: бактериальных энтероколитах и дизентерии (для лечения сальмонеллезов, в том числе брюшного тифа, они не применяются);
- лекарственные формы СА системного действия для местного лечения гнойной бактериальной инфекции и инфекций, вызванных хламидиями (трахома, паратрахома). Лекарственные формы на основе серебряных солей СА или соединений, близких к ним по строению (например, мафенид) для местного лечения гнойной инфекции;
- препараты системного действия для лечения неспецифического язвенного колита — салазосульфаниламиды, которые после трансформации в организме оказывают антимикробное действие за счет высвобождающегося производного СА.
В каждой из перечисленных групп имеются СА короткого действия и депо-СA.
СА являются антимикробными препаратами с гермистатическим типом действия. Они избирательно нарушают синтез дигидрофолиевой кислоты в микробной клетке, ингибируя активность фермента синтетазы дигидрофолиевой кислоты, и конкурируют с парааминобензойной кислотой (ПАБК) в процессе синтеза дигидрофолиевой кислоты (см. рисунок). Некоторые СА, кроме того, могут подавлять активность другого важного для синтеза фолиевых кислот фермента — дигидрофолатредуктазы (ДФР), что усиливает их антимикробную активность.
Развитие устойчивости бактерий к СА связано с рядом факторов: снижением чувствительности к СА ферментных систем, катализирующих синтез дигидрофолиевой кислоты, избыточной продукцией клеткой ПАБК или фермента, утилизирующего эту кислоту, снижением проницаемости клеточной стенки бактерий для СА.
Таблица. Производны 5-нитроимидазола: активность in vitro, мг/л; особенности фармакотерапии
Препарат
Концентрация, мг/л (число больных)
T. vaginalis
E. histolytica*
в крови
через1 ч после приема**
в ликворе
через 1,5 ч**
% проникновения
в ликвор
**Дозы внутрь: метронидазол 2,4 г, тинидазол 2,0 г, орнидазол 1,5 г однакратно (данные Jokipii A., Jokipii L., 1981 г., Scand. J. Infect. Dis, 26, Suppl, 123-129).
2. Производные диаминопиримидина
К другой группе химиотерапевтических средств, нарушающих нормальный ситез фолиевых кислот, относятся производные ДАП, которые также являются препаратами с гермистатическим типом действия. Спектр действия ДАП, так же, как и СА, включает большую группу грамположительных и грамотрицательных бактерий и простейших (токсоплазмы, плазмодии малярии, пневмоцисты). К ДАП также достаточно быстро развивается лекарственная устойчивость.
ДАП избирательно ингибируют в микробной клетке фермент ДФР с последующим нарушением синтеза тетрагидрофолиевой кислоты (следующая стадия синтеза фолатов). Это позволяет успешно сочетать ДАП с СА на основе так называемого принципа двойной мишени (см. рисунок). В результате достигается полная блокада синтеза фолиевых кислот, обеспечивается бактерицидный эффект, расширяется спектр действия, снижается частота развития лекарственной устойчивости к производным СА и ДАП. Существенным при сочетании СА с ДАП является возможность снижения дозировок каждого из препаратов.
Производные ДАП могут потенцировать по принципу двойной мишени активность соединений других классов химиотерапевтичеких веществ: хинолонов, фторхинолонов, тетрациклинов, рифампицина, ди-N-окисей хиноксалина.
| Наибольшее практическое значение ДАП приобрели как потенциаторы действия сульфаниламидов |
Первым препаратом был пириметамин (ПРМ), примененный в сочетании с СА для лечения токсоплазмоза и малярии, ПРМ среди ДАП чаще всего используется в сочетании с ультрапролонгированными СА (сульфадоксином, сульфаленом), исходя из показателя периода полувыведения (Т 1/2 ), в терапии протозойных инфекций.
ДФР микроорганизмов в различной степени чувстивительны к различным ДАП. На этом основан выбор ДАП для сочетания с СА. При лечении бактериальных инфекций у человека наиболее широко используют сочетания с ТРМП, затем с тетроксопримом, иногда метиопримом или бродимопримом.
При разработке фиксированных лекарственных форм препаратов этой группы на первых этапах основное значение придавали фармакокинетическим показателям: равному значению Т 1/2 из крови для oбecпeчения нeoбxoдимой концентрации в крови и тканях одновременно двух компонентов препарата. С этой точки зрения наиболее рациональны сочетания СА средней длительности действия с ТРМП и ультрапролонгированных СА с ПРМ. Следует отметить, что ТРМП и другие ДАП хорошо проникают в ткани и тканевые жидкости, обнаруживаясь там длительное время, при гнойных менингитах они хорошо проникают в спинномозговую жидкость.
Оптимальная фармакокинетика ДАП играет существенную роль в потенцирующем эффекте при совместном применении с СА. КТЗ является классическим примером такого препарата: Т 1/2 для СМОЗ и ТРМП — 12 ч, соответственно препарат назначают 2 раза в сутки. Потенцирующий эффект ДАП очень высок и синергизм отмечается в широком диапазоне доз, в том числе и при дозе ТРПМ, в 40 раз меньшей, чем доза СМОЗ.
| КТЗ действен для лечения большой группы бактериальных инфекций различной локализации при легких и средне-тяжелых формах заболевания. Важной областью его применения являются пневмоцистные пневмонии у больных на фоне иммунодефицитных состояний. |
Препарат эффективен при малярии и токсоплазмозе, хотя в этих случаях предпочтительнее другие сочетания СА с ДАП.
Несмотря на высокую бактерицидную активность к КТЗ, за время его применения в клинике отмечается значительное нарастание лекарственной резистентности бактерий. Это особенно демонстративно на примере брюшного тифа. В регионах с высокой заболеваемостью при широком применении препарата выделяются высокоустойчивые штаммы сальмонелл с МПК на уровне 400 мг/л. Развитие резистентности к препаратам типа КТЗ касается не только бактерий, но и простейших, в частности плазмодия малярии. Показано значение мутаций по ДФР в качестве одного из механизмов резистентности.
Побочные реакции при применении КТЗ связаны в равной степени с тем и другим компонентом препарата. В первую очередь — это кожно-аллергические реакции, которые составляют примерно половину из общего числа побочных проявлений: разнообразные экзантемы, крапивницы, в ряде случаев — отек Квинке. Развиваются эти реакции достаточно быстро, в течение первых 2 — 3 дней лечения; чаще всего они проходят вскоре после отмены препарата. Синдром Стивен — Джонсона и синдром Лайелла относительно редки (примерно 1 на 100 000 больных), тем не менее именно риск их возникновения требует особенно пристального внимания врача при терапии этими препаратами. С различной частотой встречаются реакции со стороны ЖКТ.
Учитывая широкий антибактериальный спектр препаратов, необходимо иметь в виду возможность развития дисбактериоза и микотической инфекции. Возможны гематологические реакции (тромбоцитопения, лейкопения, агранулоцитоз, анемия, эозинофилия), которые чаще наблюдаются у лиц с заболеваниями кроветворной системы, при недостаточности функции печени и почек, при скрытой недостаточности фолиевой кислоты или витамина B12. ДАП и СА являются тератогенами и одновременно хорошо проникают через плацентарный барьер, поэтому они противопоказвны при беременности. ДАП характеризуются наиболее выраженными тератогенными свойствами. СА, примененные в поздние сроки беременности, могут быть причиной развития ядерной желтухи у новорожденных (интенсивное свзывание с белками плазмы и конурентные взаимоотношения с билирубином). Особенности токсикологии СА и ДАП, а также характер возможных побочных реакций определяют достаточно широкие противопоказания к их назначению, которые должны строго соблюдаться.
Для лечения бактериальных инфекций у человека к настоящему времени выпущен ряд препаратов, в которых ТРМП сочетается с СА. Препараты различаются по величине Т 1/2 и относятся как к препаратам короткого действия, так и к депо-СА. Оказалось, что при выборе сочетаний, кроме фармакокинетических параметров, существенное значение имеет и критерий активности (степень потенцирующего эффекта при сочетании препаратов, степень активности СА в монотерапии). Показано, что при сочетании ТРМП с некоторыми длительнодействующими СА достигается высокий лечебный эффект при значительном снижении лечебных доз. Примерами являются сочетания сульфамонометоксина и ТРМП (сульфатон) и сульфаметопиразина с ТРМП (келфиприм). При различных значениях Т 1/2 для СА и ДАП соответствие в концентрационных уровнях на протяжении суток и курса лечения обеспечивается рациональной схемой введения и подбором доз.
| Для лечения протозойных инфекций, и в первую очередь лекарственно-устойчивой малярии, токсоплазмоза и пневмоцистной пневмонии, разработаны препараты, содержащие ультрапролонгированные СА — сульфаметопиразин или сульфадоксин (по 0,5 г) в сочетании с ПРМ (0,025 г). |
Наиболее широко используется сочетание с сульфадоксином. Эти препараты активны в отновении всех видов возбудителей малярии человека (P. falciparum, P. vivax, P. malariae, P. ovale), включая штаммы, устойчивые к противомалярийным препаратам группы 4-аминохинолина, а также устойчивые к ПРМ. По мере их применения в клинической практике регистрируется резистентность плазмодиев малярии. В ходе исследований создан трехкомпонентный препарат для лечения малярии, состоящий из: сульфадоксина, ПРМ и мефлоквина (новое производное хинолина), повышающего активность в отношении лекарственно-устойчивых штаммов P. falciparurn.
Значение ДАП существенно и в комбинированных препаратах на основе рифампицина. Сочетание рифампицина с ТРМП позволяет снизить частоту развития резистентности к рифампицину и достаточно успешно применяется в клинике.
Для большинства препаратов на основе СА и ДАП существуют детские лекарственные формы в таблетках с уменьшенной дозировкой или в виде сиропов и суспензий. Следует отметить различное отношение педиатров к назначению препаратов этой группы. Одни полностью отвергают целесообразность их применения при бактериальных инфекциях из-за возможных побочных реакций, недостаточной эффективности (в сравнении с антибиотиками) и в связи с развивающейся лекарственной устойчивостью, другие применяют КТЗ достаточно успешно при легких и среднетяжелых формах бактериальных инфекций, оценивая в том числе положительно лекарственные формы в виде суспензий, отмечая и достаточно хорошую переносимость, и удобство применения.
Рис. Схема механизма антимикробного действия производных сульфаниламида (СА) и диаминопримидина (ДАП)
Инъекционные формы препаратов типа ко-тримоксазола не получили широкого применения из-за сложности технологии получения (плохая растворимость ДАП и ТРМП в частности) и необходимости инфузионного капельного введения. Хорошая биодоступность пероральных форм позволяет в большинстве случаев избежать инъекционной терапии. Наибольшее практическое значение имеет лекарственная форма сочетания сульфадоксина с ПРМ, предназначенная для внутримышечного введения при наиболее тяжелых формах лекарственно-устойчивой тропической малярии.
3. Препараты группы 5-нитроимидазола
Производные 5-нитроимидазола (НИМЗ) составляют важную группу химиотерапевтических средств с активностью в отношении простейших и анаэробных бактерий. На аэробные бактерии НИМЗ не действуют, они также не активны в отношении микобактерий, патогенных грибов, спирохет, вирусов. Первым высокоактивным препаратом, примененным в клинике в 1960 г., был метронидазол. Затем был синтезирован ряд не менее активных его аналогов, которые также нашли широкое клиническое применение. Метронидазол сначала рассматривался только как антипротозойный препарат; в 1962 г. была доказана его активность и в отношении большинства анаэробных бактерий.
В настоящее время в клинической практике наибольшее значение приобрели метронидазол, тинидазол и орнидазол.
| Спектр действия производных 5-нитроимидазола включает грамотрицательные и грамположительные анаэробные бактерии и простейшие: трихомонады, лямблии, балантидии, дизентерийную амебу, лейшмании. |
В клинике препараты относятся к числу важнейших средств для лечения анаэробной инфекции и протозойных заболеваний. Активность НИМЗ в отношении анаэробных бактерий сопоставима с клиндамицином, карбапенемами, комбинироанными препаратами с ингибиторами b-лактамаз , с хлорамфениколом.
НИМЗ — ДНК-тропные соединения с избирательной активностью в отношении микроорганизмов, имеющих ферментные системы, способные восстанавливать нитрогруппу и катализировать взаимодействие белков группы ферридоксинов с нитросоединениями. Препараты ингибируют синтез ДНК-чувствительных клеток. Механизм действия после проникновения НИМЗ в микробную клетку связан с восстановлением нитрогруппы под влиянием нитроредуктаз микроорганизмов и с активностью уже восстановленного нитромидазола. Продукты восстановления образуют комплексы с ДНК, вызывая ее деградацию, нарушают процессы репликации и транскрипции ДНК. Продукты метаболизма НИМЗ, кроме того, обладают цитотоксическим свойством. НИМЗ характеризуется мутагенной активностью.
Применяющиеся более 40 лет в клинике, препараты этой группы высокоактивны в отношении анаэробов и протозоа in vitro, причем МПК на 1 — 3 порядка ниже сывороточных концентраций при применении терапевтических доз (см. таблицу) .
НИМЗ относятся к препаратам с гермицидным типом действия. Бактерицидное действие в отношении анаэробных бактерий проявляется в концентрациях, равных или в два раза превышающих МПК. Формирование лекарственной устойчивости к НИМЗ связано со снижением активности нитроредуктаз и степени внутриклеточной трансформации соединений, снижением образования комплексов с ДНК и концентрации цитотоксических продуктов метаболизма; возможно также снижение проницаемости клеточной стенки микроорганизмов для НИМЗ. Развитие приобретенной устойчивости к НИМЗ не является клинической проблемой: степень устойчивости должна быть очень высокой (МПК более 32 мг/л), чтобы превысить уровень терапевтических концентраций при курсовом лечении.
НИМЗ характеризуются благоприятной фармакокинетикой и высокой степенью биодоступности при пероральном применении, что исключает необходимость широко использовать внутривенное введение. Они хорошо проникают в ткани и жидкости организма, включая спинномозговую жидкость и грудное молоко. Лучше всего в спинномозговую жидкость проникает тинидазол (до 80% от концентрации в крови).
Препараты медленно выводятся из организма и могут обеспечить, после однократной, дозы терапевтический уровень в крови и органах в отношении В. fragilis в течение 2 дней. НИМЗ достаточно хорошо всасываются при введении ректально или интравагинально (этот способ широко применяется при лечении трихомониаза). НИМЗ выводятся почками (главным образом) и с желчью.
Препараты группы НИМЗ являются вожными средствами для лечения анаэробных инфекций различной локализации, включая тяжелые генерализованные формы и особенно инфекцию ЦНС. При смешанной аэробно-анаэробной инфекции необходима комбинированная терапия препаратами, активными в отношении аэробной флоры. НИМЗ хорошо сочетаются с антибактериальными препаратами различных фармакологических групп. При тяжелых формах анаэробной или смешанной аэробно-анаэробной инфекции лечение следует начинать с внутривенного введения НИМЗ, а при улучшении состояния больного переходить на пероральную терапию. Для эмпирической терапии предполагаемой анаэробной или смешанной анаэробно-аэробной инфекции может быть предложен ряд схем лечения, в том числе с включением НИМЗ: 1) при инфекциях ЦНС — бензилпенициллин или цефалоспорины (ЦФ) 3-й генерации + НИМЗ (предпочтительнее тинидазол); в монотерапии — хлорамфеникол; 2) при инфекциях нижних дыхательных путей — бензилпенициллин или ЦФ 3 + НИМЗ или клиндамицин; в монотерапии — карбапенемы (имипенем, меропенем) или амоксициллин-клавуланат; 3) при интраабдоминальных инфекциях — ЦФ 2 или 3 + НИМЗ или клиндамицин; в монотерапии — карбапенемы; 4) при гинекологических инфекциях — ЦФ 2 или 3 + НИМЗ; в монотерапии — карбапенемы.
НИМЗ активны в отношении Helicobacter pylory, диапазаон МПК от 0, 125 до 32 мг/л и выше. В связи со значением этого микроорганизма в патогенезе язвенной болезни НИМЗ включаются в настоящее время в комплексную терапию этого заболевания. Эффективность лечения находится в зависимости от преобладания в соответствующих регионах штаммов Н. pylori, устойчивых к НИМЗ. Иногда выделяется до 50% устойчивых штаммов. За пять лет (1991 — 1995) отмечено нарастание устойчивости к метронидазолу с 9 до 22% при обследовании 282 штаммов; в меньшей степени нарастала устойчивость к кларитромицину.
Метронидазол, орнидазол и тинидазол широко применяются для лечения протозойных инфекций. Они высокоэффективны при трихомонозе у мужчин и женщин; отмечается их хорошая переносимость, практически не развивается устойчивость к ним трихомонад. Все три препарата показаны при лечении различных форм амебиаза. Нужно отметить их преимущество при лечении внекишечных форм, особенно при амебных гепатитах. Быстрая всасываемость из ЖКТ снижает возможности препаратов при хронической амебной дизентерии и цистоносительстве. НИМЗ показаны для лечения лямблиоза; в гинекологической практике их успешно применяют в комплексной терапии при гарднереллезе.
Из особенностей токсикологии НИМЗ следует указать на установленную в эксперименте канцерогенную активность. Однако большой клинический опыт убедительно показывает безопасность препаратов с этой точки зрения. В 1996 г. опубликованы данные большого рандомизированного исследования (более чем 60 000 пациентов), которые показывают, что частота возникновения опухолей в группе больных, получавших по различным показаниям метронидазол (30 027 больных), не только не превышала, но и была даже ниже, чем в контрольной группе (30 027 больных).
Данные о неблагоприятном действии НИМЗ на плод отсутствуют, вместе с тем, учитывая хорошее проникновение препаратов через плацентарный барьер, высокое содержание в амниотической жидкости, данные по канцерогенной активности в эксперименте и мутагенное действие, препараты не назначают во время беременности. НИМЗ обнаруживаются в высоких концентрациях в грудном молоке и при показаниях к их применению у кормящих женщин (послеродовые эндометриты, вызванные анаэробной инфекцией, трихомониаз) противопоказано кормление грудью.
Клиническая практика показывает достаточно хорошую переносимость НИМЗ; препараты применяются у взрослых больных и в педиатрии с сответствующей коррецией доз в зависимости от инфекции, возраста больного и функционального состояния почек. В числе возможных побочных проявлений отмечают реакции со стороны ЖКТ, ЦНС, со стороны кроветворной системы (лейкопения); последние связаны с наличием нитрогруппы в структуре соединений. Метронидазол и тинидазол ингибируют активность фермента альдегиддегидрогеназы и нарушают метаболизм алкоголя в организме, что приводит к тетурамоподобным реакциям. Орнидазол не обладает этой активностью.
НИМЗ характеризуются радиосенсибилизирующими свойствами, и за последние годы их начали применять в онкологической практике при лучевой терапии, что повышает ее эффективность.
Более 20 лет в клиниках России для лечения различных форм гнойной инфекции успешно применяется диоксидин — препарат из группы производных ди-N-окиси хиноксалина. Наряду с выраженной антимикробной активностью диоксидин характеризуется рядом нежелательных токсикологических свойств, что вызвало серьезные дискуссии о целесообразности его применения в клинике.
| Клиническая практика показала, что при строгом соблюдении показаний к применению, дозировок и возрастных ограничений, препарат оказывается эффективным и необходимым средством в терапии тяжелой гнойной аэробной и особенно смешанной аэробно-анаэробной инфекции, в том числе неклостридиальной анаэробной инфекции. |
Главным образом препарат применяется местно (мазевые формы, орошение ран водным раствором, внутриполостное введение, эндобронхиальное). При тяжелых генерализованных формах инфекции (сепсис, интраабдоминальные инфекции, гнойные процессы после операций на кишечнике, особенно в онокологической практике, инфекции ЦНС и другие формы) и неэффективности предшествующей антибактериальной терапии диоксидин назначают внутривенно (капельно) в моно- или в комбинированной терапии. Внутривенное введение диоксидина назначается по жизненным показаниям. Препарат нашел применение в оториноларингологии при тяжелых, злокачественных отитах, синуситах, в том числе в виде инсуффляций. Для хирургической практики разработаны полимерные композиции с включением диоксидина (штифты для остеосинтеза, шовный материал, покрытия для раневой поверхности), в которых препарат используется для профилактики раневой инфекции.
Учитывая клиническую эффективность диоксидина и особенности его токсикологии, обосновано обсуждение итогов экспериментально-клинического изучения и применения и препарата, чтобы определить его место и значение в современной антибактериальной терапии.
Диоксидин относится к группе химических соединений, которые характеризуются высокой реакционной способностью, повышенной способностью к поляризации и склонностью к окислительно-восстановительным реакциям. Это во многом определяет широкий диапазон возможных биологических свойств ди-N-окисей хиноксалина и диоксидина в частности.
Диоксидин — препарат с широким антибактериальным спектром, бактерицидным типом действия, с наиболее высокой активностью в отношении анаэробных бактерий; он действует на грамотрицательные (в большей степени) и грамположительные аэробные бактерии, причем в условиях анаэробиоза его активность в отношении факультативных аэробов значительно выше; показана активность препарата в отношении микобактерий. Повышение активности в условиях анаэробиоза обусловливает высокую активность в инфицированном организме, а значительно меньшая активность в аэробных условиях хорошо объясняет отсутствие прямой корреляции между активностью in vitro (при определении стандартными методами в аэробных условиях) и активностью в эксперименте на животных. Это затрудняет разработку критериев для определения степени чувствительности, в том числе с использованием диагностических дисков. Химиотерапевтическая активность диоксидина на модельных инфекциях характеризуется высоким санирующим эффектом и «морфологическим» выздоровлением. Активность препарата в отношении штаммов аэробных бактерий, устойчивых к препаратам других классов химических веществ, в том числе в отношении метициллинрезистентных штаммов стафилококков, высокая активность в отношении анаэробов и особенности действия при экспериментальных инфекциях были основанием для клинической апробации, которая полностью подтвердила терапевтические возможности диоксидина. Важным свойством является его активность при инфекции, вызванной P. aeruginosa.
В основе механизма бактерицидного действия диоксидина лежит повреждение биосинтеза ДНК микробной клетки. Процесс идет наиболее интенсивно в условиях анаэробиоза, что хорошо объясняет и высокую активность препарата в отношении облигатных анаэробов и активность в инфицированном организме при аэробной инфекции, когда антимикробное действие в гнойном очаге по существу происходит в условиях анаэробиоза. Этот механизм специфичен для всех ди-N-окисей хиноксалина с антимикробной активностью и не описан для антимикробных препаратов других классов химических веществ. В инфицированном организме диоксидин активирует свободнорадикальные процессы, индуцируя образование активных форм кислорода. Это имеет значение как для его высокой активности in vivo, так и для проявления ряда нежелательных токсических эффектов. Диоксидин (как и производные нитроимидазола) характеризуется мутагенной активностью. Однако механизм этого эффекта различный, хотя в том и в другом случае связан с ингибированием биосинтеза ДНК. Установлен цитогенетический эффект диоксидина в отношении клеток млекопитающих, показана его зависимость от интенсивности радикалстимулирующей активности препарата. В культуре клеток лимфоцитов человека мутагенное действие определялось только в диапазоне радикалстимулирующих концентраций.
Препараты с антирадикальной активностью и другие антимутагены снимают мутагенное действие препарата. Анализ цитогенетических свойств диоксидина (исследования НИИ медицинской генетики РАМН) показал, что при местном применении в рекомендуемых дозах препарат не повышает частоты мутаций в клетках крови человека, и нет противопоказаний для его наружного применения.
Внутривенное введение должно проводиться по жизненным показаниям при неэффективности предшествующей терапии. Когда обосновывается целесообразность внутривенного введения диоксидина, следует учитывать, что за последние 15 — 20 лет созданы высокоэффективные антибактериальные препараты, имеющие существенные преимущества в сравнении с диоксидином по токсикологическим свойствам.
Препарат хорошо проникает в органы и ткани при внутривенном введении, выводится почками путем клубочковой фильтрации, а также экстраренально; не накапливается в организме при повторных введениях. Диоксидин в сыворотке крови после внутривенного введения терапевтической дозы 300 мг (разовая доза для взрослых) определяется на протяжении 10 ч в концентрациях ниже минимальных ингибирующих для большинства чувствительных микроорганизмов при определении МПК в условиях аэробиоза. В моче в течение 6 ч после введения препарата отмечены очень высокие концентрации диоксидина.
При применении местно и в полости диоксидин хорошо всасывается с раневой поверхности. Местное применение препарата нашло наиболее широкое распространение в урологической и хирургической практике. Этот способ также требует тщательного контроля за дозами во избежание передозировки и побочных действий. Диоксидин практически не метаболизирует в организме. Определяемые возможные метаболиты не обладают антибактериальной активностью.
Существенным недостатком диоксидина является его малая терапевтическая широта, что требует строгого соблюдения рекомендуемых доз. Суточная доза препарата при системном (внутривенном) применении не должна превышать 10 мг/кг (700 мг для больного с массой тела 70 кг). Необходимо также иметь в виду, что наиболее серьезным недостатком препарата является установленное в эксперименте на животных его повреждающее действие на надпочечные железы, характерное и для других соединений этого ряда веществ. Дозы диоксидина, в 10 раз превышающие терапевтическую дозу для человека (100 мг/кг), вызывают развитие дистрофических изменений в корковом слое надпочечных желез в виде деструктивных изменений, вплоть до потери клеточной структуры пучковой зоны (при повышении дозы), и резкое торможение синтеза глюкокортикоидных гормонов. Эффект дозозависимый. Соответственно при передозировке препарата у человека возможно появление побочных реакций, связанных с нарушением синтеза глюкокортикоидов (адреналовая токсичность), что требует немедленной отмены препарата. Диоксидин противопоказан при наличии в анамнезе недостаточности функции надпочечных желез.
Диоксидин оказывает тератогенное действие и с учeтoм всех токсикологических свойств противопоказан при беременности и при кормлении грудью. В длительном хроническом опыте (1,5 — 2 года) не установлено канцерогенных свойств препарата.
Диоксидин не был разрешен для применения у детей в связи с особенностями токсикологии, тем не менее были попытки по жизненным показаниям применять препарат у детей, в том числе раннего возраста. Анализировать результаты этого клинического опыта крайне сложно, так как отсутствуют необходимые подробные отчеты и публикации.
Для корректировки мутагенной активности препарата его применяли с определенным клиническим успехом совместно с антимутагеном актопротектором бемитилом по жизненным показаниям при лекарственно-устойчивых формах генерализованной инфекции, вызванной грамотрицательными бактериями, в том числе у детей раннего возраста. Однако этот опыт также окончательно не проанализирован. Мы полагаем, что применение диоксидина у детей, особенно раннего возраста и новорожденных, с целью системного действия в настоящее время не может быть оправдано, учитывая малую терапевтическую широту и возможное повреждающее действие на надпочечные железы. В особо тяжелых случаях гнойной раневой и ожоговой инфекции, при остеомиелитах, тяжелой осложненной инфекции мочевыводящих путей можно обсуждать только вопрос о местном применении препарата.
| Диоксидин следует рассматривать как препарат резерва для лечения наиболее тяжелых, лекарственно-устойчивых форм гнойной инфекции различной локализации у взрослых больных, в первую очередь при неэффективности предшествующей антибактериальной терапии. |
Диоксидин хорошо переносится тканью мозга, не вызывает судорожных реакций при местном приемнении и с этой точки зрения представляет интерес для нейрохирургической практики. Препарат оказывает ранозаживляющим действие; это свойство заслуживает специального дальнейшего изучения. Лекарственная резистентность к препарату развивается медленно и за период его применения пока не приобрела клинического значения. Механизм развития лекарственной резистентности к диоксидину не изучен.
Белых С.И. Имплантируемые терапевтические средства на основе биосовместимых полимеров. // Дисс. докт. М., 1990.
Большаков Л.В. Динамика чувствительности клинических штаммов бактерий к диоксидину с 1984 по 1988 г.г. // Антибиотики и химиотерапия, 1990, 35, 9, 17 — 8.
Борисенко К.К, Алиев М.Б., Борисенко Л.К. и др. Результаты клинического испытания эффективности и переносимости Тиберала Poщ при лечении больных мочеполовым трихомониазом. // Заболевания, передающиеся половым путем. 1997, 1, 60-3.
Гостищев В.К., Сажин В.П., Авдовенко А.Л. Перитонит, М. Медицина, 1992, 223 с.
Гуськова Т.А, Зеленецкая В.С, Панков Ю.А и др. Влияние диоксидина на кортикостероидную функцию надпочечников. // Хим.-фармац. журн., 1983, 10, 1174-7.
Гуртовой Б.А., Кулаков В.И, Воропаева С.Д. Применение антибиотиков в акушерстве и гинекологии, М.,»Русфармамед», 1 996, 140 с.
Дурнев А.Д., Дубовская О.Ю, Нигарова Э.А, Середенин С.Б. Роль свободных радикалов кислорода в механизме мутагенного действия диоксидина. // Хим.-фарм. журн., 1989, 23, 11, 1289-91.
Лопатин А.С., Станковская И.М. Побочные реакции при терапии комбинированными препаратами типа сульфаметоксазол-триметоприм. // Экспериментальная и клиническая химиотерапия вирусных и бактериальных инфекций, сб. научн. трудов ВНИХФИС, М76 1987, 118-22.
Овчинникова Л.К., Кремнева В.Ф. Фармакология антипротозойных средсв. М., «Унивеситет дружбы народов», 1990, 163 с,
Падейская Е.Н. Антибактериальный препарат диоксидин: итоги и перспективы применения в клинической практике. // Новые лекарственные препараты. Экспресс информация, 1989, вып. 7, 1-18.
Падейская Е.Н. -Комбинированные антибактерианьные препараты на основе производных сульфаниламида и диаминопиримидина. // Новые лекарственные препараты, сб. трудов ВНИХФИ, М., 1991, 94-104.
Падейская Е.Н., Полунина Л.М. Новые сульфаниламидные препараты длительного действия для лечения инфекционных заболеваний, Медицина. 1974.
Холодов Л.E., Панова И. К., Тагиров Р.Ф., Яковлев В.П. Исследование клинической фармакокинетики антибактериального препарата диоксидин с применением дифференциальной импульсной поля-рографи. // Методы индивидуаливации и оптимизации применения лекарств на основе изучения их фармакокинетики, Всесоюзн. конф., Тбилиси, 1982, ч.11, 99-103.
Яковлев С. В. Клиническая химиотерапия бактериальных инфекций, М.,»Ньюдиамед», 1996, 119 с.
Alarcon Т , Domingo G, Sanchez Rl, et ai. Evaluation of resistance to metronidazole and claritromycin in Helicobacter pylori. 36th Intersc., Conf ,Antimicrob Agents Chemother 1996;Abstracts,N E-61:92.
Anthony YH, Peter G, Wislock I, et al. Mechanism of metabolic activation of ronidazole, a 5-nitroimidazole. Biochem Soc Transaction 1984;12:7-9.
Falagas ME, Walker AM, Jick H, et al. Cancer incidence after metronodazole use: a matched metronidazole user/non-user study on 60054 subjects. 36th Intersc. Cont. Antimicrob. Agents Chemother 1996;Abstracts,N K-41:257.
Glupozynski Y, Goitier S, Vindenboor C, et al. Comparative in vitro activity of farropenem and ketoides against recent Belgian clinical isolates of Helicobacter pilori. Ibid., N E-59, p.92.
Petez-Trallero E, Montes M, Aloita M, et al. Resistance to metrinidazole and claritromycin in Helicobacter pylori. Ibid., C-133, p.58.
Panichi G. Antibiotic Treatment of anaerobic infections. Scand J Infect Dis 1989;62,Suppl.:47-51.
Источник