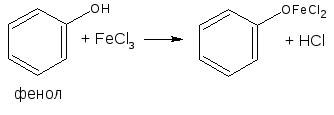
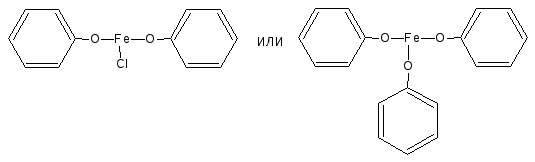
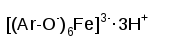- ФЕНОЛ (PHENOL) ОПИСАНИЕ
- Фармакологическое действие
- Фармакокинетика
- Показания активного вещества ФЕНОЛ
- Режим дозирования
- Побочное действие
- Противопоказания к применению
- Применение при беременности и кормлении грудью
- Применение у детей
- Особые указания
- фенолы и нафтолы, молекулы — гидроксильная группа связанная непосредственно с бензольным кольцом
- Номенклатура и изомерия
- Примеры:
- Изомерия в многоатомных фенолах обусловлена положением ОН-групп.
- 2.Синтетический путь получения фенола — кумольный метод из изопропилбензола:
- 3.Гидролиз хлорбензола (SN) :
- Физические свойства.
- Химические свойства.
- Реакции электрофильного замещения:
- б) Реакция нитрования.
- Химические свойства многоатомных фенолов
- У β-нафтола замещение протекает в α-положении:
- 2. Лекарственные вещества, содержащие фенольный гидроксил
ФЕНОЛ (PHENOL) ОПИСАНИЕ
Фармакологическое действие
Фармакокинетика
Показания активного вещества ФЕНОЛ
Открыть список кодов МКБ-10
| Код МКБ-10 | Показание |
| A63.0 | Аногенитальные [венерические] бородавки (остроконечные кондиломы) |
| H66 | Гнойный и неуточненный средний отит |
| L01 | Импетиго |
| L08.0 | Пиодермия |
| L73.8 | Другие уточненные болезни фолликулов (сикоз бороды) |
| L73.9 | Болезнь волосяных фолликулов неуточненная |
| Z29.8 | Другие уточненные профилактические меры |
Режим дозирования
Наружно в виде 2% мази: при гнойных заболеваниях кожи после удаления гноя и некротических масс мазь тонким слоем наносят на ограниченные пораженные участки кожи 1-2 раза в день.
При остром неперфоративном гнойном среднем отите (в составе комплексной терапии): 5% раствор фенола в глицерине закапывают по 8-10 кап в теплом виде в слуховой проход на 10 мин (затем удаляют при помощи ваты) 2 раза в сутки в течение 3-4 дней (при отсутствии положительной динамики через 4 дня производят парацентез).
Генитальные остроконечные кондиломы: обрабатывают раствором, состоящим из 60% фенола и 40% трикрезола, с интервалом в 1 нед.
В фармацевтической практике для консервирования лекарственных средств, сывороток, свечей используют 0.5-0.1% растворы.
Для дезинфекции помещений (стены, окна, двери) — мыльно-фенольный раствор (обладает дезинфицирующим моющим свойствами), нагретый до 50-80°С. Состав: 2% зеленого мыла + 3-5% фенола + 93-95% воды. Для приготовления 5% мыльно-фенольного раствора на 1 ведро берут 300 г зеленого мыла и 550 г жидкого фенола.
Для дезинфекции белья используют 1-2% мыльно-фенольные растворы (100-200 г жидкого фенола на 1 ведро воды); белье замачивают и выдерживают в течение 2 ч.
Для дезинсекции применяют фенольно-керосиновые, фенольно-скипидарные смеси.
Побочное действие
Зуд, жжение и/или раздражение кожи в месте аппликации, аллергические реакции.
Противопоказания к применению
Применение при беременности и кормлении грудью
Противопоказан при беременности, в период лактации.
Применение у детей
Особые указания
При при попадании большого количества вещества на кожу наблюдаются жжение, гиперемия, анестезия пораженного участка. Лечение: обработка кожи тампоном с растительным маслом или полиэтиленгликолем (нельзя использовать вазелиновое масло), симптоматическая терапия.
При попадании внутрь: ожог слизистых оболочек, боль во рту, глотке, животе, рвота бурыми массами, бледность кожных покровов, головокружение, слабость, миоз, снижение температуры тела, коллапс, кома, судороги, бурая и быстро темнеющая на воздухе моча, острая печеночная недостаточность. Лечение: промывание желудка растительным маслом с белком, затем 10% раствором глицерола с активированным углем, магния оксидом и кальция глюконатом, назначение активированного угля, форсированный диурез, введение натрия тиосульфата (100 мл 30% раствора в/в капельно), витаминов B 1 и B 6 , лечение токсического шока.
Нельзя обрабатывать обширные участки тела.
Рекомендуется предварительно механически очистить сильнозагрязненные обеззараживаемые предметы, поскольку фенол адсорбирует органические соединения и при этом снижается его бактерицидная активность. Обеззараживаемые предметы длительное время сохраняют запах фенола. Не применяют для дезинфекции помещений, используемых для приготовления и хранения пищевых продуктов и кухонной посуды. Не портит ткани, не меняет их окраску. При нанесении на поверхности, покрытые лаком, вызывает их изменение.
Источник
фенолы и нафтолы, молекулы — гидроксильная группа связанная непосредственно с бензольным кольцом
Органические соединения, содержащие в молекулах гидроксильную группу, связанную непосредственно с бензольным кольцом.
В зависимости от числа ОН-груп в бензольном кольце бывают: одно-, двух и трёхатомные.
Номенклатура и изомерия
Тривиальная (фенол, резорцин, гидрохинон, пирокатехин)
Систематическая (гидроксибензол, 1,3-дигидроксибензол, 1,4-дигидроксибензол, 1,2-дигидроксибензол)
Примеры:
- гидроксибензол(фенол) 1,2-дигидроксибензол 1,3-дигидроксибензол
- (бензендиол-1,2) (бензендиол-1,3)
- (пирокатехин) резорцин
- 1,4-дигидрокибензол
- (бензендиол-1,4)
- гидрохинон.
Изомерия в многоатомных фенолах обусловлена положением ОН-групп.
1,2,3-тригидроксибензол 1,2,4-тригидроксибзл 1,3,5-тригидроксибзл
(бензентриол-1,2,3) (бензентриол-1,2,4) (бензентриол-1,3,5)
пирогаллол оксигидрохинон флороглюцин
1.Фенол получают из каменноугольной смолы.
2.Синтетический путь получения фенола — кумольный метод из изопропилбензола:
(кумол) гидроперекись фенол ацетон
3.Гидролиз хлорбензола (SN) :
Условия протекания реакции:
- а) давление, температура 300-350оС, автоклав;
- б) катализатор — соль Сu +8% p-p NaOH
4. Получение двухатомных и трехатомных спиртов синтетическим путём сложнее, чем одноатомных. В природе источником их является сланец.Резорцин получают окислением м-диизопропилбензола, пирокатехин – окислением о-диизопропилбензола, гидрохинон – окислением п-диизопропилбензола:
Бензолдисульфокислоты дифенолят динатриевая соль
После кислотной обработки дифенолят легко превращается в пирокатехин.
5. Трёхатомные фенолы , например, оксигидрохинон получают из хинона:
Физические свойства.
Фенол – кристаллическое бесцветное вещество, трудно растворимое в Н2О. С увеличением количества ОН-групп растворимость фенолов в Н2О увеличивается. Ядовит, Является антисептиком, при попадании на кожу вызывает ожоги. Имеет tплав = 43оС. С Н2О образует гидрат, называемый карболовой кислотой.
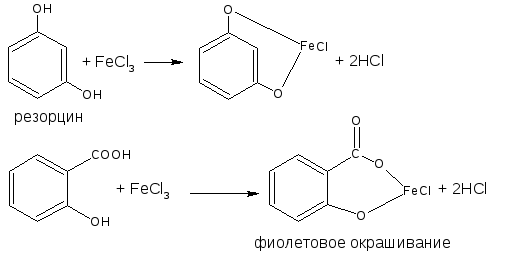
- Пирокатехин (1,2-бензендиол) имеет tплав = 104оС. При хранении темнеет. С FeCl3 дает зелёное окрашивание, которое переходит в красное при добавлении NaHCO3.
- Резорцин (1,3-бензендиол) имеет tплав = 118оС.С FeCl3 дает фиолетовое окрашивание.
Химические свойства.
Химические свойства определяются ОН-группой и бензольным кольцом.
Фенолы обладают кислотными свойствами.
В отличие от спиртов в фенолах увеличивается поляризация связи О-Н.
oo наличие группы СН3 уменьшает поляризацию связи в спиртах
В молекуле фенола неподеленные пары О вступают во взаимодействие (сопряжение) с π-электронами бензольного кольца.
В результате поляризация ОН-группы усиливается и отрыв атома Н облегчается. Фенол -слабая кислота, слабее, чем Н2СО3, СН3СООН,
- КД = 1,8*10-5 СН3СООН
- КД = 4,9*10-7 Н2СО3 у фенола КД меньше, чем кислот, но
- КД = 1,3*10-10 фенол
- КД = 1,8*10-16 Н2О больше, чем у H2O
CO2 выделяет свободный фенол из фенолятов.
NB. Кислотные свойства фенола можно усилить. Для этого в бензольное кольцо вводят некоторые заместители, обладающие –J– индуктивным эффектом, например, NO2.
2,4,6-тринитрофенол (пикриновая кислота)
По кислотности пикриновая кислота приближается к минеральным кислотам.
Образование солей (фенолятов)
NB. В отличие от спиртов фенолы реагируют с NaOH.
С6H5OH + NaOH → С6H5ONa + H2O
Фенолят натрия легко гидролизуется под действием кислот, даже таких слабых, как угольная кислота:
С6H5OH + CO2 + H2O––>C6H5OH+NaHCO3
Реакция используется для получения искусственного волокна (перлон, нейлон, капрон).
Реакции электрофильного замещения:
Так как ОН-группа является ориентантом I-рода , то она направляет другие заместители в о- и n-положения, например:
а) Реакция бромирования протекает легко в отличие от бензола, даже с бромной водой.
Замещение идёт преимущественно в n-положение, получается смесь о- и n-изомеров.
б) Реакция нитрования.
Если азотная кислота разбавленная, то при нитровании получают преимущественно о-изомер.
Если кислота концентрированная, то можно получить 2,4,6-тринитрофенол
в) Сульфирование – получение о- или п-изомеров зависит от температуры проведения реакции:
Реакция алкилирования фенолов
Сначала получают более реакционноспособные феноляты, а затем проводят их алкилирование.
Реакция с окисью этилена (ОЭ) – оксиэтилирование:
Фениловый эфир полиэтилен гликоля ПАВ
полиэтиленовые эфиры октилфенола
Такие эфиры являются поверхностно-активными веществами. Технические названия: ОП-7 (n = 7), ОП-10 (n = 10)
Сложные эфиры фенолов можно получить только взаимодействием фенолятов с галогенангидридами кислот:
Реакция протекает в пиридине. В результате получается фениловый эфир уксусной кислоты
ОН-группа в фенолах с трудом замещается галогеном. Облегчить процесс её замещения можно только путем введения в о- и n-положения электроотрицательной группы, например, NO2 :
Реакции конденсации с формальдегидом или ароматическими альдегидами:
а) в присутствии Н+ или ОН- протекает конденсация фенола c CH2O в о- и n-положениях. Реакция идет в две стадии. На первой стадии образуется феноло-спирт, который на второй стадии реагирует с фенолом:
фенолоформальдегидная смола ( новолак)
Таким образом получают так называемые лаковые, бакелитовые смолы.
Если реакцию проводят при нагревании, то конденсация приводит к образованию нерастворимого разветвленного продукта.
б) с ароматическими альдегидами
Таким образом получают красители.
Химические свойства многоатомных фенолов
Химические свойства двухатомных фенолов аналогичны свойствам одноатомных, но есть и специфика. Она заключается в следующем:
Так как в молекуле имеется две ОН-группы, то двухатомные фенолы проявляют более сильные кислотные свойства, чем одноатомные. Они реагируют не только со щелочными металлами, но и их гидроксидами.
Для двухатомных фенолов характерна реакция образования нерастворимых солей свинца:
Пирокатехин не растворимая соль свинца и пирокатехина
Реакции замещения и конденсации с участием атома Н бензольного кольца протекают легче, чем у фенола:
1,5-дигидрокси -2,4- бензолдисульфокислота
Двухатомные фенолы легко окисляются, являясь сильными восстановителями:
Качественные реакции фенолов
Фенол и резорцин – при взаимодействии с FeCl3 дают фиолетовое окрашивание, образуя трифенолят (трирезорцинолят) железа, пирокатехин и гидрохинон – зелёное и жёлтое окрашивание соответственно.
Фенол – используют в производстве полимеров, красителей, лекарств, взрывчатки.
Гидрохинон – применяют в фотографии в качестве проявителя. Является ингибитором полимеризации, а также антиокислителем жиров и масел.
Резорцин – входит в состав красителей, используется в медицине, для синтеза поликонденсационных смол.
Нафтолы — это гидроксильные производные нафталина. Различают α-нафтол и β-нафтол в зависимости от положения ОН-групп в кольце. α-нафтол и β-нафтол – кристаллические вещества. β-нафтол имеет более высокую температуру плавления, чем α-нафтол. Оба нафтола трудно р-римы в H2O. Дают окраску с FeCl3, растворяются в растворах гидроксида натрия и калия.
Основной тип реакций, характерный для нафтолов, реакции замещения, которые идут в соответствии с ранее рассмотренными правилами ориентации.
а) галогенирование (взаимодействие с Сl2)
б) нитрование ( взаимодействие с HONO2)
в) сульфирование (взаимодействие с HOSO3H)
α-нафтол 4-нитронафтол 4-нитро-1-окси-2-нафтолинсульфокислота
Нитрование, сульфирование, хлорирование идут в п-положение по отношению к ОН-группе в том же кольце, в котором находится ОН-группа. Следующий заместитель занимает о-положение.
У β-нафтола замещение протекает в α-положении:
β-нафтол 1-бромнафтол 1,6-дибром-2- нафтол
С хлоридом железа (III) в спирто-водном растворе α-нафтол даёт фиолетовое окрашивание, β-нафтол – жёлтое. Важным является получение эфиров нафтолов. Эфиры нафтола имеют приятный запах. Используются, например, метиловый эфир β-нафтола, в парфюмерии. На основе нафтолов синтезируют красители для тканей.
Источник
2. Лекарственные вещества, содержащие фенольный гидроксил
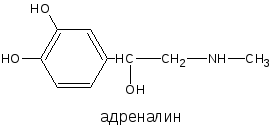
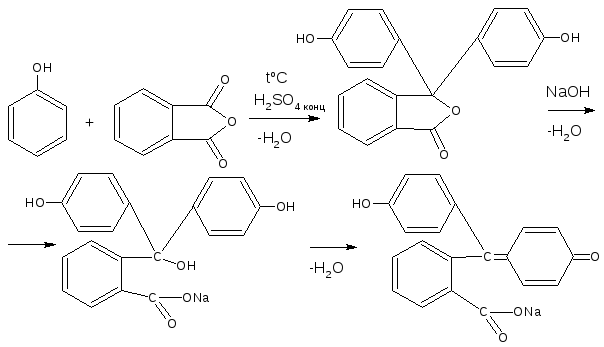
Фенольный гидроксил – это гидроксил, связанный с ароматическим радикалом. Его содержат ЛВ группы фенолов (фенол, резорцин); фенолокислот и их производных (кислота салициловая, фенилсалицилат, салициламид, оксафенамид); производные фенантренизохинолина (морфина гидрохлорид, апоморфин); синэстрол, адреналин и др.
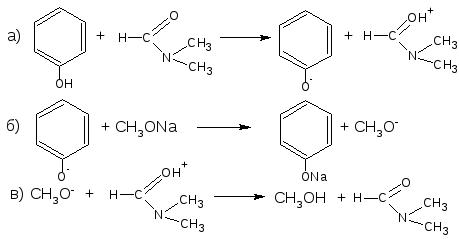
Химические свойства соединений, содержащих фенольный гидроксил, обусловлены взаимодействием электронной пары с π-электронами ароматического кольца. Это взаимодействие приводит к смещению электронной плотности с ОН-группы на кольцо, нарушению в нём равномерности распределения электронов, созданию избыточного отрицательного заряда в орто (о)- и пара (п)-положениях. Атом водорода гидроксигруппы ионизирует и придаёт фенолам слабые кислотные свойства (рКа фенола = 10,0; рКа резорцина = 9,44). Поэтому, в отличие от спиртов, они образуют соли со щелочами (при рН 12-13), растворимые комплексные соединения с хлоридом железа (III) (в нейтральных, слабощелочных и кислых растворах).
Фенолы проявляют сильные восстановительные свойства, очень легко окисляются даже слабыми окислителями. Образуют окрашенные соединения хиноидной структуры.
Наибольшее значение имеют реакции электрофильного замещения водородов в о— и п-положениях ароматического кольца – галогенирование (бромирование), конденсация с альдегидами, нитрование, сочетание с солями диазония.
На основе свойств фенольного гидроксила и активированного им ароматического кольца в анализе ЛВ используются следующие реакции:
2 – галогенирования (бромирования);
5 – образования индофенолового красителя;
6 – конденсации с альдегидами.
2.1. Реакция комплексообразования с ионами железа (III)
Основана на свойствах фенольного гидроксила образовывать растворимые комплексные соединения, окрашенные чаще в синий (фенол) или фиолетовый цвет (резорцин, кислота салициловая) реже в красный (ПАСК – натрия) и зелёный (хинозол, адреналин).
Состав комплексов, а, следовательно, и их окраска обусловлены количеством фенольных гидроксилов, влиянием других функциональных групп, реакцией среды.
Реакция рекомендована фармакопеей для большинства соединений, содержащих фенольный гидроксил.
При избытке фенола:
Предположительный состав конечного продукта в реакции с фенолом:
2.2. Реакция бромирования ароматического кольца
Основана на электрофильном замещении водорода в о- и п- положениях на бром с образованием нерастворимого бромпроизводного (белый осадок).
Основные правила бромирования:
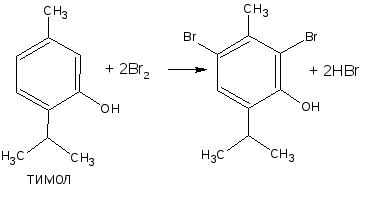
— бром замещает водород в о- и п- положениях по отношению к фенольному гидроксилу (наиболее реакционноспособное – п-положение):
— при наличии в о- или п-положениях ароматического кольца заместителей, в реакцию вступает меньше атомов брома;
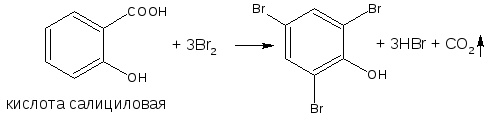
— если в о- или п- положениях находится карбоксильная группа, то при наличии избытка брома происходит декарбоксилирование и образование трибромпроизводного:
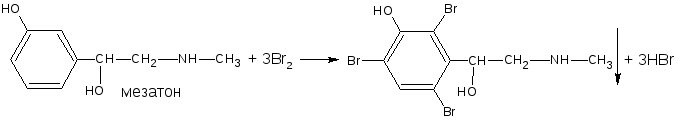
— если заместитель находится в м-положении, то он не препятствует образованию трибромпроизводного:
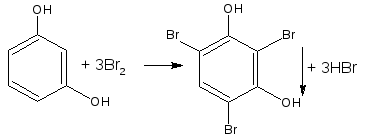
— если в соединении содержится два фенольных гидроксила в м- положении, то в результате их согласованной ориентации образуется трибромпроизводное:
— если две гидроксильные группы расположены в о- или п- положениях друг к другу, то они действуют несогласованно: бромирование количественно не проходит:
— если кроме фенольных гидроксилов соединение содержит амидную или сложно-эфирную группу (салициламид, фенилсалицилат) для их количественной оценки методом броматометрии необходимо провести предварительный гидролиз.
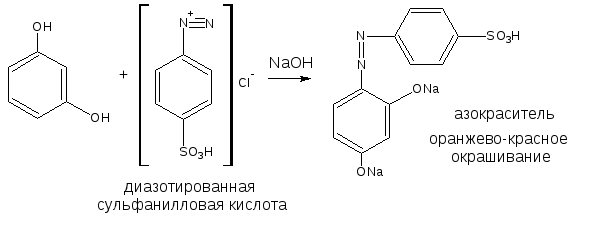
2.3. Реакция азосочетания
Сочетание идет также в о- и п-положениях, в этом случае также, как и при бромировании, предпочтительным является п-положение. Диазореактив – соль диазония (диазотированная сульфаниловая кислота). Среда – щелочная. Продукт реакции – азокраситель.
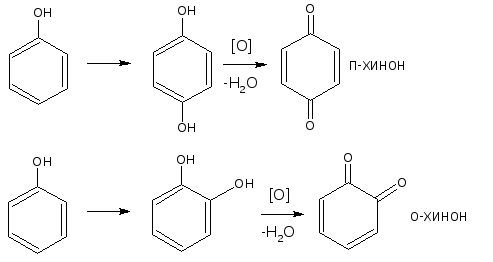
2.4. Реакция окисления
Фенолы могут окисляться до различных соединений, но чаще всего до о— или п-хинонов (циклических дикетонов),окрашенных в розовый или реже в жёлтый цвет.
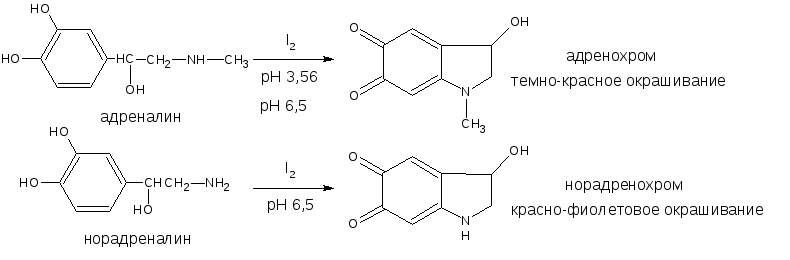
В частности, реакция окисления рекомендована ГФ для адреналина и норадреналина: в качестве окислителя используется йод при определённом значении рН среды. При этом образуются окрашенные продукты адренохром и норадренохром.
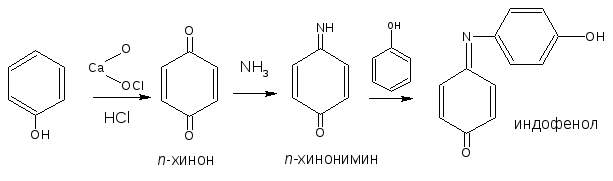
2.5. Реакция образования индофенолового красителя
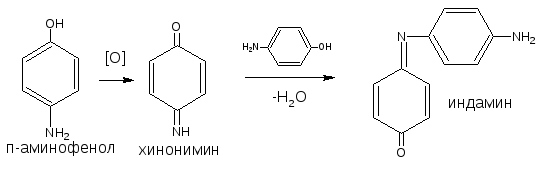
Основана на окислении фенолов до хинонов, которые при конденсации с аммиаком или аминопроизводным и избытком фенола образуют индофеноловый краситель, окрашенный в фиолетовый цвет.
ГФ Х рекомендует эту реакцию для идентификации парацетамола, который гидролизуясь, выделяет п-аминофенол, обнаруживаемый реакцией образования индоамина (по свойствам родственный индофенолу).
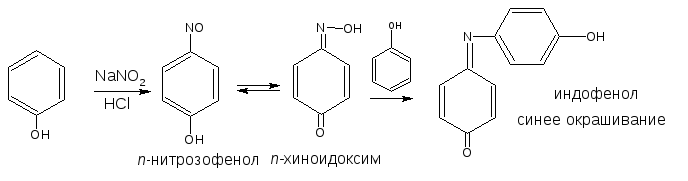
Разновидностью данной реакции является нитрозореакция Либермана, она характерна для фенолов, не имеющих заместителей в о- и п-положениях.
При действии нитрита натрия в кислой среде образуется п-нитрозофенол, изомеризующийся в п-хиноидоксим, который, реагируя с избытком фенола в кислой среде, образует индофенол:
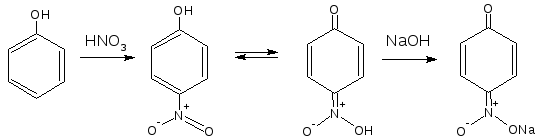
2.6. Образование нитрозосоединений
При взаимодействии с разведенной азотной кислотой фенолы могут нитроваться при комнатной температуре, образуя о- и п-нитропроизводные. Образующееся нитропроизводное содержит в п-положении подвижный атом водорода гидроксильной группы, образуется таутомерная аци-форма с хиноидной структурой, она обычно окрашена в желтый цвет. Добавление щелочи усиливает окраску, вследствие образования хорошо диссоциируемой соли:
2.7. Реакция конденсации с альдегидами или ангидридами кислот
— с формальдегидом в присутствии концентрированной серной кислоты с образованием ауринового (арилметанового) красителя окрашенного в красный цвет.
Реакция является фармакопейной для кислоты салициловой. Концентрированная серная кислота на первой стадии реакции играет роль водоотнимающего средства, на второй – является окислителем.
С фталевым ангидридом (сплавление и последующее растворение плава в щёлочи) рекомендована фармакопеей для идентификации фенола и резорцина.
Метод основан на электрофильном замещении атомов водорода ароматического кольца на бром, выделенный в реакции бромата калия с бромидом калия в кислой среде.
K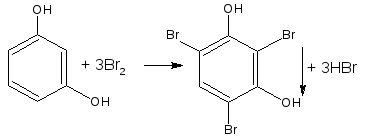
Используют способы прямого и обратного титрования. В прямом – титруют броматом калия в присутствии бромида калия с индикатором метиловым оранжевым или метиловым красным от розовой окраски до обесцвечивания. В точке эквивалентности избыточная капля бромата калия выделяет бром, который окисляет индикатор и раствор обесцвечивается. При обратном титровании вводят избыток бромата калия, добавляют калия бромид, создают кислую среду, выдерживают нужное для бромирования время и после чего избыток брома определяют йодометрически (индикатор – крахмал).
Способом прямого титрования определяют по ГФ Х тимол, обратного – фенол, резорцин, кислоту салициловую, синэстрол и другие ЛВ.
М.э. = 1/6 М.м. (фенол, резорцин, кислота салициловая)
М.э. = 1/8 М.м. (синэстрол)
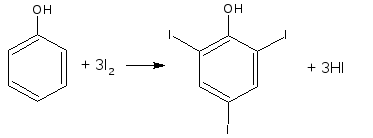
Основана на электрофильном замещении атомов водорода ароматического кольца на йод.
Для связывания йодоводородной кислоты, смещающей равновесие в обратную сторону, добавляют ацетат или гидрокарбонат натрия.
HI + CH3COONa → NaI + CH3COOH
Используют способы прямого и обратного титрования. В последнем – избыток йода оттитровывают тиосульфатом натрия.
М.э. = 1/6 М.м. (фенол)
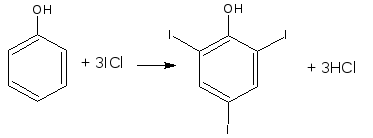
Метод основан на электрофильном замещении атомов водорода ароматического кольца на йод, входящий в состав йодмонохлорида.
Используют способ обратного титрования – избыток йодмонохлорида определяют йодометрически.
ICl + KI → I2 + KCl
М.э. = 1/6 М.м. (фенол)
2.11. Метод ацетилирования
Используют по ГФ Х для количественной оценки синэстрола.
2.12. Алкалиметрический метод нейтрализации в среде протофильного растворителя диметилформамида (ДМФА).
ЛВ группы фенолов проявляют очень слабые кислотные свойства, их определение алкалиметрическим методом нейтрализации в водных или смешанных средах невозможно, поэтому используют титрование в среде неводных растворителей, в частности, ДМФА. Метод основан на солеобразовании определяемой слабой кислоты (фенола) с титрантом (метилатом натрия) в среде протофильного растворителя, усиливающего кислотные свойства.
2.13. Фотоколориметрия (ФЭК) и спектрофотометрия (СФМ)
Основана на свойстве окрашенных растворов поглощать немонохроматический (ФЭК) или монохроматический (СФМ) свет в видимой области спектра.
В основе определения здесь и далее лежат следующие стадии:
— получение окрашенных растворов;
— измерение оптической плотности (D), характеризующей поглощение электромагнитного излучения раствором, содержащим анализируемое вещество;
— проведение расчётов на основе основного закона светопоглощения с использованием калибровочного графика, удельного коэффициента поглощения, раствора стандартного образца.
При определении этими методами ЛВ, содержащих фенольный гидроксил, получают окрашенные соединения на основе реакций комплексообразования с ионами железа (III), азосочетания с солями диазония и образования индофенолового красителя.
Источник