Лекарственные растения как источник лекарственных препаратов
С доисторических времен человек занимался лечением недугов или травм с помощью частей растений или растительных препаратов. Имеются письменные свидетельства древних цивилизаций с различными рецептами для лечения заболеваний подобными средствами. В справочниках лекарственных растений средневековья многие из растений описывались как лекарственные средства.
В современной медицине, где каждое лекарственное средство должно удовлетворять объективным критериям эффективности, по общему мнению, всего лишь несколько из сотни видов лекарственных растений сохранилось в качестве лекарственных средств с доказанной эффективностью.
Ниже приводится несколько примеров растений, уже использовавшихся в донаучные времена и содержащие вещества, которые и в настоящее время входят в состав важных лекарственных препаратов.
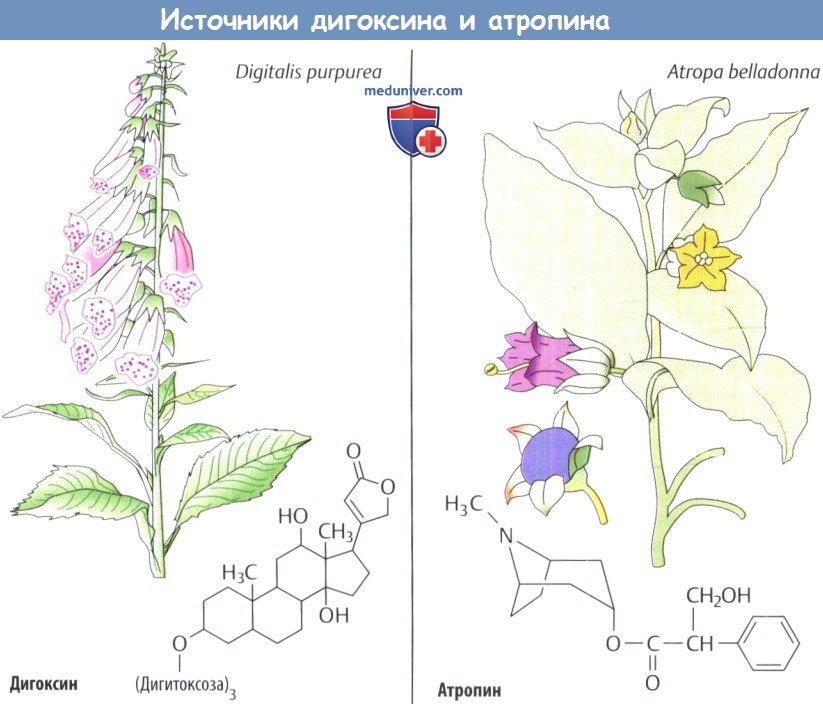
(1) Группа растений, используемых со средневекового периода при лечении водянки, включает наперстянку (Digitalis sp.), ландыш майский (Convalaria majalis), морозник черный (Helleborus niger) и бересклет европейский (Euonymus europaeus).
В конце XVIII в. шотландский врач Уильям Уизеринг начал использовать листья наперстянки в виде настоя при лечении «сердечной водянки» (отек при застойной сердечной недостаточности) и описал результат.
Активными веществами в данных растениях являются стероиды с одной или несколькими молекулами сахара, связанными с атомом углерода в положении С3. Дигоксин, у которого самый благоприятный клинический эффект среди всех сердечных гликозидов, продолжают получать из растений Digitalis purpurea или D. lanata, поскольку его химический синтез слишком сложный и дорогой.
(2) Красавка обыкновенная из Центральной Европы (Atropa belladorna, семейства пасленовых) содержит алкалоид атропин во всех ее частях и, в меньших количествах, скополамин. Эффекты данного лекарственного растения были известны уже в античное время, например расширение зрачка при использовании экстрактов в виде глазных капель с косметической целью (для усиления женской привлекательности).
В XIX в. из растения выделены алкалоиды, изучена их структура и открыт специфический механизм их действия. Атропин является прототипом группы препаратов — конкурентных антагонистов ацетилхолиновых рецепторов мускаринового типа.
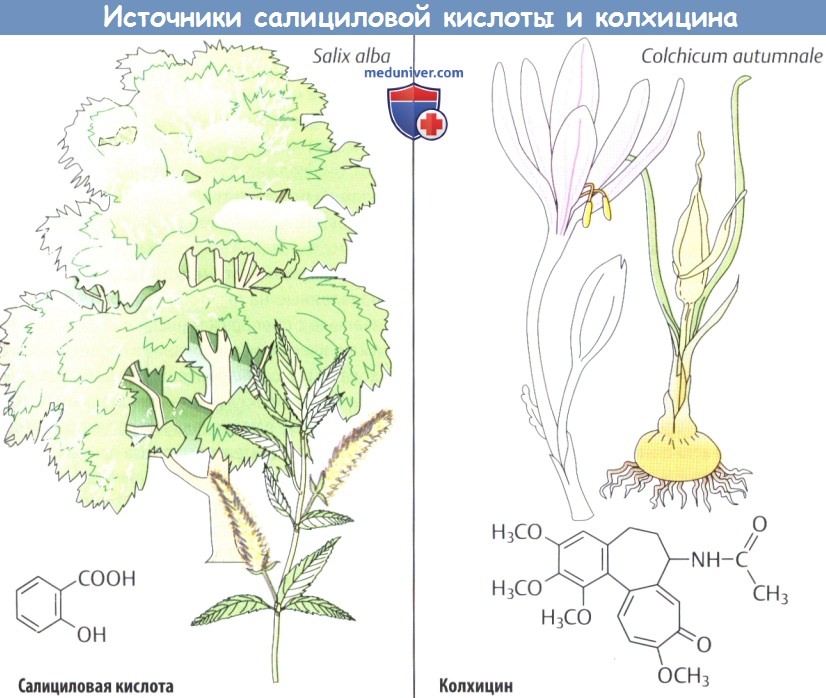
(3) Ива белая и ива корзиночная (Salix alba, S. viminalis) в своей коре содержат производные салициловой кислоты. Препараты из корзиночной ивы использовались с античных времен; в XIX в. была выделена салициловая кислота как активное вещество этого народного средства.
Эта простая по химической структуре кислота все еще используется в качестве наружного средства (кератолитическое действие), но больше не принимается внутрь при лечении боли, лихорадки и воспалительных реакций. Ацетилирование салициловой кислоты (введенное в практику примерно в 1900 г.) для получения ацетилсалициловой кислоты (Аспирин®) улучшило переносимость препарата при приеме внутрь.
(4) Безвременник осенний (Colchicum autumnale) принадлежит к лилейным и луговым цветам, цветение которых завершается в конце лета; листья и семенные коробочки появляются следующей весной. Все части растения содержат алкалоид колхицин.
Данное вещество ингибирует полимеризацию тубулина с образованием микротрубочек, которые отвечают за движение внутри клетки. Таким образом, под влиянием колхицина макрофаги и нейтрофилы теряют способность к внутриклеточному транспорту клеточных органелл. Это обусловливает благоприятный эффект во время острого приступа подагры. Более того, колхицин препятствует митозу, вызывая остановку метафазы (токсин, блокирующий митотическое веретено).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Лекарственные растения как источник лекарственных препаратов
Одной из актуальных задач современной фармации, в том числе фармакогнозии, является создание и внедрение импортозамещающих лекарственных средств, а также поиск рациональных путей использования лекарственных растений и лекарственного растительного сырья (ЛРС) в соответствии с принципами доказательной медицины [3, 4, 6]. В этом контексте для успешной реализации Стратегии лекарственного обеспечения населения Российской Федерации на период до 2025 года имеются объективные предпосылки, поскольку в области фармакогнозии за последние 15–20 лет произошли качественные изменения в плане изучения химического состава лекарственных растений и ЛРС, причем этому способствовало то обстоятельство, что данная наука обогатилась современными спектральными и физико-химическими методами. Внедрение тонкослойной хроматографии (ТСХ), газо-жидкостной хроматографии (ГЖХ), высокоэффективной жидкостной хроматографии (ВЭЖХ), ЯМР-спектроскопии и других методов открыло новые возможности для совершенствования стандартизации ЛРС и фитопрепаратов, а также внедрения научно обоснованных технологий получения лекарственных средств, в том числе на основе фенилпропаноидов и флавоноидов [1, 2, 4, 5, 8–11].
Цель исследования – обоснование целесообразности создания конкурентоспособных импортозамещающих лекарственных препаратов адаптогенного, нейротропного, иммуномодулирующего, гепатопротекторного и антиоксидантного действия на основе растительного сырья, содержащего фенилпропаноиды и флавоноиды.
Материал и методы исследования
В качестве объектов исследования служили фармакопейные растения, лекарственное растительное сырье, биологически активные соединения, выделенные из ЛРС.
В работе использованы тонкослойная хроматография, колоночная хроматография, высокоэффективная жидкостная хроматография, спектрофотомерия, 1Н-ЯМР-спектроскопия, масс-спектрометрия, различные химические превращения. 1Н-ЯМР-спектры получали на приборах «Bruker AM 300» (300 МГц), масс-спектры снимали на масс-спектрометре «Kratos MS-30», регистрацию УФ-спектров проводили с помощью спектрофотометра «Specord 40» (Analytik Jena). Воздушно-сухое растительное сырье подвергали исчерпывающему экстрагированию 70 % этиловым спиртом, полученные водно-спиртовые экстракты упаривали под вакуумом до густого остатка и далее подвергали хроматографическому разделению. Хроматографическую колонку (силикагель L 40/100) элюировали хлороформом и смесью хлороформ-этиловый спирт в различных соотношениях. Контроль за разделением веществ осуществляли с помощью ТСХ-анализа на пластинках «Сорбфил ПТСХ-АФ-А-УФ» в системах хлороформ-этанол (9:1), хлороформ-метанол-вода (26:14:3), а также н-бутанол-ледяная уксусная кислота-вода (4:1:2). ВЭЖХ-анализ осуществляли с использованием хроматографа «Милихром–5» в условиях обращенно-фазовой хроматографии в изократическом и градиентном режимах: колонка КАХ (2×80 мм), стационарная фаза «Диасорб С-16», элюентная система – ацетонитрил : вода в различных соотношениях с добавлением 1 % ледяной уксусной кислоты, скорость элюирования – 100 мкл/мин, объём вводимой пробы – 5 мкл. Детекцию веществ осуществляли при пяти длинах волн – 254, 270, 290, 330 и 360 нм.
Антидепрессантную активность оценивали с использованием теста «Отчаяние», оценку ноотропной активности проводили с помощью теста «Т-образный лабиринт» и теста «Открытое поле», анксиолитическую активность определяли методом «Приподнятый крестообразный лабиринт» и в условиях методики «конфликтная ситуация», психостимулирующую активность препаратов выявляли с помощью теста на снотворную активность («Тиопеталовый сон»), гепатопротекторную и антиоксидантную активность на модели токсического гепатита [7]. Исследование антиоксидантной активности фитопрепаратов, содержащих флавоноиды и фенилпропаноиды, осуществляли на белых половозрелых лабораторных крысах обоего пола массой тела 200 граммов. Для воспроизведения токсического повреждения печени применен четыреххлористый углерод, который наиболее часто применяется в эксперименте с целью моделирования токсического гепатита.
Результаты исследования и их обсуждение
В результате проведенных исследований из ЛРС выделены и охарактеризованы с использованием УФ-, ЯМР-спектроскопии, масс-спектрометрии, ТСХ и ВЭЖХ, различных химических превращений фенилпропаноиды и флавоноиды, представляющие интерес с точки зрения химической стандартизации сырья и препаратов соответствующих лекарственных растений, а также проявления биологической активности. Изучены зависимости спектральных и фармакологических свойств ряда фенилпропаноидов и флавоноидов от их химической структуры. Предложены новые подходы к химической стандартизации сырья лекарственных растений с использованием стандартных образцов силибина, рутина, гиперозида, ликуразида, изосалипурпозида, цианидина-3-О-глюкозида, розавина, триандрина, сирингина (элеутерозид В), розмариновой кислоты, цикориевой кислоты, гамма-схизандрина, лавандозида. Предложены новые подходы к химической стандартизации лекарственных растений, содержащих фенилпропаноиды, и препаратов на их основе, заключающиеся в использовании в методиках анализа. Государственный стандартный образец (ГСО) силибина предназначен для анализа сырья и препаратов расторопши пятнистой), ГСО розавина является надежным критерием подлинности и качества корневищ и препаратов родиолы розовой (золотой корень), ГСО сирингина успешно используется для целей стандартизации корневищ элеутерококка колючего и коры сирени обыкновенной. Показана значимость гамма-схизандрина, триандрина, цикориевой кислоты, розмариновой кислоты и лавандозида (фенилпропаноиды) для целей стандартизации сырья и препаратов лимонника китайского, ивы корзиночной, эхинацеи пурпурной, мелиссы лекарственной и лаванды колосовой соответственно.
На основе изучения физико-химических, химических, спектральных и фармакологических свойств фенилпропаноидов и флавоноидов обоснована целесообразность создания целого ряда импортозамещающих лекарственных средств. На основе сырья эхинацеи пурпурной разработаны иммуномодуляторы, превосходящие по фармакоэкономическим характеристикам зарубежные аналоги. На основе результатов фармакогностических, химических, аналитических, технологических и фармакологических исследований доказано, что в качестве лекарственного сырья целесообразно использовать не только воздушно-сухую траву, но и траву свежую, а также корневища эхинацеи пурпурной, что будет способствовать рациональному использования сырьевых ресурсов.
В качестве перспективного гепатопротектора рассматривается пролонгированная лекарственная форма, получаемая из субстанции плодов расторопши пятнистой. Выраженная антиоксидантная активность выявлена для рутина, кверцетина, дигидрокверцетина, силибина, розавина, сухого экстракта родиолы розовой. Из цветков лаванды колосовой выделено новое природное соединение – лавандозид (4-О-β-D-глюкопиранозид феруловой кислоты), обладающий седативной активностью.
В условиях методики «конфликтная ситуация» отчетливое анксиолитическое действие проявили родиолы розовой настойка, мелиссы настойка и сирени настойка. Несмотря на получение болевых раздражений, крысы пытались взять воду, увеличивая этот показатель поведения по сравнению c данными в контроле соответственно на 583,3 %, 240,1 и 151,8 %. Интересно, что эффект родиолы розовой настойки (583,3 %) был сопоставим с таковым диазепама, в случае которого число наказуемых взятий воды из поилки увеличилось на 653 %. На наш взгляд, наиболее перспективным источником анксиолитиков является трава мелиссы лекарственной, препараты на основе которой имеют широкую амплитуду фармакологических эффектов, включая седативные, иммуномодулирующие, противовирусные, антигистаминные, антиоксидантные и другие свойства, причем широта терапевтического действия сочетается с уникальной безопасностью. Этот факт заслуживает с точки зрения научного обоснования целесообразности применения препаратов на основе травы мелиссы лекарственной в педиатрии, гериатрии, а также в акушерской и гинекологической практике.
Показано, что наиболее перспективными в плане создания тонизирующих и адаптогенных средств являются растения, содержащие производные коричных спиртов (родиола розовая, сирень обыкновенная, элеутерококк колючий и др.). Показано, что наиболее перспективными в плане создания тонизирующих и адаптогенных средств являются растения, содержащие производные коричных спиртов (родиола розовая, сирень обыкновенная, элеутерококк колючий и др.): их гликозиды (циннамилгликозиды) проявляют более выраженную биологическую активность по сравнению с соответствующими агликонами, а последние, в свою очередь, более активны, чем коричные кислоты и их производные, включая гликозилированные аналоги, что нашло отражение в концепции создания лекарственных препаратов на основе сырья, содержащего фенилпропаноиды.
Антидепрессантный эффект отмечен для экстракта элеутерококка жидкого и настойки зверобоя. Определено, что антидепрессантный эффект настойки зверобоя пятнистого более выражен по сравнению с таковым соответствующего препарата зверобоя продырявленного, что можно объяснить различиями в химическом составе, а именно в траве зверобоя пятнистого доминирующим флавоноидом является гиперозид, обладающий выраженной антидепрессантной активностью, тогда как в зверобое продырявленном преобладает рутин, для которого нами не выявлен антидепрессантный эффект. В тесте «отчаяния» в наибольшей степени (на 56,4 %) уменьшался период иммобилизации при введении элеутерококка экстракта, причем этот эффект близок к антидепрессивному действию амитриптилина (73,5 %). Далее по убыванию эффективности следуют родиолы розовой настойка (53,8 %), эхинацеи пурпурной настойка (49 %), сирени настойка (46,7 %), лимонника настойка (на 29,8 %). Из выделенных фенилпропаноидов наибольшую эффективность проявили сирингин и розавин: изменения по сравнению с контролем (укорочение цикла иммобилизации) составило 49,7 и 29,5 % соответственно.
Из выделенных веществ наибольшую антидепрессантную эффективность проявили сирингин, розавин, триандрин и гиперозид. Выраженная ноотропная активность обнаружена для препаратов, разработанных на основе корневищ родиолы розовой и листьев гинкго двулопастного. Это создает предпосылки для создания импортозамещающих ноотропных препаратов на основе сырья родиолы розовой и гинкго двулопастного. С точки зрения влияния на ноотропную активность заслуживает внимания один из доминирующих флавоноидов листьев гинкго двулопастного – гинкгетин, а также доминирующий фенилпропаноид родиолы розовой – розавин. Нами учтено данное обстоятельство при разработке технологии получения субстанций и лекарственных форм на основе корневищ родиолы розовой и листьев гинкго двулопастного.
Таким образом, лекарственные растения, содержащие фенилпропаноиды и флавоноиды, являются перспективным источником адаптогенных, тонизирующих, ноотропных, антидепрессантных, анксиолитических, иммуномодулирующих, гепатопротекторных, антиоксидантных лекарственных средств.
Обоснована целесообразность создания и внедрения конкурентоспособных импортозамещающих лекарственных препаратов нейротропного, иммуномодулирующего, гепатопротекторного и антиоксидантного действия на основе растительного сырья, содержащего фенилпропаноиды и флавоноиды. Обоснованы технологии получения лекарственных субстанций и лекарственных форм с вышеперечисленной фармакологической активностью, которые превосходят соответствующие эффекты зарубежных аналогов.
На основе изучения зависимостей спектральных и фармакологических свойств ряда фенилпропаноидов и флавоноидов от их химической структуры предложены новые подходы к стандартизации лекарственного растительного сырья и соответствующих фитопрепаратов с использованием стандартных образцов силибина, рутина, гиперозида, ликуразида, изосалипурпозида, цианидина-3-О-глюкозида, розавина, триандрина, сирингина (элеутерозид В), лавандозида, розмариновой кислоты, цикориевой кислоты, гамма-схизандрина.
Работа выполнена при поддержке проекта 02.740.11.0650 ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы.
Рецензенты:
Первушкин С.В., д.фарм.н., профессор, зав. кафедрой фармацевтической технологии, Гбоуч впо «Самарский государственный медицинский университет» Министерства здравоохранения РФ, г. Самара;
Дубищев А.В., д.м.н., профессор, зав. кафедрой фармакологии им. заслуженного деятеля науки РФ, профессора А.А. Лебедева, ГБОУ ВПО «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Самара.
Источник



