Лекарственные растения как источник биологически активных веществ
Одним из перспективных источников фитопрепаратов считаются лекарственные растения, содержащие флавоноиды, которые в силу широкого распространения в растениях и большого структурного разнообразия в настоящее время находятся в центре внимания исследователей в области фармакогнозии, фармации и медицины [1–3, 8–11]. Флавоноиды – наиболее многочисленный класс природных фенольных соединений, для которых характерно структурное многообразие, высокая и разносторонняя активность и малая токсичность. Широкая амплитуда биологической активности флавоноидов связана с многообразием их химических структур и вытекающих из них различных физико-химических свойств. Этот интерес связан с тем обстоятельством, что флавоноиды, будучи эволюционно адекватными организму человека, обусловливают антиоксидантные, ангиопротекторные, гепатопротекторные, желчегонные, диуретические, нейротропные и другие важнейшие фармакологические свойства [1, 5–13]. Причем именно вышеперечисленные фармакологические эффекты в наибольшей степени привлекают ученых в области создания новых растительных лекарственных препаратов.
При этом важно отметить, что только за последние 10–15 лет число фармакопейных растений, содержащих флавоноиды, увеличилось с 11 до 30 видов [4, 6, 8]. Вместе с тем созданию лекарственных препаратов на основе флавоноидных растений препятствует недостаточная степень изученности их химического состава, зависимостей в ряду «химическая структура – спектральные характеристики» и «компонентный состав – фармакологические свойства». Это приводит к отсутствию системного подхода в трактовке совокупной значимости действующих веществ в плане проявления фармакологических эффектов, а также научно обоснованных технологий получения и анализа лекарственных средств. Кроме того, в настоящее время остро стоит проблема объективной стандартизации сырья лекарственных растений и фитопрепаратов, содержащих флавоноиды, поскольку во многих случаях в методиках анализа отсутствует доказательная база или же не используются современные инструментальные возможности. В этом контексте весьма актуальной проблемой является совершенствование имеющейся нормативной документации, а также разработка новых стандартов качества на ЛРС, лекарственные субстанции и препараты, особенно в связи с подготовкой к изданию Государственной Фармакопеи Российской Федерации XII издания.
Цель настоящих исследований – разработка методологических подходов к созданию и стандартизации лекарственного растительного сырья и фитопрепаратов, содержащих флавоноиды.
Материалы и методы исследования
В качестве объектов исследования служили фармакопейные растения, лекарственное растительное сырье, флавоноиды, выделенные из ЛРС. При этом исследовали цветки бессмертника песчаного [Helichrysum arenarium (L.) Moench.], цветки пижмы обыкновенной (Tanacetum vulgare L.), траву эрвы шерстистой (Aerva lanata L.), цветки василька синего (Centaurea cyanus L.), траву полыни эстрагон (Artemisia dracunculus L.), траву горца почечуйного (Polygonum persicaria L.), траву перца водяного (Polygonum hydropiper L.), листья гинкго двулопастного (Ginkgo biloba L.), траву репешка аптечного (Agrimonia eupatoria L.), плоды и цветки боярышника кроваво-красного (Crataegus sanguinea Pall.), цветки липы сердцевидной (Tilia cordata Mill.).
В работе использованы тонкослойная хроматография, колоночная хроматография, высокоэффективная жидкостная хроматография, спектрофотомерия, 1Н-ЯМР-спектроскопия, масс-спектрометрия, различные химические превращения. 1Н-ЯМР- спектры получали на приборах «Bruker AM 300» (300 МГц), масс-спектры снимали на масс-спектрометре «Kratos MS-30», регистрацию УФ-спектров проводили с помощью спектрофотометра «Specord 40» (Analytik Jena). Воздушно-сухое растительное сырье подвергали исчерпывающему экстрагированию 70 % спиртом этиловым, полученные водно-спиртовые экстракты упаривали под вакуумом до густого остатка и далее подвергали хроматографическому разделению на силикагеле L 40/100. Контроль за разделением веществ осуществляли с помощью ТСХ-анализа на пластинках «Сорбфил ПТСХ-АФ-А-УФ» в системах хлороформ-этанол (9:1), хлороформ-этанол-вода (26:16:3), а также н-бутанол-ледяная уксусная кислота-вода (4:1:2).
Результаты исследования и их обсуждение
С целью систематизации фармакопейных растений, содержащих флавоноиды, нами разработана классификация (таблица), позволяющая учитывать всю совокупность биологически активных соединений (БАС) с точки зрения биологической активности, стандартизации и технологии получения лекарственных препаратов.
Классификация фармакопейных растений, содержащих флавоноиды
Наименование группы фармакопейных растений
Наименование лекарственного растения
Фармакопейные растения, содержащие флавоноиды в качестве ведущей группы БАС
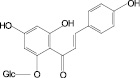
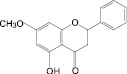
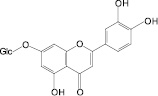
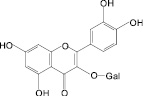
Бархат амурский, бессмертник песчаный, бессмертник итальянский, боярышник кроваво-красный, бузина черная, василек синий, володушка многожильчатая, володушка круглолистная, гибискус сабдариффа, гинкго двулопастный, горец перечный, горец почечуйный, горец птичий, гречиха посевная, датиска коноплевая, десмодиум канадский, зверобой продырявленный, зверобой пятнистый, земляника лесная, золотарник канадский, лабазник вязолистный, лапчатка серебристая, леспедеца двухцветная, леспедеца копеечниковая, лимон, расторопша пятнистая, овес посевной, очиток большой, репешок аптечный, солянка холмовая, софора японская, стальник полевой, фасоль обыкновенная, фиалка трехцветная, хвощ полевой шлемник байкальский, эрва шерстистая
Фармакопейные эфиромасличные растения, содержащие флавоноиды
Арника горная, береза повислая, береза бородавчатая, липа сердцевидная, мята перечная, пижма обыкновенная, полынь эстрагон, ромашка аптечная, ромашка душистая, тополь черный, тысячелистник обыкновенный
Фармакопейные растения, содержащие горечи и флавоноиды
Одуванчик лекарственный, пустырник пятилопастный, трилистник водяной
Фармакопейные растения, содержащие сапонины и флавоноиды
Астрагал шерстистоцветковый, каштан конский обыкновенный, солодка голая, солодка уральская
Фармакопейные растения, содержащие витамины и флавоноиды
Арония черноплодная, календула лекарственная, смородина черная, сушеница топяная, череда трехраздельная, шиповник коричный, шиповник собачий
Фармакопейные растения, содержащие простые фенолы и флавоноиды
Фармакопейные растения, содержащие дубильные вещества и флавоноиды
Сабельник болотный, скумпия кожевенная, черемуха обыкновенная, черника обыкновенная
Фармакопейные алкалоидоносные растения, содержащие флавоноиды
Пассифлора инкарнатная, чай китайский, чистотел большой
В соответствии с данной классификацией в первой группе находятся лекарственные растения, содержащие флавоноиды в качестве ведущей группы БАС. В группах 2-8 флавоноиды выступают второй группы БАС, причем в данном случае акцент сделан не только на вкладе флавоноидов в фармакологический эффект, но и на их использовании в качестве критерия подлинности, качества сырья, а также как источника получения лекарственных средств.
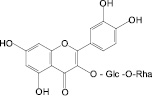
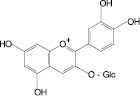
На основе результатов сравнительного изучения химического состава сырья и лекарственных препаратов фармакопейных растений научно обоснованы методологические подходы к стандартизации ЛРС, содержащего флаваноны, халконы, флавоны, флавонолы, антоцианы, наиболее широко распространенные в растениях. Эти подходы заключаются в комплексном и обоснованном использовании методов ТСХ, ВЭЖХ, спектрофотометрии и использовании соответствующих ГСО (изосалипурпозид, пиностробин, цинарозид, гиперозид, рутин, цианидин-3-О-глюкозид).
Обосновано использование в методиках качественного и количественного анализа сырья и препаратов, содержащих преимущественно флаваноны (перца водяного трава), халконы (бессмертника песчаного цветки), флавоны (пижмы обыкновенной цветки, полыни эстрагон трава), флавонолы (горца почечуйного трава, боярышника кроваво-красного цветки и плоды, липы цветки, эрвы шерстистой трава, репешка аптечного трава), антоцианы (василька синего цветки), соответствующих ГСО изосалипурпозида (халкон), пиностробина (флаванон), цинарозида (флавон), гиперозида и рутина (флавонолы), цианидин-3-О-глюкозида (антоцианы).
На основе результатов фармакогностических, химических, технологических и фармакологических исследований сырья флавоноидосодержащих фармакопейных растений обоснована целесообразность создания антиоксидантных, гепатопротекторных, диуретических, ноотропных, анксиолитических фитопрепаратов, в том числе импортозамещающих лекарственных средств.
Особого внимания заслуживают нейротропные свойства флавоноидов, которые стали привлекать исследователей сравнительно недавно. Среди фармакопейных растений, содержащих флавоноиды, в качестве источника нейротропных лекарственных препаратов применяются два вида – зверобой продырявленный и гинкго двулопастный [4–6, 8]. При изучении флавоноидов листьев гинкго двулопастного выявлено, что вклад в ноотропную активность вносит гинкгетин, являющийся одним из характерных и диагностических компонентов сырья данного растения [8]. Впервые обнаружена анксиолитическая активность для лекарственного препарата «Гинкго двулопастного настойка», при этом показана значимость всего флавоноидного комплекса листьев гинкго двулопастного для проявления наиболее полного спектра нейротропной активности.
Уточнен характер антиоксидантного действия для индивидуальных соединений, относящихся к разным классификационным группам флавоноидов, на ферментативные и неферментативные звенья антиоксидантной защиты, что позволило сформулировать рекомендации по созданию комбинированных гепатопротекторных лекарственных препаратов, в случае которых антиоксидантная составляющая актуальной в плане проявления терапевтического эффекта. При этом необходимо отметить, что именно благодаря изучению воздействия флавоноидов, а именно флаволигнанов плодов расторопши пятнистой [3, 7] на функцию печени, особенно гепатоцитов, появилось понятие «гепатопротекторные свойства» и, как следствие, фармакологическая группа – гепатопротекторы, причем произошло это сравнительно недавно – в 90-е годы XX столетия [3, 4, 6].
В ходе исследований выявлены также особенности влияния на выделительную функцию почек водных и водно-спиртовых извлечений. Проведено сравнительное исследование диуретической активности водно-спиртовых извлечений из листьев толокнянки обыкновенной (препараты сравнения), травы эрвы шерстистой, цветков пижмы обыкновенной, травы репешка аптечного аптечного и цветков бессмертника песчаного. Установлено, что настой и препарат «Эрвы шерстистой настойка» обладают быстрым развитием диуретического эффекта и короткой продолжительностью действия. Для препаратов «Пижмы настойка» и «Бессмертника песчаного настойка», а также соответствующих настоев характерно быстрое развитие эффекта и длительное диуретическое действие, тогда как в случае препарата «Толокнянки настойка» наблюдается длительный латентный период в сочетании с продолжительным диуретическим действием.
Результаты проведенных исследований позволили создать методологическую базу для совершенствования стандартизации ЛРС, содержащего флавоноиды, а также расширить возможности целенаправленного поиска новых сырьевых источников для получения эффективных отечественных фитопрепаратов и лекарственных субстанций с антиоксидантной, диуретической, ноотропной и анксиолитической активностью. Внедрение результатов данных исследований будет способствовать успешной реализации Стратегии лекарственного обеспечения населения Российской Федерации на период до 2025 года, одним из главных приоритетов которой является разработка новых конкурентоспособных импортозамещающих лекарственных препаратов, в том числе растительного происхождения.
Рецензенты:
Первушкин С.В., д.фарм.н., профессор, заведующий кафедрой фармацевтической технологии, ГБОУ ВПО «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Самара;
Дубищев А.В., д.м.н., профессор, зав. кафедрой фармакологии им. заслуженного деятеля науки РФ, профессора А.А. Лебедева, ГБОУ ВПО «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Самара.
Источник
Лекарственные растения как источник биологически активных веществ
Потребность в биологически активных веществах на современном этапе тесно связана с решением глобальных проблем интенсификации производства и экологическим оздоровлением окружающей среды, а именно: получение новых видов продуктов различного назначения и в первую очередь препаратов профилактического и терапевтического действия; утилизация отходов промышленности и сельского хозяйства; получение экологически безопасных средств защиты сельскохозяйственных растений от болезней, вредителей, сорных растений для повышения их биологической продуктивности. Разработка промышленной технологии производства биологически активных веществ из сырья природного происхождения позволяет осуществить комплексное использование биоресурсов. В настоящее время известен широкий спектр биологически активных веществ (БАВ) различного назначения, которые могут быть либо получены из природных живых организмов, либо синтезированы с помощью различных химических превращений. Многие природные БАВ растительного и животного происхождения обладают лечебными свойствами и являются аналогами синтетических лекарственных препаратов. Наибольшее применение в промышленности получили экстракционные (новогаленовые) лекарственные препараты (кардиотонические гликозиды), гормональные препараты (инсулин), ферментативные (антибиотики) лекарственные препараты, продуцируемые микроорганизмами. В Государственной фармакопее России большинство (≈45 %) медикаментов получены в промышленных условиях из лекарственных растений. Выделение и очистка биологически активных веществ (БАВ) из природного растительного и животного сырья в настоящее время остается сложной, трудоемкой и энергоемкой стадией промышленного производства. При экстрагировании растительного или животного сырья водой или водно-спиртовыми растворами извлекаются кроме действующих веществ балластные вещества, которые не стабильны при хранении, снижают качество БАВ и требуют энергетических затрат на их очистку.
Целью исследований является разработка методологии получения биологически активных веществ из растительного и животного сырья.
Материалы и методы исследования
Для достижения поставленной цели приведен теоретический обзор ключевых этапов разрабатываемой методологии получения БАВ: классификация природных БАВ, структура и их физико-химические свойства, теоретические аспекты биосинтеза, экстракции, физиологические особенности. В качестве объекта исследования было взято растительное сырье, трава Адонис весенний (Adonis vernalis), для получения кардиотонического гликозида Адонизид и животное сырье, щитовидные железы домашних животных (свиней и крупного рогатого скота), для получения гормона инсулина, являющегося аналогом инсулина человека. В качестве растворителей использовали воду, алифатические спирты (С2–С4) (этанол, пропанол, изопропанол), ацетон, хлороформ, высаливателей ‒ водные растворы солей (KCl, NaCl, NH4Cl), ионообменные смолы (Вофатит R или ЭДЭ 10,11), оксид алюминия. Извлечение гликозида и инсулина осуществляли стандартными методами экстракции.
Результаты исследования и их обсуждение
Теоретические основы экстракции связаны с закономерностями распределения веществ между двумя гетерогенными жидкостями, фазовых равновесий бинарных и тройных систем, эффектом гомогенизации (всаливание), преобладающим взаимодействием гомогенизатор ‒ растворитель [4]. Эффективность экстракции определяется коэффициентом распределения гомогенизатора между сосуществующими (сопряженными) фазами по формуле:
где 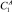
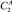
Биологически активные вещества (БАВ) – химические вещества, необходимые для поддержания жизнедеятельности живых организмов, обладающие высокой физиологической активностью при небольших концентрациях по отношению к определенным группам живых организмов или их клеткам (злокачественным опухолям), избирательно задерживая (или ускоряя) их рост или полностью подавляя их развитие. За единицу биологической активности химического вещества принимают минимальное количество этого вещества, способное подавлять развитие или задерживать рост определенного числа клеток, тканей стандартного штамма (биотеста) в единице питательной среды. Природные БАВ образуются в процессе жизнедеятельности живых организмов. Они могут образовываться в процессе обмена веществ, выделяясь в окружающую среду (экзогенные) или накапливаться внутри организма (эндогенные). Эффективность БАВ зависит от физиологических особенностей живых организмов, в растениях регулируется экологическими факторами (климат, погода, тип почвы и других) [9].
Многие БАВ впервые были получены из природного растительного и животного сырья и использовались для лечения болезней растений, животных, человека, борьбы с вредителями культурных растений (пестициды). Многие природные БАВ обладают токсикологическим действием, вызывая заболевания растений, животных, человека. К ним относятся микотоксины, продуцируемые грибами (Fusarium или Aspergillus), вызывают заболевания высших растений (злаковых), устойчивы при хранении, термической обработке растительного сырья. В организме человека микотоксины ингибируют биосинтез белка, поражают сердечно-сосудистую систему, клетки костного мозга, лимфатических узлов, обладают канцерогенными свойствами.
Кардиотонические гликозиды увеличивают силу и уменьшают частоту сердечных сокращений, улучшают тканевой обмен сердечной мышцы, являются стероидами – производными циклопентанпергидрофенантрена, имеющими С17 – ненасыщенное лактонное кольцо: пятичленное бутенолидное (карденолиды) или шестичленное (кумалиновое) кольцо (буфадиенолиды), содержатся в клеточном соке различных органов растений: семенах (строфанты), листьях (наперстянка, ландыш), цветках (ландыш), подземных органах (кендырь коноплевый). Экстракты природных душистых веществ, представляющие сложные смеси эфирных масел, используют для получения косметических, парфюмерных композиций, ароматерапии. Природные экзогенные БАВ, продуцируемые живыми организмами, способны ингибировать физиологические процессы других организмов (аллелопатия). Колины – органические соединения, выделяемые высшими растениями I через корневую систему, вызывающие угнетение высших растений II. Фитонциды – летучие органические соединения, выделяемые высшими растениями в атмосферный воздух, вызывают гибель патогенных микроорганизмов. Антибиотики – продукты жизнедеятельности микроорганизмов, угнетающие микроорганизмы II [2, 4]. Маразмины вызывают угнетение высших растений.
Эндогенные БАВ (белки, жиры, углеводы, витамины, ферменты, гормоны) представляют собой природные полимеры. Высокой интенсивностью биосинтеза белков отличаются многие микроорганизмы. Белки играют ключевую роль в образовании клеток, тканей организма, составляют основу биомембран. Поддерживают жизненно важных функции живых организмов.
Биологическая активность белков тесно связана с аминокислотным составом (протеины, протеиды). Растения и большинство микроорганизмов способны синтезировать все входящие в их состав аминокислоты из простых веществ – углекислоты, воды и минеральных солей. В организмах животных и человека некоторые аминокислоты (незаменимые) не могут синтезироваться и должны поступать в готовом виде как компоненты пищи. Длительное отсутствие в организме хотя бы одной незаменимой аминокислоты приводит к тяжелым заболеваниям человека и животных. Дефицит аминокислот компенсируют добавлением лекарственных препаратов. Гормоны «сигнальные химические вещества, вырабатываемые клетками тела и влияющие на клетки других частей тела» живого организма.
Свойства гормонов зависят от химического строения. Фитогормоны (ауксины, цитокинины, гиббереллины, абсцизовая кислота, этилен, брассиностероиды) взаимосвязаны в фитогормональной системе. Изменение уровня одного гормона приводит к изменению всей системы (биосинтез, деструкция и транспорт). Гормональные эффекты реализуются путем изменения конформации (пространственной структуры) макромолекул белков за счет образования активного комплекса (гормоно-рецепторного), выполняя роль преобразователя сигнала, между рецептором и определенной ферментативной системой [9, 11].
Предшественником большинства фитогормонов являются органические кислоты (аминокислоты). Биологические особенности транспортировки фитогормонов заключаются в том, что, образовавшись в одном органе (например, в апикальной меристеме стебля), они регулируют рост клеток в другом органе (корне). Ауксины, образуясь из аминокислоты триптофана, регулируют растяжение, деление и дифференцирование различных органов растений (тропизм), формирование проводящих флоэмных и ксилемных элементов в каллусной ткани. Цитокинины (зеатин) регулируют формирование хлоропластов на ранних стадиях развития листа, задерживают старение листьев, транспирацию листьев, повышая устойчивость клеток растения к различным неблагоприятным экологическим факторам (температуре, недостатку воды, повышенной засоленности, воздействию фитонцидов, рентгеновскому излучению). Гиббереллины, продуцируемые патогенным грибом Gibberella fujicuro, в растениях стимулируют растяжение клеток за счет повышения митотической активности меристемы, усиливают синтез клеточной стенки, переход к формированию генеративных органов к цветению, представляют собой терпиноиды, производные гиббереловой кислоты (ГК3). Предшественником биосинтеза (in vivo) гиббереловой кислоты является мевалоновая кислота. Дефицит гиббереллинов может привести к карликовости растений.
Этилен ‒ экзогенный газообразный фитогормон, стимулирует опадание листьев, цветков, завязей и плодов, вызывает изменение ориентации микрофибрилл целлюлозы, выделяется при хранении яблок. Предшественником этилена в биосинтезе является аминокислота метионин. Биосинтез этилена усиливается при стрессе растений (травмах). Под действием этилена подавляется митотическая активность, блокируется транспорт ауксина, стимулируется биосинтез абсцизовой кислоты, ингибитора ауксина, цитокининов, гиббереллинов. Брассиностероиды относятся к малоизученным фитогормонам.
Методы экстракции являются и в настоящее время приоритетными в промышленности при производстве лекарственных препаратов из растительного и животного сырья. Экстракция БАВ представляет собой сложный последовательный процесс растворения, сорбции, десорбции, диализа, диффузии. Скорость экстракции определяется лимитирующей стадией (диффузией). Интерес к экстракционным новогаленовым препаратам обусловлен комплексным лечебным действием. Особое внимание уделяется в медицине кардиотоническим лекарственным препаратам для лечения сердечно-сосудистых заболеваний, которые представляют смертельную угрозу для человека после онкологических заболеваний. Экстракцию кардиотонического гликозида (Адонизид) из растения осуществляют этанолом. Очистку от балластных веществ (хлорофиллов и смол) проводят высаливанием хлороформом с последующей адсорбцией на оксиде алюминия (толщиной 1…1,5 см). Использование инновационных методов экстракции (ультразвука низкой частоты, сжиженных газов) позволит снизить время лимитирующей стадии экстракции БАВ из растительного сырья в 10…1000 раз [5], что позволит минимизировать содержание балластных веществ, энергетические затраты при извлечении действующего вещества, гарантировать качество лекарственного препарата. Физический механизм действия ультразвука сводится к интенсивному перемешиванию внутри клетки, снижению гидростатического сопротивления движения, ускоряет теплообмен и массоперенос молекул растворителя и растворенных веществ через макропоры (0,1–0,2 мкм) клеточной мембраны в межклеточное пространство, диспергирование при экстракции. Новогаленовый препарат Адонизид, полученный с помощью ультразвуковой экстракции, отвечает всем требованиям Государственной фармакопеи [12].
Среди эндогенных БАВ в промышленности нашли применение в качестве лекарственных препаратов гормоны белково-пептидной группы (поджелудочной и паращитовидной железы), отвечающие за обменные процессы в организме человека, пронкновение через мембрану клетки в ее ядро. Наибольший интерес для медицины представляет гормон инсулин (insula), который используют для лечения заболевания сахарного диабета за счет снижения концентрации глюкозы в крови, стимулирования образования в печени и мышцах из глюкозы гликогена, усиления синтеза липидов и белков. Стероидная группа гормонов синтезируется преимущественно в половых железах, а также надпочечниках (эстроген, прогестерон) и контролирует физическое развитие человека и процесс размножения, связываются с рецепторами на поверхности структурного элемента, запуская биосинтез молекул-посредников. Гидрофильные гормоны переносятся с током крови, а липофильные связываются с белками крови и транспортируются вместе с ней. Молекула инсулина образована двумя полипептидными цепями (А и В), которые соединяются двумя сульфидными (–S–S–) мостиками через остатки цистеина. A-цепь состоит из 21 аминокислотного остатка, B-цепь образована 30 аминокислотными остатками.
Биосинтез инсулина протекает на рибосомах шероховатой эндоплазматической сети с образованием неактивной формы предшественника гормона пептида препроинсулина, представляющего собой полипептидную цепь (110 аминокислотных остатков), построенную из последовательно расположенных пептидов: L-пептид, B-пептид, C-пептид и A-пептид. Затем от молекулы предшественника отщепляется сигнальный (L) пептид и образуется проинсулин, который транспортируется в комплекс Гольджи, где происходит созревание инсулина (лимитирующая стадия). При созревании молекула проинсулина разделяется на инсулин и биологически инертный пептидный остаток.
Промышленный способ получения инсулина в качестве лекарственного препарата основан на экстракции поджелудочной железы этанолом в кислой среде, фильтрации, высаливании, многократной кристаллизации для очистки от примесей других гормонов, содержащихся в поджелудочной железе. Наибольшие энергетические затраты приходятся на стадии очистки инсулина [3, 6].
Проведенные авторами [7] исследования позволили обосновать способ получения инсулина экстракцией поджелудочной железы домашних животных (свиней, коров) алифатическими спиртами (С3–С4) пропанол, изопропанол в присутствии кислот (рН = 1,5. 3,5), высаливание водными растворами солей KCl, NaCl, NH4Cl (5…25 %), с последующим осаждением ацетоном для удаления липидов. Очистку инсулина проводили на ионообменных смолах (Вофатит R или ЭДЭ 10,11), используя в качестве элюента, водные растворы оснований (LiOH, NH4OH, NaOH) (рН = 7,5…9,5).
Предложена методология получения биологически активных веществ из растительного и животного сырья, основанная на принципах исследования химического строения предшественника БАВ, физико-химических свойств растворов, теоретических основ экстракции (распределения веществ между двумя несмешивающимися растворителями) [12], механизма биосинтеза и действия на живой организм, отсутствию в них токсичных примесей. Используя эту методологию, можно обосновать гипотезу механизма выделения инсулина указанным способом, который основан на денатурации в кислой среде белково-пептидной структуры гормона, деструкции белково-пептидной связи и повышении растворимости белка и липидов в полярном растворителе (спиртах). При введении в экстракт водных растворов солей происходит расслоение системы (высаливание), в результате которого липидная фракция переходит в спиртовой слой, а белковая фракция инсулина – в водный слой. Оптимальный состав растворителя и высаливателя необходимо осуществлять с помощью изучения фазовых равновесий и изменения физико-химических свойств от состава. Предполагаемый механизм действия БАВ, обладающего лечебными свойствами, в живом организме ‒ сложная последовательная реакция: транспорт к месту расположения мишени; распознавание мишени, биохимическое взаимодействие с ней по принципу сродства (аффинности); активизация мишени в результате образования активированного комплекса (Мишень БАВ).
Источник