Научная электронная библиотека
Юров И. Ю., Воинова В. Ю., Ворсанова С. Г., Юров Ю. Б.,
5.3. Действие тератогенов
Внешний фактор, который может вызвать врожденный порок, нарушая нормальное эмбриональное и фетальное развитие, называется тератогеном. Потенциальные эффекты любого тератогена будут зависеть от дозы и времени воздействия на организм во время беременности, а также предрасположенности к нему матери и плода.
Химические тератогены. Вещества с доказанным тератогенным эффектом, которые обуславливают около 2 % врожденных аномалий, перечислены в табл. 5. Кроме того, предполагалось, но не было доказано, тератогенное действие некоторых противораковых средств (метотрексат, хлорамбуцил), антиконвульсантов (карбамазепин). В качестве примера тератогена можно привести соединения ртути, которыми заражена рыба в Японии в результате загрязнения окружающей среды. Употребление этой рыбы беременными вызывает у детей синдром, подобный церебральному параличу.
Вещества с доказанным тератогенным эффектом
Гипоплазия зубной эмали
Фокомелия, аномалии сердца и ушных раковин
Дефекты нервной трубки, характерное лицо
Гипоплазия носа, изменения эпифиза
Пороки сердца, микроцефалия, характерное лицо
Аномалии матки, аденокарцинома влагалища
Пороки сердца, расщепление неба, гипоплазия пальцев
Ретиноиды (витамин А)
Дефекты органов зрения и слуха, гидроцефалия
Примером лекарства с тератогенным действием является талидомид, который широко использовался в Европе с 1958 по 1962 г., как седативное средство, в том числе беременными женщинами. За такой короткий период свыше 10 000 детей пострадали от этого лекарства. Критический период действия талидомида – между 20 и 35 днями от зачатия. Наиболее характерная аномалия, вызванная талидомидом, – фокомелия (порок, при котором в конечности отсутствуют некоторые или все длинные кости, но остаются пальцы, что создает вид, «подобный тюленю»). Кроме того, у детей формируются дефекты ушных раковин, микрофтальмия и расщелина губы и неба. Почти 40 % детей с этими пороками развития умирают в младенчестве в результате тяжелых аномалий развития сердца, почек и желудочно-кишечного тракта. «Талидомидовая трагедия» сфокусировала внимание на важности противопоказаний к применению многих лекарств во время беременности, если только не установлена их абсолютная безопасность. Чтобы избежать повторения подобной трагедии, производителями проводятся исследования лекарств до выпуска к общему применению. Кроме того, во многих странах созданы системы мониторинга в форме регистров врожденных аномалий развития.
Следует упомянуть также о фетальном алкогольном синдроме. У детей матерей, принимающих алкоголь во время беременности, формируются особенности лица с короткими глазными щелями, длинным сглаженным фильтром; наблюдается также задержка психического развития, гиперактивность. Данных об уровне алкоголя, безопасном для плода, нет, и даже малые его количества могут быть вредны.
Инфекции у матерей. Ряд инфекций могут нарушать эмбриональное развитие (табл. 6).
Инфекции матерей, имеющие тератогенный эффект
Вирус простого герпеса
Хориоретинит, глухота, микроцефалия
Микроцефалия, катаракта, ретинит, пороки сердца
Вирус ветряной оспы (varicella zoster)
Микроцефалия, хориоретинит, дефекты кожи
Гидроцефалия, остеит, ринит
Гидроцефалия, микроцефалия, катаракта, хориоретинит, глухота
Вирус краснухи поражает 15–25 % детей, инфицированных в первом триместре беременности, вызывая кардиоваскулярные аномалии (открытый артериальный проток, стеноз легочной артерии).
Цитомегаловирус вызывает высокий риск врожденных аномалий, если инфицирование произошло в первом триместре беременности.
Иммунизации против цитомегаловируса нет, даже перенесённая острая инфекция не дает стойкого иммунитета.
Материнское инфицирование паразитом токсоплазмой создает 20 %-й риск инфицирования плода в первом триместре, возрастая до 75 % во втором и третьем триместрах. Вакцины против токсоплазмоза не существует.
Если женщина имеет одну из этих инфекций, то необходимо установить следующее:
а) инфицирован ли плод путем исследования крови на специфические антитела;
б) нет ли признаков генерализации инфекции в виде тромбоцитопении и нарушения функции печени.
Физические факторы. Трудно доказать тератогенное воздействие радиоволн, ультразвука и магнитных полей в силу их повсеместного распространения. Однако существуют явные доказательства того, что два физических фактора – ионизирующая радиация и длительная гипертермия могут обладать тератогенным действием.
Ионизирующая радиация – дозы гораздо большие, чем те, что используются для рентгеноскопии и рентгенографии, могут быть причиной микроцефалии и пороков развития глаз у развивающегося плода. Наиболее чувствительное время экспозиции – 2–5-я недели после зачатия. Хотя риск применения малых доз минимален, во время беременности рекомендуется избегать радиографии.
Длительная гипертермия – на ранних сроках беременности может вызвать микроцефалию, микрофтальмию и нарушения нейрональной миграции. Следовательно, необходимо избегать перегревания в первом триместре беременности.
Болезни матерей. Многие заболевания матери связаны с повышенным риском неблагоприятного исхода беременности.
Инсулинзависимый сахарный диабет у беременных женщин приводит к 2–3-кратному повышению количества врожденных аномалий у их потомства. Наиболее частыми пороками развития среди них являются врожденные пороки сердца, дефекты нервной трубки, агенезия крестца, гипоплазия бедер, голопрозенцефалия и сирингомиелия (аномалия спинного мозга в виде образования полостей в сером веществе). Вероятность врожденных аномалий зависит от уровня глюкозы и гликозилированного гемоглобина в крови беременной. Инсулиннезависимый диабет и гестационный диабет у матери не ведут к повышению риска аномалий у потомства.
Фенилкетонурия. Матери с высоким уровнем фенилаланина в крови имеют высокий риск врожденных аномалий у потомства:
умственная отсталость наблюдается почти в 100 % случаев, могут встречаться микроцефалия и пороки сердца. Все женщины с фенилкетонурией должны соблюдать строгую диету с низким содержанием фенилаланина, концентрация в крови которого должна мониторироваться.
Эпилепсия у матери сама по себе не приводит к возникновению врожденных аномалий у детей. Однако, большинство исследований указывает на повышенную частоту пороков развития у детей, матери которых принимали антиконвульсанты (противоэпилептические препараты) во время беременности. Риск врожденных аномалий у таких детей в 2–4 раза выше общепопуляционного. Эти данные касаются монотерапии, при использовании же двух и более препаратов риск удваивается. Наибольшим тератогенным эффектом обладает вальпроат натрия. Аномалии, встречающиеся у больных, подвергшихся экспозиции антиконвульсантов во время своего внутриутробного развития, широко варьируют и встречаются в виде дефектов нервной трубки, расщепления губы и неба, аномалий мочеполовой системы (в частности, гипоспадии), пороков сердца и дефектов конечностей. Эти аномалии неспецифичны, что затрудняет диагностику, однако дети с фетальным вальпроатным синдромом имеют типичное лицо (широкое основание носа, широкий плоский его кончик, тонкая верхняя губа). Если женщине нельзя отменить антиконвульсанты во время беременности, то следует использовать только один лекарственный препарат и избегать при этом вальпроата натрия.
В более чем половине случаев врожденных аномалий развития не удается установить причину их возникновения. Это касается таких частых состояний как диафрагмальная грыжа, трахео-эзофагальная фистула, атрезия ануса и др. Чтобы предполагать генетическую природу врожденных пороков развития, полезно оценивать их симметричность. Симметричные и затрагивающие срединные структуры аномалии чаще имеют генетическую основу, в то время как для асимметричных она менее вероятна. Например, явная асимметрия конечностей имеет, как правило, негенетическую природу и часто связана с нарушением кровообращения конечности в ходе ее развития.
Таким образом, в формировании врожденных аномалий значительную роль играют тератогенные факторы окружающей среды.
Источник
Тератогенные эффекты психотропных средств
Опубликовано пт, 04/08/2017 — 07:57
Прием карбамазепина, также, как и вальпроатов, ассоциируется со многими рисками для плода, но мальформации в первом случае, несколько менее выражены, чем во втором. Например, прием карбамазепина в первом триместре беременности обусловливает отск поялвения дефектров нервной стрбки, однако, 0,5%-1% риск карбамазепина для новорожденного в два раза меньше, чем при воздействии на плод вальпроатов (Lindhour, Schmidt, 1986; Rosa, 1991).
Прием во время беременности вальпоатов ассоциируется с риском фетального и неонатального токсикоза, включая проявления гепатотоксичности (Kennedy, Koren, 1998), коагулопатий (Mountain et.al., 1970) и неонатальной гипогликемии (Ebbesen et.al., 2000). 10 из 13 детей, чьи матери во время периода гестации получали вальпроаты, при рождении имели неонатальную гипогликемию, а также синдром отмены, включая проявления раздражительности, гипертонии, судорожного синдрома и рвоты, которые начались после 12-24 часов после рождения и продолжались около одной недели (Ebbesen et.al., 2000).
Фармакокинетические исследования свидетельствуют о том, что концентрация вальпроатов в крови беременной женщины снижается почти в два раза, по сравнению с уровнем содержания этих препаратов до начала беременности ( Yerby et.al., 1990,1992).
Риск возникновенич фетальным мальформаций, в частности, появление расщелины неба, для плода при приеме ламотриджина оценивается на уровне 2,9%( Dominguez-Saldago et.al., 2004).
Сообщения о тератогенных эффектах антидепрессантов из группы избирательных блокаторов обратного захвата серотонина появились в конце 90-х годов ХХ века. Так, в частности, прием флуоксетина 4679 беременными женщинами привел к возникновению мальформаций у 126 новорожденных детей (2,7%) (Chambers et.al., 1996; Briggs et.al., 2005). По данным Wilton et.al. (1998) сертралин в 1,9% случаев также вызывал большие мальформации (GlaxoSmithKline 2005).
Первые исследования, посвященные влияниям трициклических антидепрессантов на плож беременных женщин дали противоречивые результаты. Регистрировались аномалии конечностей (Barson, 1972; Elia et.al., 1987). По данным мета – анализа Altshuler et.al (1996) конгенитальные мальформации детей при приеме во время первого триместра беременности их матерей трициклических антидепрессантов имели место в 3,14% случаев (414 новорожденных).
Угнетения респираторного центра отмечались у новорожденных, если кормящая мать (период лактации) принимала доксепин. Трициклические антидепресаанты, однако, в меньшей степени, чем доксепин проникали через молоко матери в плазму новорожденного (Wisner et.al., 1996).
Прием бупропиона во время беременности приводит к появлению у детей больших мальформаций в 2,2% случаев (Boschier et.al., 2003). Высокий уровень плацентарного трансфера имел место на фоне приема венлафаксина и его активного метаболита – дезвенлафаксина (Hendrick et.al., 2003).
Сведения о тератогенном эффекте антипсихотиков, по сравнению с аналогичными данными других психотропных препаратов следует считать ограниченными.
Источник
Лекарственные препараты с выраженным тератогенным действием
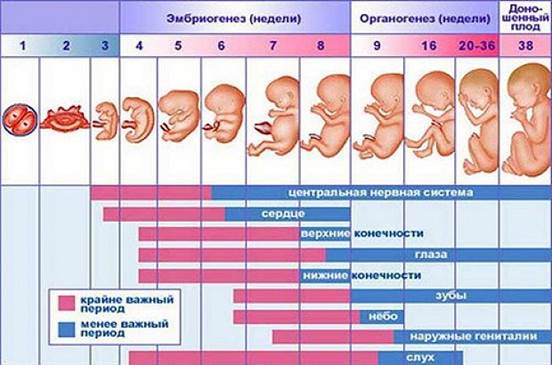
Врожденные аномалии у детей имеют широкий этиологический спектр. В настоящее время актуальность проблемы высока как на всем земном шаре, так и в России. Статистически частота врожденных пороков развития в России составляет 5-6 случаев на 1000 детей, тогда как в странах Европы 3-4 случая на 1000 родов. В настоящее время медицина не до конца выяснила причины врожденных аномалий у детей. Известно, что 10% врожденных пороков вызваны хромосомными и генетическими изменениями, 1% пороков вызваны действием лекарственных препаратов, в остальных 89% случаев изменения повлекли иные факторы. Путем рандомизированного исследования в странах мира лекарственные препараты во время беременности принимали более 80% опрошенных по данным Всемирной организации здравоохранения[2, 5]. Лекарства, которые выписывают доктора беременным, необходимы для нормального протекания беременности и развития здорового ребенка. Однако, есть определенный процент женщин, которые прибегают к самолечению, не выполняя указания врача. Во время беременности выделяют 3 триместра, в каждом из которых бесконтрольный и неправильный прием лекарственных средств может привести к врожденным порокам развития. Анализируя периоды беременности можно отметить, что отклонения от нормы будущего ребенка связаны с приемом лекарственных препаратов. Так, в первый триместр беременности, с 1-ой по 12-13-ю гинекологическую неделю, зародыш претерпевает ряд изменений, среди которых образование наружных половых органов, появляется точечно окостенение в хрящевом скелете, а также начинают функционировать мышцы, происходит окончание формирования плаценты[3]. (Рис.1) Во время 1-2 недели беременности, которые являются критическим периодом, эмбрион чувствителен к действию лекарств и при неправильном их приеме может произойти внутриутробная смерть зародыша. Второй триместр беременности длительностью с 14-ой по 26-ю гинекологическую неделю отличается относительным спокойствием, для этого периода характерно совершенствование органов и систем органов, которые начали закладываться в первом триместре. Третий триместр продолжается с 27-ой недели до родов. На данном этапе происходит формирование плода в плаценте. Происходит совершенствование нервной системы, почек, печени, органов чувств. Развиваются дыхательный, глотательный рефлексы. Плод набирает массу и активно растет в длину [3]. (Рис.1)
Рис.1 Внутриутробное развитие
Различают 3 вида патологических вариантов воздействия лекарственных средств на развитие плода: эмбриотоксический, тератогенный,фетотоксический. Эмбриотоксическое действие лекарственных препаратов, возникающее в первые 2-3 недели беременности, отмечается в негативном влиянии на зиготу и бластоцисту. Как следствие, может возникнуть гибель плода или морфофункциональные нарушения клеточных систем. Среди препаратов, которые вызывающие эмбриотоксическое действие выделяют противоопухолевые средства, противосудорожные препараты, никотин, эстрогены, гестогены, минералокортикоиды, антибиотики, сульфаниламиды, мочегонные препараты. (Табл. 1) Тератогенные эффекты, возникающие с 3 недели эмбриогенеза, вызывают нарушения биохимического, морфологического и функционального характера. Действие зависит от химической структуры, способности проникать через плаценту, дозировки препарата и скорость выведение лекарства из организма матери. По опасности препараты с тератогенными эффектами делятся на 3 группы: препараты, высоко опасные для плода, их употребление категорически запрещается даже за 6 месяцев до беременности, лекарства с определенной тератогенной опасностью, препараты, вызывающие отклонения при наличии определенных условий, например, высокий возраст беременной женщины, дозы применяемых лекарств [6]. Препараты с тератогенными эффектами являются наиболее опасными, так как они действуют на плод во время гистогенеза и органогенеза. Таким образом нарушение дифференцировки тканей может привести к порокам опорно-двигательной системы, а также внутренних органов. К таким средствам относятся: противоэпилептические средства, препараты половых гормонов, антибиотики, антикоагулянты, анальгетики, антидепрессанты, противомалярийные и противоопухолевые средства. Также известно, что прием ретиноидов, которые оказывают тератогенный эффект, вызывал врожденные аномалии развития, даже если курс лечения был завершен до начала беременности. (Табл. 1) [2,7]. Фетотоксическое действие наблюдается с 14-ой по 38-ую неделю беременности. Вызывают дисфункцию жизненно-важных систем органов. Примеры препаратов: аминогликозидные антибиотики, бета-адреномиметики и т.д. ( Табл. 1) [2,7] Лекарственные препараты проникают в организм плода через систему «мать-плацента-плод». Безусловно, самым важным органом во время беременности является плацента. Она служит своеобразным барьером между организмом матери и плода. Изначально толщина плаценты достигает 25мкм, но ближе к завершению беременности плацента становится заметно тоньше, ее толщина достигает 2 мкм. Этот факт способствует более легкому проникновению лекарств через плацентарный барьер в кровь плода. Также на ослабление плацентарного барьера влияют различные заболевания, например, сахарный диабет. Способность к проникновению различных веществ через плаценту обусловлена различными факторами, среди которых морфофункциональное состояние плаценты, плацентарный кровоток, физико-химическая характеристика лекарственных веществ и т.д. Известно, что большей проницаемостью через плаценту обладают низкомолекулярные вещества. Проникновение различных веществ через плаценту возможно различными путями, среди которых пиноцитоз, диффузия, активный транспорт. После проникновения лекарственного препарата происходит его дальнейшее попадание в пупочную вену, поэтому препарат достигает главных органов, например, сердце и мозг, минуя печень. Также важной проблемой является то, что некоторые препараты могут несколько раз циркулировать по организму плода, вызывая у него больший риск возникновения аномалий и пороков [8].
Таблица 1. Влияние лекарственных препаратов на развитие плода в первом, втором и третьем триместре беременности [4,5,9].
Источник