Лихорадящий больной. Место и польза антипиретиков
Опубликовано в журнале:
«Русский медицинский журнал», 2011, ТОМ №19, № 18, с. 1-7
Профессор Л.И. Дворецкий
1 МГМУ имени И.М. Сеченова
Лихорадка – один из древнейших защитно–приспособительных механизмов организма в ответ на действие патогенных раздражителей, главным образом инфекционных агентов.
Издавна у постели лихорадящего больного перед врачами всех времен возникало две проблемы, требующие по возможности быстрого принятия решения – диагностическая и терапевтическая. Основная проблема, разумеется, заключалась в распознавании причины лихорадки, а следовательно, в выборе адекватного лечения (этиотропная, патогенетическая, симптоматическая терапия). Другая задача касалась воздействия на лихорадку как на симптом (симптоматическая терапия), влияющий на состояние больного, на различные органы и системы. По мере прогресса медицинской науки обе проблемы и поныне сохраняют актуальность и клиническое значение во врачебной практике.
В данной статье предполагается рассмотреть современное состояние проблемы симптоматического лечения лихорадки с использованием жаропонижающих средств, независимо от ее причины, а также с позиций современного понимания механизмов лихорадочной реакции организма.
Патофизиология лихорадки
Повышение температуры тела является одной из приспособительных реакций живого организма в ответ на воздействие разнообразных патогенных факторов (инфекции, эндотоксины, опухоли, конфликты в иммунной системе, травмы и повреждения, отравления, физические факторы и др.). Показано, что у млекопитающих при повышении температуры тела повышается фагоцитоз, продукция антител, выработка интерферона, стероидных гормонов и альдостерона, что позволяет рассматривать лихорадку как биологически целесообразную реакцию [1].
Терморегуляция представляет собой процесс, в котором участвует целый континиум нервных структур и соединительных нервных волокон, исходящих из гипоталамуса и лимбической системы и идущих через нижние отделы ствола головного мозга и ретикулярную формацию в спинной мозг и симпатические ганглии. Главную роль в процессе терморегуляции играет участок головного мозга, расположенный в переднем гипоталамусе и в преоптической области, более известный, еще со студенческой скамьи как центр терморегуляции, предназначенный для регулирования температуры тела в норме и патологии [2].
Следует различать понятия «лихорадка» и «гипертермия», которые иногда употребляются как синонимы при обозначении одного и того же состояния. В основе повышения температуры тела при лихорадке и гипертермии лежат разные механизмы. Лихорадка представляет собой сложный патофизиологический ответ организма на различные патогенные воздействия в виде повышения температуры тела, опосредуемого цитокинами, наряду с образованием реактантов острой фазы и активацией многих систем (иммунной, эндокринной и др.). В отличие от лихорадки, гипертермия – нерегулируемое повышение температуры тела, в котором пирогенные цитокины непосредственного участия не принимают, а жаропонижающие средства при этом оказываются неэффективными. Иными словами, гипертермия представляет собой сбой терморегуляторного гомеостаза, при котором происходит неконтролируемая выработка тепла, недостаточная теплоотдача или нарушение терморегуляции на уровне гипоталамуса [3]. Теплопродукция может повышаться при тиреотоксикозе и феохромоцитоме. Причиной гипертермий могут быть лекарственные препараты (ингибиторы моноаминоксидазы (МАО), трициклические атидепрессанты, нейролептики, М–холиноблокаторы, антипаркинсонические препараты). Особое место среди гипертермий занимает так называемая злокачественная гипертермия – наследственное заболевание, характеризующееся избыточным накоплением ионов кальция в миоплазме, что вызывает длительную контрактуру мышц. Длительное мышечное сокращение вызывает значительное повышение температуры тела под влиянием анестетиков и мышечных релаксантов (триггерные агенты). Гипертермия развивается обычно во время или после анестезии. В таблице 1 представлены основные признаки лихорадки и гипертермии.
Таблица 1. Основные признаки лихорадки и гипертермии
| Основные признаки | Лихорадка | Гипертермия |
| Величина температуры тела | Обычно до 40°С | Часто выше 40°С |
| Патофизиологический механизм | Высвобождение пирогенных цитокинов под влиянием экзогенных пирогенов | Повышенное высвобождение тепла |
| Механизмы терморегуляции | Сохранены | Нарушены |
| Основные причины | Инфекции, опухоли, системные васкулиты, медикаменты | Перегревание, лекарства, нарушение ЦНС, тиреотоксикоз, феохромоцитома, злокачественная гипертермия |
| Эффект жаропонижающих препаратов | Обычно эффективны | Отсутствует |
| Прогноз | Зависит от основного заболевания | Летальность до 20% при злокачественной гипертермии |
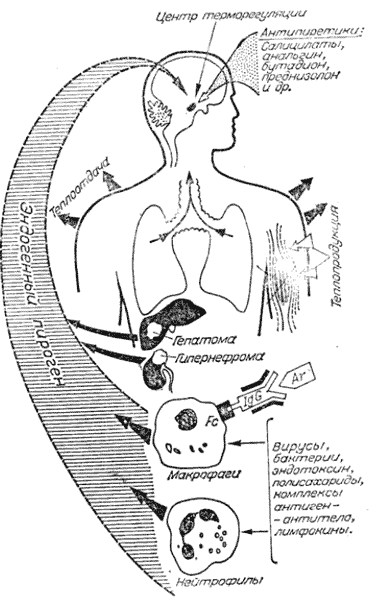
Схема лихорадочной реакции у человека в ответ на воздействие различных патогенных факторов представлена на рисунке 1. Данная схема заимствована из статьи А.И. Воробьева и М.Д. Бриллиант [1], одной из первых, посвященных проблеме лихорадок неясного генеза в клинической практике.
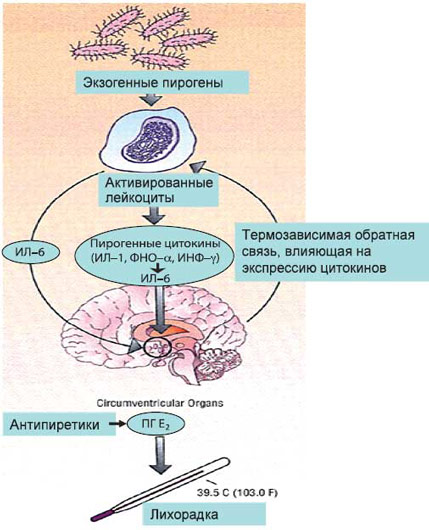
| Рис. 1. Схема развития лихорадочной реакции [1] | Рис. 2. Гипотетическая модель лихорадочной реакции [3] Повышение температуры тела происходит при участии экзогенных и эндогенных пирогенов и их взаимодействии друг с другом. Экзогенные пирогены представлены микроорганизмами, токсинами и другими продуктами микробного происхождения (липополисахариды), а также неинфекционными антигенами, иммунными комплексами. Эндогенные пирогены – это клеточные цитокины, являющиеся главным медиатором лихорадки. Под воздействием экзогенных пирогенов происходит стимуляция клеток, главным образом нейтрофилов, моноцитов, макрофагов, вырабатывающих эндогенный пироген (пирогенные цитокины). Способностью к выработке эндогенного пирогена обладают опухолевые клетки (лимфопролиферативные опухоли, рак почки, печени и др.). Этим, по–видимому, и объясняется наличие лихорадки у данной категории пациентов, причем нередко опережающей другие симптомы болезни [4]. В настоящее время известно 11 цитокинов, обладающих пирогенной активностью. К наиболее важным пирогенным цитокинам относятся: интерлейкин–1 (ИЛ–1), интерлейкин–6 (ИЛ–6), фактор некроза опухоли–α (ФНО–α), γ–интерферон [5]. Указанные цитокины находятся в тесном взаимодействии друг с другом: некоторые из них в одних условиях усиливают экспрессию других цитокинов или их рецепторов, а в других – снижают ее. Согласно одной из гипотез, предполагается, что при взаимодействии между пирогенными цитокинами и их рецепторами в преоптической области происходит активация фосфолипазы А2, с высвобождением арахидоновой кислоты в качестве субстрата для циклооксигеназного пути. Некоторые цитокины могут вызывать такой эффект посредством прямого увеличения экспрессии циклооксигеназы, в результате чего образуются метаболиты арахидоновой кислоты – простагландина (ПГ) Е2 и ПГF2a [3,6]. Последний легко проникает через гематоэнцефалический барьер и может служить медиатором, активирующим термочувствительные нейроны с последующим повышением температуры тела (рис. 2). Негативные эффекты лихорадки Будучи биологически целесообразной реакцией организма, свидетельствующей о неблагополучии и направленной на борьбу с патогенами, в частности инфекцией, лихорадка в то же время может вызывать целый ряд негативных последствий у пациентов всех возрастных групп. Такие ситуации могут возникать у больных при наличии тяжелой сопутствующей патологии и риске ее декомпенсации на фоне лихорадки, а также в случаях индивидуальной плохой переносимости высокой температуры. Негативные последствия повышения температуры тела до фебрильных цифр сводятся к следующим:
Вышеуказанные негативные последствия лихорадки могут оказывать особенно неблагоприятное воздействие на больных, страдающих различными сердечно–сосудистыми, неврологическими и другими заболеваниями. С учетом этого лихорадка у данной категории пациентов требует купирования или ослабления ее проявлений, т.е. симптоматического лечения. Медикаментозные способы купирования лихорадки основаны на знаниях и понимании механизмов повышения температуры тела при различных патологических процессах. Жаропонижающий эффект препаратов осуществляется на уровне центра терморегуляции при их взаимодействии с так называемыми медиаторами повышения температуры – «посредниками» между эндогенным пирогеном (пирогенными цитокинами) и температурными рецепторами преоптической области гипоталамуса. Одним из таких «посредников» является ПГ Е2, производное арахидоновой кислоты. Так, например, салицилаты необратимо связываются с синтетазой простагландина, а глюкокортикоиды подавляют синтез ПГ Е2, ингибируя фосфолипазу А2. Таким образом, мишенью всех антипиретиков является ПГ Е2, а возможно, и другие метаболиты арахидоновой кислоты. Вместе с тем жаропонижающие препараты не оказывают антипиретического действия при повышении температуры, не связанной с пирогенными цитокинами, например при гипертермиях, обусловленных уменьшением теплоотдачи (атропиновая гипертермия, злокачественная гипертермия, тепловой удар при перегревании и др.) История жаропонижающих средств Усилия врачей всех эпох медицины сводились к уменьшению выраженности лихорадки, снижению температуры тела и облегчению состояния больного даже при невозможности воздействовать на основную причину лихорадки. Способы купирования лихорадки были многообразны и диктовались исключительно клиническим опытом медиков, а также самих пациентов и их окружающих. Достаточно указать на воздействие низких температур непосредственно на тело больного (холодные компрессы, обертывания, пузыри со льдом и др.), использование некоторых химических веществ. Иногда эмпирически применяемые у лихорадящих больных «лекарства» оказывались в последующем именно этиотропными препаратами. Об этом свидетельствует опыт использования коры хинного дерева, которая веками применялась индейцами как жаропонижающее средство. С 1632 г. иезуитский миссионер Бернабе Кобо дал первое описание «иезуитской коры» и привез ее в Европу, где кору стали с успехом применять у лихорадящих больных. Оказалось, что эффект наблюдался только при лихорадках у больных малярией. Это происходило задолго до того, как в 1880 г. французский военный врач Шарль Лаверан предположил, что малярия вызывается простейшими, за что был удостоен впоследствии Нобелевской премии. В 1763 г. было сделано первое научное сообщение о жаропонижающем действии препарата, полученного из ивовой коры. Позже было установлено, что активным началом этого препарата является салицин, на основе которого в лабораториях немецкой компании Bayer, ранее производившей лишь анилиновые красители и учрежденной в 1863 г. коммерсантом Фридрихом Байером и владельцем небольшой красильни Иоганном Вескоттом, была создана ацетилсалициловая кислота (АСК), появившаяся в немецких аптеках в 1899 г. под торговым названием «аспирин». Однако задолго до появления на фармацевтическом рынке аспирина компанией Bayer был разработан препарат с жаропонижающими свойствами. Принятый в 1884 г. на службу в компанию 23–летний Карл Дуйсберг, вставший в последующем у руля корпорации, поручил одному из научных сотрудников разработать лекарство на базе паранитрофенола – побочного продукта производства красок, лежавшего на складе мертвым грузом. Так в 1887 г. на свет появился жаропонижающий препарат, для которого Дуйсберг придумал фирменное имя – фенацетин. Это лекарство широко использовалось в качестве жаропонижающего и анальгетического средства несколько десятков лет и лишь в 60–70–е гг. ХХ в. из–за негативных побочных эффектов было полностью изъято из употребления. К тому времени на фармацевтическом рынке появился новый препарат – парацетамол, который позиционировался как жаропонижающее и болеутоляющее средство, более безопасное по сравнению с АСК для детей и лиц с «язвенным анамнезом» [10]. В 1955 г. начались продажи парацетамола в США («Тайленол»), а в 1956 году – в Великобритании («Панадол»). Небезынтересно отметить, что это оказалось вторым рождением парацетамола, который является метаболитом фенацетина и был синтезирован в 1877 г. Однако только в 1887 г. (время внедрения в клиническую практику фенацетина) он был применен у больных Джозефом фон Мерингом. В 1893 г. автор опубликовал результаты клинического применения парацетамола и фенацетина (ацетанилида), утверждая, что парацетамол, в отличие от фенацетина, обладает способностью вызывать метгемоглобинемию. Это и открыло дорогу фенацетину, а парацетамол оказался забытым на десятилетия. В 1949 г. удалось установить, что фенацетин действительно метаболизируется в парацетамол, а метгемоглобинемия возникает у людей в основном под действием другого метаболита – фенилгидроксиламина. Было также высказано предположение, что загрязнение парацетамола 4–аминофенолом (веществом, из которого он был синтезирован фон Мерингом) могло стать причиной ложных выводов [7]. Это и привело к «повторному открытию» парацетамола [6]. Наконец фенацетин уступил место парацетамолу, который относительно широко стали применять после изъятия из оборота амидопирина и фенацетина. Появилось множество парацетамолсодержащих комбинированных лекарственных форм, в том числе в сочетаниях с ацетилсалициловой кислотой, метамизолом, кодеином, кофеином и другими препаратами. Лекарственные препараты с жаропонижающим эффектом Первые попытки воздействовать на лихорадку с помощью лекарственных средств связаны с применением ацетилсалициловой кислоты, уже с момента легализации ее в качестве лекарственного препарата. Однако с учетом ставших впоследствии известными фармакологических свойств АСК жаропонижающий эффект препарата в ряде случаев мог быть обусловлен не только и не столько его антипиретическими свойствами, но и воздействием на механизмы воспаления, одним из проявлений которого оказывалась лихорадка. АСК до сих пор служит препаратом номер один при лечении многих заболеваний, в том числе используется как жаропонижающее средство. Правда, показания к ее применению при лихорадке в последнее время были серьезно пересмотрены, особенно в педиатрической практике в связи с риском возникновения у детей синдрома Рея. В настоящее время АСК вытесняют другие жаропонижающие препараты, в первую очередь парацетамол. Парацетамол ингибирует синтез простагландинов, блокируя обе формы фермента циклооксигеназы (ЦОГ–1 и ЦОГ–2), причем действует преимущественно в ЦНС, воздействуя на центры боли и терморегуляции. Предполагается также, что препарат селективно блокирует ЦОГ–3, которая находится только в ЦНС, не влияя на ЦОГ–1 и ЦОГ–2, расположенные в других тканях. Этим объясняется выраженный анальгетический и жаропонижающий эффекты и низкий противовоспалительный [8]. Отсутствие блокирующего влияния на синтез простагландинов в таких тканях обусловливает отсутствие у него отрицательного влияния на слизистую оболочку желудочно–кишечного тракта (ЖКТ) и водно–солевой обмен (задержка ионов Na+ и воды). В отличие от АСК и других нестероидных противовоспалительных препаратов (НПВП), парацетамол не вызывает существенных побочных эффектов, прежде всего эрозивно–язвенных процессов в желудке, и поэтому остается предпочтительным для купирования лихорадки. Вместе с тем жаропонижающий эффект парацетамола был менее выраженным по сравнении с НПВП. Однако у АСК есть преимущества перед ним, когда речь идет о лихорадке у пациента с тяжелым поражением печени (в частности, при хроническом алкоголизме) и некоторых других состояниях. Вслед за АСК и парацетамолом арсенал жаропонижающих средств пополнялся новыми препаратами из группы НПВП, в частности производными индолуксусной кислоты (индометацин), фенилускусной кислоты (диклофенак), пропионовой кислоты (ибупрофен, кетопрофен, напроксен), оксикамы (пироксикам, мелоксикам), производные гетероарилуксусной кислоты (кеторолак) и др. Ибупрофен синтезирован и зарегистрирован в 1962 г., а с 1974 г. стал применяться в США в качестве болеутоляющего и жаропонижающего препарата. Самым ярким моментом в истории ибупрофена было получение в 1985 г. Королевской награды в знак признания научно–технических достижений в разработке этого препарата. В 1966 г. арсенал НПВП пополнился диклофенаком, а в дальнейшем были синтезированы пироксикам, напроксен. Комбинированное использование двух препаратов из группы НПВП обычно не считается рациональным, так как возможны нежелательные реакции со стороны желудочно–кишечного тракта. Вместе с тем, поскольку жаропонижающий эффект парацетамола был менее выраженным по сравнению с НПВП, с клинической точки зрения казалось логичным использовать комбинацию парацетамола с одним из НПВП (ибупрофеном), когда при суммировании обезболивающего эффекта побочные явления не усиливаются. Таким образом, ибупрофен является НПВП, обладающим противовоспалительным, жаропонижающим и обезболивающим действием, а парацетамол оказывает обезболивающее и жаропонижающее действие. Эффективность комбинации этих препаратов выше, чем отдельных компонентов. Парацетамол и ибупрофен, входящие в состав комбинированного препарата Ибуклин ® , полностью отвечают критериям высокой эффективности и безопасности и официально рекомендуются ВОЗ и национальными программами в качестве жаропонижающих средств [WHO, 1993; S. M. Lesko et al., 1997; Практические рекомендации для врачей Российской ассоциации педиатрических центров, 2000]. Ибуклин ® имеет существенные преимущества перед монопрепаратами – парацетамолом и ибупрофеном, т.к. в комбинированном препарате сочетается быстрое начало действия и длительный жаропонижающий эффект [13]. Ибуклин ® содержит 400 мг ибупрофена и 325 мг парацетамола. Препарат оказывает жаропонижающее, противовоспалительное, анальгезирующее действие, обусловленное неселективным ингибированием ЦОГ–1 и ЦОГ–2 и подавлением синтеза ПГ. Ибуклин ® применяется внутрь по 1 таблетке 3 раза/сут. (не более 6 таблеток в сутки). Длительность лечения – не более 3 дней в качестве жаропонижающего средства. Помимо купирования лихорадочного синдрома, препарат может быть использован в лечении болевого синдрома средней интенсивности. Препарат отпускается по рецепту врача. Кроме того, зарегистрирована детская форма препарата Ибуклин юниор, содержащая 100 мг ибупрофена и 125 мг парацетамола. Ибуклин юниор отпускается по рецепту врача. Возможность комбинированного применения ибупрофена и парацетамола в педиатрической практике оценивалась в рандомизированном исследовании у 146 детей в возрасте от 6 мес. до 6 лет [9]. За 24 ч комбинация ибупрофена и парацетамола снизила продолжительность лихорадочного периода на 4,4 ч по сравнению с парацетамолом и на 2,5 ч по сравнению с ибупрофеном. Побочные эффекты при всех вариантах терапии существенно не различались. Тактика применения жаропонижающих препаратов При принятии решения о назначении антипиретиков с целью купирования лихорадки врач должен отдавать себе отчет в том, что подобная терапия в данной ситуации носит исключительно симптоматический характер (если назначение НПВП не имеет целью достижение противовоспалительного эффекта, например, при артритах различного происхождения). При легкой или умеренной лихорадке жаропонижающие препараты назначают только детям с фебрильными припадками, беременным, а также больным с сердечной и дыхательной недостаточностью или сосудистым поражением головного мозга. Необоснованное применение жаропонижающих препаратов не дает возможности проследить за динамикой температуры, а противовоспалительное действие НПВП может маскировать проявления местной инфекции, затрудняя своевременную диагностику, а также способствует ее распространению. Следует помнить о биологической целесообразности лихорадочной реакции, а также о том, что отсутствие повышения температуры при инфекции свидетельствует о вероятности иммунодефицита и является неблагоприятным прогностическим фактором. Поэтому показаниями к назначению жаропонижающих средств являются не столько высокие цифры температуры тела, сколько ее плохая переносимость и риск возможного негативного влияния высокой температуры на различные органы и системы у больных с сопутствующей патологией и факторами риска. Принятие решения о назначении жаропонижающего средства требует ответа на следующие вопросы:
При выборе препарата среди НПВП следует учитывать не только жаропонижающие свойства, но также и анальгетический эффект, поскольку болевые ощущения (головные боли, миалгии, артралгии и др.) нередко сопутствуют лихорадке. В таблице 2 представлены основные характеристики наиболее часто используемых НПВП, оцениваемые в порядке убывания того или иного свойства. Таблица 2. Сравнительная характеристика основных НПВП [10]
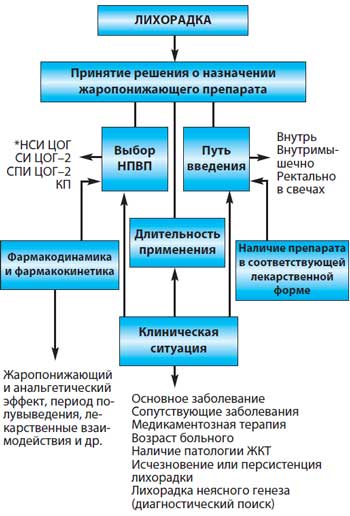
Большой выбор НПВП, обладающих жаропонижающими свойствами, ставит перед врачом проблему выбора препарата не только с точки зрения его антипиретического эффекта, но и минимального побочного действия. При выборе НПВП необходимо учитывать безопасность препарата, в том числе риск ульцерогенного эффекта, гепатотоксичность, цитопеническое действие, нефротоксичность, возможность взаимодействия с другими медикаментами, фармакокинетику препарата (длительность полувыведения, связь с белками, биодоступность и др.). При этом потенциальный риск развития побочных эффектов даже при кратковременном приеме препаратов может превышать их жаропонижающий эффект. Поэтому принятие решения о назначении антипиретиков должно быть взвешенным с учетом конкретной клинической ситуации, знаний особенностей фармакодинамики и фармакокинетики препаратов, имеющихся в распоряжении врача. Путь введения НПВП должен обеспечивать оптимальную терапевтическую концентрацию препарата в крови, минимизировать риск побочных эффектов со стороны ЖКТ, быть удобным для применения и комфортным для пациента. С целью жаропонижающего эффекта используется прием препаратов внутрь, внутримышечные инъекции, внутривенные вливания и введение ректальных суппозиториев. Пероральный прием НПВП является наиболее распространенным, но влечет за собой наибольший риск побочных эффектов со стороны ЖКТ (до 15%) [11]. Это зависит от продолжительности печеночной рециркуляции, определяющей длительность контакта со слизистой ЖКТ, что и приводит к гастроэнтерологической токсичности НПВП. С учетом этого при выборе перорального пути назначения НПВП предпочтение следует отдавать препаратам с коротким периодом полувыведения, быстрым всасыванием и быстрой элиминацией (ибупрофен, кетопрофен, диклофенак). Быстрая абсорбция способствует скорому наступлению жаропонижающего эффекта, а короткий период полувыведения снижает риск аккумуляции НПВП. Внутримышечное (или внутривенное) введение НПВП с целью купирования или ослабления лихорадки широко практикуется врачами из–за более быстрого достижения жаропонижающего эффекта, а также в расчете на меньший риск гастроэнтерологической токсичности. Следует отметить, что различные побочные эффекты НПВП, в том числе и со стороны желудка, обусловлены не местным воздействием препарата, а ингибицией ЦОГ–1 независимо от способов введения их больному. Вместе с тем при внутримышечном введении часто назначаемого диклофенака возможно развитие мышечных некрозов в местах инъекций, а при длительном внутримышечном введении увеличивается риск возникновения инфильтратов и абсцессов мягких тканей. Кроме того, применение инъекционных форм является экономически более затратным. Лекарственные формы НПВП в виде ректальных суппозиториев, применяемые в качестве жаропонижающих средств, имеют целый ряд преимуществ, в частности абсорбция лекарственного препарата через кровеносную и лимфатическую систему, отсутствие влияния пищи и других медикаментов на биодоступность НПВП, уменьшение риска побочных эффектов со стороны ЖКТ, особенно при патологии желудка, двенадцатиперстной кишки, высокая биодоступность, сравнимая с таковой при внутримышечном введении. Не следует назначать АСК детям при вирусных инфекциях из–за опасности развития синдрома Рейе (обычно он развивается при гриппе и ветряной оспе, реже – при энтеровирусных инфекциях). Кроме того, АСК обладает антиагрегантным и антифагоцитарным действием, поэтому лучше применять парацетамол. Он почти не угнетает циклооксигеназу в периферических тканях и поэтому не обладает противовоспалительным действием; при окислении парацетамола в ЦНС образуется мощный ингибитор циклооксигеназы, который и отвечает за жаропонижающее действие препарата. В плане быстроты начала действия и длительности жаропонижающего эффекта комбинация ибупрофена (400 мг) + парацетамола (325 мг) (Ибуклин ® ) более эффективна в сравнении с монопрепаратами [13]. Продолжительность применения жаропонижающих средств определяется главным образом клинической ситуацией. В большинстве случаев, например при ОРВИ, инфекциях ЛОР–органов, длительность назначения НПВП для купирования лихорадки не превышает нескольких дней. В то же время у больных с различными бактериальными инфекциями при сохраняющейся лихорадке на фоне неэффективной антибактериальной терапии потребность в назначении НПВП может быть более длительной. Особое место занимают так называемые лихорадки неясного генеза, причина которых нередко остается нерасшифрованной в течение длительного времени, а сохраняющаяся лихорадка требует более продолжительного использования НПВП. В подобных ситуациях важное значение приобретает эффективность жаропонижающего действия, удобство применения и главное – безопасность используемого препарата. Необходимость более длительного применения должна определяться клинической ситуацией (переносимость препарата, риск развития побочных эффектов, наличие и тяжесть сердечно–сосудистой, психоневрологической патологии и др.). Алгоритм принятия решений при назначении НПВП у больных с лихорадкой представлен на рисунке 3. Рис. 3. Алгоритм принятия решений при назначении НПВП у больных с лихорадкой [12]
Источник |