ДНК как лекарство: клеточная и генная терапия меняют фармацевтику
Лекарства, полученные с помощью генной инженерии и клеточных технологий, вряд ли в ближайшие годы станут столь массовыми, что обгонят по продажам антибиотики и жаропонижающие. Но эти современные препараты незаменимы в лечении некоторых видов рака, редких наследственных заболеваний, терапии ВИЧ и других вирусных инфекций. А это большой рынок с потенциальным оборотом в десятки миллиардов долларов.
Стволовые клетки и генная инженерия
Генная терапия — общее название для технологий (а также соответствующих лекарств), которые используют изменение генов для достижения нужных медицинских эффектов. Например, в организм пациента могут доставить ген, кодирующий определенный белок. Когда нужная ДНК попадет в клетки, те смогут начать производство данного протеина, что будет иметь лечебное воздействие.
Другой вариант — отредактировать «дефектные» варианты генов, чтобы они начали работать правильно. Если у человека есть только одна мутантная версия гена, который вызывает заболевание, можно просто отрезать ее — и ДНК починит себя сама, скопировав генетическую информацию со своей второй «половинки». В случае, когда повреждены обе цепи ДНК, можно доставить в клетки донорскую последовательность.
Наконец, есть возможность с помощью специальных препаратов управлять экспрессией генов. Если активность определенного гена приводит к болезни, ее подавляют. И наоборот: в ситуации, когда заболевание возникает по причине «недоработки» какого-то гена, лекарство помогает его включить.
Что касается клеточной терапии, она в большинстве случаев представляет собой лечение стволовыми клетками. Они могут развиться в клетки любого типа, любого органа, если правильно управлять их ростом. И эту науку ученые освоили, но важно было еще и получить достаточный запас стволовых клеток. Проблему решил японский ученый Синья Яманака, который в 2006 году впервые смог получить индуцированные плюрипотентные стволовые клетки, то есть вернуть клетки взрослого человека в то состояние, когда из них может вырасти что угодно. Перед наукой открылись захватывающие перспективы: можно выращивать новые органы, восстанавливать поврежденные участки нервной системы, лечить заболевания крови — все это становится возможным с применением стволовых клеток.
На стыке клеточной и генной терапии находится технология модификации клеток. Сегодня ученые экспериментируют в основном с клетками иммунитета — Т-лимфоцитами. С помощью генетического редактирования их «учат» лучше распознавать вредителей (например, раковые клетки) и эффективно их уничтожать.
Генный рынок
В 2016 году рынок препаратов для генной терапии оценивался в $584 млн. А к 2023 году, по прогнозам аналитиков, глобальная выручка от продажи таких препаратов превысит $4,4 млрд — это более 30% роста ежегодно.
Среди лидеров рынка как традиционные фармацевтические гиганты (такие, как Novartis и GlaxoSmithKline), так и более специализированные компании (Spark Therapeutics, Bluebird bio, Amgen, Celgene).
Как следует из отчета Allied Market Research, подавляющее большинство препаратов генной терапии производится для больных с онкологическими патологиями. И в ближайшее время — как минимум до 2023 года — эта ниша сохранит свое первенство на рынке. Следом за лекарствами от рака идут средства генной терапии от редких заболеваний, сердечнососудистых болезней, неврологических расстройств, инфекций.
Лидеры рынка следуют за трендами и разрабатывают препараты для онкобольных. Например, в компании Amgen, которая возглавила топ-25 биотехнологических компаний в 2017 году с капитализацией в $129,1 млрд, из 37 препаратов в стадии клинических испытаний 20 относятся к лечению опухолей и заболеваний крови.
А компания Novartis стала первой, кому американское управление по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration, FDA) разрешило запустить массовое производство клеточной терапии рака, основанной на генетической модификации. Это тот самый случай, когда фармкомпания производит лекарство из Т-лимфоцитов, превращая их в средство борьбы с онкологией, а именно с острым лимфобластным лейкозом.
Novartis уже начала получать первые деньги от продажи своего препарата под названием Kymriah. И немалые — каждый курс генной терапии рака стоит порядка $475 000. Вслед за этим FDA одобрило еще одно лекарство для лечения онкологии с подобным механизмом действия — Yescarta от компании Gilead Sciences (капитализация в 2017 году — $103 млрд); оно будет продаваться по цене в $373 000 за курс и помогать больным с неходжкинской лимфомой.
На продажах Kymriah фармгигант Novartis сможет зарабатывать порядка $300 млн в год. А Gilead Science аналитики пророчат выручку от препарата Yescarta в $250 млн за 2018 год.
Novartis хочет расширить спектр применения своего лекарства, чтобы его также можно было назначать пациентам с неходжкинской лимфомой — это позволит компании побороться за рынок, который оценивают примерно в $1 млрд. Но фармгиганту придется конкурировать не только с Gilead Sciences, которые уже предложили свое — и более дешевое — решение, но и с Bluebird Bio и Juno Therapeutics, разрабатывающими аналогичные продукты.
Прибыльность клеточной генной терапии аналитики пока затрудняются оценить. Но по их данным, стоимость производства подобных лекарств от рака должна составлять не менее $200 000 за курс.
По-настоящему революционные открытия, которые происходят на рынке генной терапии и грозят перевернуть фармацевтический рынок (как минимум в области лечения онкологии), привлекают в отрасль инвестиции: за последние пять лет компании-производители получили порядка $600 млн венчурного капитала на свои разработки.
Рыночные перспективы стволовых клеток
По прогнозу аналитиков из Grand View Research, рынок препаратов, основанных на стволовых клетках, к 2025 году достигнет $15,6 млрд. Сегодня самые перспективные сферы применения стволовых клеток — это лечение болезни Паркинсона и болезни Альцгеймера, а также повреждений спинного мозга, сахарного диабета первого типа, заболеваний крови и онкологии.
Но пока что даже топовые компании, занимающиеся стволовыми клетками, не могут похвастаться такими же масштабами, как их коллеги по генной терапии. Например, крупнейшая компания, которая торгуется на бирже NASDAQ — Sangamo Therapeutics, — имеет капитализацию всего в $2,1 млрд.
В данный момент Sangamo Therapeutics разрабатывает два вида терапии на основе собственных — аутологичных — стволовых клеток для лечения заболеваний крови. Если производитель добьется успеха, то с помощью этих препаратов можно будет лечить такие генетические болезни крови, как бета-талассемия и серповидноклеточная анемия.
Развитие рынка стволовых клеток тормозится тем, что лекарства на основе аутологичных клеток делать невыгодно, так как такое производство нельзя масштабировать: лекарство, созданное для одного пациента, нельзя применить для другого. В то же время может быть прибыльно производить препараты на основе чужих — аллогенных — стволовых клеток. Но на разработку таких средств требуется много времени: необходимо сделать их «незаметными» для иммунитета пациентов, чтобы снизить риск отторжения.
Что дальше?
По всем оценкам, рынок клеточной и генной терапии в ближайшие годы будет активно развиваться, и средний годовой рост продаж составит не менее 30%. Новые открытия в сфере генной терапии обещают 2200 клинических испытаний, которые проводятся по всему миру: ученые ищут средства от различных видов рака, редких генетических нарушений, болезни Паркинсона, ВИЧ и других болезней.
Впереди планеты всей, как всегда, США — около 55% исследований происходят именно там. Также разработками в сфере генной терапии занимаются в Европе, Канаде и Китае. Один препарат, созданный при участии генной инженерии, запустили и в России — это Неоваскулген, лекарство, призванное помочь при ишемии нижних конечностей.
Что же касается стволовых клеток, рост рынка ожидается в результате появления новых препаратов регенеративной медицины — сейчас многие из них находятся в стадии разработки. Большинство исследований проходят в США, но новые решения в области стволовых клеток также появляются в Сингапуре и Японии.
Источник
ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
1.3. КЛЕТОЧНАЯ И ГЕННАЯ ИНЖЕНЕРИЯ
Современная биотехнология включает ряд высоких технологий, которые базируются на последних достижениях экологии, генетики, микробиологии, цитологии, молекулярной биологии. В современной биотехнологии используются биологические системы всех уровней: от молекулярно-генетического до биогеоценотического (биосферного); при этом создаются принципиально новые биологические системы, не встречающиеся в природе. Биологические системы, используемые в биотехнологии, вместе с небиологическими компонентами (технологическое оборудование, материалы, системы энергоснабжения, контроля и управления) удобно называть рабочими системами.
К основным разделам современной биотехнологии относятся: микробиологический синтез, клеточная инженерия и генная инженерия.
Используя методы генной и клеточной инженерии, современная биотехнология осуществляет широкое конструирование генетически модифицированных организмов (ГМО), в том числе микроорганизмов, растений и животных.
Целый ряд ГМО используется в неконтролируемых условиях (в сельском хозяйстве, рыбоводстве, для биологической борьбы с вредителями сельского и лесного хозяйства и т. д.).
Однако перед генной инженерией стоит ряд этических и технологических проблем. Например, при выпуске ГМО в окружающую среду они могут взаимодействовать с разнообразными организмами, сообществами и экосистемами конкретных территорий. При этом процесс и исход таких взаимодействий не всегда поддается прогнозированию.
В результате возникает проблема генетической безопасности как отдельных популяций человека, растений и животных, так и экосистем в целом. В частности, существует опасность внедрения трансгенов («искусственных генов») в геном неконтролируемых организмов в результате скрещивания и/или рекомбинации ГМО и «диких» форм.
Многие ученые и организации возражают против создания генетически модифицированных организмов, поскольку при этом возможны непредсказуемые последствия. Поэтому развитые страны должны принять нормативные акты, регулирующие создание, испытание и использование ГМО, включающее выпуск в окружающую среду.
1.3.1. КЛЕТОЧНАЯ ИНЖЕНЕРИЯ: ДОСТИЖЕНИЯ И ПЕРСПЕКТИВЫ
Клеточная инженерия — это один из основных разделов современной биотехнологии, основанный на выделении и культивировании тканей и клеток высших многоклеточных организмов.
Культивирование тканей и клеток происходит вне организма— in vitro («в пробирке, в колбе, в стеклянной посуде»), в специально подобранных условиях.
КЛЕТОЧНО-ТКАНЕВЫЕ КУЛЬТУРЫ РАСТЕНИЙ
Основным типом культивируемой растительной клетки является каллусная — это наименее дифференцированная ткань, которая в обычных условиях возникает при повреждениях и функционирует непродолжительное время. Каллус получают из паренхимы корнеплодов, стеблей, листьев, а также из гаплоидных тканей пыльников. Культивирование клеток растений производят или поверхностным способом, или в жидкой питательной среде. В любом случае необходимо подобрать определенное соотношение компонентов питательной среды. В состав питательной среды обязательно входят: углеводы (сахароза или глюкоза), минеральные соли, витамины, регуляторы роста и развития (определенные фитогормоны); иногда добавляют дрожжевой экстракт или растительные экстракты. Поддерживается определенная температуры, кислотность, газовый состав.
КЛЕТОЧНО-ТКАНЕВЫЕ КУЛЬТУРЫ ЖИВОТНЫХ
Основным типом культивируемой животной клетки являются опухолевые клетки «шеломы или саркомы (раковые клетки). В то же время культивированию поддаются и другие типы клеток: клетки селезенки, фибробласты соединительной ткани, гепатоциты печени, лимфоциты и т. д. Культуры опухолевых клеток практически бессмертны, они переносят неограниченное количество пассажей (пересевов на свежую питательную среду); длительность существования культур других тканей ограничена. Простейшей питательной средой для животных клеток служит сыворотка крови, но в ряде случаев используются полусинтетические и синтетические среды.
СОМАТИЧЕСКАЯ ГИБРИДИЗАЦИЯ. ГИБРИДОМЫ
Методы клеточной инженерии позволяют объединять различные типы клеток. Слияние клеток, принадлежащих к разным биологическим видам, называется соматической гибридизацией. Сущность соматической гибридизации заключается в получении синтетических культур путем слияния протопластов различных видов организмов. Для слияния клеток используют различные физические и химические методы. После слияния протопластов образуются многоядерные гетерокариотические клетки. В дальнейшем при слиянии ядер образуются синкариотические клетки, содержащие в ядрах хромосомные наборы разных организмов. При слиянии антителообразукицих клеток (например, В-лимфоцитов человека) и раковых клеток (например, клеток миеломы мышей) образуются гибридомы — клеточные гибриды, сохраняющие свойства лимфоцитов (способность к образованию строго определенных антител) и свойства раковых клеток (способность к неограниченному числу делений). Гибридомы вырабатывают однородные антитела, взаимодействующие со строго определенными возбудителями заболеваний или другими антигенами. Такие антитела называют моноклональными.
ЗНАЧЕНИЕ КЛЕТОЧНОЙ ИНЖЕНЕРИИ
- Применение клеточных культур позволяет преодолеть многие проблемы биоэтики (биологической этики), связанные с умерщвлением животных. Поэтому культуры клеток широко используются в научных исследованиях.
- В культуре можно выращивать строго определенные клетки в неограниченном количестве. Поэтому культуры клеток и тканей, выделенные из природного материала, широко используются при промышленном производстве биологически активных веществ. В частности, на клеточно-тканевом уровне выращиваются женьшень, родиола розовая и другие лекарственные растения.
- Из апикальных меристем путем микроклонирования получают посадочный материал ценных сортов растений, свободный от многих болезней (например, от вирусов и микоплазм), в частности, безвирусный посадочный материал цветочных и плодово-ягодных культур. На питательной среде размножают и каллусные ткани, которые в дальнейшем дифференцируются с образованием целостных растений.
- Решаются проблемы получения отдаленных гибридов растений. Во-первых, путем соматической гибридизации можно скрещивать растения, которые не скрещиваются обычным путем. Во-вторых, полученные отдаленные гибриды можно воспроизводить, минуя семенное размножение и мейотический фильтр.
- На культурах клеток получают вакцины, например, против кори, полиомиелита. В настоящее время решается вопрос крупномасштабного производства моноклональных антител на основе гибридомных культур.
- Сохраняя культуры клеток, можно сохранять генотипы отдельных организмов и создавать банки генофондов отдельных сортов и даже целых видов, например, в виде мериклонов (культур меристем).
- Манипуляции с отдельными клетками и их компонентами используются для клонирования животных. Например, ядра из клеток кишечного эпителия головастика внедряются в энуклеированные яйцеклетки лягушки. В результате из таких яйцеклеток развиваются особи с генетически идентичными ядрами.
1.3.2. ГЕННАЯ ИНЖЕНЕРИЯ: ДОСТИЖЕНИЯ И ПЕРСПЕКТИВЫ.
ВОЗМОЖНОСТИ КОРРЕКЦИИ ГЕНОТИПА
ПРИ ГЕНЕТИЧЕСКИХ ЗАБОЛЕВАНИЯХ
Генная инженерия представляет собой совокупность методов, позволяющих создавать синтетические системы на молекулярно-биологическом уровне.
Генная инженерия дает возможность конструировать функционально активные структуры в форме рекомбинантных ДНК вне биологических систем (in vitro), а затем вводить их в клетки.
Генная инженерия возникла в 1972 г., когда в лаборатории П. Берга (Станфордский университет, США) была получена первая рекомбинантная (гибридная) ДНК (рекДНК), в которой были соединены фрагменты ДНК фага лямбда и кишечной палочки с кольцевой ДНК обезьяньего вируса SV40. С конца 80-х гг. XX в. генетически модифицированные растения начинают использоваться в сельском хозяйстве.
Методы генной инженерии основаны на получении фрагментов исходной ДНК и их модификации.
Для получения исходных фрагментов ДНК разных организмов используется несколько способов:
- получение фрагментов ДНК та природного материала цугом разрезания исходной ДНК с помощью специфических нуклеаз (рестриктаз);
- прямой химический синтез ДНК, например, для создания зондов;
- синтез комплементарной ДНК (кДНК) на матрице мРНК с использованием фермента обратной транскриптазы (ревертазы).
Определение нуклеотидного состава фрагментов ДНК производится с помощью радиоактивных зондов — молекул ДНК с заранее известной структурой, в состав которых входят радиоактивные изотопы фосфора или водорода. Если структура выделенного фрагмента хотя бы частично комплементарна структуре зонда, то происходит ДНК–ДНК–гибридизация, и на микрофотографии препарата появляется засветка от радиоактивного изотопа.
Выделенные участки ДНК встраивают в векторы переноса ДНК. Векторы — это небольшие молекулы ДЕК, способные проникать в другие клетки и реплицироваться в них.
В состав вектора входит не менее трех групп генов.
- Гены, которые интересует экспериментатора.
- Гены, отвечающие за репликацию вектора.
- Гены-маркеры, по деятельности которых можно судить об успешности трансформации (например, гены устойчивости к антибиотикам или гены, отвечающие за синтез белков, светящихся в ультрафиолетовом свете).
Для внедрения векторов в прокариотические или эукариотические клетки используют различные способы.
- Биотрансформация. Используются векторы, способные сами проникать в клетки. Частным случаем биотрансформации является агро- бактериальная трансформация.
- Микроинъекции. Используются, если клетки, подлежащие трансформации, достаточно крупные (например, икринки, пыльцевые трубки).
- Биобаллистика (биолистика). Векторы «вбивают» в клетки с помощью специальных «пушек».
В качестве векторов часто используют плазмиды — кольцевые молекулы ДНК прокариотических клеток, а также ДНК вирусов. У эукариот в качестве векторов используют мобильные генетические элементы — участки хромосом, способные образовывать множество копий и встраиваться в другие хромосомы. В составе одного вектора можно комбинировать различные фрагменты ДНК (различные гены). Вновь образованные фрагменты ДНК называют рекомбинантными.
Природа создала естественный инструмент для переноса генов в растения — плазмиды агробактерий.
Плазмиды — это кольцевые молекулы ДНК, способные размножаться (реплицироваться) в клетке независимо от цикла размножения клетки. «Дикие» плазмиды очень широко распространены в природных бактериальных популяциях и способны передаваться от одной бактериальной клетки к другой в процессе конъюгации — аналога полового размножения. Плазмиды несут гены устойчивости к антибиотикам, гены ферментов, необходимых для утилизации необычных органических веществ и другие полезные гены, выгодные бактериальным клеткам. Плазмиды стали настоящим подарком для молекулярных биологов, сейчас на их основе созданы многие современные «векторные» системы, используемые в генной инженерии. Векторами называют искусственно полученные из вирусов и плазмид кольцевые молекулы ДНК, способные переносить целевые гены от одной клетки к другой по желанию экспериментатора.
Агробактерии обладают уникальным механизмом, благодаря которому определенный фрагмент плазмиды, называемый т-ДНК, переходит в ядро растительной клетки и становится частью хромосомной ДНК.
Используя это свойство, исследователи нагружают т-ДНК целевыми генами и получают возможность переносить их в геном растений сравнительно быстро, эффективно и просто.
На рисунке 4 показано, как воздействуют на микроорганизм (в данном случае на бактерию), заставляя ее синтезировать желаемое вещество. Кроме ДНК, в своем клеточном ядре бактерия (1) содержит плазмиду, представляющую собой молекулу ДНК кольцевой формы, которая находится вне ядра в цитоплазме.
Рекомбинация ДНК
Эта плазмида изолируется (2) и с помощью рестриктирующего фермента раскрывается в точно определенном месте (3). Тем временем с помощью других рестриктирующих ферментов из ДНК другого организма выделяют гены, определяющие синтез желаемого вещества (4). С помощью других ферментов этот ген встраивают в ранее открытую плазмиду (5). Плазмиду возвращают назад в бактерию (6). После этих манипуляций бактерии помещают в культуральную среду, где они синтезируют желаемое вещество (7).
Векторы переноса ДНК вместе с внедренными фрагментами ДНК различными способами вводят в прокариотические или эукариотические клетки и получают трансгенные клетки. В ходе размножения трансгенных клеток происходит клонирование требуемых фрагментов ДНК, в частности отдельных генов. Клонированные гены эукариот подвергают различным модификациям (например, добавляют перед ними сильные промоторы) и внедряют в клетки-продуценты. Основная проблема состоит в том, чтобы чужеродные гены экспрессировались постоянно, т. е. должен происходить синтез необходимых веществ без ущерба для клетки-хозяина.
Практические достижения современной генной инженерии заключаются в следующем:
- созданы банки генов, или клонотеки, представляющие собой коллекции клонов бактерий. Каждый из этих клонов содержит фрагменты ДНК определенного организма (дрозофилы, человека и др.);
- на основе трансформированных штаммов вирусов, бактерий и дрожжей осуществляется промышленное производство инсулина, интерферона, гормональных препаратов. На стадии испытаний находится производство белков, позволяющих сохранить свертываемость крови при гемофилии, и других лекарственных препаратов;
- созданы трансгенные высшие организмы (некоторые рыбы и млекопитающие, многие растения) в клетках которых успешно функционируют гены совершенно других организмов. Широко известны генетически модифицированные растения (ГМР), устойчивые к высоким дозам определенных гербицидов, а также Bt-модифицированные растения, устойчивые к вредителям;
- разработаны методы клонирования строго определенных участков ДНК, например, метод полимеразной цепной реакции (ПЦР). ПЦР-технологии применяются для идентификации определенных нуклеотид- ных последовательностей, что используется при ранней диагностике некоторых заболеваний, например, для выявления носителей ВИЧ-инфек- ции.
Возможности генной инженерии практически безграничны. В настоящее время интенсивно изучается возможность коррекции генома человека (и других организмов) при генетических и негенетических заболеваниях.
Рассмотрим несколько примеров.
Нынешний этап развития генетической инженерии растений получил название «метаболическая инженерия». При этом ставится задача не столько улучшить те или иные имеющиеся качества растения, как при традиционной селекции, сколько научить растение производить совершенно новые соединения, используемые в медицине, химическом производстве и других областях. Этими соединениями могут быть, например, особые жирные кислоты, полезные белки с высоким содержанием незаменимых аминокислот, модифицированные полисахариды, съедобные вакцины, антитела, интерфероны и другие «лекарственные» белки, новые полимеры, не засоряющие окружающую среду, и многое, многое другое. Использование трансгенных растений позволяет наладить масштабное и дешевое производство таких веществ и тем самым сделать их более доступными для широкого потребления.
Важнейшим сырьем для получения разного рода химических веществ являются жирные кислоты — основной компонент растительного масла. В 1995 г. была закончена экспериментальная проверка и получено разрешение от федеральных властей США на выращивание и коммерческое использование трансгенных растений рапса с измененным составом растительного масла, включающего вместе с обычными 16- и 18-член- ными жирными кислотами также и до 45% 12-членной жирной кислоты — лаурата. Это вещество широко используется для производства стиральных порошков, шампуней, косметики. Экспериментальная работа заключалась в том, что был клонирован ген специфической тиоэстеразы из растения Umbellularia califonica, где содержание лаурата в жире семян достигало 70%. Структурная часть гена этого фермента под контролем промотора-терминатора гена белка, специфического для ранней стадии семяобразования, была встроена в геном рапса и арабидопсиса, что и привело к увеличению содержания лаурата в масле этих растений.
Для борьбы с насекомыми-вредителями в растениеводстве используются химические средства — инсектициды. Однако они оказывают вредное влияние на млекопитающих, убивают и полезных насекомых, загрязняют окружающую среду, дороги, и, кроме того, насекомые довольно скоро приспосабливаются к ним. Известно более 400 видов насекомых, устойчивых к используемым инсектицидам. Поэтому все большее внимание привлекают биологические средства борьбы, обеспечивающие строгую избирательность действия и отсутствие адаптации вредителей к применяемому биопестициду.
Уже довольно давно известна бактерия Bacillus thuringiensis, продуцирующая белок, являющийся очень токсичным для многих видов насекомых, в то же время безопасный для млекопитающих. Белок (дельта-эндотоксин, СЛГ-белок) продуцируется различными штаммами В. thuringiensis. Взаимодействие токсина с рецепторами строго специфично, что усложняет подбор комбинации токсин-насекомое. В природе найдено большое количество штаммов В. thuringiensis, чьи токсины действуют только на определенные виды насекомых. Препараты В. thuringiensis в течение десятилетий использовали для контроля насекомых на полях. Безопасность токсина и его составных белков для человека и других млекопитающих полностью доказана. Встраивание гена этого белка в геном растений дает возможность получить трансгенные растения, не поедаемые насекомыми.
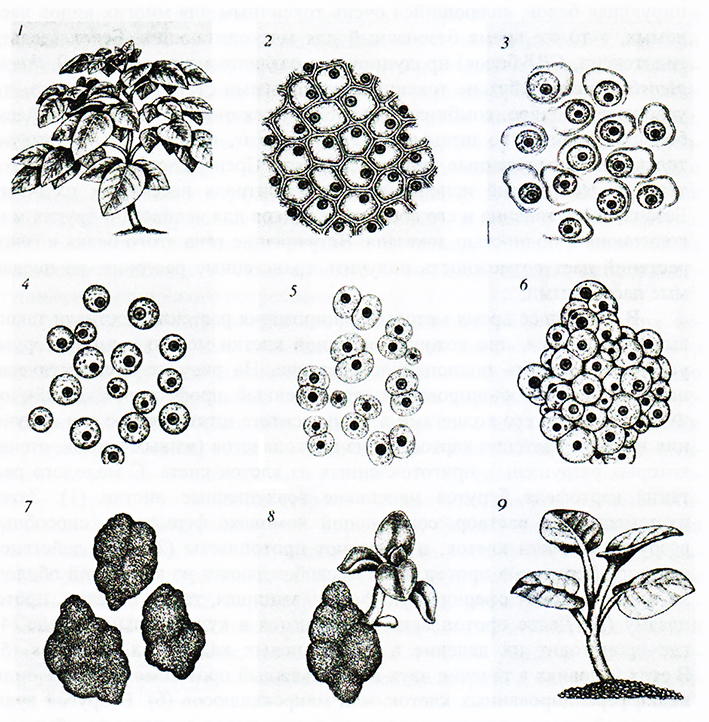
В настоящее время методы клонирования растений достигли такого высокого уровня, при котором из одной клетки можно в лабораторных условиях получить полноценное растение. На рисунке 5 схематически показан процесс клонирования, примененный профессором Джеймсом Ф. Шепардом и его коллегами в Университете штата Канзас для получения полного растения картофеля из протопластов (живых клеток, стенки которых разрушены), приготовленных из клеток листа. С молодого растения картофеля берутся маленькие верхушечные листки (1). Затем их помещают в раствор, содержащий комплекс ферментов, способных разрушать стенки клеток, и получают протопласты (2). Под действием раствора ферментов протопласты высвобождаются из клеточной оболочки и приобретают сферическую форму, защищая, таким образом, протоплазму (3). Далее протопласты развиваются в культуральной среде (4), где происходит их деление и синтез новых клеточных оболочек (5). В этих условиях в течение двух недель каждый протопласт дает колонию недифференцированных клеток, или микрокаллюсов (6). В другой культуральной среде эти микрокаллюсы развиваются в каллюсы обычного размера (7); их клетки начинают дифференцироваться, образуя примордиальный побег (8). В третьей культуральной среде этот побег развивается в уже имеющее корни растеньице, которое высаживается в почву (9). При соответствующих условиях могут быть слиты протопласты двух различных растений, в результате чего получается клетка, обладающая генами растений, которые не поддаются скрещиванию классическими методами. Такое развитие растения из слившихся протопластов двух различных растений получило название «процесс соматической гибридизации».
Соматическая гибридизация картофеля
Лечение заболеваний с помощью генов получило название генотерапии. Сейчас в мире насчитывается порядка 400 проектов, посвященных лечению с помощью генотерапии. Заместительная генотерапия заключается во вводе в клетку неповрежденного гена. Внесенная копия заменит по функциям сохранившийся в геноме больного дефектный ген. Все проводимые сегодня клинические испытания используют внесение в клетку дополнительных количеств ДНК.
При корректирующей терапии предполагается замена дефектного гена нормальным в результате рекомбинации. Пока этот метод на стадии лабораторных испытаний, так как эффективность его еще очень низка, но последние исследования показывают успехи в лечении некоторых заболеваний.
Амавроз Лебера — врожденная слепота, редкая форма наследственного заболевания, которое проявляется уже в младенчестве. Из-за дефектного гена — Retinal Pigment Epithelium, 65 kDa (RPE65) — в сетчатке умирают и не восстанавливаются светочувствительные клетки. По статистике, от амавроза Лебера страдает один человек на 81 тысячу. Болезнь сопровождается ослаблением или полной потерей зрения без анатомического нарушения структуры органов. Традиционная лекарственная терапия бессильна в борьбе с этим заболеванием. На помощь пришла генотерапия. Исследователи из США и Англии делали инъекцию вирусного вектора, содержащего исправленный ген в один глаз пациентов, страдающих амаврозом Лебера. Вектор содержал фермент, необходимый для продукции светочувствительного пигмента, и вводился в эпителий пигментного слоя сетчатки. В первом исследовании у всех 12 пациентов светочувствительность в «пролеченном» глазу вернулась. У 4 детей зрение восстановилось до такой степени, что они могли заниматься спортом и нормально учиться в школе. Кроме того, были проведены исследования на саймири (беличьи обезьянки), страдающих дальтонизмом. Инъекция «исправленных» генов вернула им полное цветовое зрение.
Список наследственных заболеваний, которые пытаются или планируют лечить генами, велик. Это и ревматоидный артрит, и фенилкетонурия, и заболевания, связанные с недостатком гормонов (инсулина, эритропоэтина, гормона роста). В случае хронической анемии, связанной с дефицитом эритропоэтина, на основании опытов на животных предлагается принципиально новый подход к лечению. Так как каждая из наших клеток содержит один и тот же геном, можно заставить фибробласты кожи, которые в норме не производят эритропоэтина, синтезировать этот гормон. Для этого нужно ввести в геном новую контролирующую область и тем самым снять запрет со считывания (экспрессии) гена эритропоэтина, присутствующего, но «молчащего» в фибробластах.
Практически в любой области медицины либо начаты клинические испытания лечения наследственных заболеваний с помощью генотерапии, либо в опытах на животных разрабатываются подходы к такому лечению. По мере усовершенствования методов доставки генов и контроля их экспрессии список заболеваний, к которым можно применять генотерапию, будет, безусловно, расширяться.
Генотерапия применима не только к наследственным заболеваниям. Предстоит решить проблему лечения генами «чумы XX века» — синдрома приобретенного иммунодефицита (СПИД), возникающего при заражении вирусом иммунодефицита человека (ВИЧ). ВИЧ представляет собой ретровирус, поражающий Г-лимфоциты и макрофаги. Болезнь удалось бы победить, если бы были найдены новые гены, введение которых в зараженные ВИЧ лимфоциты останавливало бы дальнейшее размножение вируса. Предложено множество хитроумных способов борьбы со СПИДом с помощью привнесенных генов. Все они основаны на новейших данных о строении и функционировании генома ретровируса. Например, вводя прямо в мышцы больного ретровирусные векторы, несущие отдельные гены ВИЧ, ученые рассчитывали на то, что гены ВИЧ после внедрения в ДНК хромосом хозяина смогут дать информацию для синтеза вирусных белков и произойдет «противоСПИДная» иммунизация больного этими белками. Однако еще не получено ощутимых результатов, которые сулили бы успех в борьбе с вирусом дикого типа, коварство которого заключается в его изменчивости.
Огромные перспективы открывает использование генотерапии для лечения онкологических заболеваний. Трансгенных животных можно использовать для изучения наследственных заболеваний мозга и нервной системы. Гены болезни Альцгеймера (отложение белка р-амилоида приводит к образованию характерных бляшек) и гены, отвечающие за развитие эпилепсии, болезней мозга вводятся в геном нормальных животных; при этом получают трансгенных животных-моделей, на которых можно испытывать различные терапевтические приемы.
Трансгенных животных стали использовать для исследования воспалительных и иммунологических заболеваний человека, например, ревматоидного артрита. Моделируются болезни, связанные с липидным обменом.
1.3.3. МИКРОБИОЛОГИЧЕСКИЙ СИНТЕЗ
В биотехнологии обычно используются чистые культуры микроорганизмов-продуцентов, так как это позволяет получить продукт с заранее известными свойствами. Применяются штаммы микроорганизмов — микроорганизмы одного вида, выращенные в определенных условиях, вследствие чего обладающие определенными свойствами, которые отличаются от других чистых культур данного вида.
Не все микроорганизмы могут быть использованы в промышленных условиях, а лишь микроорганизмы-продуценты, обладающие способностью под воздействием внешних факторов (состава среды, условий культивирования, температуры, рН среды и т. д.) образовывать в больших количествах преимущественно то соединение, которое является главным (целевым) продуктом данного производства. К микроорганизмам-продуцентам предъявляется ряд требований. Микроорганизмы должны:
- расти на дешевых и доступных питательных средах;
- максимально усваивать питательные вещества среды;
- обладать высокой скоростью роста биомассы и давать высокий выход целевого продукта;
- проявлять синтетическую активность, направленную в сторону получения желаемого продукта; образование побочных продуктов должно быть незначительным;
- быть генетически однородными, стабильными в отношении продуктивности, требований к питательному субстрату и условиям культивирования;
- быть устойчивыми к фагам и другой посторонней микрофлоре;
- быть безвредными для людей (не обладать патогенными свойствами) и для окружающей среды;
- обладать хорошей способностью выделения.
Сверхсинтез — способность микроорганизма синтезировать определенный продукт в количествах, превосходящих физиологические потребности,— часто встречается в природе. Микроорганизмы с такими свойствами первыми были использованы в хозяйственной деятельности человека, и таким образом был проведен стихийный отбор наиболее продуктивных форм.
В промышленности применяют три вида штаммов: природные штаммы, нередко улучшенные естественным или искусственным отбором; штаммы, измененные в результате индуцированных мутаций; штаммы культуры, полученные методами генной или клеточной инженерии.
Часто путем отбора не удается получить высокоактивные продуценты, поэтому возникает задача изменения природы организма в нужном направлении. Для этого используют методы селекции. Селекция— это направленный отбор мутантов, т. е. микроорганизмов, наследственные признаки которых претерпели изменения в нужном для человека направлении.
Природные штаммы микроорганизмов не обладают способностью выделять и накапливать в питательной среде такое количество нужного продукта, которое обеспечило бы низкую его стоимость и требуемый объем производства. Поэтому задачей селекции является не только усиление природной способности микроорганизмов продуцировать определенное вещество (ферменты, антибиотики, аминокислоты и т. д.), но во многих случаях и создание продуцента «заново» из штамма дикого типа, способного синтезировать вещество, но не способного его продуцировать.
Эти задачи осуществляются получением у природных штаммов наследственных изменений — мутаций, влияющих на фенотип (физиологические и морфологические признаки) клетки. Спонтанные (происходящие случайным образом) мутации помогают микробным популяциям приспосабливаться к новым условиям существования. Мутации приводят к усилению природной способности микроорганизмов синтезировать и продуцировать определенное вещество, а также к появлению новой способности— синтезировать вещество в избытке (сверх своих потребностей) и продуцировать его.
Для ускорения селекции используют индуцированный мутагенез, применяя мутагенные факторы физической, химической и биологической природы. К универсальным физическим мутагенам относятся ультрафиолетовое облучение (УФО), рентгеновские лучи и др.; химические факторы мутагенного воздействия — азотистый иприт, нитрозамины, четыреххлористый углерод и другие химикаты; биологическими мутагенами являются фаги (вирусы микроорганизмов).
Таким образом, селекционированные штаммы микроорганизмов обладают определенными ценными наследственно закрепленными свойствами.
Источник