- Как тестируют лекарства?
- Обзор
- Подберите мне лекарство
- Опыты на животных
- Испытания на добровольцах
- Другие статьи по темам:
- ЧТО ТАКОЕ КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ?
- Клинические исследования как необходимость научной точности
- Четыре фазы клинических испытаний
- Фармацевтические компании, исследователи, врачи и пациенты — все вовлечены!
- Обеспечение прозрачности результатов в строгих правовых рамках
- ВПЕРЕДИ НОВЫЕ ЗАДАЧИ
- Читайте также
Как тестируют лекарства?
Обзор
Морфин, героин, эфедрин, мышьяк и свинец — не так давно эти вещества продавались как лекарства и назначались в качестве средств от кашля, боли или воспаления. Тестировать их сразу in vivo пришлось детям, беременным женщинам и остальным пациентам. О побочных эффектах тогда задумывались мало, альтернативных лекарств не было.
Сейчас от появления нового вещества, перспективного в плане решения каких-либо медицинских проблем до его регистрации в качестве лекарственного препарата проходит около 10-12 лет. За это время вещество подвергается сотням тестов и экспериментов. Но и после обретения торгового названия и своего места на аптечной полке лекарство многократно проверяют.
Современное тестирование лекарств обеспечивает защиту от токсичных, фальсифицированных и неэффективных препаратов. Но главная цель исследований лекарственных препаратов — поиск новых полезных свойств, расширение показаний, открытие новых лекарственных субстанций для лечения тех болезней, которые пока остаются не побежденными.
Подберите мне лекарство
Откуда берутся новые лекарства? Нередко их получают простым подбором «на заказ». Мишенью действия большинства фармпрепаратов являются белковые рецепторы или ионные каналы в оболочках клеток. Меняя структуру мишени, лекарство вызывает ряд желаемых эффектов. Если мы знаем строение рецептора, подобрать к нему «ключ» — дело техники. С помощью виртуального моделирования и роботов-лаборантов современная техника решает этот вопрос быстрее человека. Как это происходит?
После того, как определена точка приложения будущего лекарства, компания-разработчик приобретает подходящую под свои требования библиотеку химических веществ, которая может содержать сотни и тысячи различных соединений, обладающих похожими свойствами. Вещества тестируют, добавляя в тысячи микропробирок, где содержатся одинаковые белки-мишени или культуры клеток. Пробирки, где замечена биологическая активность, отбирают для дальнейших экспериментов и постепенно выделяют десяток наиболее перспективных прототипов для будущего лекарства. Их отправляются на стадию доклинических испытаний. Перебор вручную занял бы несколько человеческих жизней. С помощью работающей без перерывов и выходных роботизированной пипетки и компьютерного анализа поиск новых лекарств значительно ускоряется.
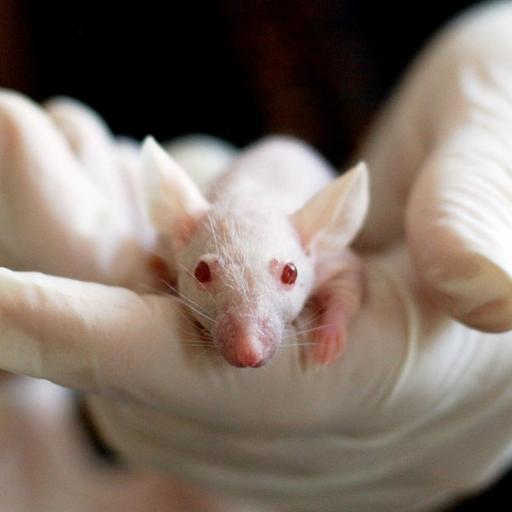
Опыты на животных
Доклинические испытания — это масштабный этап исследования кандидатов в лекарства. Он может длиться до 10 лет и проводится преимущественно на животных. Некоторые тесты, например при исследовании мутагенности, традиционно выполняют на культурах клеток, бактериях, мухах дрозофилах или аквариумных рыбках. В продвинутых лабораториях отдельные эксперименты научились моделировать в виртуальной реальности. Однако основные испытуемые — это грызуны: мыши, крысы, хомяки, морские свинки и кролики. Ряд тестов требует участия более крупных млекопитающих: собак, обезьян, реже — мини-пиги, кошек, хорьков и др.
Исследование проводится на здоровых животных обоих полов, отобранных по возрасту, размерам и происхождению. Испытуемых содержат в стандартизованных условиях, кормят и поят строго по режиму одинаковой пищей. Если будущее лекарство предназначено для детей, то исследования проводят на детенышах, лекарства для беременных испытывают на беременных самках, препараты геронтологической практики — на стареющих животных.
Цель доклинических исследований:
- Отсеять вещества, непригодные для дальнейших испытаний из-за токсичности, канцерогенности или других свойств.
- Определить «стартовую» безопасную дозу препарата для использования в первой фазе клинических исследований на людях.
- Оценить соотношение польза/риск для каждого кандидата в лекарства.
Важнейший аспект доклинических испытаний — проверка вещества на вредность. Начинают с определения дозы: нормальной переносимой, токсической и летальной. Определяют, какие органы и ткани животных оказываются более подвержены действию препарата? Какие побочные эффекты вызывает вещество?
Сначала препарат вводят с короткими 3-6-часовыми промежутками в течение суток и отслеживают результаты острой токсичности. Затем приступают к тестированию хронической токсичности. Эта часть исследования зависит от предполагаемой продолжительности лечебного курса у человека и может длиться от нескольких недель до года и более.
Далее испытывают влияние препарата на фертильность у самцов и самок животных. Определяют эмбриотоксичность и фетотоксичность — отрицательное влияние вещества на эмбрион, плод, а также отслеживают рост и развитие детенышей после рождения. Отдельно изучают мутагенность — способность вызывать мутации у взрослого животного и канцерогенность — вероятность злокачественных опухолей.
Сведения о канцерогенности вещества обязательно необходимы для получения разрешения на клинические исследования в нашей стране. Лекарства, которые будут продаваться без рецепта или предназначенные для длительного использования тестируются с особой тщательностью. Например, гормональные препараты проходят тестирование на канцерогенность около 7-10 лет, и подопытными, помимо крыс и мышей, должны быть собаки или обезьяны.
Данные проверки на вредность являются опорными для последующих экспериментов. Существуют коэффициенты пересчета доз исходя из массы тела. Ориентируясь на эти цифры можно проецировать влияние препарата на человека.
Второй аспект доклинических исследований — фармакокинетика — путь, который проделывает вещество в организме: как всасывается, как распределяется, вступает ли в химические превращения, какими органами и с какой скоростью выводится. Знание фармакокинетики дает представление о достижимой концентрации вещества в крови, а значит, позволяет точнее подобрать эффективную дозу для человека, выбрать оптимальную форму введения препарата в организм: через рот или с помощью инъекций.
Третий вопрос, на который отвечают лабораторные изыскания — предположительная эффективность кандидата в лекарства. Методология этой части исследования значительно отличается в зависимости от целевой сферы применения вещества. Например, при тестировании нейролептиков у животных исследуют их поведенческие реакции и двигательную активность. Для тестирования сердечных лекарств проводят испытания на собаках, кошках или обезьянах, у которых искусственно нарушают кровообращение сердца, имитируя стенокардию.
На территории России принят единый стандарт проведения доклинических исследований — ГОСТ 33044-2014, который соответствует международному стандарту GLP (Good Laboratory Practice — «Надлежащая лабораторная практика»). Только успешно прошедшие все фазы доклинических исследований кандидаты допускаются к изучению на людях, в среднем это 2 вещества из 100, остальные отбраковываются как слишком вредные или неэффективные. С учетом этих цифр трудно переоценить значение лабораторных животных в медицинской науке.
Испытания на добровольцах
«По-взрослому» будущие лекарства испытывают на здоровых и больных людях, которые должны добровольно выразить свое согласие на участие в эксперименте после того, как ознакомятся со всеми «за» и «против». Для здоровых людей аргументом «за» чаще является финансовая заинтересованность — за участие в клинических исследованиях можно заработать в среднем 15-20 тысяч рублей.
Здоровых добровольцев привлекают на клинические исследования 1 фазы. Группа подопытных здесь не более 100 человек. Людям дают различные дозы препарата и динамически определяют его концентрацию в крови, отслеживают побочные действия и их связь с дозой. Таким образом уточняют максимальную безопасную дозировку у человека. На этом этапе отсеиваются около 30% веществ.
Быстрым и дешевым видом клинического испытания является исследование на биоэквивалентность. Такие тесты применяют для регистрации дженериков — копий оригинальных лекарственных препаратов. Исследования биоэквивалентности проводят на небольшой группе из 12-24 здоровых добровольцев. Испытуемым вводят новый препарат и в течение 1-2 дней берут пробы крови с определенным интервалом. После измерения концентрации вещества в крови строят график и сравнивают его с таковым у оригинального лекарства. Успешные испытания биоэквивалентности позволяют считать схожими данные о токсичности и эффективности воспроизведенной копии и оригинального препарата. Таким образом, производитель дженерика не тратит время и деньги на полный цикл исследования лекарственного препарата. Все, что нужно — это доказать идентичность оригинальному лекарству.
2 фаза клинических испытаний — исследование на группе больных из 100-200 человек. Люди с различными заболеваниями обычно становятся участниками испытаний по рекомендации врача. Медицинское обследование на протяжении эксперимента, все виды лечения по профилю исследования в этом случае бесплатные. Для некоторых пациентов участие в клинических испытаниях — это шанс отстоять свою жизнь у смертельного заболевания, так как получить еще незарегистрированный и потенциально более эффективный лекарственный препарат другим путем невозможно.
Во время 2 фазы препарат используют в терапевтических дозировках и оценивают его эффективность, а также выявляют оставшиеся незамеченными ранее побочные эффекты. Требования к качеству 2 фазы значительно выше. В идеале это рандомизированные двойные слепые исследования с плацебо-контролем. Рандомизированные — значит всех участников делят на группы случайным образом, а не по желанию врача. Одна из групп будет получать вместо лекарства пустышку — плацебо. Двойное слепое — значит ни пациенты, ни врачи, участвующие в эксперименте, не будут знать о том, кто какое лечение получает. Для этого плацебо и традиционные препараты должны выглядеть одинаково, а данные о них и пациентах шифруются. Если препарат оказался эффективнее плацебо, лекарство допускают до следующего этапа. Отсев на этом этапе — около 70% вступивших в него веществ.
3 фаза — самая ответственная для кандидата. Успешно прошедшие его получают регистрацию в качестве лекарственного препарата. В 3 фазе участвуют от нескольких сотен до 3000 людей с соответствующим заболеванием. Главная цель — сравнить эффективность вещества с уже имеющимися препаратами или методами лечения. Исследование, как и на предыдущей фазе, должно соответствовать рандомизированному с двойным ослеплением. Заключительный этап испытаний преодолевают в среднем не более 30% кандидатов. Однако и после регистрации лекарства продолжают тестировать.
Каждый участник исследования подписывает договор, в котором указаны все риски, а также условия эксперимента. Организация, которая проводит клинические исследования обязана застраховать жизнь и здоровье каждого участника исследования за собственный счет. Сумма страховки составляет от 300 тысяч до 2 млн в случае смерти.
4 фаза — это исследования зарегистрированного препарата, который уже используется в качестве лекарства. Положительные результаты 4 фазы клинических испытаний обычно используются фирмой производителем в маркетинговых целях, отрицательные часто умалчиваются и не публикуются. Пострегистрационные исследования не являются обязательными. Они необходимы, когда есть потребность расширить показания для применения лекарства, если обнаружились его дополнительные полезные свойства. Иногда компании-производители проводят дополнительные исследования в пострегистрационном периоде для того, чтобы привести досье препарата к единому международному стандарту. То есть выполняют те исследования, которые ранее были необязательны или невозможны.
В нашей стране проведение клинических исследований стандартизировано по ГОСТ Р 52379-2005, что соответствует международному стандарту GCP (Good Clinical Practice — «Надлежащая клиническая практика»).
Фармкомпании далеко не всегда занимаются процедурой тестирования лекарств самостоятельно. Нередко они выступают лишь в роли заказчика, а исполнителем являются сторонние исследовательские организации, которые обеспечивают весь цикл от лабораторных испытаний до регистрации лекарства или только отдельные этапы этого процесса, что ускоряет рождение нового лекарства в среднем на 30%. Являются ли результаты исследований, выполненных с помощью аутсорфинга, более объективными — вопрос. Ведь исполнитель находится в прямой финансовой зависимости от заказчика.
После регистрации лекарства постоянно подвергаются контролю со стороны Росздравнадзора. Для проверки выборочно изымаются образцы препаратов прямо на производстве (для отечественных средств), при пересечении границы (для импортных лекарств), а также непосредственно в аптеках и больницах. Эксперты контролируют условия производства и хранения лекарств, проверяют подлинность документации, соответствие упаковки установленным правилам, а также исследуют состав лекарственных препаратов обычными химическими методами и с помощью спектроскопии.
Препараты, которые официально признаны лекарствами на территории нашей страны, проходят серьезную проверку перед выходом на фармацевтический рынок и после. Чем солиднее возраст лекарственного средства, тем лучше изучено его влияние на здоровье человека, тем выше его безопасность. Однако по эффективности старые лекарства нередко уступают вновь зарегистрированным, чьи отдаленные «побочки» нам еще предстоит испытать на себе.
Другие статьи по темам:
Все материалы сайта были проверены врачами. Однако, даже самая достоверная статья не позволяет учесть все особенности заболевания у конкретного человека. Поэтому информация, размещенная на нашем сайте, не может заменить визита к врачу, а лишь дополняет его. Статьи подготовлены для ознакомительных целей и носят рекомендательный характер. При появлении симптомов, пожалуйста, обратитесь к врачу.
Источник
ЧТО ТАКОЕ КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ?
Клинические исследования проводятся с участием людей и относятся к серии научных исследований, которые необходимо выполнить для разработки новых лекарств.
Они подлежат строгому регулированию и являются важнейшим этапом в процессе регистрации лекарственного средства и определении методов его оптимального применения для обеспечения терапевтического эффекта у пациентов.
Клинические исследования могут длиться несколько лет и должны быть организованы в строгом соответствии с протоколом исследования, который гарантирует безопасность участников.
Клинические исследования как необходимость научной точности
Под клиническими исследованиями понимаются все научные исследования с участием людей, которые проводятся с целью оценки эффективности и безопасности нового лекарственного препарата / изделия медицинского назначения или расширения показаний к применению существующего на рынке лекарственного препарата / изделия медицинского назначения. 1 Клинические исследования проводятся квалифицированными специалистами в области медицины на базе стационаров или амбулаторно.
Клинические исследования используются для оценки безопасности и эффективности новых методов лечения, и являются обязательным условием для вывода лекарственного препарата на рынок. Они требуют применения строгого научного подхода, чтобы гарантировать как терапевтический эффект, так и безопасность участников. Помимо терапевтического интереса, клинические исследования также вносят вклад в развитие медицины и биологии. 2
Четыре фазы клинических испытаний
До начала клинических исследований с участием человека в обязательном порядке проводятся доклинические исследования, которые включают в себя тестирование изучаемой молекулы на животных.
Разработка нового лекарственного препарата обычно состоит из четырех последовательных фаз клинических исследований, целью которых является изучение действия препарата в организме человека и оценка его эффективности.
Фаза I: соответствует первому применению исследуемого препарата у человека и может длиться несколько месяцев.Молекула обычно тестируется в группе от 20 до 100 человек (здоровых добровольцев) для оценки переносимости и фармакокинетики (изучение того, что происходит с лекарством в организме). На этом этапе также определяется самая высокая и безопасная доза для применения у пациентов.
Фаза II: оценка эффективности препарата в группе от нескольких десятков до нескольких сотен пациентов. На этом этапе проверяется, активна ли молекула в лечении целевого заболевания, определяется оптимальная доза и регистрируются побочные эффекты.
Фаза III: часто упоминается как «ключевое исследование». Молекула тестируется на большей группе пациентов, состав которой может достигать нескольких тысяч человек. На этом этапе можно определить соотношение польза / риск и выработать меры предосторожности при дальнейшем использовании молекулы. По завершении этого этапа в органы здравоохранения может быть подана заявка на получение регистрационного удостоверения (РУ).
Фаза IV: проводится после получения регистрационного удостоверения. На этом этапе изучается переносимость и эффективность лекарства в долгосрочной перспективе. Постмаркетинговый мониторинг важен, потому что даже после многочисленных исследований определенные эффекты препарата могут быть не полностью изучены. 4
На данный момент только одна молекула из десяти проходит все вышеописанные стадии 3 . Однако процесс клинической разработки лекарств для лечения онкологических или редких заболеваний может быть ускорен путем уменьшения количества участвующих в исследованиях пациентов и объединения определенных фаз.
Фармацевтические компании, исследователи, врачи и пациенты — все вовлечены!
Клинические исследования обычно занимают несколько лет, а иногда могут длиться до десяти лет, и требуют ежедневных усилий всех вовлеченных в них сторон, направленных на поиск новых, жизненно важных для пациентов методов лечения.
Клинические исследования чаще всего инициируются и финансируются фармацевтическими компаниями. Все клинические исследования проводятся квалифицированными специалистами в соответствующей области медицины, которых называют исследователями. Они несут ответственность за надлежащее проведение исследования, за включение пациентов в исследование и за их безопасность. Что касается участников, то они всегда привлекаются на добровольной основе.
Обеспечение прозрачности результатов в строгих правовых рамках
Чтобы начать клиническое исследование, требуются различные разрешения от компетентных органов каждой страны. Сроки получения разрешений варьируются в различных странах: от 30 до более чем 200 дней. В Российской Федерации этот срок составляет около 90-100 дней.
Каждый участник должен получить всю информацию об исследовании в письменной форме (включая все преимущества и риски, связанные с исследованием) и должен дать свое согласие, подписав форму информированного согласия, прежде чем он/она сможет начать участие в исследовании. Этические аспекты медицинских исследований во всем мире регулируются Нюрнбергским кодексом и Хельсинкской декларацией 1964 года, а также их последующими редакциями.
Публикация результатов клинических исследований представляет большой интерес для медицинского и научного сообществ, поскольку помогает обеспечить прозрачность результатов, независимо от их характера. Хельсинская декларация гласит: «Каждое исследование с участием людей в качестве субъектов исследования должно быть зарегистрировано в публично доступной базе данных прежде, чем в него будет включен первый субъект».
ВПЕРЕДИ НОВЫЕ ЗАДАЧИ
- Ускорение исследований и получения регистрационного удостоверения.Столкнувшись с пандемией COVID-19, многие фармацевтические компании ведут настоящую «гонку вакцин» и стремятся ускорить исследования, чтобы в срочном порядке предоставить эффективную вакцину, доступную для всех.
- Повышенная потребность в прозрачности:в контексте, когда широкая общественность выражает недоверие к фармацевтической промышленности, заинтересованные стороны мобилизуются для большей прозрачности. Поскольку в Европе публикуется только половина результатов исследований 5 , было принято несколько нормативных актов, способствующих публикации результатов клинических испытаний.
- Цифровизация клинических испытаний. Ускорение перехода к цифровому формату – важная задача для всех заинтересованных сторон в сфере здравоохранения. Использование цифровых технологий в клинических исследованиях может быть целесообразным, поскольку это облегчит участие пациентов, живущих далеко от исследовательских центров, повысит их приверженность лечению (например, посредством уведомлений) и обеспечит доступ к данным в режиме реального времени.
- Пациент в центре исследований: . Они могут лучше всех рассказать о своем заболевании / состоянии, его течении и эффективности лечения, которое они получают. Вовлечение пациентов на как можно более раннем этапе позволяет ускорить клинические исследования и разработать методы лечения, которые наилучшим образом соответствует их потребностям.
А как в Сервье?
Клинические исследования Группы проводятся командами экспертов с применением высоких и строгих стандартов. Надлежащее проведение исследований требует слаженной работы команд, ответственных за международную координацию, и локальных команд в 18 странах, что позволяет организовывать клинические исследования во всем мире. Таким образом, глобализация процесса разработки лекарственных препаратов в Сервье играет фундаментальную роль в формировании научного имиджа компании и позволяет разрабатывать инновационные лекарства, соответствующие различным потребностям пациентов.
Чтобы создавать лекарственные препараты, которые наилучшим образом отвечали бы потребностям пациентов, Сервье стремится привлекать их к разработке лекарственных препаратов напрямую или через ассоциации пациентов: сюда включают обсуждение протоколов клинических исследований, разработку форм информированного согласия и брошюр для повышения осведомленности пациентов, получение отзывов пациентов после исследования и предоставление им адаптированных резюме исследования.
Цифровые технологии и данные повышают гибкость, эффективность и продуктивность, ускоряя процесс разработки лекарственных средств, итеративный алгоритм идентификации молекул и проведение клинических исследований, а также помогают лучше понимать пациентов. Для внедрения цифровых технологий в клинические исследования используется программа SCORE: она обеспечивает удаленную связь между пациентами и медицинскими и научными специалистами, позволяя им получать доступ к данным исследований в режиме реального времени, тем самым упрощая принятие решений. Платформа FEDERATES, которая в настоящее время находится в стадии разработки, повысит качество передачи информации и данных в режиме реального времени и ускорит проведение исследования на разных этапах.
5 Goldacre Ben, DeVito Nicholas J, Heneghan Carl, Irving Francis, Bacon Seb, Fleminger Jessica et al. Compliance with requirement to report results on the EU Clinical Trials Register: cohort study and web resource BMJ 2018; 362 :k3218
Читайте также
САХАРНЫЙ ДИАБЕТ 2 ТИПА — БОЛЕЗНЬ ОБРАЗА ЖИЗНИ
Источник