Лекарственные препараты, содержащие железо: классификация, применение, плюсы и минусы лекарств
ЖДА — очень распространенное состояние, встречается у 20-25% населения ( 1 ). Восполнить уже возникший дефицит железа продуктами питания невозможно, поскольку максимально возможное количество, которое может всосаться из пищи — 2,5 мг/сут ( 2 ), а для достижения лечебного результата необходимо обеспечить поступление элементарного железа в дозе от 100 до 300 мг в сутки, что возможно только из лекарственных препаратов железа ( 3 ).
Препаратов для восполнения недостатка железа в настоящее время много. По способу введения их можно разделить на пероральные и парентеральные. В данной статье подробно рассмотрим фармакологические особенности пероральных форм.
Согласно принятому стандарту для профилактики и лечения ЖДА основу терапии составляют пероральные ЛС, содержащие Fe.
Пероральные препараты принципиально делят на:
— препараты, содержащие двухвалентное железо (диссоциирующие соли);
— препараты трехвалентного железа (железосодержащие хелатные комплексы).
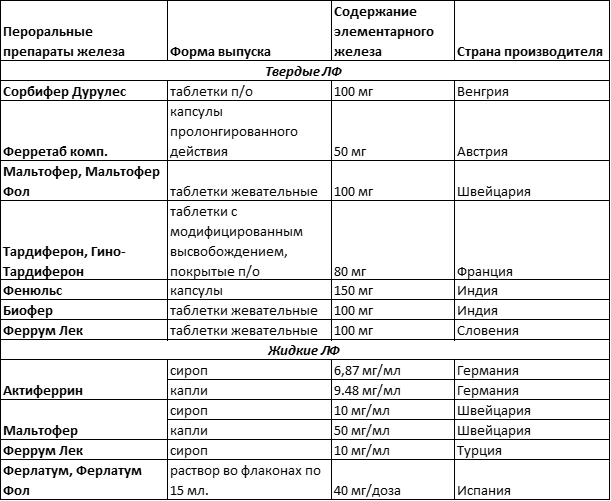
Табл. 1 Классификация пероральных препаратов железа
Препараты железа (II)
Плюсы: Двухвалентное железо поступает в кровь быстрее трехвалентного, поэтому препараты двухвалентного железа обеспечивают выраженный прирост гемоглобина, особенно в начале лечения ( 4 ).
Минусы:
- Пассивная диффузия железа из солевых препаратов обуславливает риск их передозировки. Это чревато развитием гемосидероза и гепатотоксичности. Высокий уровень сывороточного железа может привести к изменению иммунного статуса и обострению хронических инфекций.
- Соли железа взаимодействуют в кишечнике с компонентами пищи (кофе, чай, яйца, молоко и др.) и рядом ЛС. Пища снижает биодоступность солевых препаратов железа, поэтому их надо применять за 1 час до еды. Антациды, препараты кальция, тетрациклины, левомицетин, пеницилламин и пр. также затрудняют абсорбцию железа.
- При всасывании в кишечнике на этапе перехода из Fe ++ в Fe +++ из ионных соединений железа высвобождаются свободные радикалы, которые повреждающе действуют на слизистую. Возникают диспептические расстройства (тошнота, тяжесть, боль в эпигастрии, рвота, запор, диарея), крайней формой может стать некроз. Оксидативный стресс со стороны органов пищеварения наблюдается более чем у 20% больных при приеме солей двухвалентного железа.
- Также часто из нежелательных побочных реакций при приеме ионных ферропрепаратов встречаются покраснение кожи, металлический привкус во рту, снижение аппетита, потемнение зубов и десен.
- При плохой переносимости их можно принимать с пищей. При этом побочные явления уменьшаются, но ухудшается биодоступность.
Сульфат железа — классическое средство, до сих пор широко применяется при железодифицитных состояниях и считается эталоном по профилактической и лечебной эффективности. Основное соединение железа, входящее в большинство препаратов двухвалентного железа ( 5 ). Имеет наилучшую биодоступность, но часто плохо переносится пациентами ( 6 ).
Для наилучшей переносимости и защиты слизистой оболочки ЖКТ от раздражающего действия разработаны лекарственные формы с продленным действием. Специальная структура таблеток Сорбифер Дурулес, Тардиферон, Гино-Тардиферон способствует постепенному увеличению концентрации железа в сыворотке крови и исключает накопление местных патологических концентраций железа.
Фенюльс состоит из микродиализных гранул, заключенных в капсулу, что обеспечивает их равномерное высвобождение в ЖКТ. Однако при прохождении лекарственной формы в нижних отделах кишечника всасывания железа не происходит. Соответственно, это приводит к снижению биодоступности по сравнению с непролонгированным сульфатом железа. Кроме того, вопрос переносимости остается спорным. При приеме препаратов с контролируемым высвобождением – количество побочных реакций со стороны ЖКТ (тошнота, рвота, запоры, боль в эпигастрии) не уменьшается ( 7 ).
Фумарат железа (Ферретаб комп.) хорошо переносится. Пролонгированная форма представляет собой капсулу с тремя мини-таблетками железа фумарата и 1 мини-таблеткой фолиевой кислоты ( 8 ). Препарат выбора для профилактики и лечения ЖДА беременных.
Глюконат железа (Тотема) Переносится лучше железа сульфата. Медь и марганец в препарате увеличивают биодоступность железа, что позволяет снизить эффективную профилактическую дозу до 50 мг, а лечебную дозу до 100-200 мг (сравните: 100 мг и 100-300 мг для других железосодержащих препаратов). Медь и марганец также нормализуют усвоение железа тканями и блокируют образование свободных радикалов.
Nota Bene! Во избежание негативного воздействия на зубную эмаль жидкие препараты железа ( Тотема, Актиферрин ) рекомендуется принимать через трубочку.
Препараты железа (III)
Плюсы: Обладают лучшим профилем безопасности. Всасывание железа происходит путем активной контролируемой абсорбции, поэтому передозировка маловероятна ( 9 ). Можно принимать с едой, совмещать с другими ЛС, реже вызывают диспептические явления, не вызывают потемнения зубов.
Минусы:
- Меньшая биодоступность по сравнению с солевыми препаратами железа.
- При применении трехвалентного железа также возможны повреждения структурных элементов ЖКТ, а также различных органов и систем. В условиях аноксии при переходе железа из трех- в двухвалентное образуется гидроксил-радикал, который оказывает токсическое действие на печень, сердечно-сосудистую систему, вызывает дисфункцию гормональной, иммунной систем ( 10 , 11 ).
Табл. 2 Лекарственные формы препаратов железа
Комбинированные препараты железа
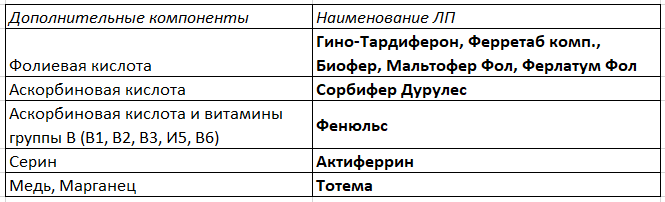
- Для повышения биодоступности железа в препараты добавляют стимулятор всасывания железа — аскорбиновую кислоту , которая препятствует окислению железа и поддерживает его в двухвалентной форме.
Nota Bene! Аскорбиновая кислота улучшает всасывание железа в ЖКТ только в том случае, когда ее содержание в препарате в 2–3 раза превышает содержание элементарного железа. Добавки аскорбиновой кислоты в малых дозах менее эффективны.
- Серин также является «носителем» железа, улучшает его всасывание и позволяет снизить дозировку.
- Микроэлементы марганец и медь стимулируют синтез гемоглобина и эритропоэз.
- Также в состав добавляют витамины группы В, которые способствуют усилению профилактического и лечебного эффекта препарата железа.
- Дефицит фолиевой кислоты, участвующей в поддержании нормального эритропоэза, часто сопутствует ЖДА, поэтому ее также добавляют в препараты железа.
Табл. 3 Комбинированные препараты железа
Обсудить последние новости со всеми коллегами России вы можете в чатах:
Источник
Современная фармакотерапия железодефицитных состояний
Наиболее распространенным нарушением питания в мире является дефицит железа, приводящий к развитию железодефицитных состояний. Различают три стадии дефицита железа: предлатентный, латентный и манифестный. Предлатентный дефицит железа характеризуется снижением запасов микроэлемента без уменьшения расходования железа на эритропоэз. Латентный дефицит железа наблюдается при полном истощении запасов микроэлемента в депо, однако признаков развития анемии нет. Манифестный дефицит железа, или железодефицитная анемия (ЖДА), возникает при снижении гемоглобинового фонда железа и имеет характерные симптомы [1].
ЖДА — полиэтиологичное заболевание, развитие которого связано с дефицитом железа в организме из-за нарушения поступления, усвоения или повышенных потерь данного микроэлемента, характеризующееся микроцитозом и гипохромной анемией [2].
По данным ВОЗ, распространенность анемии среди населения в целом во всем мире составляет 24,8 %, наиболее часто встречается у детей дошкольного возраста (47,4%) и у беременных женщин (41,8%), однако и 30 % небеременных женщин страдает от этой патологии [3].
По данным Росстата, в России наблюдается рост заболеваемости анемией. Так, в 2010 году зарегистрировано 1570,5 пациентов с анемией, в 2018 ‒ 1617,7; из числа закончивших беременность страдали анемией 35,6% [4].
Частыми причинами развития ЖДА являются:
- кровопотери (обильные менструальные кровотечения, беременность, роды, желудочно-кишечные, легочные, при заболевании почек);
- нарушения всасывания железа (резекция желудка и кишечника, недостаточность поджелудочной железы, глютеновая энтеропатия, болезнь Крона);
- повышенная потребности в железе (быстрый рост, недоношенные, новорожденные дети, подростки, беременность и лактация);
- недостаточное поступление с пищей (вегетарианская или веганская диета).
Биологическую роль железа трудно переоценить. Данный микроэлемент входит в состав порфириновых соединений, главным образом гемоглобина, миоглобина и порфирина, цитохромов и некоторых ферментов. Его функция определяется участием в окислительно-восстановительных процессах, реакциях кислородозависимого свободнорадикального окисления и антиокислительной системы, росте и старении тканей, механизмах общей и тканевой резистентности, кроветворении, снабжении органов и тканей кислородом, активации и ингибировании целого ряда ферментов. Многие метаболические процессы в организме: синтез стероидов, метаболизм лекарственных препаратов, синтез ДНК, пролиферация и дифференциация клеток, регуляция генов ‒ протекают с участием железа [6].
Этим определяется многообразие клинических проявлений анемии, состоящих из гипоксического и сидеропенического синдромов. Гипоксический синдром включает общие для всех анемий симптомы: бледность, усиленное сердцебиение, шум в ушах, головную боль, слабость. К проявлениям сидеропенического синдрома относятся: извращения вкуса, сухость кожи, изменение ногтей, выпадение волос, ангулярный стоматит, жжение языка, диспептический синдром [2]. Такие симптомы характеризуют манифестный дефицит железа. Предлатентный и латентный дефицит данного микроэлемента характеризуется отсутствием клинических признаков.
Исследования показали, что дефицит железа отрицательно сказывается на состоянии здоровья, особенно беременных женщин и детей.
Неблагоприятные исходы беременности, наблюдающиеся при анемии: невынашивание, плацентарная недостаточность, гипотрофия плода, аномалии родовой деятельности, гнойно-септических осложнения и гипогалактии у родильниц, патологическая кровопотеря в родах и послеродовом периоде [5,7]. Недостаток незаменимого микроэлемента в антенатальном периоде приводит к развитию анемии у новорожденного, нарушению его физического и когнитивного развития, повышает риск инфекционной заболеваемости в раннем возрасте и аллергическую настроенность детского организма [8].
Традиционно для диагностики анемий используют:
- концентрацию гемоглобина (НЬ),
- количество эритроцитов (Rbc – red blood cells),
- гематокрит (Hct – hematocrit),
- расчетные эритроцитарные индексы ‒ MCV (mean corpuscular volume ‒ средний объем эритроцита),
- MCH (mean corpuscular hemoglobin ‒ среднее содержание гемоглобина в отдельном эритроците),
- MCHC (mean corpuscular hemoglobin concentration ‒ средняя концентрация гемоглобина в эритроците),
- RDW (red cell distribution width ‒ ширина распределения эритроцитов по объему).
Учитывая стадийное развитие дефицита железа, ВОЗ рекомендует определение концентрации ферритина (белок, запасающий железо, который содержится во всех клетках, и его уровень можно измерить в сыворотке крови) одновременно с уровнем гемоглобина для диагностики дефицита железа у внешне здоровых людей, т.к. при отсутствии воспаления концентрация ферритина в плазме/сыворотке крови положительно коррелирует с общими запасами железа в организме.
Снижение концентрации сывороточного ферритина ниже 12 мкг/л у здоровых детей и 15 мкг/л у взрослых, с поправкой ниже 30 мкг/л у детей и 70 мкг/л у взрослых с инфекционными или воспалительными заболеваниями, означает неизбежное снижение концентрации гемоглобина в последующем [12].
Терапия железодефицитной анемии должна основываться на точном знании природы заболевания и носить патогенетический характер, которым является прием пероральных препаратов железа. В настоящее время врач имеет в своем распоряжении большое количество лекарств, обладающих различной биодоступностью, эффективностью, переносимостью и стоимостью.
Для правильного выбора лекарственного средства необходимо помнить, что в пище железо встречается трехвалентное окисное (Fe3+), в желудке оно растворяется и хелатируется муцином, аминокислотами, сахарами и аскорбиновой кислотой, чтобы быть пригодным к всасыванию в щелочной среде 12-перстной кишки и проксимальном отделе тонкого кишечника в виде закисного двухвалентного железа (Fe2+) через марганец-зависимые белки-транспортеры двухвалентных металлов (ДМТ1-белки). В клетках слизистой оболочки тонкого кишечника, во время процесса всасывания, закисное железо через белок ферропортин на базальной мембране поступает в кровь, где с помощью медь-зависимых феррооксидаз окисляется до трехвалентного состояния и связывается с транспортным белком ‒ трансферрином ‒ и транспортируется по всему организму в депо (печень, селезенка) и к эритроидным предшественникам в костный мозг. Попавший в клетки с помощью эндоцитоза комплекс Fе3+ ‒ трансферрин освобождает ионы железа, внутриклеточный свободный пул которого играет важную роль в регуляции пролиферации клетки, синтезе геминовых белков, экспрессии трансферриновых рецепторов, синтезе активных радикалов кислорода и др. [9].
Биодоступность двухвалентных солей железа в несколько раз выше, чем трехвалентных, так как они свободно диффундируют через каналы ДМТ1-белков и ферропортин. Фармакологический эффект препаратов быстрый, и нормализация уровня гемоглобина в среднем происходит через 2 недели ‒ 2 месяца, а восполнение депо железа происходит уже через 3‒4 месяца от начала лечения, в зависимости от тяжести анемии и дозировки препарата. В связи с чем ВОЗ рекомендует препараты двухвалентного железа в качестве стартовой терапии железодефицитной анемии [11]. Всасывание ионов из препаратов трехвалентного железа более медленное, так как необходима активная (энергозависимая) трансформация с участием феррооксидаз. Поэтому такие препараты требуют более длительного применения, а в случае дефицита меди в организме будут неэффективны вообще [1].
Вышеописанными патогенетическими свойствами обладает лекарственный препарат Сорбифер Дурулес, содержащий 320 мг сульфата железа (II), что эквивалентно содержанию 100 мг Fe2+ и 60 мг аскорбиновой кислоты, которая способствует дополнительному увеличению биодоступности железа, т.к. улучшает всасываемость ионов в кишечнике. Применением препарата в среднесуточной дозировке по 1 таблетке 2 раза в день достигается цель лечения железодефицитной анемии – введение железа в количестве, необходимом для нормализации уровня гемоглобина, и соответствует рекомендации ВОЗ об оптимальной лечебной дозе железа [11]. Кроме того, технология дурулес у данного лекарственного препарата обеспечивает постепенное медленное высвобождение ионов железа (на протяжении 6 часов) и равномерное поступление лекарственного препарата, предотвращая развитие патологически высоких местных концентраций железа и повреждения слизистой оболочки желудочно-кишечного тракта.
Эффективность лечения железодефицитной анемии зависит не только от биодоступности применяемого препарата, но и от его доступности. Стоимость большинства других препаратов двухвалентных солей значительно выше, чем Сорбифер Дурулес, как и препаратов трехвалентного железа, а из-за их низкой усвояемости терапия более длительная, что делает лечение еще более дорогим и может послужить причиной отказа от применения препарата.
Для мониторинга и оценки эффективности препаратов железа, помимо оценки уровня гемоглобина, особенно при латентном дефиците железа, также может использоваться оценка уровня ферритина, который возрастает в ответ на применение препаратов железа и позволяет оценить насыщение депо железом [12].
Поэтому важно проводить своевременную диагностику дефицита железа, даже в отсутствие клинических проявлений, информировать пациента о его последствиях и подбирать оптимальный для каждого конкретного больного лекарственный препарат, применяя идеи персонифицированного подхода.
Источник