- Лекарственное средство определение фармакопея
- ОФС.1.4.1.0001.15 Лекарственные формы
- ОФС.1.4.1.0001.15 Лекарственные формы
- ОСНОВНЫЕ ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
- КЛАССИФИКАЦИЯ И ПЕРЕЧЕНЬ ЛЕКАРСТВЕННЫХ ФОРМ
- ОБЩИЕ ТРЕБОВАНИЯ К ПРОИЗВОДСТВУ И ИЗГОТОВЛЕНИЮ ЛЕКАРСТВЕННЫХ ФОРМ
- ОЦЕНКА КАЧЕСТВА ЛЕКАРСТВЕННЫХ ФОРМ
- УПАКОВКА
- МАРКИРОВКА
- ХРАНЕНИЕ
- СРОК ГОДНОСТИ
Лекарственное средство определение фармакопея
В настоящее время в Государственный Реестр лекарственных средств Российской Федерации внесено более 20 тысяч наименований лекарственных средств как отечественных, так и зарубежных производителей.
Согласно Федеральному закону «Об обращении лекарственных средств» N 61-ФЗ от 12 апреля 2010 г. [6]:
– «лекарственные препараты – лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности;
– «лекарственная форма – состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта».
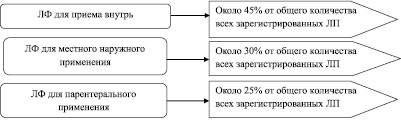
Количество лекарственных форм, в виде которых лекарственные препараты находятся в обращении на территории РФ, составляет 42 наименования. Проведенный анализ показал, что наиболее распространенной лекарственной формой являются таблетки. Число препаратов, представленных в этой лекарственной форме достигает 30 %, на долю лекарственных препаратов в виде растворов приходится 17 %, капсулированные лекарственные препараты составляют 6 %, лиофилизаты, порошки и капли – по 4 %, мази – 3 %. На долю остальных 36 лекарственных форм приходится 32 %. Распределение лекарственных форм по пути введения представлено на рисунке.
Виды лекарственных форм, в которых представлены препараты на российском фармацевтическом рынке, в зависимости от пути введения
Данные рисунка свидетельствуют о том, что наибольший процент из числа зарегистрированных лекарственных препаратов приходится на препараты в лекарственных формах для внутреннего применения (45 %), далее следуют препараты в лекарственных формах для местного и наружного применения (30 %), а затем – препараты для парентерального применения (25 %).
Для обозначения общих требований, предъявляемых к лекарственным формам, впервые в ГФ РФ включена ОФС «Лекарственные формы». В ней приведены основные термины и определения, используемые при описании производства и изготовления ЛФ, классификация ЛФ по агрегатному состоянию, по типу дисперсной системы, по пути введения и типу высвобождения.
Отнесение ЛФ к той или иной классификационной подгруппе в зависимости от ее особенностей (агрегатного состояния, технологии получения, вспомогательных веществ, способов введения) и свойств действующего вещества (источника получения фармацевтической субстанции, физико-химических свойств и др.) определяет подходы к оценке их качества.
В ОФС «Лекарственные формы» описаны общие подходы к производству/ изготовлению ЛФ. Отмечены показатели, которые являются обязательными для оценки качества лекарственного препарата независимо от ЛФ, даны указания по введению других показателей качества в зависимости от свойств ЛФ и показатели, испытание по которым проводится на стадии производственного процесса. Приведены также общие указания по упаковке, маркировке и хранению.
В ГФ РФ включены 21 ОФС на лекарственные формы. Их перечень представлен в табл. 1.
Перечень ОФС на лекарственные формы, включенные в ГФ РФ ХIII издания
Аэрозоли и спреи
Глазные лекарственные формы
Лекарственные формы для ингаляций
Лекарственные формы для парентерального применения
Настои и отвары
Из 21 ОФС на ЛФ в ГФ РФ XIII издания впервые введены: «Лекарственные формы для ингаляций», «Растворы», «Трансдермальные пластыри» и «Гранулы резано-прессованные», ОФС на 13 ЛФ были представлены в ГФ СССР Х издания [1] и ГФ СССР ХI издания (вып. 2) [2, 7].
Лекарственные средства для ингаляций – жидкие или твердые ЛФ, предназначенные для введения действующих веществ в легкие в виде паров или дисперсий твердых или жидких частиц в газовой среде с целью получения местного или системного эффекта. Одним из главных параметров эффективности ингаляции является такая величина, как депозиция, т.е. отложение препарата в дыхательных путях. Основным фактором, определяющим депозицию частиц в дыхательных путях, является размер частиц аэрозоля. Для определения количества действующего вещества, которое доходит до респираторного тракта, введен показатель «Респирабельная фракция», определяемая по включенной впервые в ГФ РФ ОФС «Аэродинамическое распределение мелкодисперсных частиц».
ЛФ для ингаляций могут быть представлены растворами, суспензиями, эмульсиями, аэрозолями, спреями и порошками. Для ЛФ для ингаляций, снабженных дозирующим устройством, определяют такой показатель, как «Однородность доставляемой дозы».
ОФС «Растворы» посвящена большой группе лекарственных препаратов, находящихся в следующих ЛФ: собственно растворы, капли, микстуры, ароматные воды, сиропы, концентраты для приготовления растворов. В ОФС приведены общие указания по особенностям технологии и стандартизации лекарственных препаратов в зависимости от ЛФ и назначения.
В отличие от пластырей медицинских, для трансдермальных пластырей, впервые описанных в ГФ РФ и предназначенных для контролируемой доставки лекарственного вещества в системный кровоток путем пассивной диффузии через неповрежденную кожу, основным показателем качества является скорость высвобождения действующего вещества или скорость подачи через полимерную мембрану в выбранную среду растворения. Этот показатель определяется по ОФС «Растворение для трансдермальных пластырей», также впервые включенной в ГФ РФ XIII издания.
Среди ЛФ, получаемых из лекарственного растительного сырья, впервые описаны гранулы резано-прессованные, предназначенные для получения водных извлечений.
Актуализированные ОФС на ЛФ, представленные ранее в действующих фармакопеях, значительно дополнены в соответствии с требованиями мировых фармакопейных стандартов.
В ОФС «Аэрозоли и спреи» особое внимание уделено требованиям к качеству, предъявляемым в зависимости от того, является ЛФ дозированной или недозированной: для недозированных аэрозолей определяют содержание действующего вещества в баллоне, процент выхода содержимого упаковки; для дозированных аэрозолей – содержание действующего вещества в дозе; количество доз в баллоне.
В ОФС «Глазные лекарственные формы», разработанной взамен ОФС ГФ Х и ГФ ХI «Капли глазные», помимо капель глазных представлены и другие ЛФ, применяемые в офтальмологической практике: жидкие и мягкие ЛФ для местного применения, твердые ЛФ для приготовления капель глазных, твердые ЛФ для инъекционного и имплантационного введения. Твердыми дозированными офтальмологическими ЛФ являются пленки глазные, состоящие из пленкообразователя и одного или нескольких лекарственных веществ, предназначенные для помещения в конъюнктивальную полость, а также имплантаты глазные, предназначенные для введения во внутренние структуры глаза на длительный период времени для оказания определенного фармакологического действия.
ОФС «Гранулы» и «Капсулы» содержат методику определения распадаемости в зависимости от вида гранул (гранулы, покрытые и непокрытые оболочкой, кишечнорастворимые и шипучие) и капсул (капсулы твердые и мягкие, кишечнорастворимые).
Важной группой ЛФ являются ЛФ для парентерального применения, что связано с быстротой их действия и высокой степенью биологической доступности. По сравнению с ОФС ГФ СССР ХI «Инъекционные лекарственные формы», в которой представлены преимущественно растворы, в ОФС «Лекарственные формы для парентерального применения» включены, помимо таких жидких ЛФ, как растворы для инъекций, также инфузионные ЛФ, концентраты, порошки и лиофилизаты, ЛФ для имплантации, в том числе, с длительным периодом высвобождения.
Для суппозиториев введен показатель «Растворение». Выполнение этого теста предполагает использование специального прибора. Для оценки качества суппозиториев на липофильной основе по этому показателю представлена отдельная ОФС.
В ОФС «Суспензии» дополнительно введены такие показатели качества как рН, размер частиц и вязкость.
Таблетки, как уже отмечалось ранее, являются наиболее востребованными среди лекарственных препаратов, имеющихся в арсенале современной медицины. Наличие или отсутствие оболочки, скорость и характер высвобождения действующего вещества, состав и способ применения таблеток определяют их классификационное деление на группы и обуславливают различие методик испытаний и предъявляемых требований.
Значительно дополнена ОФС «Эмульсии», в которой подробно описаны особенности технологии и испытания.
В ОФС «Настои и отвары», помимо особенностей технологии, описаны испытания этой ЛФ, изготавливаемой преимущественно экстемпорально. Настойки, в соответствии с современными требованиями, кроме испытаний на сухой остаток и тяжелые металлы, подвергаются испытаниям по показателям «Плотность», «Спирт этиловый», «Метанол и 2-пропанол».
ОФС «Сборы» дополнена качественными реакциями, хроматографическим и УФ-спектрофотометрическим анализом, испытаниями на однородность массы, зараженность вредителями запасов, присутствие радионуклидов, тяжелых металлов, остаточных количеств пестицидов, что очень важно для обеспечения безопасности лекарственных препаратов, получаемых из лекарственного растительного сырья.
Для сухих экстрактов предусмотрен контроль по показателю «Насыпной объем» в соответствии с требованиями включенной в ГФ ХIII статьи «Степень сыпучести порошков»; для масляных экстрактов – кислотное число, йодное, перекисное и число омыления, растворимость и показатель преломления. Определяют массу или объем содержимого упаковки и при необходимости – остаточное количество органических растворителей.
Как уже отмечалось ранее, в ГФ РФ ХIII издания включены также статьи на фармацевтико-технологические испытания лекарственных форм, многие из которых впервые введены в практику отечественного фармакопейного анализа (табл. 2).
Перечень ОФС, регламентирующих фармацевтико-технологические испытания лекарственных форм
Источник
ОФС.1.4.1.0001.15 Лекарственные формы
Содержимое (Table of Contents)
ОФС.1.4.1.0001.15 Лекарственные формы
В настоящей общей фармакопейной статье рассматривается перечень лекарственных форм, приводятся общие требования к их производству, изготовлению, показателям и методам оценки качества.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Лекарственные формы ОФС.1.4.1.0001.15
Вводится впервые
В настоящей общей фармакопейной статье рассматривается перечень лекарственных форм, приводятся общие требования к их производству, изготовлению, показателям и методам оценки качества.
ОСНОВНЫЕ ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
Лекарственные средства — вещества или их комбинации, вступающие в контакт с организмом человека или животного, проникающие в органы, ткани организма человека или животного, применяемые для профилактики, диагностики (за исключением веществ или их комбинаций, не контактирующих с организмом человека или животного), лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности и полученные из крови, плазмы крови, из органов, тканей организма человека или животного, растений, минералов методами синтеза или с применением биологических технологий. К лекарственным средствам относятся фармацевтические субстанции и лекарственные препараты.
Лекарственная форма – состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта.
Лекарственные препараты — лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности.
Фармацевтическая субстанция — лекарственное средство в виде одного или нескольких обладающих фармакологической активностью действующих веществ вне зависимости от природы происхождения, которое предназначено для производства, изготовления лекарственных препаратов и определяет их эффективность.
Вспомогательные вещества — вещества неорганического или органического происхождения, используемые в процессе производства, изготовления лекарственных препаратов для придания им необходимых физико-химических свойств.
Производство лекарственных средств — деятельность по производству лекарственных средств организациями-производителями лекарственных средств на одной стадии, нескольких или всех стадиях технологического процесса, а также по хранению и реализации произведенных лекарственных средств.
Изготовление – деятельность по изготовлению лекарственных средств, осуществляемая аптечными организациями, ветеринарными аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность, по рецептам на лекарственные препараты, по требованиям медицинских организаций, ветеринарных организаций, в соответствии с правилами изготовления и отпуска лекарственных препаратов, утвержденными уполномоченным федеральным органом исполнительной власти.
Стабильность — способность лекарственного средства сохранять химические, физические, микробиологические, биофармацевтические и фармакологические свойства в определенных границах на протяжении срока годности.
Путь введения — способ доставки лекарственного средства в организм человека или животного.
КЛАССИФИКАЦИЯ И ПЕРЕЧЕНЬ ЛЕКАРСТВЕННЫХ ФОРМ
Все лекарственные формы могут быть иерархически классифицированы: по агрегатному состоянию, типу дисперсной системы, пути введения и типу высвобождения (таблица).
Таблица — Классификация лекарственных форм
| Уровень | Классификационный признак | |||||
| 1 | Лекарственные формы по агрегатному состоянию | |||||
| твердые | жидкие | мягкие | газообразные | |||
| 2 | Лекарственные формы по типу дисперсной системы | |||||
| гомогенные | гетерогенные | комбинированные | ||||
| 3 | Лекарственные формы по пути введения | |||||
| для внутрь | для наружного применения | для местного применения | для парентерального применения | |||
| 4 | Лекарственные формы по типу высвобождения | |||||
| с обычным высвобождением | с модифицированным высвобождением | |||||
К твердым лекарственным формам относятся таблетки, капсулы, порошки, гранулы, драже, пастилки, лиофилизаты, имплантаты, карандаши, тампоны, сборы, пленки и др.
Жидкие лекарственные формы – растворы, капли, сиропы, суспензии, эмульсии, жидкие экстракты, настойки, эликсиры, концентраты, шампуни, настои, отвары и др.
К мягким лекарственным формам относятся мази, кремы, гели, линименты, пасты, суппозитории, пластыри, жевательные резинки и др.
Газообразные лекарственные формы – газы медицинские, аэрозоли, спреи, ингаляционные лекарственные формы и др.
По типу дисперсной системы лекарственные формы могут быть гомогенными, гетерогенными и комбинированными.
По пути введения различают лекарственные формы для приема внутрь, наружного применения, местного применения и парентеральные лекарственные формы.
По типу высвобождения лекарственные формы могут иметь обычное и модифицированное высвобождение. Модифицированное (нестандартное) высвобождение может быть замедленным, непрерывным, прерывистым (пульсирующим), отсроченным и ускоренным.
Отнесение лекарственной формы к той или иной классификационной подгруппе определяет подходы к оценке ее качества.
В зависимости от пути введения и назначения лекарственной формы в перечень испытаний ее качества включаются испытания, отражающие, при необходимости, особенности данной лекарственной формы.
ОБЩИЕ ТРЕБОВАНИЯ К ПРОИЗВОДСТВУ И ИЗГОТОВЛЕНИЮ ЛЕКАРСТВЕННЫХ ФОРМ
Производство лекарственных средств в различных лекарственных формах должно осуществляться в соответствии с Правилами организации производства и контроля качества лекарственных средств (GMP). Правила GMP распространяются на все виды лекарственных средств и устанавливают общие требования к организации их производства и контроля качества, а также специальные требования к организации производства отдельных видов лекарственных средств.
Изготовление лекарственных средств в различных лекарственных формах должно проводиться в соответствии с действующими требованиями к изготовлению лекарственных средств в аптечных организациях.
Нестерильные лекарственные формы производят и изготавливают с использованием материалов и методов, предотвращающих загрязнение и рост микроорганизмов и обеспечивающих их соответствие требованиям ОФС «Микробиологическая чистота».
Стерильные лекарственные формы (парентеральные, глазные лекарственные формы, а также лекарственные формы, предназначенные для нанесения на поврежденную кожу и слизистые, лекарственные формы для новорожденных) производят и изготавливают с применением материалов и методов, предотвращающих загрязнение и обеспечивающих их стерильность в соответствии с требованиями ОФС «Стерильность».
ОЦЕНКА КАЧЕСТВА ЛЕКАРСТВЕННЫХ ФОРМ
Оценку качества лекарственных препаратов в различных лекарственных формах проводят, как правило, по показателям качества, характеризующим конкретную лекарственную форму, а также по показателям качества действующего вещества/веществ и, при необходимости, вспомогательного вещества/веществ данного лекарственного препарата («Подлинность», «Количественное определение» и др.).
К показателям, которые являются обязательными для оценки качества лекарственного препарата независимо от лекарственной формы, относятся «Описание», «Подлинность», «Количественное определение», «Микробиологическая чистота» (для нестерильных лекарственных форм) и «Стерильность» (для стерильных лекарственных форм).
Описание. Приводят сведения, которые наиболее полно характеризуют требования, предъявляемые к внешнему виду и органолептическим характеристикам (цвет, запах) лекарственного препарата в данной лекарственной форме.
Подлинность. Проводимые испытания определяются составом лекарственного препарата: действующими, реже вспомогательными веществами (антимикробными консервантами, антиоксидантами, стабилизаторами и др.), входящими в состав лекарственного препарата. Для оценки подлинности рекомендуется сочетание физико-химических (ВЭЖХ, ГХ, ТСХ и др.) и химических методов анализа.
Количественное определение. Данное испытание, как и определение подлинности, зависит от состава лекарственного препарата: действующих и вспомогательных веществ. Для количественного определения рекомендуется использовать физико-химические (ВЭЖХ, спектрофотометрия) и химические методы анализа (титриметрия), допускается применение других фармакопейных методов анализа.
Если не указано иначе в фармакопейной статье или нормативной документации, содержание определяемых веществ выражается в мг или ЕД в одной дозе для дозированных лекарственных форм или в 1 г (мл) препарата для недозированных форм.
При введении в состав лекарственных препаратов антимикробных консервантов, метод их определения и критерии оценки их эффективности должны соответствовать требованиям ОФС «Определение эффективности антимикробных консервантов».
Микробиологическая чистота. Контролируется во всех нестерильных лекарственных формах в соответствии с требованиями ОФС «Микробиологическая чистота».
Стерильность. Лекарственные препараты, предназначенные для использования на открытых ранах или на поврежденной коже, лекарственные формы для новорожденных, а также парентеральные и глазные лекарственные формы должны быть стерильными и проходить испытание в соответствии с требованиями ОФС «Стерильность».
Показатели качества лекарственного препарата могут определяться способом его производства (например, использование органических растворителей) и свойствами действующего вещества (способность к образованию изомеров, продуктов распада и др.).
Содержание остаточных органических растворителей в лекарственном препарате оценивают в соответствии с требованиями ОФС «Остаточные органические растворители».
В случае возможного наличия примесей в составе лекарственного препарата (например, в результате накопления примесей (продукты деструкции) в процессе хранения лекарственного препарата) необходимо контролировать их содержание по показателю «Родственные примеси».
Для отдельных лекарственных форм могут быть выделены характерные показатели качества.
Для твердых дозированных форм, трансдермальных пластырей, суппозиториев на липофильной основе, как правило, проводят испытание по показателю «Растворение».
Для таблеток, капсул, суппозиториев и вагинальных таблеток может быть предусмотрена оценка распадаемости.
Порошки оценивают по показателям «Размер частиц», «Потеря в массе при высушивании».
Лекарственные формы для парентерального применения должны выдерживать требования по содержанию бактериальных эндотоксинов и/или пирогенов, видимых и невидимых механических включений.
Капли глазные должны выдерживать требования по содержанию видимых механических включений.
Для ряда лекарственных форм проводят оценку качества по показателям, которые контролируются на производстве. Например, для таблеток – «Истираемость таблеток» и «Прочность таблеток на раздавливание», для стерильных мазей – «Герметичность упаковки», для порошков определяют сыпучесть, угол естественного откоса, насыпной объем и др.
Для жидких лекарственных форм, представленных растворами, в отдельных случаях проводят оценку прозрачности, цветности, рН и осмоляльности.
Аэрозоли и спреи оцениваются по таким показателям, как «Герметичность упаковки», «Выход содержимого упаковки» (для недозированных аэрозолей и спреев), «Однородность массы дозы» (для дозированных аэрозолей и спреев) и др. Для аэрозолей для ингаляций оценивают аэродинамическое распределение мелкодисперсных частиц, респирабельную фракцию и др.
Однородность массы. Дозированные лекарственные формы, в том числе в однодозовой индивидуальной упаковке, должны выдерживать испытание однородности массы для единицы дозированной лекарственной формы. Испытание проводят в соответствии с ОФС «Однородность массы дозированных лекарственных форм». Если предусмотрено определение однородности дозирования, определение однородности массы не требуется.
Однородность дозирования. Дозированные лекарственные формы, в том числе в однодозовой индивидуальной упаковке, должны выдерживать испытание однородности дозирования в соответствии с ОФС «Однородность дозирования», если нет иных указаний в фармакопейной статье или нормативной документации.
Масса (объем) содержимого упаковки. Испытания проводят для недозированных лекарственных форм в соответствии с ОФС «Масса (объем) содержимого упаковки», за исключением жидких лекарственных форм для парентерального применения и приема внутрь.
Извлекаемый объем. Испытание проводят для жидких лекарственных форм для приема внутрь в соответствии с требованиями ОФС «Извлекаемый объем». Испытания не проводят для лекарственных форм в однодозовых упаковках, если в фармакопейную статью или нормативную документацию включено испытание на однородность дозирования.
Извлекаемый объем лекарственных форм для парентерального применения. Испытанию подвергаются лекарственные формы для парентерального применения в соответствии с требованиями ОФС «Извлекаемый объем лекарственных форм для парентерального применения».
УПАКОВКА
Упаковка должна обеспечивать качество лекарственного препарата в течение установленного срока годности в заявленных условиях хранения. Материалы первичной и вторичной упаковки должны быть разрешены для производства данного вида упаковки с учетом пути введения лекарственной формы.
МАРКИРОВКА
Для дозированных лекарственных форм приводят названия действующих веществ и их количества в одной дозе препарата, если нет других указаний в фармакопейной статье или нормативной документации. Для недозированных лекарственных форм приводят названия действующих веществ и их количества в определенном объеме (массе) лекарственного препарата. Для парентеральных лекарственных форм, лекарственных форм для ингаляций, лекарственных форм для наружного и (или) местного применения, глазных лекарственных форм указывают названия действующих веществ, их количества и перечень названий всех вспомогательных веществ. Для лекарственных форм для инфузий приводят названия действующих и вспомогательных веществ и их количества.
ХРАНЕНИЕ
В соответствии с требованиями ОФС «Хранение лекарственных средств». Условия хранения должны обеспечивать стабильность лекарственного препарата в течение всего установленного срока его годности в заявленном виде упаковки.
СРОК ГОДНОСТИ
Сроки годности лекарственных средств в различных лекарственных формах устанавливают в соответствии с требованиями ОФС «Сроки годности лекарственных средств».
Источник