Лекарственное растительное сырье содержащее антраценпроизводные вещества
В медицинской практике широко применяются лекарственные препараты на основе растительного сырья, содержащего антраценпроизводные [1–4, 6], причем наиболее популярным источником являются два вида кассии (сенна) – кассия остролистная (Сassia acutifolia Del.), или сенна александрийская (Senna alexandrina Mill.), и кассия узколистная (Cassia angustifolia Vahl.). Слабительное действие препаратов листьев кассии (отвар, сенадексин, глаксена и др.) обусловливают антраценпроизводные, представленные сеннозидами А, B, C, D, глюко-реином, глюко-алоэ-эмодином, реином, диреином [3, 6–9, 12, 13]. Среди сопутствующих веществ известны флавоноиды, в частности кемпферол-3-O-гентиобиозид, а также производные нафталина – 8-О-β-D-глюкопиранозид торахризона и др. [9]. Несмотря на высокую степень изученности химического состава листьев кассии, противоречивой остается информация относительно трактовки доминирующих компонентов. Так, в некоторых работах отмечается, что доминирующими веществами являются сеннозиды А, B, C и D [2, 6], в других работах – кемпферол-3-O-гентиобиозид [9], а в отдельных литературных источниках – реин [13]. Видимо, именно это обстоятельство является причиной того факта, что до сих пор не сложились единые подходы к стандартизации листьев кассии, а в существующих подходах к анализу не в полной мере используется все разнообразие химического состава сырья кассии [2, 7–10, 13]. Это в полной мере касается и другого лекарственного растительного сырья, содержащего антраценпроизводные, а именно: коры крушины ломкой (Frangula alnus Mill.), плодов жостера слабительного (Rhamnus cathartica L.), корней щавеля конского (Rumex confertus Willd.).
Цель настоящих исследований – разработка методологических подходов к созданию и стандартизации лекарственного растительного сырья и фитопрепаратов, содержащих антраценпроизводные.
Материалы и методы исследования
В качестве объектов исследования служили листья сенны александрийской (Cassia acutifolia Del.), кора крушины ломкой (Frangula alnus Mill.), плоды жостера слабительного (Rhamnus cathartica L.), корни щавеля конского (Rumex confertus Willd.), фитопрепараты, полученные из вышеперечисленного ЛРС, а также антраценпроизводные, флавоноиды и производные нафталина, выделенные из ЛРС.
Препаративное выделение веществ из ЛРС осуществляли с использованием колоночной хроматографии. Воздушно-сухое сырье (100 г) подвергали исчерпывающему экстрагированию 70 % этиловым спиртом, сочетая при этом способ мацерации (24 ч) с последующей экстракцией при температуре 85–90 °С. Водно-спиртовые экстракты упаривали под вакуумом до густого остатка (около 30 мл). Сгущенный экстракт высушивали на силикагеле L 40/100 и полученный порошок (экстракт + силикагель) наносили на слой силикагеля, сформированный в хлороформе. Хроматографическую колонку элюировали хлороформом и смесью хлороформ – этиловый спирт в различных соотношениях. Контроль за разделением веществ осуществляли с помощью ТСХ-анализа на пластинках «Сорбфил ПТСХ-АФ-А-УФ». Окончательную очистку веществ осуществляли рехроматографией на колонке с полиамидом «Woelm» (Германия), а также перекристаллизацией из различных растворителей.
Cпектры ЯМР 1Н и ЯМР 13С получали на приборе «Bruker AM 300», масс-спектры снимали на масс-спектрометре «Kratos MS-30», регистрацию УФ-спектров проводили с помощью спектрофотометра «Specord 40» (Analytik Jena).
Результаты исследования и их обсуждение
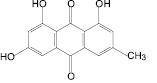
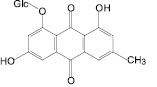
В результате исследования компонентного состава листьев сенны александрийской, коры крушины ломкой, плодов жостера слабительного, корней щавеля конского выделены доминирующие вещества – 1,7-дигидрокси-3-карбоксиантрахинон, франгулин А, франгулин В, эмодин, 1-O-β-D-глюкопиранозид эмодина, 8-O-β-D-глюкопиранозид эмодина (антраценпроизводные), кемпферол-3-O-гентиобиозид, 3-О-рутинозид рамнетина (флавоноиды) и 8-О-β-D-глюкопиранозид торахризона (производное нафталина).
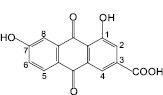
С использованием ТСХ обнаружено, что именно 1,7-дигидрокси-3-карбоксиантрахинон, кемпферол-3-O-гентиобиозид и 8-О-β-D-глюкопиранозид торахризона являются доминирующими компонентами листьев сенны. На наш взгляд, обнаружение методом ТСХ данных соединений, диагностически значимых для листьев сенны, является перспективным подходом в плане идентификации сырья и препаратов данного растения. Это тем более важно, что в силу невысокого содержания сеннозида А и В в листьях кассии [8] определение данных соединений методом ТСХ весьма проблематично. Этот вывод согласуется с результатами исследований зарубежных ученых [13], в соответствии с которыми доминирующим антраценпроизводным листьев кассии является реин. При этом обращает на себя внимание тот факт, что, по нашим данным, доминирующим антраценпроизводным соединением листьев кассии является не реин, а близкий к нему по хроматографической подвижности, физико-химическим и спектральным характеристикам антрахинон – 1,7-дигидрокси-3-карбоксиантрахинон, названный нами неореином. Этот вывод сделан на основании данных 1Н-ЯМР-спектра 1,7-дигидрокси-3-карбоксиантрахинона: наличие при 11,91 м.д. одного уширенного синглетного сигнала, принадлежащего 1-ОН-группе, в сочетании с характером сигналов ароматических протонов при С-5, С-6 и С-8. По литературным данным, в 1Н-ЯМР-спектре реина характерными являются два синглетных сигнала в области 12,0 и 11,9 м.д. 1-ОН-группы и 8-ОН-группы [11].
Компоненты листьев кассии остролистной
Доминирующие антраценпроизводные коры крушины ломкой
Доминирующие компоненты плодов жостера слабительного
Доминирующие антраценпроизводные корней щавеля конского
К доминирующим фенольным компонентам относятся также 8-O-β-D-глюкопиранозид торахризона и кемпферол-3-О-гентиобиозид, которые, на наш взгляд, имеют диагностическое значение в плане идентификации сырья кассии. Интересно, что, по данным зарубежных ученых, и в условиях ВЭЖХ кемпферол-3-О-гентиобиозид является доминирующим соединением [9].
Используемые подходы к стандартизации ЛРС, нашедшие отражение в Государственной фармакопее СССР XI издания [2], а также в Европейской и других зарубежных фармакопеях [7, 10], как правило, предусматривают громоздкие и многостадийные методики, включающие кислотный гидролиз и многократную экстракцию диэтиловым эфиром, что нельзя признать целесообразным с точки зрения точности методики и неизбежной потери антраценпроизводных.
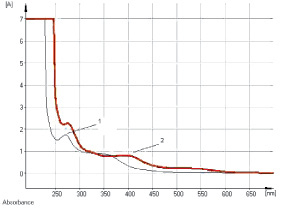
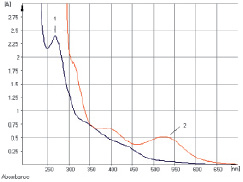
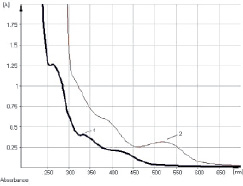
Изучение условий экстракции ЛРС показало, что оптимальным для извлечения антраценпроизводных является этиловый спирт в диапазоне концентраций 40–70 % при нагревании на кипящей водяной бане в течение 60–90 мин. В ходе исследований разработана методика количественного определения суммы антраценпроизводных в листьях сенны методом прямой спектрофотометрии щелочно-аммиачного раствора водно-спиртового извлечения при аналитической длине волны 530 нм в пересчете на сеннозид В (рис. 1). Заслуживает внимания тот факт, что характер кривой поглощения раствора водно-спиртового извлечения листьев сенны в основном обусловливают флавоноиды (рис. 2), в частности выделенный нами кемпферол-3-О-гентиобиозид, хотя определенный вклад вносят и другие компоненты: 1,7-дигидрокси-3-карбоксиантрахинон (неореин), 8-О-β-D-глюкопиранозид торахризона (производное нафталина).
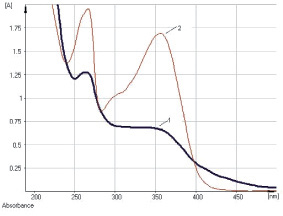
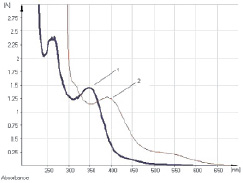
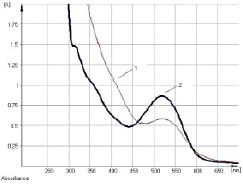
Исследование УФ-спектров показало, что максимум поглощения щелочно-аммиачного раствора водно-спиртового извлечения из коры крушины ломкой в длинноволновой области спектра находится при 524 ± 2 нм (рис. 3). В длинноволновой области электронного спектра щелочно-аммиачного раствора франгулина А также наблюдается четкий максимум поглощения при 524 ± 2 нм (рис. 4). Следовательно, в качестве аналитической длины волны может быть использовано значение 524 нм, а стандартным образцом может служить доминирующий антрагликозид – франгулин А, причем в случае отсутствия стандарта в расчетной формуле может быть использовано теоретическое значение удельного показателя поглощения (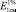
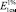
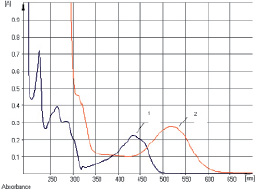
Исследование УФ-спектров растворов водно-спиртовых извлечений из плодов жостера слабительного показало (рис. 5), что данная аналитическая длина волны может быть использована и в методике количественного определения суммы антраценпроизводных в сырье данного растения, хотя кривая поглощения УФ-спектр исходного раствора извлечения обусловлена в основном флавоноидами (3-О-рутинозид рамнетина). В длинноволновой области спектра щелочно-аммиачного раствора 1-О-β-D-глюкозида эмодина, как и в случае щелочно-аммиачного раствора извлечения плодов жостера, наблюдается четкий максимум поглощения при 520 ± 2 нм (рис. 6).
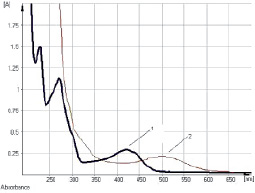
Исследование УФ-спектров водно-спиртового извлечения из корней щавеля конского показало, что максимум поглощения щелочно-аммиачного раствора водно-спиртового извлечения из корней щавеля конского находится при длине волны 520 ± 2 нм (рис. 7). В длинноволновой области спектра щелочно-аммиачного раствора 8-О-β-D-глюкозида эмодина также наблюдается четкий максимум поглощения при 520 ± 2 нм (рис. 8). Следовательно, за аналитическую длину волны можно принять значение 520 нм, а стандартным образцом может служить доминирующий антрагликозид – 8-О-β-D-глюкозида эмодина. В случае отсутствия стандарта в расчетной формуле может быть использовано значение удельного показателя поглощения (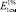
С использованием разработанных методик проанализирован ряд промышленных образцов ЛРС и показано, что содержание суммы антраценпроизводных в образцах листьев сенны варьирует в пределах от 1,51 до 1,88 % (в пересчете на сеннозид В), в коре крушины – от 5,63 до 8,51 % (в пересчете на франгулин А), в плодах жостера слабительного – от 2,57 % до 5,10 % (в пересчете на франгулин А) и в корнях щавеля конского – от 4,25 до 5,04 % (в пересчете на 8-О-β-D-глюкозида эмодина).
Рис. 1. Электронные спектры раствора водно-спиртового извлечения (1) и щелочно-аммиачного раствора водно-спиртового извлечения листьев сенны (2)
Рис. 2. Электронные спектры раствора водно-спиртового извлечения листьев сенны (1) и раствора кемпферол-3-О-гентиобиозида (2)
Рис. 3. УФ-спектр исходного раствора (1) и щелочно-аммиачного раствора (2) водно-спиртового извлечения из коры крушины ломкой
Рис. 4. УФ-спектр исходного раствора франгулина А (1) и щелочно-аммиачного раствора франгулина А (2)
Рис. 5. Электронные спектры извлечений из плодов жостера слабительного. Обозначения: 1 – спиртовой раствор извлечения; 2 – извлечение в щелочно-аммиачном растворе
Рис. 6. Электронные спектры растворов 1-О-β-D-глюкопиранозида эмодина. Обозначения: 1 – исходный раствор вещества; 2 – щелочно-аммиачный раствор вещества
Рис. 7. Электронные спектры водно-спиртового извлечения из корней щавеля конского (1) и щелочно-аммиачного раствора извлечения из корней щавеля конского (2)
Рис. 8. Электронные спектры щелочно-аммиачных растворов водно-спиртового извлечения из корней щавеля конского (1) и 8-О-β-D-глюкозида эмодина (2)
На основе результатов химических и аналитических исследований обоснованы состав и технология получения лекарственных препаратов «Сенны сироп», «Крушины сироп», «Жостера сироп» и «Щавеля конского сироп», предусматривающие использование в качестве лекарственной субстанции водного извлечения (отвар) из сырья соответствующих растений, что является актуальным с точки зрения импортозамещения [5]. Научно обоснованные подходы к стандартизации исследуемого сырья использованы при разработке методик количественного определения суммы антраценпроизводных в лекарственных препаратах. Содержание суммы антраценпроизводных в сиропе сенны, сиропе крушины, сиропе жостера и сиропе щавеля конского составляет 0,055 % ± 0,002; 0,30 % ± 0,01; 0,22 % ± 0,003; 0,25 % ± 0,003 % соответственно.
Результаты проведенных исследований позволили создать методологическую базу для совершенствования стандартизации ЛРС, содержащего антраценпроизводные, а также расширить возможности целенаправленного поиска новых сырьевых источников для получения эффективных отечественных фитопрепаратов слабительного действия. Научно обоснованы состав и технология получения новых лекарственных препаратов «Сенны сироп», «Крушины сироп», «Жостера сироп» и «Щавеля конского сироп».
Рецензенты:
Шаталаев И.Ф., д.б.н., профессор, заведующий кафедрой химии фармацевтического факультета, ГБОУ ВПО «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Самара;
Дубищев А.В., д.м.н., профессор, зав. кафедрой фармакологии им. заслуженного деятеля науки РФ, профессора А.А. Лебедева, ГБОУ ВПО «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Самара.
Источник
55. Антраценпроизводные: строение, классификация, био-фармакологическое действи
Производными антрацена (или антраценпроизводными) называют природные соединения, в основе структуры которых лежит ядро антрацена различной степени окисленности по кольцу В (среднему).
Классификация:1) соединения, молекулы которых содержат одно ядро антрацена – мономеры;
2) соединения с двумя ядрами антрацена – димеры;
3) конденсированные антраценпроизводные.
В частности, мономеры, в зависимости от степени окисленности среднего кольца (В) подразделяют на:
А) окисленные формы – производные 9,10-антрахинона;
Б) восстановленные формы – производные антранола, антрона, окси-антрона, антрагидрохинона
В зависимости от характера и расположения заместителей, окисленные формы антраценпроизводных подразделяют на:
— производные хризацина (1, 8-дигидрооксиантрахинона) – табл. 1,
— производные ализарина (1, 2-дигидрооксиантрахинона) – табл. 2.
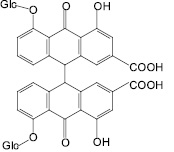
Производные хризацина широко представлены в растениях: эмодины, реин, хризафанол. Эмодины различаются положением заместителей: гидроксильных, метильных, карбоксильных групп. Название эмодина изменяется в зависимости от того, в каком растении оно находится, в крушине и жостере – франгуло-эмодин, в ревене и щавеле – реум-эмодин, в алоэ – алоэ-эмодин.
Производные ализарина содержатся в марене красильной.
Вышеуказанные мономерные соединения хризацинового типа и их гликозиды содержатся в крушине ольховидной, ревене тангутстком, кассии остролистной (=сенне), алоэ древовидном, жостере слабительном, щавеле конском, обусловливая их слабительное действие.
Ализарин и его производные содержатся в марене красильной и обладают спазмолитическим и мочегонным действием, а поэтому применяются для лечения почечно-каменной болезни
Фармакологические свойства антраценпроизводных. Несмотря на близость химической структуры антраценпроизводных, они отличаются друг от друга по медико-фармакологическому действию.
ЛРС, содержащее производные хризацина (это: кассия остролистная, крушина ольховидная, жостер слабительный, ревень тангутсткий, щавель конский) применяется как слабительное средство. Слабительный эффект наступает через 8-10 часов после приема препаратов. Это связано с тем, что сами по себе антрагликозиды не активны. Они медленно гидролизуются в желудочно-кишечном тракте ферментами организма и присутствующей бактериальной флоры в щелочной среде с высвобождением агликонов антраценпроизводных. Последние раздражают рецепторы нижнего отдела толстого кишечника, в результате чего усиливается перистальтика, расслабляется и сокращается кишечная мускулатура и проявляется слабительное действие. Препараты слабительного действия: Рамнил (из крушины), Кафиол, Регулакс, Глаксена, Сенаде, Пурсенид (из сенны) и др.
Необходимо сказать, что бытующее у населения мнение о безвредности слабительных средств растительного происхождения необоснованно. Препараты антрагликозидов не рекомендуется длительно применять во избежание нарушений вводно-солевого обмена и нарушения питания организма. Кроме того, препараты противопоказаны при воспалительных процессах в брюшной полости и острых лихорадочных состояниях, при запорах неврогенного и эндокринного происхождения, нарушениях функций почек.
Источник