Лекарственное растительное сырье щавеля конского корни анализируют по содержанию
В медицинской практике широко применяются лекарственные препараты на основе лекарственного растительного сырья (ЛРС), содержащего антраценпроизводные [4, 5], а именно: листья и плоды кассии остролистной (Сassia acutifolia Del.), или сенны александрийской (Senna alexandrina Mill.), листья и плоды кассии узколистной (Cassia angustifolia Vahl.), трава зверобоя продырявленного (Hypericum perforatum L.) и трава зверобоя пятнистого (Hypericum maculatum Grantz.).
Одной из актуальных проблем в фармации является совершенствование методов анализа ЛРС и фитопрепаратов, причем одной из противоречивых проблем с точки зрения фармакопейного анализа является стандартизация ЛРС, содержащего антраценпроизводные. Внедрение методов тонкослойной хроматографии (ТСХ) и высокоэффективной жидкостной хроматографии (ВЭЖХ) открыло новые возможности для целей стандартизации ЛРС и фитопрепаратов, что нашло отражение в вышедшей в свет Государственной фармакопее Российской Федерации XIII издания [2]. в Государственную фармакопею Российской Федерации XIII издания включены виды сырья вышеперечисленных лекарственных растений: ФС.2.5.0038.15 «Сенны листья», ФС 2.5.0021.15 «Крушины ломкой кора», ФС 2.5.0014.15 «Жостера слабительного плоды», 2.5.0052.15 «Щавеля конского корни» и 2.5.0015.15 «Зверобоя трава», однако по-прежнему актуальной остается проблема совершенствования методов стандартизация ЛРС и фитопрепаратов,
Цель настоящих исследований – научное обоснование методологических подходов к стандартизации лекарственного растительного сырья, содержащих антраценпроизводные.
Материалы и методы исследования
В качестве объектов исследования служили кора крушины ломкой (Frangula alnus Mill.), плоды жостера слабительного (Rhamnus cathartica L.), корни щавеля конского (Rumex confertus Willd.), листья сенны александрийской (Cassia acutifolia Del.), трава зверобоя продырявленного (Hypericum perforatum L.) и трава зверобоя пятнистого (Hypericum maculatum Grantz.), а также антраценпроизводные и флавоноиды, выделенные из вышеперечисленного ЛРС. Выделение индивидуальных веществ из ЛРС осуществляли с использованием колоночной хроматографии. Контроль за разделением веществ осуществляли с помощью ТСХ-анализа на пластинках «Сорбфил ПТСХ-АФ-А-УФ». Cпектры ЯМР 1Н и ЯМР 13С получали на приборе «Bruker AM 300», масс-спектры снимали на масс-спектрометре «Kratos MS-30», регистрацию УФ-спектров проводили с помощью спектрофотометра «Specord 40» (Analytik Jena).
Результаты исследования и их обсуждение
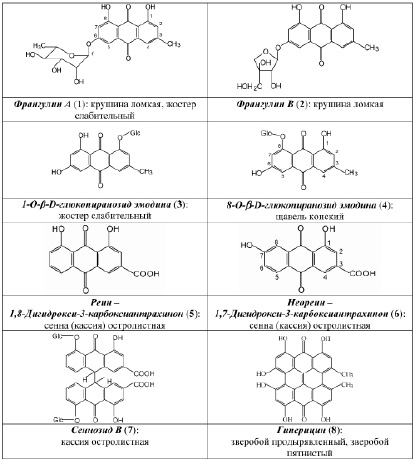
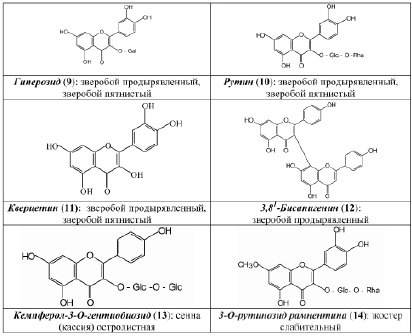
В результате исследования компонентного состава коры крушины ломкой, плодов жостера слабительного, корней щавеля конского, листьев сенны александрийской, травы зверобоя продырявленного и травы зверобоя пятнистого выделены в индивидуальном виде доминирующие вещества, представленные антраценпроизводными (1–8) (рис. 1) и флавоноидами (9–14) (рис. 2).
В ходе научного обоснования подходов к стандартизации ЛРС, содержащего антраценпроизводные, нами принималось во внимание то обстоятельство, что наряду с антраценпроизводными в сырье содержатся и другие БАС, частности, флавоноиды и дубильные вещества [3], которые представляют интерес с точки зрения диагностики. Так, в листьях сенны александрийской и сенны узколистной флавоноид кемпферол-3–O-гентиобиозид (13) является доминирующим фенольным компонентом и во многом определяет УФ-спектр водно-спиртовых извлечений сырья данных растений. в плодах жостера слабительного доминирующим фенольным компонентом является 3–О-рутинозид рамнетина (14) (флавоноид). в корнях щавеля конского второй группой БАС являются дубильные вещества. Трава зверобоя продырявленного и трава зверобоя пятнистого с точки зрения химической классификации относятся к флавоноидам, однако очень важным является учет наличия в сырье данных растений антраценпроизводных, которые обусловливают антидепрессантное действие лекарственных препаратов на основе травы зверобоя и рассматриваются за рубежом как их критерии качества.
Следовательно, успешное решение проблемы стандартизации возможно лишь на основе учета совокупной значимости содержащихся в сырье различных групп БАС.
Качество сырья «Зверобоя трава» регламентирует ГФ РФ XIII издания (ФС.2.5.0015.15). Раздел «Подлинность» наряду с внешними и микроскопическими признаками включает определение основных групп биологически активных веществ с использованием ТСХ и стандартного образца рутина (10), являющегося 3–О-рутинозидом кверцетина (11). на наш взгляд, в данном методе целесообразно было бы использование ГСО гиперозида (9) – второго по значимости (после рутина) флавоноида для зверобоя продырявленного и доминирующего флавоноида в траве зверобоя пятнистого. Кроме того, использование второго стандарта в методиках – довольно часто применяемый методический подход, который соответствует современным тенденциям фармацевтического анализа.
Количественное определение суммы флавоноидов осуществляют методом дифференциальной спектрофотометрии при аналитической длине волны 415 нм с использованием ГСО рутина. на наш взгляд, было бы целесообразным определение в траве зверобоя не только суммы флавоноидов, но и суммы антраценпроизводных, принимая во внимание то обстоятельство, что данная группа веществ, во-первых, отвечает за антидепрессантный эффект, а, во-вторых, тот факт, что в Европейской фармакопее стандартизация данного сырья осуществляется по содержанию антраценпроизводных (в пересчете на гиперицин). Сравнительное исследование химического состава сырья фармакопейных видов зверобоя показало (метод ВЭЖХ), что в траве зверобоя продырявленного среди флавоноидов преобладает рутин [5], тогда как в траве зверобоя пятнистого доминирует гиперозид (9). Кроме того, в последнем виде не обнаружен 3,811–бисапигенин (12), содержащийся в траве зверобоя продырявленного и обладающий, по нашим данным, антидепрессантной активностью. Результаты данных исследований свидетельствуют о целесообразности стандартизации сырья и препаратов зверобоя не только по содержанию флавоноидов, но и антраценпроизводных.
Рис. 1. Антраценпроизводные фармакопейных растений
Рис. 2. Флавоноиды антраценсодержащих фармакопейных растений
Одной из нерешенных проблем с точки зрения фармакопейного анализа является стандартизация сырья видов кассии, или сенны. Целесообразность внедрения новых современных методов анализа связана с тем, что в существующих подходах к анализу не в полной мере используется все разнообразие химического состава сырья кассии [1, 2, 6–8]. на наш взгляд, актуальным является учет значимости флавоноидов, в частности, кемпферол-3–О-гентиобиозида (13), как по содержанию, так и по возможному вкладу в фармакологическое действие препаратов на основе кассии.
С использованием ТСХ обнаружено, что именно кемпферол-3–О-гентиобиозид является доминирующим компонентом листьев сенны. на наш взгляд, обнаружение методом ТСХ данного соединения, диагностически значимого для листьев сенны, является перспективным подходом в плане идентификации сырья данного растения. Это тем более важно, что в силу невысокого содержания сеннозида а и в в листьях кассии [6, 8] определение данных антрагликозидов методом ТСХ весьма проблематично. по нашим данным, доминирующим соединением листьев кассии является близкий к реину (5) по хроматографической подвижности и физико-химическим характеристикам 1,7–дигидрокси-3–карбоксиантрахинон (6), являющийся новым природным соединением.
Кроме того, методика количественного определения суммы антраценпроизводных, включенная в ФС.2.5.0038.15 «Сенны листья», на наш взгляд, имеет ряд недостатков: является многостадийной и небезопасной, включающей такие стадии, как кислотный гидролиз, многократную экстракцию сырья, обработку диэтиловым эфиром – легкокипящим огнеопасным растворителем. Методики количественного определения антраценпроизводных, включенные в зарубежные фармакопеи, с точки зрения пробоподготовки сопоставимы с ГФ СССР XI издания [1] и ГФ РФ XIII издания (ФС.2.5.0038.15 «Сенны листья») и отличаются только значением используемой аналитической длиной волны (515 нм вместо 523 нм), а также подходом [7], предусматривающим расчет содержания на сеннозид в (7).
В соответствии с Европейской фармакопеей для расчета содержания суммы антраценпроизводных целесообразно использовать теоретическое значение удельного показателя поглощения (240) стандартного образца сеннозида в [7]. Видимо, поэтому наблюдается расхождения в регламентируемых числовых показателях: содержание сырье суммы агликонов антраценового ряда в пересчете на хризофановую кислоту не менее 1,35 % и содержание суммы антрагликозидов не менее 2,5 % в пересчете на сеннозид B [7].
Аналогичные проблемы нами решены и при разработке методик качественного и количественного анализа плодов жостера слабительного, коры крушины ломкой и корней щавеля конского [4], в случае которых обосновано использование стандартных образцов франгулина а (1) и 8–О-b-D-глюкопиранозида эмодина (4). Так, в случае коры крушины ломкой ГФ РФ XIII издания раздел «Подлинность» включает определение основных групп биологически активных веществ с использованием ТСХ и стандартного образца барбалоина. Методический подход, предусматривающий определение подлинности по отсутствию барбалоина, который в отличие от франгулина а (1) и франшулина в (2) не содержится в коре крушины, представляется ошибочным решением. Что касается раздела «Количественное определение», то представляется нелогичным включение в ГФ РФ XIII издания (двух методик – из ГФ СССР XI издания (в пересчете на истизин) и Европейской фармакопеи (в пересчете на глюкофрангулин А). Видимо, поэтому числовой показатель «сумма антрагликозидов» в отечественной и европейской фармакопеях отличаются значительно – 4,5 % и 7 % соответственно. Нами на примере данного сырья показано, что определение содержания антраценпроизводных целесообразно определять без сочетания таких стадий или процессов, как кислотный гидролиз (ледяная уксусная кислота) и экстракция (диэтиловый эфир). при этом определение содержания суммы антраценпроизводных осуществляется методом спектрофотометрии при длине волны 524 нм в пересчете на франгулин А, являющийся доминирующим антрагликозидом коры крушины.
Выводы
Таким образом, результаты проведенных исследований позволили научно обосновать новые подходы к стандартизации фармакопейных видов ЛРС, содержащих антраценпроизводные. Доказано, что в сырье растений (виды зверобоя, виды кассии, жостер слабительный), содержащих одновременно антраценпроизводные и флавоноиды, стандартизацию целесообразно осуществлять с учетом обеих групп действующих веществ.
Источник
ФС.2.5.0052.15 Щавеля конского корни
Содержимое (Table of Contents)
ФС.2.5.0052.15 Щавеля конского корни
Собранные осенью или весной, тщательно отмытые и высушенные корни дикорастущего многолетнего травянистого растения щавеля конского – Rúmex confértus Willd., сем. гречишных — Polygonaceae.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАКОПЕЙНАЯ СТАТЬЯ
Щавеля конского корни ФС.2.5.0052.15
Rúmicis conférti radices Взамен ВФС 42-1077-81
Собранные осенью или весной, тщательно отмытые и высушенные корни дикорастущего многолетнего травянистого растения щавеля конского – Rúmex confértus Willd., сем. гречишных — Polygonaceae.
ПОДЛИННОСТЬ
Внешние признаки. Цельное сырье. Цельные или продольно разрезанные корни, твердые, продольно-морщинистые, прямые или слегка изогнутые, длиной 3 – 10 см, толщиной 2 – 10 см. Излом неровный. Цвет снаружи – темно-коричневый, на изломе — желтовато-коричневый или серовато-коричневый, внутри – желто-оранжевый. Запах слабый, своеобразный. Вкус водного извлечения горьковатый, вяжущий.
Микроскопические признаки. Цельное сырье. При рассмотрении на поперечном срезе должно быть видно вторичное строение корня: пробковый слой состоит из старых слущивающихся слоев и новых слоев, состоящих из ровных 3 – 5 рядов клеток правильной прямоугольной формы. К центру от пробки находится основная паренхима коровой части корня, прямоугольные клетки которой имеют более или менее утолщенные клеточные стенки, неправильное очертание полостей и располагаются рядами – от 8 до 10. К центру от камбия расположены элементы вторичной ксилемы, а к периферии
— вторичная флоэма. Во вторичной ксилеме хорошо заметны 3 – 4 широких первичных радиальных луча паренхимы, достигающих центра корня, первичной ксилемы.
Рисунок 1 – Щавеля конского корни (поперечный срез).
А – общий вид (20×); Б – фрагмент коры (100×); окраска натрия гидроксида раствором 5 %. 1 – пробка; 2 – паренхима коры; 3 – камбий; 4 –сосуды ксилемы; 5 – первичная ксилема; 6 – каменистые клетки; 7 – друзы
Рисунок 2 – Щавеля конского корни (продольный срез).
1 – паренхима коровой части; 2 – склереиды; 3 – пробка (400×)
Рисунок 3 – Щавеля конского корни (продольный срез). Коровая часть.
А – общий вид (100×); Б – паренхима коровой части (400×). 1 – паренхима коровой части; 2 – пробка; 3 – склереиды; 4 – лубяные волокна
На продольном срезе коровой части хорошо заметны элементы механической ткани – склереиды. Они представлены клетками округлой формы, желтого цвета с серединным щелевидным просветом, в которых отсутствуют или изредка присутствуют поровые каналы.
Лубяные волокна локализуются во флоэме корня и в поперечном сечении имеют продолговатую, прозенхимную форму.
Определение основных групп биологически активных веществ
Тонкослойная хроматография
На линию старта аналитической хроматографической пластинки со слоем силикагеля на алюминиевой или полимерной подложке размером
10 × 15 см наносят 10 мкл испытуемого раствора (см. раздел «Количественное определение» приготовление раствора Б испытуемого раствора) и рядом 20 мкл раствора стандартного образца (СО) 8-O-β-D-глюкозида эмодина (см. раздел «Количественное определение» приготовление раствора А СО 8-O-β-D-глюкозида эмодина). Пластинку с нанесенными пробами сушат на воздухе, помещают в хроматографическую камеру, предварительно насыщенную в течение не менее 1 ч смесью растворителей н-бутанол – уксусная кислота ледяная – вода (4:1:5), и хроматографируют восходящим способом. Когда фронт растворителей пройдет около 80 – 90 % длины пластинки от линии старта, ее вынимают из камеры, сушат до удаления следов растворителей. Пластинку обрабатывают диазореактивом, нагревают при 100 – 105 °С в течение 5 мин и просматривают при дневном свете.
На хроматограмме испытуемого раствора должна обнаруживаться зона адсорбции розового цвета на уровне зоны адсорбции розового цвета на хроматограмме раствора СО 8-O-β-D-глюкозида эмодина; допускается обнаружение других зон адсорбции.
ИСПЫТАНИЯ
Влажность. Цельное сырье – не более 13 %.
Зола общая. Цельное сырье — не более 10 %.
Зола, нерастворимая в хлористоводородной кислоте. Цельное сырье — не более 5 %.
Измельченность сырья. Цельное сырье: частиц, проходящих сквозь сито с отверстиями размером 2 мм, — не более 5 %.
Посторонние примеси
Корневища с остатками неотделенных стеблей. Цельное сырье – не более 5 %.
Кусочки корней короче 2 см. Цельное сырье – не более 3 %.
Органическая примесь. Цельное сырье – не более 1 %.
Минеральная примесь. Цельное сырье – не более 0,5 %.
Радионуклиды. В соответствии с требованиями ОФС «Определение содержания радионуклидов в лекарственном растительном сырье и лекарственных растительных препаратах».
Микробиологическая чистота. В соответствии с требованиями ОФС «Микробиологическая чистота».
Количественное определение. Цельное сырье: сумма антраценпроизводных в пересчете на 8-O-β-D-глюкозид эмодина — не менее 3 %.
Раствор СО 8-O-β-D-глюкозида эмодина. Около 0,02 г (точная навеска) СО 8-O-β-D-глюкозида эмодина помещают в мерную колбу вместимостью 50 мл, растворяют в 30 мл спирта 96 % при нагревании. Затем содержимое колбы охлаждают до комнатной температуры, доводят объем раствора спиртом 96 % до метки и перемешивают (раствор А СО 8-O-β-D-глюкозида эмодина). Срок годности раствора 30 сут.
1,0 мл раствора А СО 8-O-β-D-глюкозида эмодина помещают в мерную колбу вместимостью 25 мл, доводят объем раствора щелочно-аммиачным раствором до метки, перемешивают, затем раствор переносят в колбу вместимостью 50 мл и нагревают с обратным холодильником на кипящей водяной бане в течение 15 мин и охлаждают (раствор Б СО 8-O-β-D-глюкозида эмодина).
Щелочно-аммиачный раствор. 50,0 г натрия гидроксида растворяют при перемешивании в 870 мл воды. После охлаждения к раствору прибавляют 80 мл аммиака раствора концентрированного и перемешивают. Срок годности раствора 1 сут.
Аналитическую пробу сырья измельчают до величины частиц, проходящих сквозь сито с отверстиями размером 1 мм. Около 1,0 г (точная навеска) измельченного сырья помещают в колбу со шлифом вместимостью 250 мл, прибавляют 50 мл спирта 70 %. Колбу закрывают пробкой и взвешивают с точностью до ± 0,01 г, присоединяют к обратному холодильнику и нагревают на кипящей водяной бане (умеренное кипение) в течение 90 мин. Затем охлаждают в течение 30 мин, закрывают той же пробкой, снова взвешивают и восполняют недостающий экстрагент до первоначальной массы. Извлечение фильтруют через бумажный фильтр (раствор А испытуемого раствора)
1,0 мл раствора А испытуемого раствора помещают в мерную колбу вместимостью 50 мл, доводят объем раствора щелочно-аммиачным раствором до метки, перемешивают и нагревают в течение 15 мин на кипящей водяной бане с обратным холодильником (раствор Б испытуемого раствора). После охлаждения измеряют оптическую плотность раствор Б испытуемого раствора на спектрофотометре при длине волны 520 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения используют:
1 мл спирта 70 % помещают в мерную колбу вместимостью 50 мл, доводят объем раствора щелочно-аммиачным раствором до метки, перемешивают и нагревают в течение 15 мин на кипящей водяной бане с обратным холодильником.
Параллельно измеряют оптическую плотность раствора Б СО 8-O-β-D-глюкозида эмодина. В качестве раствора сравнения используют: 1 мл спирта 96 % помещают в мерную колбу вместимостью 25 мл, доводят объем щелочно-аммиачным раствором до метки, перемешивают, помещают в мерную колбу вместимостью 50 мл и нагревают в течение 15 мин на кипящей водяной бане с обратным холодильником.
Содержание суммы антраценпроизводных в пересчете на 8-O-β-D-глюкозида эмодин в абсолютно сухом сырье в процентах (X) вычисляют по формуле:
A – оптическая плотность раствор Б испытуемого раствора;
Ao – оптическая плотность раствора Б СО 8-O-β-D-глюкозида эмодина;
a – навеска сырья, г;
aо – навеска СО 8-O-β-D-глюкозида эмодина, г;
Р – содержание основного вещества в СО 8-O-β -D-глюкозида эмодина, %;
W – влажность сырья, %.
Допускается содержание суммы антраценпроизводных в пересчете на 8-O-β-D-глюкозида эмодин вычислять с использованием удельного показателя поглощения 8-O-β-D-глюкозида эмодина с щелочно-аммиачным раствором по формуле:
где A – оптическая плотность раствор Б испытуемого раствора;

a – навеска сырья, г;
W – влажность сырья, %.
Упаковка, маркировка и транспортирование. В соответствии с требованиями ОФС «Упаковка, маркировка и транспортирование лекарствен-
ного растительного сырья и лекарственных растительных препаратов».
Источник