Лекарственное растительное сырье часть 2
Самылина И.А., Сорокина А.А., Пятигорская Н.В.
НИИ фармации ММА им. И.М. Сеченова, Москва
Лекарственные растения используют в медицинской практике в высушенном, реже – свежем, виде. Из высушенного лекарственного растительного сырья готовят настои и отвары, из свежих растений – соки, отвары; отдельные части растений иногда прикладывают на пораженный участок тела. Настои и отвары – это древнейшая лекарственная форма, упоминание о которой встречается в трудах арабских и древнегреческих врачей и ученых.
Настои и отвары входили во все издания Российской фармакопеи, начиная с первого (1866). Широкое применение этой лекарственной формы как в официальной, так и в народной медицине определяется ее преимуществами: многосторонним и мягким терапевтическим действием, возможностью применения в течение длительного времени, отсутствием побочных эффектов, немногочисленными противопоказаниями, простотой изготовления, экономической доступностью для всех слоев населения.
В Государственный реестр лекарственных средств, разрешенных к медицинскому применению в Российской Федерации, включено 260 видов лекарственного растительного сырья, 120 из них (46 % от общего количества) разрешены к применению в виде настоев и отваров для внутреннего и наружного применения. В качестве сырьевых источников для изготовления водных извлечений используются все морфологические группы сырья: цветки, листья травы, почки, кора, плоды, семена и подземные органы. Чаще всего применяются травы (36 видов), плоды (22 вида), подземные органы (20 видов) и листья (18 видов). Из 120 видов сырья два (трава горицвета и трава термопсиса ланцетовидного) разрешены к изготовлению настоев только в аптеках как компоненты микстуры Бехтерева и микстуры от кашля для взрослых, остальные 118 видов могут отпускаться больному для использования в домашних условиях. Восемь видов сырья, относящихся к сильнодействующим лекарственным средствам (список Б), должны отпускаться из аптеки по рецепту врача: трава чистотела, побеги багульника, сбор “Астматол” (листья красавки, дурмана обыкновенного и белены), сбор по прописи Здренко M.Н. (трава аврана, трава василистника малого, корни окопника шероховатого); 110 видов разрешены для безрецептурного отпуска населению.
Сырье, применяемое для получения настоев и отваров, содержит различные группы биологически активных веществ (БАВ): алкалоиды, антраценпроизводные, витамины, горечи, дубильные вещества, кумарины, ксантоны, лигнаны, полисахариды, сапонины, сердечные гликозиды, флавоноиды, фенолгликозиды, эфирные масла. Наиболее широко для изготовления водных извлечений используется лекарственное растительное сырье, содержащее эфирные масла, горечи, флавоноиды, витамины, полисахариды.
Государственная фармакопея (ГФ) указывает, что при изготовлении настоев и отваров используется только растительное сырье, отвечающее требованиям соответствующей нормативной документации. Часть (23,1 %) сырья, используемого для изготовления настоев и отваров, фасуется в потребительские упаковки без предварительного измельчения (плоды, семена, почки, цветки), остальные виды имеют различную дисперсность. Подавляющая часть сырья имеет размер частиц, проходящих сквозь сито диаметром 7 мм; листья эвкалипта – 5 мм, толокнянки, брусники – 3 мм; сырье, фасованное в фильтр-пакеты, – 2 мм. Кроме того, настои получают из лекарственного растительного сырья механической уборки (обмолоченного), где по нормативному документу устанавливаются следующие размеры: “до 10 мм и более” – листья мяты, “от 1 до 35 мм” – листья шалфея. В производстве сборов, фасованных в пачки, используется сырье размером с частицы, проходящие сквозь сито с диаметром отверстий 7 и 5 мм, а фасованного в фильтр-пакеты – 2 мм.
Статьи, посвященные настоям и отварам, во всех изданиях фармакопеи, вплоть до ныне действующего XI, представляют собой конкретные указания по технологии изготовления водных извлечений (условия экстрагирования, фильтрования и т. д.). Согласно фармакопее, измельченное растительное сырье помещают в сосуд фарфоровый, эмалированный или из нержавеющей стали, заливают водой комнатной температуры, закрывают крышкой и нагревают на кипящей водяной бане при частом перемешивании в течение 15 минут (настои) или 30 минут (отвары). Затем сосуд снимают с водяной бани и охлаждают при комнатной температуре 10 минут (отвары) или 45 минут (настои), после чего процеживают. Остаток сырья отжимают и к готовому извлечению добавляют воду до предписанного объема. Отвары из листьев толокнянки, коры дуба, корневища змеевика и другого лекарственного сырья, содержащего дубильные вещества, процеживают немедленно после снятия с водяной бани; отвары из листьев сенны – после полного охлаждения. Если нет специальных указаний в рецепте, водные извлечения из лекарственного растительного сырья готовят в соотношении 1 : 10, т. е. из 1 части массы измельченного сырья получают 10 объемных частей настоя или отвара.
Настои из травы горицвета, корневищ с корнями валерианы готовят в соотношении 1 : 30, а из растительного сырья группы сильнодействующих – 1 : 400. При изготовлении отваров растительное сырье поглощает часть жидкости, в связи с чем воды следует брать несколько больше, чем указано в прописи. При приготовлении водных извлечений из корней следует дополнительно брать воды в 1,5 раза больше по отношению к массе сырья, из коры, травы и цветков — примерно в 2, а из семян – в 3 раза больше. Хранят настои и отвары в прохладном месте, лучше – в холодильнике, но не дольше 2 суток.
Кроме ГФ нормативно-правовыми документами, регламентирующими изготовление водных извлечений из лекарственного растительного сырья, являются приказы МЗ РФ. Так, приказ “Об утверждении инструкции по изготовлению в аптеках жидких лекарственных форм” № 308 от 21.10.1997 ввел в действие с 01.01.1998 инструкцию, которая регламентирует основные правила изготовления жидких лекарственных форм, в т. ч. водных извлечений из лекарственного растительного сырья и микстур, содержащих водные извлечения. Инструкция содержит методику изготовления, рассчитанную на получение в условиях аптеки извлечения из сбора, изготовляемого также в аптеке.
Еще одним документом, несущим официальную информацию по лекарственному средству, в частности лекарственному растительному сырью, используемому для изготовления водных извлечений, являются листок-вкладыш или инструкция по медицинскому применению, текст которой размещен на упаковке с сырьем. Информация о лекарственном средстве как социально значимом продукте, применение которого связано не только с положительными свойствами, но и с риском развития побочных эффектов, должна жестко регулироваться. В официальной информации недопустимо приведение неподтвержденных мнений, гипотез, предположений, промежуточных результатов незавершенных исследований.
В 1960-х – начале 70-х гг. в экстемпоральной рецептуре аптек встречалось значительное число рецептов с микстурами на основе настоев. Наиболее повторяющиеся вошли в перечень внутриаптечных заготовок, а две из них (микстура Траскова и микстура Бехтерева) впоследствии выпускались на фармацевтической фабрике. Технологии изготовления этих лекарственных форм на основе водных извлечений были подробно описаны в соответствующих мануальных справочниках. До настоящего времени, несмотря на широкий ассортимент лекарственных средств промышленного изготовления, популярностью пользуются изготовленные в аптеках микстура от кашля для взрослых и микстура от кашля для детей.
Лекарственные средства, которые не стерилизуются в процессе производства, могут быть контаминированы микроорганизмами. По своей природе водные извлечения подвержены интенсивному микробному обсеменению, поскольку являются хорошей средой для микроорганизмов. В процессе их хранения уровень микробной обсемененности возрастает. Проведенные исследования показали, что хранение настоев и отваров в прохладном месте обеспечивает их микробную стабильность только в течение 2–3 суток с момента изготовления.
Развитию лекарственной формы “настои и отвары”, внедрению ее в отечественное промышленное производство мешает ряд недостатков, основными из которых являются нестандартность (отсутствие четких критериев оценки качества) и нестокость при хранении. Вместе с тем за рубежом существуют лекарственные средства, в состав которых входят водные извлечения. Например, препараты Мараславин (Болгария), Геделикс (Германия), Доппельгерц Энерготоник (Германия), Ночной сон (Нидерланды).
В свете проблемы совершенствования водных извлечений представляет интерес такая форма выпуска жидких лекарственных средств для внутреннего применения, как “питьевые ампулы”, популярная во Франции и других странах. Она представляет собой водные растворы, фасованные в ампулы по 10 мл. Содержимое вскрытой ампулы используется как разовая доза для приема внутрь.
Еще одним направлением совершенствования данной лекарственной формы является использование сухих стандартизованных экстрактов-концентратов, предназначенных для быстрого приготовления водных извлечений как в домашних, так и в условиях аптечного производства. Стандартизованные сухие экстракты-концентраты содержат действующие вещества в количестве, равном их содержанию в исходном лекарственном растительном сырье. В качестве экстракта-концентрата для изготовления водных извлечений выпускают экстракт алтейного корня сухой и экстракт термопсиса сухой. Особенно перспективен перевод водных извлечений в сухие экстракты для сборов, содержащих максимальное число БАВ, необходимых для обеспечения фармакотерапевтического эффекта.
Получение подобных сухих экстрактов позволяет сохранить преимущества сборов, такие как их соответствие поливалентности патогенеза заболеваний, взаимное усиление полезных фармакологических свойств каждого компонента, воздействие в целом на организм больного как корригирующей системы. Одновременно устраняются такие негативные стороны, как возможное нарушение технологии экстракции, изменение соотношения входящих компонентов в процессе расслоения сбора при хранении, нарушение в дозировке и др. Эта лекарственная форма давно нашла широкое распространение за рубежом. Водорастворимые сухие экстракты, получившие название “чай”, производятся фармацевтическими фирмами Германии, США, Болгарии, Чехии, Словакии и других стран. Они представляют собой многокомпонентные препараты, включающие сухие экстракты от 5 до 12 лекарственных растений.
В России ОАО “Московская фармацевтическая фабрика” выпускает сухие микстуры от кашля для взрослых и детей, представляющие собой водорастворимые порошкообразные смеси с сухими экстрактами алтейного корня, травы термопсиса и корня солодки, расфасованные соответственно по 1,7 и 1,47 г в пакеты из ламинированной бумаги. Доза сухой микстуры в пакете рассчитана на 1 прием, ее следует растворить в 15 мл кипяченой и охлажденной воды.
Изучение настоев и отваров требует теоретического и экспериментального обоснования, разработки методологических подходов, позволяющих научно обосновывать решение всех вопросов, связанных с данной лекарственной формой.
Информация об авторах:
Саммита Ирина Александровна — доктор фармацевтических наук, профессор, член-корреспондент
РАМН, директор НИИ фармации; заведующая кафедрой фармакогнозии ММЛ им. ИМ. Сеченова.
Тел. 8(499) 128-57-88;
Сорокина Алла Анатольевна — доктор фармацевтических наук, профессор кафедры
фармакогнозии ММЛ им. И.М. Сеченова.
Тел. 8(495) 120-20-20;
Пятигорская Натальи Валерьевна — кандидат фармацевтических наук, доцент,
заместитель директора НИИ фармации по научной работе.
Тел. 8(499) 128-57-55
Источник
Лекарственное растительное сырье часть 2
В медицинской практике широко применяются лекарственные препараты на основе лекарственного растительного сырья (ЛРС), содержащего антраценпроизводные [4, 5], а именно: листья и плоды кассии остролистной (Сassia acutifolia Del.), или сенны александрийской (Senna alexandrina Mill.), листья и плоды кассии узколистной (Cassia angustifolia Vahl.), трава зверобоя продырявленного (Hypericum perforatum L.) и трава зверобоя пятнистого (Hypericum maculatum Grantz.).
Одной из актуальных проблем в фармации является совершенствование методов анализа ЛРС и фитопрепаратов, причем одной из противоречивых проблем с точки зрения фармакопейного анализа является стандартизация ЛРС, содержащего антраценпроизводные. Внедрение методов тонкослойной хроматографии (ТСХ) и высокоэффективной жидкостной хроматографии (ВЭЖХ) открыло новые возможности для целей стандартизации ЛРС и фитопрепаратов, что нашло отражение в вышедшей в свет Государственной фармакопее Российской Федерации XIII издания [2]. в Государственную фармакопею Российской Федерации XIII издания включены виды сырья вышеперечисленных лекарственных растений: ФС.2.5.0038.15 «Сенны листья», ФС 2.5.0021.15 «Крушины ломкой кора», ФС 2.5.0014.15 «Жостера слабительного плоды», 2.5.0052.15 «Щавеля конского корни» и 2.5.0015.15 «Зверобоя трава», однако по-прежнему актуальной остается проблема совершенствования методов стандартизация ЛРС и фитопрепаратов,
Цель настоящих исследований – научное обоснование методологических подходов к стандартизации лекарственного растительного сырья, содержащих антраценпроизводные.
Материалы и методы исследования
В качестве объектов исследования служили кора крушины ломкой (Frangula alnus Mill.), плоды жостера слабительного (Rhamnus cathartica L.), корни щавеля конского (Rumex confertus Willd.), листья сенны александрийской (Cassia acutifolia Del.), трава зверобоя продырявленного (Hypericum perforatum L.) и трава зверобоя пятнистого (Hypericum maculatum Grantz.), а также антраценпроизводные и флавоноиды, выделенные из вышеперечисленного ЛРС. Выделение индивидуальных веществ из ЛРС осуществляли с использованием колоночной хроматографии. Контроль за разделением веществ осуществляли с помощью ТСХ-анализа на пластинках «Сорбфил ПТСХ-АФ-А-УФ». Cпектры ЯМР 1Н и ЯМР 13С получали на приборе «Bruker AM 300», масс-спектры снимали на масс-спектрометре «Kratos MS-30», регистрацию УФ-спектров проводили с помощью спектрофотометра «Specord 40» (Analytik Jena).
Результаты исследования и их обсуждение
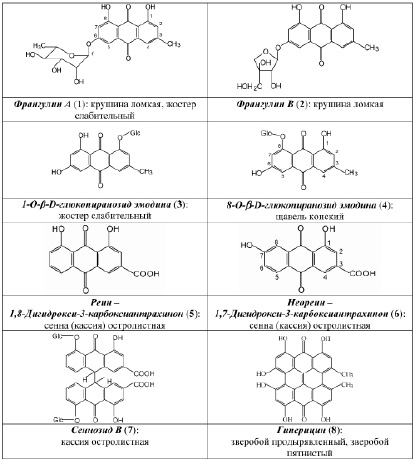
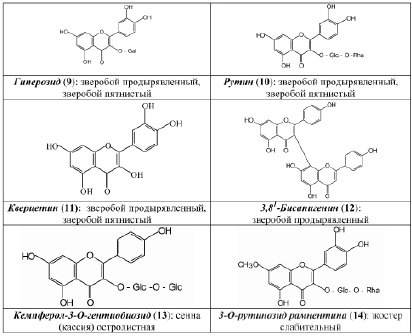
В результате исследования компонентного состава коры крушины ломкой, плодов жостера слабительного, корней щавеля конского, листьев сенны александрийской, травы зверобоя продырявленного и травы зверобоя пятнистого выделены в индивидуальном виде доминирующие вещества, представленные антраценпроизводными (1–8) (рис. 1) и флавоноидами (9–14) (рис. 2).
В ходе научного обоснования подходов к стандартизации ЛРС, содержащего антраценпроизводные, нами принималось во внимание то обстоятельство, что наряду с антраценпроизводными в сырье содержатся и другие БАС, частности, флавоноиды и дубильные вещества [3], которые представляют интерес с точки зрения диагностики. Так, в листьях сенны александрийской и сенны узколистной флавоноид кемпферол-3–O-гентиобиозид (13) является доминирующим фенольным компонентом и во многом определяет УФ-спектр водно-спиртовых извлечений сырья данных растений. в плодах жостера слабительного доминирующим фенольным компонентом является 3–О-рутинозид рамнетина (14) (флавоноид). в корнях щавеля конского второй группой БАС являются дубильные вещества. Трава зверобоя продырявленного и трава зверобоя пятнистого с точки зрения химической классификации относятся к флавоноидам, однако очень важным является учет наличия в сырье данных растений антраценпроизводных, которые обусловливают антидепрессантное действие лекарственных препаратов на основе травы зверобоя и рассматриваются за рубежом как их критерии качества.
Следовательно, успешное решение проблемы стандартизации возможно лишь на основе учета совокупной значимости содержащихся в сырье различных групп БАС.
Качество сырья «Зверобоя трава» регламентирует ГФ РФ XIII издания (ФС.2.5.0015.15). Раздел «Подлинность» наряду с внешними и микроскопическими признаками включает определение основных групп биологически активных веществ с использованием ТСХ и стандартного образца рутина (10), являющегося 3–О-рутинозидом кверцетина (11). на наш взгляд, в данном методе целесообразно было бы использование ГСО гиперозида (9) – второго по значимости (после рутина) флавоноида для зверобоя продырявленного и доминирующего флавоноида в траве зверобоя пятнистого. Кроме того, использование второго стандарта в методиках – довольно часто применяемый методический подход, который соответствует современным тенденциям фармацевтического анализа.
Количественное определение суммы флавоноидов осуществляют методом дифференциальной спектрофотометрии при аналитической длине волны 415 нм с использованием ГСО рутина. на наш взгляд, было бы целесообразным определение в траве зверобоя не только суммы флавоноидов, но и суммы антраценпроизводных, принимая во внимание то обстоятельство, что данная группа веществ, во-первых, отвечает за антидепрессантный эффект, а, во-вторых, тот факт, что в Европейской фармакопее стандартизация данного сырья осуществляется по содержанию антраценпроизводных (в пересчете на гиперицин). Сравнительное исследование химического состава сырья фармакопейных видов зверобоя показало (метод ВЭЖХ), что в траве зверобоя продырявленного среди флавоноидов преобладает рутин [5], тогда как в траве зверобоя пятнистого доминирует гиперозид (9). Кроме того, в последнем виде не обнаружен 3,811–бисапигенин (12), содержащийся в траве зверобоя продырявленного и обладающий, по нашим данным, антидепрессантной активностью. Результаты данных исследований свидетельствуют о целесообразности стандартизации сырья и препаратов зверобоя не только по содержанию флавоноидов, но и антраценпроизводных.
Рис. 1. Антраценпроизводные фармакопейных растений
Рис. 2. Флавоноиды антраценсодержащих фармакопейных растений
Одной из нерешенных проблем с точки зрения фармакопейного анализа является стандартизация сырья видов кассии, или сенны. Целесообразность внедрения новых современных методов анализа связана с тем, что в существующих подходах к анализу не в полной мере используется все разнообразие химического состава сырья кассии [1, 2, 6–8]. на наш взгляд, актуальным является учет значимости флавоноидов, в частности, кемпферол-3–О-гентиобиозида (13), как по содержанию, так и по возможному вкладу в фармакологическое действие препаратов на основе кассии.
С использованием ТСХ обнаружено, что именно кемпферол-3–О-гентиобиозид является доминирующим компонентом листьев сенны. на наш взгляд, обнаружение методом ТСХ данного соединения, диагностически значимого для листьев сенны, является перспективным подходом в плане идентификации сырья данного растения. Это тем более важно, что в силу невысокого содержания сеннозида а и в в листьях кассии [6, 8] определение данных антрагликозидов методом ТСХ весьма проблематично. по нашим данным, доминирующим соединением листьев кассии является близкий к реину (5) по хроматографической подвижности и физико-химическим характеристикам 1,7–дигидрокси-3–карбоксиантрахинон (6), являющийся новым природным соединением.
Кроме того, методика количественного определения суммы антраценпроизводных, включенная в ФС.2.5.0038.15 «Сенны листья», на наш взгляд, имеет ряд недостатков: является многостадийной и небезопасной, включающей такие стадии, как кислотный гидролиз, многократную экстракцию сырья, обработку диэтиловым эфиром – легкокипящим огнеопасным растворителем. Методики количественного определения антраценпроизводных, включенные в зарубежные фармакопеи, с точки зрения пробоподготовки сопоставимы с ГФ СССР XI издания [1] и ГФ РФ XIII издания (ФС.2.5.0038.15 «Сенны листья») и отличаются только значением используемой аналитической длиной волны (515 нм вместо 523 нм), а также подходом [7], предусматривающим расчет содержания на сеннозид в (7).
В соответствии с Европейской фармакопеей для расчета содержания суммы антраценпроизводных целесообразно использовать теоретическое значение удельного показателя поглощения (240) стандартного образца сеннозида в [7]. Видимо, поэтому наблюдается расхождения в регламентируемых числовых показателях: содержание сырье суммы агликонов антраценового ряда в пересчете на хризофановую кислоту не менее 1,35 % и содержание суммы антрагликозидов не менее 2,5 % в пересчете на сеннозид B [7].
Аналогичные проблемы нами решены и при разработке методик качественного и количественного анализа плодов жостера слабительного, коры крушины ломкой и корней щавеля конского [4], в случае которых обосновано использование стандартных образцов франгулина а (1) и 8–О-b-D-глюкопиранозида эмодина (4). Так, в случае коры крушины ломкой ГФ РФ XIII издания раздел «Подлинность» включает определение основных групп биологически активных веществ с использованием ТСХ и стандартного образца барбалоина. Методический подход, предусматривающий определение подлинности по отсутствию барбалоина, который в отличие от франгулина а (1) и франшулина в (2) не содержится в коре крушины, представляется ошибочным решением. Что касается раздела «Количественное определение», то представляется нелогичным включение в ГФ РФ XIII издания (двух методик – из ГФ СССР XI издания (в пересчете на истизин) и Европейской фармакопеи (в пересчете на глюкофрангулин А). Видимо, поэтому числовой показатель «сумма антрагликозидов» в отечественной и европейской фармакопеях отличаются значительно – 4,5 % и 7 % соответственно. Нами на примере данного сырья показано, что определение содержания антраценпроизводных целесообразно определять без сочетания таких стадий или процессов, как кислотный гидролиз (ледяная уксусная кислота) и экстракция (диэтиловый эфир). при этом определение содержания суммы антраценпроизводных осуществляется методом спектрофотометрии при длине волны 524 нм в пересчете на франгулин А, являющийся доминирующим антрагликозидом коры крушины.
Выводы
Таким образом, результаты проведенных исследований позволили научно обосновать новые подходы к стандартизации фармакопейных видов ЛРС, содержащих антраценпроизводные. Доказано, что в сырье растений (виды зверобоя, виды кассии, жостер слабительный), содержащих одновременно антраценпроизводные и флавоноиды, стандартизацию целесообразно осуществлять с учетом обеих групп действующих веществ.
Источник