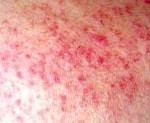
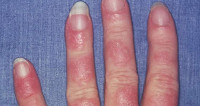
Лекарственная волчанка
Лекарственная волчанка – обратимый волчаночноподобный синдром, вызванный приемом лекарственных препаратов. Клинические проявления лекарственной волчанки сходны с СКВ и включают лихорадку, артралгии, миалгии, полиартрит, плеврит, пневмонит, гепатомегалию, гломерулонефрит. Диагноз основывается на характерных лабораторных критериях (определении в крови антинуклеарного фактора, антинуклеарных антител, LE-клеток) и связи симптоматики с приемом определенных лекарственных медикаментов. Обычно проявления лекарственной волчанки исчезают после отмены причинно значимого препарата; в тяжелых случаях назначаются кортикостероидные препараты.
Общие сведения
Лекарственная волчанка (лекарственный волчаночный синдром) – симптомокомплекс, обусловленный побочным действием лекарственных средств и регрессирующий после их отмены. Лекарственная волчанка по своим клиническим проявлениям и иммунобиологическим механизмам сходна с системной красной волчанкой. В ревматологии лекарственная волчанка диагностируется примерно в 10 раз реже, чем идиопатическая СКВ. В большинстве случаев лекарственно-индуцированный волчаночноподобный синдром развивается у пациентов в возрасте старше 50 лет, практически с одинаковой частотой у мужчин и женщин.
Причины лекарственной волчанки
Развитие лекарственной волчанки может провоцироваться длительным применением или высокими дозировками большого круга лекарственных препаратов. К медикаментам с известным побочным эффектом относятся антигипертензивные (метилдопа, гидралазин, атенолол), противоаритмические (новокаинамид), противотуберкулезные (изониазид), противосудорожные средства (гидантоин, фенитоин), сульфаниламиды и антибиотики (пенициллин, тетрациклин), нейролептики (хлорпромазин), соли лития, золота и другие препараты. Чаще всего лекарственная волчанка возникает у пациентов, страдающих артериальной гипертензией, аритмией, туберкулезом, эпилепсией, ревматоидным артритом, инфекционными заболеваниями и принимающих перечисленные препараты. Возможно развитие волчаночноподобного синдрома у женщин, длительно применяющих оральные контрацептивы.
Патогенез лекарственной волчанки связывается со способностью названных лекарственных препаратов вызывать в организме образование антинуклеарных антител (АНА). Большую роль в предрасположенности к патологии играет генетическая детерминация, а именно – ацетилирующий фенотип пациента. Медленное ацетилирование данных препаратов ферментами печени сопровождается выработкой более высоких титров AHA и более частым развитием лекарственной волчанки. Вместе с тем, у больных с волчаночным синдромом, индуцированным новокаинамидом или гидралазином, выявляется медленный тип ацетилирования.
В целом вероятность развития лекарственной волчанки зависит от дозы препарата и длительности фармакотерапии. При продолжительном приеме лекарственного средства у 10-30% пациентов, имеющих в сыворотке крови антинуклеарные антитела, развивается волчаночноподобный синдром.
Симптомы лекарственной волчанки
В клинике лекарственной волчанки преобладают общие проявления, суставной и кардио-пульмональный синдромы. Заболевание может манифестировать остро или постепенно с таких неспецифических симптомов, как недомогание, миалгия, лихорадка, незначительная потеря массы тела. 80% пациентов беспокоят артралгии, реже – полиартриты. У пациентов, принимающих противоаритмические средства (прокаинамид) наблюдаются серозиты (экссудативный плеврит, перикардит), тампонада сердца, пневмонит, асептические инфильтраты в легких. В ряде случаев возможно развитие лимфаденопатии, гепатомегалии, появление эритематозных высыпаний на коже.
В отличие от идиопатической системной красной волчанки, при лекарственно индуцированном синдроме редко встречаются бабочковидная эритема на щеках, язвенный стоматит, синдром Рейно, алопеция, нефротический синдром, неврологические и психические расстройства (судорожный синдром, психозы). Вместе с тем, для лекарственной волчанки, вызванной приемом апрессина, характерно развитие гломерулонефрита.
Диагностика лекарственной волчанки
От момента появления первых клинических симптомов лекарственной волчанки до постановки диагноза нередко проходит от нескольких месяцев до нескольких лет. В течение этого времени пациенты могут безрезультатно обследоваться у пульмонолога, кардиолога, ревматолога по поводу отдельных проявлений синдрома. Правильная постановка диагноза возможна при всесторонней оценке клинической симптоматики, сопоставлении признаков болезни с приемом определенных лекарственных средств, проведении иммунологических тестов.
Наиболее специфичными лабораторными критериями, указывающими на лекарственную волчанку, служит наличие в крови антинуклеарных антител (антител к гистонам), антинуклеарного фактора, антител к односпиральной ДНК, LE-клеток, снижение уровня комплемента. Менее специфичны для волчаночного синдрома, но высокоспецифичными для СКВ, являются антитела к ds ДНК, анти-Ro/SS-A, Ат к Sm-антигену, анти-La/SS-B. Дифференциальную диагностику лекарственной волчанки необходимо осуществлять с идиопатической СКВ, злокачественными опухолями легких и средостения.
Лечение лекарственной волчанки
Отмена лекарственного препарата, вызвавшего лекарственную волчанку, приводит к постепенному регрессу клинико-лабораторных признаков синдрома. Исчезновение клинической симптоматики обычно происходит в течение нескольких дней или недель после прекращения приема лекарственного средства. Антинуклеарные антитела исчезают медленнее — в течение нескольких месяцев (иногда до 1 года и дольше). С целью купирования суставного синдрома возможно назначение нестероидных противовоспалительных средств. При тяжелом течении лекарственной волчанки, длительной персистенции клинических симптомов обосновано назначение глюкокортикоидов.
Во избежание развития лекарственной волчанки не следует самопроизвольно и бесконтрольно принимать медикаменты; назначение фармакологических средств должно быть обоснованным и согласованным с лечащим врачом. Для предотвращения рецидива волчаночного синдрома необходима адекватная замена причинно значимого препарата альтернативным лекарственным средством.
Источник
Синдром лекарственной волчанки
Полный текст:
Аннотация
Синдром лекарственной волчанки (ЛВ) – аутоиммунный феномен, имеющий сходные клинические и лабораторные проявления с идиопатической системной красной волчанкой (СКВ). К настоящему времени известно примерно о 100 лекарственных средствах (ЛС), ассоциированных с развитием ЛВ. Диагноз ЛВ верифицируется при наличии хронологической связи с длительным приемом ЛС и при обязательном присутствии одного клинического и одного лабораторного диагностических критериев СКВ.
В статье рассмотрены вопросы этиологии, патогенеза и дифференциального диагноза ЛВ. Представлен спектр ЛС, способных вызвать развитие ЛВ. Рассмотрены особенности различных форм ЛВ. На основании данных литературы последних лет проанализировано возникновение аутоиммунных реакций на фоне применения генно-инженерных биологических препаратов (ГИБП), в первую очередь ингибиторов фактора некроза опухоли α. Обсуждаются терапевтические подходы при ЛВ. Даны рекомендации по скринингу больных при назначении ГИБП. Приведены клинические примеры.
Ключевые слова
Об авторах
Наталия Геннадьевна Клюквина.
115522, Москва, Каширское шоссе, 34А.
Литература
1. Насонов ЕЛ. Новые возможности фармакотерапии иммуновоспалительных ревматических заболеваний: фокус на ингибиторы интерлейкина-17. Научно-практическая ревматология. 2017;55(1):68-86. doi: 10.14412/1995-4484-2017-68-86
2. Насонов ЕЛ. Фармакотерапия ревматоидного артрита: новая стратегия, новые мишени. Научно-практическая ревматология. 2017;55(4):409-19. doi: 10.14412/1995-4484-2017-409-419
3. Vasoo S. Drug-induced lupus: an update. Lupus. 2006;15(11):757-61.
4. Vedove CD, Giglio MD, Schena D, Girolomoni G. Drug-induced lupus erythematosus.Arch Dermatol Res.2009 Jan;301(1):99-105. doi: 10.1007/s00403-008-0895-5. Epub 2008 Sep 17.
5. Hoffman BJ. Sensitivity of sulfadiazine resembling acute disseminated lupus erythematosus. Arch Dermatol Syph.1945;51:190-2.
6. Gold S. Role of sulphonamides and penicillin in the pathogenesis in systemic lupus erythematosus. Lancet. 1951 Feb 3;1(6649): 268-72.
7. Honey M. SLE presenting with sulphonamide hypersensitivity. Br Med J. 1956 Jun 2;1(4978):1272-5.
8. Morrow JD, Schroeder HA, Perry HM. Studies on the control of hypertension by Hyphex: II. Toxic reactions and side effects. Circulation. 1953 Dec;8(6):829-39.
9. Beernink DH, Miller JJ. Anticonvulsantinduced antinuclear antibodies and lupus-like disease in children. J Pediatr. 1973 Jan;82(1): 113-7.
10. Sarzi-Puttini P, Atzeni F, Capsoni F, et al. Drug-induced lupus erythematosus. Autoimmunity. 2005 Nov;38(7):507-18.
11. Perry HM, Schroeder HA. Syndrome simulating collagen disease caused by hydralazine (Apresoline). J Am Med Assoc. 1954 Feb 20;154(8):670-3.
12. Ghose MK. Pericardial tamponade. A presenting manifestation of procainamideinduced lupus erythematosus. Am J Med. 1975 Apr;58(4):581-5.
13. Khattak FH, Morris IM, Mattingly PC. Sulphasalazine-induced systemic lupus erythematosus in a patient with rheumatoid arthritis. Br J Rheumatol.1996 Jan;35(1):104.
14. Gordon MM, Porter DR, Capell HA. Does sulphasalazine cause druginduced systemic lupus erythematosus? No effect evident in a prospective randomized trial of 200 rheumatoid arthritis patients treated with either sulphasalazine or auranofin over five years. Ann Rheum Dis. 1999 May;58(5):288-90.
15. Mongey AB, Hess EV. Drug-Induced Disease. In: Lahita RD, editor. Systemic lupus erythematosus. 5th Edition. Elsevier; 2011.P. 599-628.
16. Elkayam O, Yaron M, Caspi D. Minocycline-induced autoimmune syndromes: an overview.Semin Arthritis Rheum. 1999 Jun;28(6):392-7.
17. Spiera RF, Bermman RS, Werner AJ, Spiera H. Ticlopidine-induced lupus: A report of 4 cases.Arch Intern Med. 2002 Oct 28;162(19):2240-3.
18. Atzeni F, Marrazza MG, Sarzi-Puttini P, Carrabba M. Drug-induced lupus erythematosus. Reumatismo. 2003;55(3):147-54.
19. Speirs C, Chapel H, Fielder AL, et al. Complement system protein C4 and susceptibility to hydralazine-induced systemic lupus erythematosus. Lancet. 1989 Apr 29;1(8644): 922-4.
20. Yung RL, Richardson BC. Drug-Induced lupus mechanisms. In: Lahita RD, editor. Systemic lupus erythematosus. 5th Edition. Elsevier; 2011.P. 385-404.
21. Rubin RL. Drug-induced lupus. Toxicology. 2005 Apr 15;209(2):135-47.
22. Uetrecht J. Current trends in druginduced autoimmunity. Toxicology. 1997 Apr 11;119(1):37-43.
23. Williams DP, Pirmohamed M, Naisbitt DJ, et al. Induction of metabolismdependent and independent neutrophil apoptosis by clozapine.Mol Pharmacol. 2000 Jul; 58(1):207-16.
24. Kretz-Rommel A, Rubin RL. Disruption of positive selection of thymocytes causing autoimmunity. Nat Med.2000 Mar;6(3):298-305.
25. Yung RL, Richardson BS. Drug-induced lupus. Rheum Dis Clin N Am. 1994;20:60-86. 26. Vivino FB, Schumacher HR Jr. Synovial fluid characteristics and the lupus erythematosus cell phenomenon in drug induced lupus. Arthritis Rheum.1989 May; 32(5):560-8.
26. Siddiqui MA, Khan IA. Isoniazidinduced lupus erythematosus presenting with cardiac tamponade. Am J Ther.2002 Mar-Apr;9(2):163-5.
27. Graziadei IW, Obermoser GE, Sepp NT, et al. Drug induced lupus like syndrome associated with severe autoimmune hepatitis. Lupus. 2003;12(5):409-12.
28. Callen JP. Drug-induced cutaneous lupus erythematosus, a distinct syndrome that is frequently under-recognised. J Am Acad Dermatol. 2001 Aug;45(2):315-6.
29. Ioannidis JI, Karassa FB, Druyls E. Biologic agents in rheumatology: unmet issues after 200 trials and $200 billion sales. Nat Rev Rheumatol. 2013;11:665-673. doi: 10.1038/nrrheum.2013.134.
30. Porfyridis I, Kalomenidis I, Psallidas I, et al. Etanercept-induced pleuropericardial lupus-like syndrome. Eur Respir J.2009 Apr;33(4):939-41. doi: 10.1183/09031936.00182308.
31. Choi HK, Merkel PA, Walker AM, Niles JL. Drug-associated antineutrophil cytoplasmic antibody-positive vasculitis. Arthritis Rheum. 2000 Feb;43(2):405-13.
32. Uetrecht J. Drug-induced lupus erythematosus. In: Kuhn A, Lehmann P, Ruzicka T, editors. Cutaneous lupus erythematosus., Berlin: Springer; 2005. P. 117-32.
33. Srivastava M, Rencic A, Diglio G, et al. Drug-induced, Ro/SSApositive cutaneous lupus erythematosus.Arch Dermatol. 2003 Jan;139(1):45-9.
34. Cassis TB, Callen JP. Bupropion-induced subacute cutaneous lupus erythematosus. Australas J Dermatol.2005 Nov;46(4):266-9.
35. Fenniche S, Dhaoui A, Ammar FB, et al. Acebutolol-induced subacute cutaneous lupus erythematosus.Skin Pharmacol Physiol.2005 Sep-Oct;18(5):230-3. Epub 2005 Jul 5.
36. Petri M, Kim MY, Kalunian KC, et al. Combined oral contraceptives in women with systemic lupus erythematosus. N Engl J Med. 2005 Dec 15;353(24):2550-8.
37. Petri M, Albritton J. Antibiotic allergy in systemic lupus erythematosus. J Rheumatol. 1992 Feb;19(2):265-9.
38. Capponi A, De Simone C, Guerriero C, et al. Ro/SSA-positive cutaneous lupus induced by carbamazepine. Arch Dermatol. 2005 Jan;141(1):103-4.
39. Buyon JP, Petri M, Kim MY, et al. The effect of combined estrogenprogesterone hormone replacement therapy on disease activity in systemic lupus erythematosus: a randomized trial. Ann Intern Med. 2005 Jun 21;142(12 Pt 1):953-62.
40. Almoallim H, Al-Ghamdi Y, Almaghrabi H, Alyasi O. Anti-tumor necrosis factor-αinduced systemic lupus erythematosus. Open Rheumatol J.2012;6:315-9. doi: 10.2174/1874312901206010315. Epub 2012 Nov 16.
41. Kontoyiannis D, Kollias G. Accelerated autoimmunity and lupus nephritis in NZB mice with an engineerd heterozygous deficiency in tumour necrosis factor.Eur J Immunol. 2000 Jul;30(7):2038-47.
42. Williams EL, Gadola S, Edwards CJ. Anti-TNF-induced lupus. Rheumatology (Oxford).2009 Jul;48(7):716-20. doi: 10.1093/rheumatology/kep080. Epub 2009 May 4.
43. Maczynska I, Millo B, RatajczakStefanska V, et al. Proinflammatory cytokine (IL-1beta, IL-6, IL-12, IL-18 and TNFalpha) levels in sera of patients with subacute cutaneous lupus erythematosus (SCLE). Immunol Lett.2006 Jan 15;102(1):79-82. Epub 2005 Aug 25.
44. Eriksson C, Engstrand S, Sundqvist KG, Rantapaa-Dahlqvist S. Autoantibody formation in patients with rheumatoid arthritis treated with anti-TNF alpha. Ann Rheum Dis. 2005 Mar;64(3):403-7. Epub 2004 Aug 5.
45. Wetter DA, Davis MDP. Lupus-like syndrome attributable to anti-tumor necrosis factor alpha therapy in 14 patients during an 8-year period at Mayo Clinic. Mayo Clin Proc.2009 Nov;84(11):979-84. doi: 10.4065/84.11.979.
46. Cambien B, Bergmeier W, Saffaripour S, et al. Antithrombotic activity of TNF-alpha. J Clin Invest.2003 Nov;112(10):1589-96.
47. Katz U, Zandman-Goddard G. Druginduced lupus: an update. Autoimmun Rev. 2010 Nov;10(1):46-50. doi: 10.1016/j.autrev. 2010.07.005. Epub 2010 Jul 23.
48. Thornhill J, Watson KD, Lord PA, et al. Drug-induced lupus in patients with inflammatory arthritis treared with TNF blocking agents: results from the BSR Biologics Register. BSR Abstracts; 2008.
49. Costa MF, Said NR, Zimmermann B. Drug-induced lupus due to anti-tumor necrosis factor alpha agents.Semin Arthritis Rheum. 2008 Jun;37(6):381-7. Epub 2007 Oct 30.
50. Bessissow T, Renard M, Hoffman I, et al. Review article: nonmalignant haematological complications of antitumour necrosis factor alpha therapy. Aliment Pharmacol Ther.2012; 36:212-323.
51. Bosch X, Saiz A, Ramos-Casals M. BIOGEAS Study Group. Monoclonal antibody therapy-associated neurological disorders. Nat Rev Neurol.2011 Mar;7(3):165-72. doi: 10.1038/nrneurol.2011.1. Epub 2011 Jan 25.
52. Ramos-Casal M, Brito-Zeron P, Munoz S, et al. Autoimmune diseases induced by TNF-targeted therapies. Analysis of 233 cases. Medicine (Baltimore). 2007 Jul; 86(4):242-51.
53. Charles PJ, Smeenk RJ, De Jong J, et al. Assessment of antibodies to double-stranded DNA induced in rheumatoid arthritis patients following treatment with infliximab, a monoclonal antibody to tumor necrosis factor. Arthritis Rheum.2000 Nov;43(11):2383-90.
54. Муравьев ЮВ, Муравьева ЛА. Несвоевременные мысли о применении генно-инженерных биологических препаратов при ревматических болезнях. Научно-практическая ревматология. 2016;54(3): 361-6. doi: 10.14412/1995-4484-2016-361-366
55. Муравьев ЮВ, Лебедева ВВ, Аламанкина СЮ. Индуцированный инфликсимабом волчаночно-подобный синдром у больной ревматоидным артритом (описание случая): случайность или закономерность? Научно-практическая ревматология. 2017;55(4):446-8. doi: 10.14412/1995-4484-2017-446-448
56. Аль-Иззи М, Рида А. Случай кожной формы красной волчанки, индуцированной применением голимумаба. Русский медицинский журнал. 2017;(1):41-3.
57. Nakamura Y, Izumi CI, Nakagawa Y, Hatta K. A case of effusive-constrictive pericarditis accompanying rheumatoid arthritis: the possibility of adverse effect of TNF-inhibitor therapy. Journal of Cardiology Cases. 2013;7:e8-e10.
58. Burmester GR, Pope JE. Novel treatment strategies in rheumatoid arthritis. Lancet. 2017 Jun 10;389(10086):2338-2348. doi: 10.1016/S0140-6736(17)31491-5.
59. Ramos-Casals M, Perez-Alvarez R, Diaz-Lagares C. Autoimmune diseases induced by biological agents: a double-edged sword? Autoimmun Rev.2010 Jan;9(3):188-93. doi: 10.1016/j.autrev.2009.10.003. Epub 2009 Oct 23.
60. Michalopoulos G, Vrakas S, Makris K, Tzathas C. Systemic lupus erythematosus in Crohn’s disease: drug-induced or idiopathic? Ann Gastroenterol. 2015 Jul-Sep;28(3): 408-409.
61. McClung MR, Lewiecki EM, Geller ML, et al. Effect of denosumab on bone mineral density and biochemical markers of bone turnover: 8-year results of phase 2 clinical trial. Osteoporos Int.2013 Jan;24(1):227-35. doi: 10.1007/s00198-012-2052-4. Epub 2012 Jul 10.
62. Торопцова НВ, Никитинская ОА, Смирнов АВ. Опыт трехлетнего применения генно-инженерного биологического препарата деносумаб для лечения женщин с постменопаузальным остеопорозом: эффективность, безопасность и приверженность лечению. Научно-практическая ревматология. 2017;55(3):261-6. doi: 10.14412/1995-4484-2017-261-266
63. Ramos-Casals M, Brito-Zeron P, Soto MJ, et al. Autoimmune diseases induced by TNF-targeted therapies. Best Pract Res Clin Rheumatol. 2008 Oct;22(5):847-61. doi: 10.1016/j.berh.2008.09.008.
64. Papagoras C, Voulgari PV, Drosos AA. Strategies after the failure of the first antitumor necrosis factor alpha agent in rheuma toid arthritis. Autoimmun Rev. 2010 Jun; 9(8):574-82. doi: 10.1016/j.autrev.2010.04.002. Epub 2010 Apr 28.
65. Almoallim H, Almasari A, Khadawardi H. Lupus Myositis with Normal Creatinine Kinase Levels Following Adalimumab Use in a Rheumatoid Arthritis Patient.Turk J Rheumatol.2011;26(4):328-32.
66. Williams VL, Cohen PR. TNF alpha antagonist-induced lupus-like syndrome: report and review of the literature with implications for treatment with alternative TNF alpha antagonists. Int J Dermatol.2011 May;50(5):619-25. doi: 10.1111/j.1365-4632.2011.04871.x.
67. Sturkenboom MC, Meier CR, Jick H, Stricker BH. Minocycline and lupus-like syndrome in acne patients.Arch Intern Med. 1999 Mar 8;159(5):493-7.
68. Муравьев ЮВ, Гридина ГИ, Каратеев ДЕ. Тромбоэмболия – неожиданная неблагоприятная реакция, возникшая в период применения ингибитора фактора некроза опухоли αадалимумаба. Научно-практическая ревматология. 2013;51(3):354-6. doi: 10.14412/1995-4484-2013-1514
Для цитирования:
Клюквина Н.Г., Гунчикова В.М., Новикова А.М. Синдром лекарственной волчанки. Современная ревматология. 2018;12(4):32-41. https://doi.org/10.14412/1996-7012-2018-4-32-41
For citation:
Klyukvina N.G., Gunchikova V.M., Novikova A.M. Drug-induced lupus. Modern Rheumatology Journal. 2018;12(4):32-41. (In Russ.) https://doi.org/10.14412/1996-7012-2018-4-32-41

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Источник