Лекарственная устойчивость микробов роль плазмид
Защиту бактерий от действия лекарственных средств ( лс ) обеспечивает комплекс факторов, основными из которых считают ферментативную инактивацию препаратов и удаление либо маскировку рецепторов для них. Гены, кодирующие синтез продуктов, обусловливающих лекарственную устойчивость, могут быть хромосомными либо включенными в состав R-плазмид, передаваемых в бактериальной популяции.
Ферментативная инактивация лекарственных средств ( лс )
Ферментативная инактивация лекарственных средств ( лс ) реализуется внеклеточно и внутриклеточно. Изменения активности ферментов связаны с мутациями генов, кодирующих их структуру, либо с увеличением образования числа копий генов, кодирующих его (амплификация).
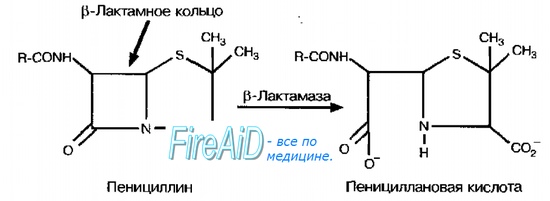
В-Лактамазы. Механизм действия обусловлен разрушением b-лактамного кольца в молекулах антибиотиков. Стафилококки секретируют ферменты после попадания препарата в окружающую их среду, что приводит к снижению его концентрации. Для них характерна популяционная резистентность — большая доза инфекционного агента вызывает более интенсивное развитие устойчивости. Синтез ферментов кодируют индуцибельные гены, то есть b-лактамазы более интенсивно образуются в присутствии препарата. Более тонкая клеточная стенка грамотрицательных бактерий позволяет антибиотикам проникать внутрь клетки, где они взаимодействуют с b-лактамазами в периплазматическом пространстве.
Грамотрицательные бактерии (эшерихии, синегнойная палочка) проявляют более выраженную резистентность (по сравнению с грамположительными бактериями), не зависящую от дозы инфекционного агента. По специфичности действия b-лактамазы, продуцируемые грамотрицательными бактериями, разделяют на несколько групп (взаимодействующие только с пенициллинами, или цефалоспоринами, или и с обеими группами антибиотиков). У грамотрицательных бактерий синтез b-лактамаз происходит перманентно, вне зависимости от наличия JIC.
Ацетилтрансферазы, фосфорилазы и нуклеотидазы стрептококков, стафилококков, энтеробактерий и синегнойной палочки модифицируют аминогликозиды, препятствуя их связыванию с рибосомами (механизм действия хлорамфеникол ацетилтрансферазы, продуцируемой стафилококками и энтеробактериями аналогичен действию ацетилтрансфераз аминогликозидов). Ферменты расположены на поверхности ЦПМ и инактивируют лишь часть препарата, проникшего в клетку, так что концентрация препарата в биологических жидкостях снижается незначительно (не более чем на 0,5%).
— Вернуться в оглавление раздела «Микробиология.»
Источник
Свойства бактерий, контролируемые плазмидами. Плазмиды лекарственной резистентности. Общая характеристика и механизмы действия.
По данным японских исследователей, первый случай выделения бактерий, устойчивых к нескольким лекарственным веществам с различными механизмами действия, был отмечен в 1955 г. в клинике при обследовании женщины, больной дизентерией. От нее была выделена шигелла, устойчивая к действию сульфамидов, стрептомицина, хлорамфеникола и тетрациклина. Вскоре после этого в 1956 г. было выделено большое количество дизентерийных штаммов, обладавших резистентностью к тем же четырем лекарственным веществам, причем во многих случаях лечение проводилось лишь одним из них. Вслед за японскими работами появились сообщения о множественной резистентности, выявленной у других представителей семейства энтеробактерий и стафилококков. Японские ученые доказали возможность передачи всего комплекса устойчивости от его носителей к чувствительным бактериям. Для обозначения комплекса генетических детерминантов множественной лекарственной устойчивости японские исследователи предложили символ R.
R-плазмиды детерминируют резистентность бактерий к лекарственным веществам – главным образом антибио-тикам и сульфаниламидам. В широком плане к плазмидам резистентности относят плазмиды, кодирующие резистентность бактерий к бактериофагам, бактерио-цинам, сыворотке, ионизирующему излучению, тяжелым металлам и др. Наиболее полно изученыR-плазмиды грамотрицательных бактерий. Большинство из них конъюгативные, аR-плазмиды грамположительных – неконъюгативные.
Большинство генов устойчивости транспозонного происхождения. Их отличительная особенность в том, что они включаются в определенных местах. Такие последовательности именуются интегронами, а их носителями являются обычно транспозоны.
ДНК R-плазмид представлена в виде ковалентно закрытых кольцевых молекул, предположительно в суперспирализированной форме.
Молекулярная масса, копийность
и другие свойства некоторых R-плазмид.
Резистентность бактерий, содержащихR-плазмиды, обычно зависит, от вида бактерий и типа антибиотиков. Например, клеткиE. coliв большинстве устойчивы к стрептомицину при его концентрации в среде 10 — 25 мкг/мл, тогда как шигеллы – при концентрации 10000 мкг/мл, сальмонеллы резистентны к тетрациклину при концентрации 10 мкг/мл, тогда как шигеллы – при концентрации 100 – 250 мкг/мл.
Для плазмидных детерминантов резистентности часто характерно повышенная экспрессивность. Повышение копийности плазмид в результате мутаций генов репликации сопровождается значительным повышением уровня резистентности и подчиняется закономерности «доза-эффект». Повышении экспрессии плазмидных детерминантов лекарственной устойчивости может происходить также и посредством других механизмов: амплификация, приобретение множественных копий транспозонов, повышение интенсивности транскрипции генов.
При смешанном культивировании бактерий различной видовой принадлежности возможен межродовой перенос некоторых плазмид. Например, S. typhimurium V. cholerae, S. marcescens Y. pestis, P. aeruginosa E. coli.
В результате систематического мониторинга лекарственной резистентности кишечных бактерий разных видов, предпринятого в 60-х гг. в Японии, были получены результаты, свидетельствующие, что клетки
58% штаммов, устойчивых к тетрациклину, канамицину, стрептомицину, сульфаниламидам, содержат плазмиды. Исследования последних лет свидетельствуют о том, что и конъюгативные и неконъюгативныеR-плазмиды, детерминирующие резистентность к антибиоти-кам и сульфаниламидам, присутствуют в бактериях многих видов, в разных зонах мира.
Лекарственная резистентность энтеропатогенных штаммов E. coli, выделенных в Англии в 1980-81 гг.
К-во резистентных штаммов (%)
Всего 232 штамма, из них 134 – с резистентностью, а 65 – с трансферрабельной резистентностью.
Исследование 24 энтеропатогенных штамма E. coli, выделенных от больных людей и домашних животных в 70-е гг. в СССР показало, что 16 из них являются резистентными к 1 или более антибиотиков, чаще всего к стрептомицину, тетрациклину, канамицину. В клетках 9 штаммов были конъюгативные плазмиды.
Возрастание частоты резистентности и встречаемости в резистентных штаммах R-плазмид происходит по мере использования антибиотиков и др.
Значительный рост резистентности, обусловленный плазмидами, отмечается у стрептококков, причем частота зависит от антибиотика. Например, большинство выделенных в Японии S. pyogenesрезистентны к 1 — 2 антибиотикам, более 50% штаммов резистентны одновременно к тетрациклину, эритромицину и хлорамфениколу. Резистентность к тетрациклину особенно часто встречается среди стрептококков этого вида, группB, D. Для многих штаммовS. pneumonieпоказана множественная лекарственная резистентность.
Возрастание частоты резистентности четко видно на стафилококках (S. aureus)– частых возбудителей внутригоспитальных инфекций.
После открытия пенициллина, период эффективной пенициллинотерапии был очень коротким, т.к. уже к 1946 г. госпитальные штаммы были на 50% резистентны к нему. В начале 60-х гг. были введены в практику метециллин и оксациллин, бывшие достаточно эффективными до конца 60-х гг.
Начиная с 50-х гг., начиная с США, стали выделять штаммы одновременно резистентные и к пенициллину, и к стрептомицину, хлорамфениколу и эритромицину. Неомицин-резистентные штаммы стафилококков появились в 1959-60 гг., а через 10 лет развилась резистентность к родственным антибиотикам: канамицину и парамицину. В 1976 г. были зарегистрированы внутригоспитальные вспышки, вызванные стафилококками, резистентными и к гентамицину и др. аминогликозидам. В этом же году появились сообщения о выделении стафилококков, резистентных и к гентамицину и метициллину, но и к пенициллину и стрептомицину, выделенных в Мельбурне, Лондоне, Дублине и США.
Как выяснилось, плазмиды могут участвовать в формировании хромосомной резистентности в качестве векторов транспозируемых генетических элементов.
Частота, с которой появляются резистентные бактерии в среде очень высока. Поскольку лекарственные вещества и кормовые антибиотики используются в ветеринарии и растениеводстве, то распространение селекционированных резистентных организмов от одного к другому хозяину, а так же от животных к человеку имеет важное эпизоотическое и эпидемиологическое значение.
Источник
Резистентность микроорганизмов к антимикробным препаратам
Появление феномена устойчивости к лечебным препаратам у патогенных микроорганизмов, оказывает крайне негативный эффект на здоровье человечества, т.к. приводит к резкому снижению эффективности этиотропной терапии инфекционных болезней. Интенсивный селективный прессинг антибиотиков, ведет к быстрой эволюции и распространению новых механизмов резистентности в медицинских учреждениях и, прежде всего, в отделениях реанимации и интенсивной терапии. В статье проанализированы данные литературы о механизмах возникновения и передачи устойчивости патогенных микроорганизмов к антибактериальным препаратам и приобретенной резистентности, связанной с продукцией бета-лактамаз широкого спектра.
Ключевые слова: Антибактериальные препараты, антибиотикоустойчивость, β-лактамазы.
Pokudina Inna Olegovna, Shkurat Mihail Alekseevich, Battalov Dmitrij Valentinovich
The emergence of the phenomenon of resistance to therapeutic drugs in the pathogenic microorganisms, has a very negative effect on the health of humanity, because it leads to a sharp decrease in the efficiency of etiotropic therapy of infectious diseases. Intense selective pressure of antibiotics leads to the rapid evolution and spread of new resistance mechanisms in health care settings and, above all, in the Intensive care unit. The article analyzes the literature data about the mechanisms of emergence and transmission of the resistance of pathogens to antimicrobial agents and acquired resistance associated with the production of beta-lactamases extended spectrum.
Keywords: Antibacterial drugs, antibiotic-resistant, β-lactamase.
Введение
Появление феномена устойчивости возбудителей инфекционных болезней к лечебным препаратам, приводящих к резкому снижению эффективности этиотропной терапии, является серьезной угрозой благополучию и здоровью человечества. В настоящее время распространение антибиотикорезистентности приняло глобальный характер. Актуальность и серьезность этой проблемы в полной мере осознана международным медицинским сообществом. Всемирная организация здравоохранения (ВОЗ) разработала и опубликовала в 2001 году «Глобальную стратегию ВОЗ по сдерживанию устойчивости к противомикробным препаратам», в которой рекомендовано рассматривать указанную проблему в качестве одного из приоритетов национальных систем здравоохранения [World Health Organization, 2001]. Предотвращение формирования и распространения антимикробной резистентности признано ВОЗ, странами Европейского Союза и Северной Америки в качестве глобальной проблемы, а также в качестве национального приоритета [Мудрак Д.А., 2010].
Благодаря пластичности генетического аппарата и способности обмениваться генами бактерии могут приспособиться фактически к любому лекарственному препарату, будь он веществом биологического происхождения или же синтезирован с нуля в лаборатории. Микробам даже не нужно контактировать с антибиотиками: нужный ген может попасть к ним по цепочке от других клеток [http://www.nkj.ru/news/25639/].
В настоящее время β-лактамные антибиотики являются наиболее часто применяемыми препаратами для лечения бактериальных инфекций и основой современной химиотерапии, так как занимают ведущее или важное место в лечении большинства инфекционных болезней, однако их эффективность в последние годы резко снизилась вследствие возникновения и распространения среди возбудителей нозокомиальных инфекций устойчивости к ним, наиболее частым механизмом развития которой является продукция бета-лактамаз [Bush K, Jacoby GA. ,2010]
Резистентность бактерий к антимикробным препаратам.
Медицина впервые столкнулась с проблемой устойчивости, или резистентности, болезнетворных бактерий к антимикробным препаратам еще в 40-х годах прошлого века, почти одновременно с открытием антибиотиков. Уже через год после начала применения пенициллина у золотистого стафилококка обнаружился фермент пенициллиназа, разрушающий этот антибиотик. В 1970-е годы впервые были выявлены микроорганизмы, устойчивые к целым группам лекарственных средств. Наверно, самый известный пример здесь – метициллин-резистентный стафилококк, или MRSA, устойчивый к широкому спектру лекарств. Его часто используют как модельный исследовательский объект, чтобы понять механизмы, задействованные при развитии лекарственной устойчивости, а также для испытания новых веществ, которые могли бы такую устойчивость преодолеть. [Chambers HF, Deleo FR, 2009]
В конце 1990-х годов появились штаммы давно известных микроорганизмов, приобретших устойчивость ко всем известным антибиотикам. В результате сегодня врачи сталкиваются с инфекциями, вызванными, например, штаммами энтерококков или синегнойной палочкой, которые не поддаются лечению имеющимися в арсенале медицины препаратами [Страчунский Л.С., Козлов С.Н., 2002].
Основным отличием АБП (антибактериальных препаратов) от других веществ, оказывающих токсическое действие на бактериальную клетку является их высокая избирательность. Как правило, АБП ингибируют метаболические процессы, уникальные для прокариотической клетки и отсутствующие у эукариотических клеток. Именно с этим связан тот факт, что в концентрациях, подавляющих жизнедеятельность бактерий, АБП обычно не оказывают существенного влияния на организм человека и животных. Отдельные таксономические группы бактерий существенно различаются по уровню чувствительности, количественным выражением которого является величина МПК (минимальная подавляющая концентрация) АБП [Сидоренко С.В., Тишков В.И., 2004].
Резистентность микробов к АБП может быть либо природной, либо приобретенной. Гены атибиотикорезистентности, являясь транспозонами, легко перемещаются (из плазмиды в плазмиду или в хромосому), что обеспечивает их быстрое распространение внутри популяций, видов и даже между различными видами бактерий.
Под природной устойчивостью понимают сохранение бактериями жизнеспособности в присутствии АБП в концентрациях, реально достижимых в организме человека. Природная резистентность является постоянным видовым признаком бактерий, закодирована в хромосомных генах и легко прогнозируема на основании данных видовой идентификации. Истинная природная устойчивость характеризуется отсутствием у микроорганизмов мишени для проявления действия АБП. Так, например, устойчивость микоплазм к β-лактамным антибиотикам связана с отсутствием у этих бактерий пептидогликана.
Понятием приобретенной устойчивости характеризуют свойство отдельных штаммов бактерий сохранять жизнеспособность при концентрациях АБП, подавляющих основную часть микробной популяции. Возможны ситуации, когда большая часть микробной популяции проявляет приобретенную устойчивость. Появление у бактерий приобретенной резистентности не обязательно сопровождается снижением клинической эффективности антибиотика. Формирование резистентности во всех случаях обусловлено или приобретением новой генетической информации, переносимой транспозонами или плазмидами или изменением уровня экспрессии собственных генов [Сидоренко С.В., Тишков В.И., 2004]. Основным механизмом приобретенной резистентности является продукция микроорганизмами плазмидных бета-лактамаз широкого и расширенного спектра ,при этом наблюдают интенсивное межвидовое распространение детерминант резистентности [Bradford PA, et. al., 1997].
Феномен устойчивости специфичен, поэтому данные по отдельным странам, лечебным учреждениям и даже отделениям одной больницы могут различаться. Появление и распространение приобретенной резистентности составляет основную клиническую проблему, поскольку ее наличие у конкретной бактерии – возбудителя инфекционной болезни, невозможно прогнозировать [Березин А.Г., Ромашов О.М., 2003].
Механизмы защиты бактерий от антимикробных лекарственных средств.
Бактериями используются различные механизмы защиты от антимикробных лекарственных средств, причем некоторые бактерии обладают несколькими механизмами защиты одновременно. Интенсивный селективный прессинг антибиотиков, обусловливает быструю эволюцию и распространение новых механизмов резистентности в медицинских учреждениях и, прежде всего, в отделениях реанимации и интенсивной терапии [Мудрак Д.А., 2010].
Возникновению и распространению резистентности микроорганизмов к антимикробным препаратам способствуют: во-первых, появление в генах микробов случайных мутаций, которые могут, например, изменять спектр активности бактериальных ферментов, расщепляющих антибиотики. Во-вторых, это обмен генетическим материалом между клетками, то есть перенос генов от устойчивых к менее устойчивым или чувствительным микроорганизмам. В-третьих, селекция новых резистентных штаммов под действием избирательного давления антибиотиков, связанного с бесконтрольностью их применения в разных сферах [Abbanat D, Morrow B, Bush K., 2008].
Сегодня биохимические механизмы АБР подразделяют на несколько групп:
— Модификация мишени действия АБП путем изменчивости в результате спонтанных мутаций в кодирующих структуру мишеней генах или иных генетических событий, в результате которых, например, у некоторых пенициллин связывающих белков уменьшается сродство к β-лактамам;
— Инактивация АБП бактериальными ферментами, такими как β-лактамазы или ферменты, модифицирующие аминогликозиды. Механизмы инактивации (ферментативного разрушения или модификации) существовали у бактерий, продуцирующих антибиотики, задолго до начала использования этих веществ в качестве медицинских препаратов. В последующем детерминанты резистентности распространились среди возбудителей инфекционных болезней у человека.
— Активное выведение АБП из микробной клетки (эффлюкс), широко распространённый механизм устойчивости грамположительных и грамотрицательных бактерий к различным антибиотикам, таким как β-лактамы, фторхинолоны, макролиды, линкозамиды, тетрациклины, реализуемый различными системами эффлюкса;
— Нарушение проницаемости оболочки микробной клетки, этот механизм распространен, в основном, среди грамотрицательных бактерий, обладающих внешней мембраной и является наименее специфичным в отношении АБП разных групп;
— Защита мишени действия антибиотиков, которая обусловлена синтезом белков, препятствующих взаимодействию АБП с мишенями действия: различными ферментами, рибосомами, нуклеотидными последовательностями [Saidijam M., Benedetti G., Ren Q, 2006].
Антимикробная резистентность, обусловленная бета-лактамазами
По количеству применяемых в клинике препаратов β-лактамные антибиотики наиболее многочисленная группа среди всех антибактериальных средств. Семейство бета-лактамных антибиотиков включает четыре основные группы антимикробных препаратов: пенициллины, цефалоспорины, монобактамы и карбапенемы. Бета-лактамные антибиотики действуют на клетку бактерии двумя основными путями. Во-первых, они встраиваются в стенку бактериальной клетки и подавляют активность фермента транспептидазы, участвующего в завершающем этапе построения стенки бактерии. Во-вторых, они связываются с пенициллинсвязывающими белками (ПСБ), которые в норме подавляют гидролазы бактериальной клетки и таким образом высвобождают эти гидролазы, что приводит к лизису бактериальной стенки [Massova I, Mobashery S.1998, Bush K. Macielag MJ, 2010].
Эффективность бета-лактамных антибиотиков может снижаться вследствие возникновения к ним устойчивости, наиболее частым механизмом развития которой является продукция бактериями β-лактамаз. Эти ферменты инактивируют АБП в результате гидролиза одной из связей β-лактамного кольца, а также изменяют тип строения ПСБ [Bradford PA, 2001]. Бета-лактамазы расширенного спектра — БЛРС (extended spectrum beta-lactamases — ESBL) — это ферменты, которые продуцируются некоторыми видами бактерий и способны гидролизовать все пенициллины и цефалоспорины расширенного спектра [Paterson DL, Bonomo RA, 2005, Mariani-Kurkdjian P, Doit C, Bingen E. 2012]. У грамотрицательных бактерий (E. coli, K. pneumoniae и Acinetobacter spp) β-лактамазы расширенного спектра кодируют гены blaSHV, blaTEM, blaCTX и blaAMPC. Варианты blaSHV, blaTEM, устойчивые к широкому спектру антибиотиков, образовались в результате мутаций генов TEM-1 и SHV-1 [Knothe, H. et. al, 2005]. Во всем мире отмечается, что изоляты E.coli, продуцирующие наиболее часто встречающиеся ферменты типа CTX-M (особенно CTX-M-15), являются важной причиной инфекций мочевыводящих путей и инфекций крови [Pitout JD, 2012]. Глобально, ESBLs считаются проблематичными, особенно у госпитальных пациентов. У пациентов, контаминированных штаммами-продуцентами ESBL особенно высок риск неэффективности лечения [Bush K, 2010].
β-лактамазы представляют обширную группу генетически и функционально различных ферментов. Природная способность к продукции β -лактамаз характерна для многих видов микроорганизмов. Однако наибольшую значимость в последнее время приобретает широкое распространение плазмидно кодируемых β-лактамаз, являющихся факторами вторичной (приобретенной) резистентности у изначально чувствительных микроорганизмов. Бета-лактамазы, вероятно, впервые появились у микроорганизмов одновременно со способностью к продукции БЛА как факторы нейтрализующие действие синтезируемых антибиотических веществ. В результате межвидового генного переноса бета-лактамазы получили широкое распространение среди различных микроорганизмов, в том числе и патогенных. У грамотрицательных микроорганизмов бета-лактамазы локализуются в периплазматическом пространстве, у грамположительных они свободно диффундируют в окружающуюсреду [ Huang XZ et. al., 2012].
К настоящему времени описано более 890 β-лактамаз, многие из вновь выявленных ферментов обладают широким спектром гидролитической активности против большинства классов β-лактамов [http://www.lahey.org/Studies/]. Их различают по следующим практически важным свойствам :
1. субстратному профилю, т.е. способности к преимущественному гидролизу тех или иных β-лактамов);
2. чувствительности к применяющимся в медицинской практике ингибиторам: клавулановой кислоте, сульбактаму, тазобактаму, обладающими минимальной антибактериальной активностью, но способные необратимо связываться с бета-лактамазами и, таким образом, ингибировать их активность;
3. по типу экспрессии (конститутивный или индуцибельный). При конститутивном типе микроорганизмы синтезируют бета-лактамазы с постоянной скоростью, при индуцибельном количество синтезируемого фермента резко возрастает после контакта с антибиотиком (индукции). Эта характеристика, наряду с субстратным профилем фермента, определяет возможность формирования резистентности;
4. источнику и локализации кодирующих генов. Эта характеристика определяет эпидемиологию резистентности. При плазмидной локализации генов происходит быстрое внутри- и межвидовое распространение резистентности, при хромосомной наблюдают распространение резистентного клона.
Видоспецифические β-лактамазы кодируются хромосомно. [Bush K, Macielag MJ, 2010].
Гены ферментов часто входят в состав конъюгативных плазмид и мобильных генетических элементов (транспозонов, бактериофагов и интегронов), при появлении генетически обусловленных механизмов резистентности возможны концентрация и передача внехромосомной ДНК с помощью плазмид и мобильных генетических элементов, что приводит к распространению генов, кодирующих резистентность к антибиотикам среди бактерий. Плазмиды могут передаваться в бактериальной популяции от клетки-донора к клетке-реципиенту при конъюгации [Villa et al., 2000]. Благодаря транспозрнам происходит широкое распространение генов резистентности на различных плазмидах даже среди неродственных бактерий. Интегроны имеют детерминанты резистентности, обнаруженные на кассетнымх генамах, которые включают один ген и один рекомбинантный сайт [Миронов А.Ю. Харсеева Г.Г., Клюкина Т.В., 2011]. Примечательно, что генетические мутации, приводящие к замене всего нескольких аминокислот в белковой последовательности, изменяют структуру фермента таким образом, что спектр разрушаемых им антибиотиков значительно расширяется [Богун Л.В., 2007].
Существуют различные схемы классификации бета-лактамаз, наиболее известная была разработана Bush, Jacoby and Medeiros [Bush et al., 1995]. В настоящее время используется структурная и функциональная системы классификации β-лактамаз на основе их молекулярной структуры и ранее разработанных схем [Ghafourian S, Sadeghifard N et.al., 2014]. (табл.1)
Таблица 1 Классификация β-лактамаз [Ghafourian S, Sadeghifard N et.al., 2014].
Класс по Амблеру
Цефалоспориназы (АmpС) грамотрицательных бактерий, не ингибируются клавулановой кислотой
Пенициллиназы грамположительных бактерий
Пенициллиназы широкого спектра, в том числеТЕМ-1, ТЕМ-2, SHV-1, преимущественно грамотрицательных бактерий
β-лактамазы расширенного спектра грамотрицательных бактерий- ТЕМ-3 — ТЕМ-26, SHV-2 — SHV-6
Ингибиторустойчивые β-лактамазы широкого спектра-ТЕМ-30 — ТЕМ-36
Карбенициллингидролизующие β-лактамазы, чувствительные к ингибитору — клавулановой кислоте- PSE-1, PSE-3, PSE-4
Плазмидные β-лактамазы расширенного спектра грамотрицательных бактерий — ОХА-1 — ОХА-11
Цефалоспориназы грамотрицательных бактерий, ингибируемые клавулановой кислотой
Неметалло-β-лактамазы, гидролизующие карбапенемы,ингибируемые клавулановой кислотой
Металло-β-лактамазы грамотрицательных бактерий, гидролизуют карбапенемы и другие бета-лактамы, кроме монолактамов, не ингибируются клавулановой кислотой VIM-1 — VIM-11, IMP-1 — IMP-18
Различные ферменты, не входящие в другие группы
Все известные в настоящее время бета-лактамазы делят на 4 молекулярных класса, в пределах которых ферменты характеризуются общностью свойств и определенной аминокислотной гомологией [Ambler R. P. et al.,1991].
Большинство клинически значимых бета-лактамаз принадлежат к классам А и С. В частности, класс А включает хромосомные β-лактамазы Klebsiella spp., Citrobacter diversus, Proteus vulgaris и большинство
Bacteroides spp., а также практически все плазмидные бета-лактамазы. Класс С содержит хромосомные цефалоспориназы AmpС, класс В — ферменты ОХА, которые широко распространены в плазмидах Enterobacteriaceae. Ферменты класса В относятся к металлоэнзимам, поскольку в качестве кофермента в них присутствует атом цинка. β-лактамазы классов: А, С и D относятся к ферментам «серинового» типа (по аминокислоте, находящейся в активном центре фермента). [Livermore D.M. , 1998].
Для клинической практики имеют значение β-лактамазы нескольких групп: β-лактамазы расширенного спектра грамотрицательных бактерий , цефалоспориназы (АmpС) грамотрицательных бактерий, металло-β-лактамазы (МБЛ) грамотрицательных бактерий [Lukac PJ, Bonomo RA, Logan LK., 2015].
В соответствии с современными представлениями считается, что бета-лактамазы и ПСБ, являющиеся мишенями действия беталактамных антибиотиков, имеют общего предшественника. В процессе эволюции ферменты, осуществляющие синтез пептидогликана и разрушающие беталактамные антибиотики, выделились в самостоятельные группы [Massova I., Mobashery S , 1998].
Хромосомные бета-лактамазы присутствовали в бактериях изначально, еще до создания АМП: они принимают участие в метаболизме микробной клетки, а также защищают бактерии от бета-лактамаз, вырабатываемых в природных условиях грибками. Однако в настоящее время основным фактором отбора штаммов — продуцентов бета-лактамаз является использование бета-лактамных АМП, которые способствуют искусственному отбору бактерий [Davies J, Davies D., 2010].
В ответ на изменения в стратегии и тактике применения антибиотиков в различных регионах мира происходят изменения в распространении отдельных групп и классов бета-лактамаз – смена лидирующих групп [Babini GS, Livermore DM, 2000]. К наиболее важным тенденциям следует отнести увеличение частоты выделения бета-лактамаз класса С (группы 1 и 1е по 4 K.Bush, 2009) и появление карбапенемаз, прежде всего, относящихся к классу В (группы 3 и 3a по K.Bush, 2009) – металло-бета-лактамаз. Карбапенем-устойчивые Enterobacteriaceae резистентны почти ко всем антибиотикам и в 40% случаев приводят к смерти пациента [Tawfik A. F., 2011].
Частота распространения микроорганизмов-продуцентов БЛРС значительно варьирует в отдельных географических регионах. Первые сообщения о появлении штаммов-продуцентов ESBL была зарегистрированы в Европе, в частности в Германии [Knothe, H., et al., 1983] и Англии [Du Bois et al., 1995]. Согласно данным за 2011 год, количество изолятов E. coli,устойчивых к цефалоспоринам третьего поколения варьировало от 3% в Швеции до 36 % на Кипре, что четко показывает градиент резистентности с большим процентом в Южной Европе и меньшим в странах Северной Европы [Ghafourian S, Sadeghifard N., 2014].
С 2009 года Национальная референсная лаборатория Германии отслеживает молекулярную эпидемиологию карбапенемаз грамотрицательных нозокомиальных патогенов. В 2011 среди 1454 бактериальных изолятов устойчивость к карбапенемам была обнаружена у 34,4% штаммов Enterobacteriaceae, 19,9% штаммов Pseudomonas aeruginosa и в 96,3% изолятов Acinetobacter baumannii. В США за 2009-2010 годы в 13% случаев инфекций кровотока и катетер-ассоциированных инфекций мочевыводящих путей, вызванных Klebsiella, возбудитель был устойчив к карбапенемам [Kallen A, Guh A. ,2012]. Для E.coli этот показатель составил около 2% [Sanchez, G. V., Master R. N. et. al. 2010]. Наиболее частыми карбапенемазами среди Enterobacteriaceae являются OXA-48, KPC и VIM-1, у Pseudomonas aeruginosa — VIM-2 [Kaase M., 2012].
Разработка новых β-лактамных антибиотиков и их внедрение в практику для лечения инфекционных заболеваний, вызванных штаммами, резистентными к известным антибиотикам приводит к тому, промежуток между использованием нового препарата и появлением к нему устойчивости все более сокращается [Ghafourian S, Sadeghifard N et.al., 2014].
Своевременное выявление изменений в распространении бактериальной резистентности к антибиотикам, имеет важное практическое и теоретическое значение, так как позволяет корректировать рекомендации по антибактериальной терапии нозокомиальных инфекций, разрабатывать экспрессные молекулярные методы детекции антибактериальной резистентности, дает важную информацию для создания новых препаратов, преодолевающих резистентность.
Источник