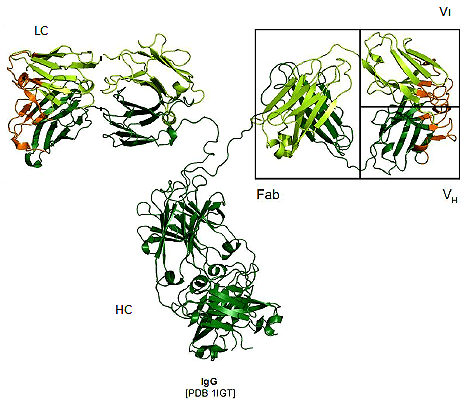- Иммуноглобулины на страже здоровья
- История вопроса: как антитела превратились в «волшебную пулю»
- Иммуноглобулинотерапия – природный механизм защиты
- Двойной иммунный ответ «ковиду»
- Враг моего врага — мой друг. Как бактерии и вирусы помогают создавать антитела для лечения человека
- Враг моего врага — мой друг. Как бактерии и вирусы помогают создавать антитела для лечения человека
- Антитела как лекарства
- Библиотека в пробирке
- Рано праздновать победу!
Иммуноглобулины на страже здоровья
Лекарства на основе иммуноглобулинов (или антител) известны давно. Еще в начале XX века немецкий ученый Эмиль Беринг изобрел препарат для лечения дифтерии на основе сыворотки крови переболевших, и именно за это получил самую первую Нобелевскую премию по физиологии и медицине. Учение об антителах стало одним из перспективных направлений в науке на долгие годы вперед.
На практике это сделало возможным появление новых лекарств против опасных заболеваний, таких как гепатит B, клещевой энцефалит, столбняк и др. Но несмотря на доказанную пользу и вируснейтрализующее действие, у иммуноглобулинов первого поколения были выраженные побочные эффекты и неудобная форма приема – внутримышечная. Она была болезненной и имела ограничения по объему, допустимому для введения в организм. Это заставило ученых сконцентрироваться на инновациях в области иммуноглобулинов. Дальнейший рост производства был неразрывно связан с прогрессом в технологиях очистки, повышающих безопасность препаратов.
В XXI столетии мировые лидеры в этом направлении используют современные стандарты многоступенчатой очистки иммуноглобулинов. Благодаря им примеси, провоцирующие побочные реакции в препарате сведены к минимуму, а концентрация чистого иммуноглобулина класса G достигает 98%. Препараты последнего поколения безопасны и защищены от вирусов. Именно передовые методы очистки позволили использовать потенциал антител в борьбе с инфекционными агентами в полной мере.
Сегодня разработки холдинга «Нацимбио» Госкорпорации Ростех приходят на помощь и в борьбе с коронавирусной инфекцией – недавно в России был официально одобрен ее препарат направленного действия «КОВИД-глобулин». Это первый в мире зарегистрированный препарат иммуноглобулинов из плазмы крови для лечения COVID-19.
Рассказываем о том, что такое иммуноглобулины, об истории изучения антител, их применении в борьбе с коронавирусом.
История вопроса: как антитела превратились в «волшебную пулю»
Иммуноглобулины (антитела) – это особые белки, которые участвуют в иммунном ответе. Они связываются с фрагментами опасных «врагов» нашего организма – бактерий, вирусов, грибов, собственных опухолевых клеток, токсинов, и запускают механизм уничтожения угрозы. Антитела можно назвать эволюционным изобретением человека, как и всех позвоночных животных. В день наш организм производит порядка 2-3 граммов разнообразных антител. Всего в течение жизни в человеческом теле может синтезироваться огромное множество уникальных вариантов разновидностей иммуноглобулинов. Благодаря этому наш организм способен подобрать специфическое антитело к любому из опасных агентов, с которым встретится.
Изучать эти процессы ученые начали во второй половине XIX века. Именно тогда зародилась иммунология, появились первые данные о способности организма распознать и победить возбудителя заболевания при повторной встрече с ним. Конечно, основу заложил еще английский врач Эдвард Дженнер, который в конце XVIII века изобрел первую вакцину против натуральной оспы. Позже ученые выяснили, что такая защита возможна благодаря особым веществам в жидкой части крови – сыворотке. Значит сыворотку можно ввести в организм вместо прививки и добиться временной защиты или помочь справиться с инфекцией уже больному человеку. Первым на практике это успешно продемонстрировал немецкий ученый Эмиль Беринг в конце XIX века, когда изобрел препарат для лечения дифтерии на основе сыворотки крови переболевших.

Эмиль Беринг с ассистентом
В то время дифтерия уносила тысячи детских жизней по всему миру – каждый двадцатый ребенок в Европе и США становился жертвой этой коварной болезни. Медики были бессильны, поэтому первый успех антидифтерийной сыворотки Беринга для кого-то стал настоящим рождественским чудом. В ночь перед Рождеством 1891 года умирающие от дифтерии пациенты Берлинского детского госпиталя получили инъекцию спасительной сыворотки Беринга. Тогда этот укол оказался последним шансом на жизнь для многих маленьких пациентов, но не стал спасением для всех.
Доработать и довести до совершенства противодифтерийную сыворотку Берингу помог коллега и приятель врач-иммунолог Пауль Эрлих. Его глубокие познания в иммунологии помогли точнее рассчитать дозировку антитоксина и подготовить очищенные, более безопасные сыворотки. В 1894 году новая версия была успешно введена более 200 маленьким пациентам.
В 1901 году Беринг получает первую в истории Нобелевскую премию по физиологии и медицине. В официальной формулировке созданную им сыворотку назвали «победоносным оружием против болезни и смерти». Спустя семь лет удостоился Нобелевской премии и Пауль Эрлих – «за открытие антител и обоснование гуморальной теории иммунитета».
Популярный сегодня термин «иммуноглобулины» появился гораздо позже – в 1959 году его предложил бельгийский иммунохимик Йозеф Хереманс. Это название очень хорошо отражает двойную сущность антител – функционально они являются иммунными факторами, а по своей структуре относятся к группе белков сыворотки крови с названием «глобулины».
В 1972 году было расшифровано химическое строение антител – за это американский иммунолог Джеральд Эдельман и английский биохимик Родни Портер также получили Нобелевскую премию. Следующие два важных открытий в этой сфере произошли в 1984 году – обоснование теории идиотипической цепи и разработка методики получения моноклональных антител, которые также удостоились Нобелевской премии. С этого же периода стартовало развитие методов очистки иммуноглобулинов, которые стали ключевым условием эффективности терапии. Сегодня стандартом в этой области является хроматография.
Более ста лет исследований и четыре Нобелевские премии – такого внимания и признания не получало ни одно другое открытие в области физиологии и медицины.
Иммуноглобулинотерапия – природный механизм защиты
В наши дни иммуноглобулины используются для борьбы с различными инфекционными болезнями – клещевым энцефалитом, цитамегаловирусом, стафилококком, а также как терапия пациентов с аллергиями и первичным иммунодефицитом. В последнем случае показано лечение с использованием иммуноглобулина человека нормального. При таких видах иммунодефицитов, когда организм пациентов не способен вырабатывать антитела самостоятельно, препарат иммуноглобулина человека нормального восполняет нехватку антител, обычно циркулирующих в крови здорового человека, обеспечивая пациентам высокое качество жизни.
В случае лечения аллергии используют препарат противоаллергического иммуноглобулина. Иммуноглобулины также помогают в борьбе с аутоиммунными болезнями, такими как системная красная волчанка, синдром Гийена – Барре или синдром Кавасаки.
Иммуноглобулинотерапия в силу своей естественной природы часто прописывается беременным, когда противопоказаны многие антибиотики из-за негативного влияния на плод. При этом, антирезусный иммуноглобулин – это единственный способ избежать гемолитическую болезнь плода при резус-конфликте во время беременности.
Сегодня фарминдустрия может предложить препараты специфических иммуноглобулинов к различным видам микроорганизмов. Но даже при отсутствии нужного препарата, его можно достаточно оперативно создать. В этом и заключается одно из ключевых преимуществ иммуноглобулинов – возможность экстренно получить специфические антитела. Таким образом, иммуноглобулинотерапия незаменима при появлении новых штаммов инфекции, например, вируса гриппа, при эпидемиях, особенно в условиях отсутствия вакцины. Неудивительно, что терапия иммуноглобулином стала особо актуальной в условиях пандемии COVID-19.
Двойной иммунный ответ «ковиду»
В нашей стране одним из крупнейших производителей препаратов на основе антител является «Нацимбио». Предприятие фармхолдинга – НПО «Микроген» – выпускает «Иммуноглобулин человека нормальный», «Альбумин» и другие лекарства на основе плазмы крови, включая специфические иммуноглобулины, линейку которых недавно дополнил «КОВИД-глобулин». Таким образом, Россия получила возможность применять сразу два вида иммунизации против коронавируса – иммуноглобулин и вакцину.

Фото: Нацимбио
«Нацимбио» разрабатывал препарат при активном сотрудничестве с Департаментом здравоохранения Москвы. К этой работе были привлечены столичные врачи и эксперты, Москва также предоставила центры для проведения клинических испытаний препарата. Ну, и самое главное – это передача сырья для производства иммуноглобулина. «КОВИД-глобулин» создается на основе плазмы крови людей, обладающих антителами к вирусу SARS-CoV-2. Для этого столичный Департамент здравоохранения поставил «Нацимбио» 2,5 тонны донорской плазмы. Особенностью иммуноглобулина является применение системы хроматографической очистки, которая обеспечивает вирусную безопасность и полное отсутствие посторонних элементов и белков.
После успешно проведенных доклинических испытаний и первой фазы клинических исследований Минздрав РФ зарегистрировал «КОВИД-глобулин». В начале апреля стартовала вторая и третья фазы клинических испытаний, которые продлятся примерно полгода.
В планах на этот год – переработка не менее 15 тонн плазмы, что позволит помочь 10-15 тыс. пациентов. Стать причастным к этому большому делу может любой желающий, кто перенес COVID-19. Подробнее о том, как стать донором плазмы читайте здесь
Источник
Враг моего врага — мой друг. Как бактерии и вирусы помогают создавать антитела для лечения человека
08 сентября 2015
Враг моего врага — мой друг. Как бактерии и вирусы помогают создавать антитела для лечения человека
Автор
Редактор
Статья на конкурс «био/мол/текст»: Одну из самых существенных опасностей для здоровья человека представляют бактерии. Но и у бактерий есть противники: вирусы-бактериофаги, которые используют микробную клетку в качестве гостиницы, где всё включено, а покидая пристанище, нередко убивают хозяина. Изобретение метода фагового дисплея позволило использовать свойства бактериофагов в поиске новых антител, которые чрезвычайно востребованы для совершенствования диагностики и терапии многих опасных заболеваний.
Обратите внимание!
Эта работа опубликована в номинации «лучшая статья по иммунологии» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Антитела как лекарства
В фармакологии используются два основных понятия: лекарство и мишень. Мишень — это структура организма, связанная с определенной функцией, нарушение которой приводит к заболеванию. В случае болезни на мишень можно оказать определенное воздействие, которое должно привести к лечебному эффекту. Лекарством называется вещество, специфически взаимодействующее с мишенью и влияющее на состояние клетки, ткани, организма [1]. В качестве мишени может выступать рецептор на поверхности клеточной мембраны, фермент или канал, проводящий в клетку различные соединения. Однако путь к потребителю для любого лекарства долог: после подтверждения его функциональной активности следуют стадии доклинических и клинических испытаний, на которых малые молекулы подстерегает опасность так никогда и не стать лекарством. Под действием ферментных систем пациента они могут стать ядовитыми, или их изомеры окажутся токсичными. Низкомолекулярное вещество может выводиться слишком быстро или, напротив, накапливаться в организме, отравляя его. Поэтому в последние годы всё бóльшую долю на рынке лекарственных средств занимают макромолекулы, и среди них важнейшую роль играют антитела — защитные белки организма (рис. 1).
Рисунок 1. Структура антитела. Антитело состоит из двух тяжелых (HC) и двух легких (LC) аминокислотных цепей, соединенных между собой. Каждая из этих цепей имеет вариабельный домен (VH или VL), который ответственен за связывание антигена. Вариабельным он называется именно потому, что эти участки наиболее сильно отличаются у разных антител, то есть представлены множеством вариантов. Участок, который отщепляется ферментом папаином, называется Fab-фрагментом.
Когда в кровь попадает антиген — компонент бактерии или вируса, — он моментально оказывается под пристальным вниманием двух основных типов иммунных клеток: Т- и В-лимфоцитов. В-клетки после стимуляции со стороны Т-клеток или при непосредственном контакте с чужеродным агентом синтезируют антитела к нему. Некоторые из активированных В-лимфоцитов — плазматические клетки — специализируются на продукции антител, а остальные становятся клетками памяти, чтобы при встрече с тем же антигеном в будущем дать ему быстрый и эффективный отпор. Синтезированное плазматической клеткой антитело связывается с «чужаком», тем самым обезвреживая его. Происходит это несколькими путями: антитела специфически связываются с токсичными участками антигена, агглютинируют (слипаются) с крупными частицами, которые несут антигены на своей поверхности, или даже напрямую вызывают разрушение бактериальной клетки. Кроме того, «облепленный» антителами антиген становится уязвимым для других компонентов иммунитета — например, для макрофагов или системы комплемента [2].
От структуры антитéла зависят такие важные свойства, как связывание им антигена, прочность этого связывания и стабильность молекулы. Однако природа создания антител в организме очень сложна, и никто не может гарантировать, что в ответ даже на идентичные антигены образуются одинаковые по структуре антитела. Если же для создания лекарства или диагностического набора используются антитела к одному и тому же антигену, но обладающие разной структурой, то из-за разницы в стабильности и специфичности о стандартизации и воспроизводимости результатов работы можно будет забыть. Это означает, что такие антитела никак не могут стать диагностическими или лекарственными. Отсюда вывод: нужны антитела с идентичной структурой.
Антитела-«клоны» получают при помощи методов клеточной биологии из одной клетки-предшественницы. Такие антитела называются моноклональными. Их использование в качестве терапевтических агентов стало для медицины стратегическим этапом в смене концепции лечения — от неспецифической терапии к направленной. На сегодняшний день моноклональные антитела наиболее активно используются в онкогематологии, лечении опухолей, аутоиммунных заболеваний, а особенно широко — в диагностике [3].
Получение антител для нужд человека, как правило, начинается с иммунизации животных. Проводится несколько инъекций антигена, и в сыворотке крови накапливаются специфические антитела. Эти антитела, полученные напрямую из сыворотки иммунизированного животного, произведены разными плазматическими клетками, то есть они поликлональны. Для получения совершенно идентичных — моноклональных — антител в семидесятых годах прошлого века учеными Георгом Кёлером и Сéсаром Мильштейном был разработан метод гибридóм [3]. Он основан на слиянии плазматических лимфоцитов (продуцируют антитела, но не живут в культуре) и клеток миеломы (это опухолевые клетки, которые ничего не продуцируют, но зато замечательно культивируются), в результате чего такая гибридная клетка от В-лимфоцита наследует способность выделять нужные исследователям антитела, а от опухолевой — бессмертие (практически бесконечное деление).
Гибридома стала выдающимся достижением, открывшим огромные возможности для исследователей [4]. Однако антитела, которые можно получить с помощью гибридомного метода, всё же нарабатываются животными и не годятся для терапии человека. Поэтому перед исследователями встала задача получения полностью человеческих антител. Для ее решения была разработана группа методов, названная дисплейной. Общим для всех этих методов является то, что они предполагают работу со «сцепкой» нуклеотидной и аминокислотной последовательностей каждого конкретного варианта антитела. Название «дисплейные» происходит от английского display — выставлять напоказ, демонстрировать. Неотъемлемой стадией этих методов является «выставление» на поверхности фаговой частицы фрагментов антител для дальнейшего отбора нужных вариантов антигенами.
Библиотека в пробирке
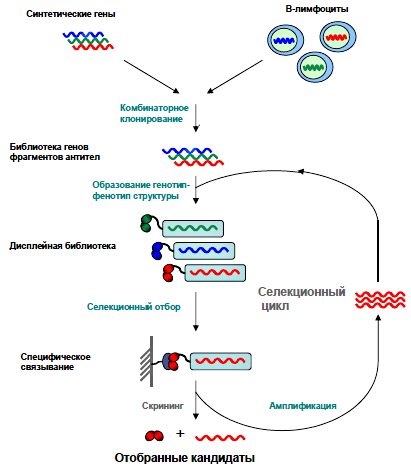
Метод, который был назван фаговым дисплеем, основан на способности бактериофагов (вирусов, поражающих бактерии) выставлять на своей поверхности случайные пептидные последовательности в составе поверхностных белков [5]. Бактериофаг представляет собой ДНК, окруженную белковой оболочкой — капсидом, — и способен размножаться только внутри клетки-хозяина. Проникая туда, он беззастенчиво пользуется ферментными системами несчастной бактерии, предоставляя ей свою ДНК для синтеза необходимых для его размножения белков [6]. Инфицированная фагом бактериальная клетка послушно воспроизводит всё, что закодировано в геноме вируса, чтобы его потомство собрало свою оболочку из готовых строительных блоков. Если в геном фага-прародителя исследователем внедрена нуклеотидная последовательность, кодирующая нужный пептид, у его потомства на поверхности вирусной частицы появляется несколько копий гибридного капсидного белка, состоящего из собственной полипептидной цепи и фрагмента антитела. Множество бактериофагов, на поверхности которых представлены случайные фрагменты антител, называется фаговой библиотекой (рис. 2).
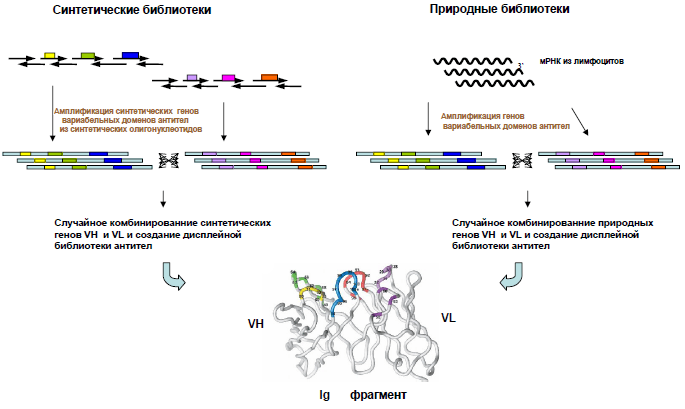
Рисунок 2. Создание синтетических и природных библиотек антител. За основу библиотеки берутся нуклеотидные последовательности вариабельных доменов антител (иммуноглобулинов, Ig), природные или синтетические. Далее их случайным образом комбинируют, и в результате образуется множество фрагментов антител, на основе которых можно создать фаговую библиотеку [8].
В современных библиотеках репертуар антител может достигать 10 миллиардов уникальных вариантов [7]. Как же выбрать из этого разнообразия всего несколько молекул, специфичных к одному-единственному антигену? В случае дисплейной библиотеки вирусные частицы работают «библиотекарями», а «читателями» становятся бактериальные клетки. Если бы поиск книг в обычной библиотеке осуществлялся так же, как антител в дисплейной, выглядело бы это весьма необычно. Допустим, перед нами стоит задача выбрать все книги об интересующем нас предмете из библиотеки, в которой находится 10 миллиардов книг: исторические, художественные, сказки, любовные романы в ярких обложках. Для поиска в дисплейной библиотеке не нужно путаться в карточках и заполнять заявку, а нужно всего лишь принести с собой сам этот предмет! И тогда к нему (антигену) тут же начнут подходить библиотекари (фаги) с книгами в руках. Специфичные книги (антитела), которые написаны только о том, что мы принесли с собой, «приклеятся» к антигену намертво, а те, в которых о предмете упоминается вскользь, можно будет без труда унести обратно на полку. После того как с помощью антигена (предмета) были найдены наиболее специфичные молекулы (книги), они передаются бактериям-«читателям». «Читатели» оказываются настолько добросовестными, что не только воспринимают информацию, но и многократно копируют ее. Отбор фагов с фрагментами антител, специфичных к антигену, называется селекцией (рис. 3).
Рисунок 3. Схема селекции. Создание фаговой библиотеки из синтетического или природного источника предполагает образование структур, объединяющих в себе как нуклеотидные, так и аминокислотные последовательности фрагмента антитела (генотип-фенотип-структура). Затем обеспечивается контакт с антигеном (привязанным к пластику дисплейной библиотеки), который специфически связывается с определенными фрагментами антител, экспонированными на фаговой частице.
Обычно проводится 3–4 раунда селекции, в результате чего отбирается ДНК уже сравнительно небольшого количества фагов, и на ее основе в бактериальных клетках нарабатываются фрагменты антител для дальнейшего анализа. По источнику материала дисплейные библиотеки можно разделить на три группы.
- Библиотеки на основе ДНК иммунных клеток здоровых людей называются наивными. Раз люди-доноры здоровы, значит, их иммунным клеткам не доводилось сражаться с по-настоящему опасными антигенами. Как любого, кто не решал серьезных жизненных проблем, их называют наивными.
- Сфокусированные библиотеки создаются из клеток иммунизированного животного. В этом случае иммунной системе животного приходится потрудиться, ведь в течение нескольких недель ее регулярно атакуют, заставляя вырабатывать поликлональные антитела. Антиген, который вводят исследователи, оказывается в фокусе внимания иммунной системы животного, что увеличивает число вариантов антител к нужному антигену.
- Синтетические библиотеки состоят из генов, синтезированных искусственно [8].
Каждый из перечисленных видов библиотек имеет свои достоинства и недостатки. Например, синтетические библиотеки базируются на небольшом количестве структур вариабельных доменов антител, поэтому работать с ними гораздо проще, чем с природными, которые содержат разнообразные по термодинамическим и экспрессионным характеристикам последовательности. Зато при использовании вариантов из природных библиотек ниже вероятность развития иммунного ответа [9].
Полученные таким способом молекулы можно подвергнуть изменениям, совершенствуя их свойства. Кроме того, из одного и того же фрагмента антитела можно создать целый ряд терапевтических агентов. В зависимости от цели терапии его можно связать с токсином (например, для борьбы с опухолью), с цитокином (для адресной доставки к больному месту) или с другим фрагментом-помощником, даже с радионуклидом.
Успех современной фармакологии во многом зависит от развития таких областей науки, как молекулярная биология, биоинформатика и генная инженерия. Благодаря этим дисциплинам стало возможным синтезировать нужные последовательности ДНК, комбинировать и изменять их, а также получать животные белки в бактериальных системах. Несомненным достоинством современных технологий является то, что с их помощью можно не только получать аналоги уже существующих антител, но и создавать совершенно новые [7].
Рано праздновать победу!
Несмотря на все преимущества антител перед малыми молекулами, с их применением возникли проблемы. В 2004 году было обнаружено, что в нескольких случаях прием инфликсимаба (ремикейда, Remicade) — противовоспалительных моноклональных антител — сопровождался развитием у пациентов лимфом. В мае 2006 года в журнале Американской медицинской ассоциации (JAMA) опубликовали данные, что ремикейд усиливает риск развития рака в три раза [10]. В июне 2008 года FDA сообщило о возможной связи развития лимфом и других видов опухолей у детей и подростков с приемом ремикейда.
Установлено увеличение риска смертельного исхода у онкологических больных при приеме авастина (2,5%) — блокатора фактора роста эндотелия (VEGF) — по сравнению с использованием только химиотерапии (1,7%). Дело в том, что сам по себе Avastin (бевацизумаб) не взаимодействует с раковыми клетками. Он блокирует фактор роста эндотелия (клеток выстилки сосудов), который выделяет опухоль, чтобы создать вокруг себя больше кровеносных сосудов для интенсивного питания. Опухоль выделяет такой же VEGF, как и другие, здоровые части организма, поэтому блокирование роста определенной доли нужных организму сосудов (например, сосудов для питания сердца) оказывается неизбежным. Таким образом, в случае применения авастина повышение смертности пациентов связано не с основным заболеванием, а с сердечной недостаточностью [10].
Развитие подобных побочных эффектов предсказуемо. Живой организм — очень сложная система, и вмешательство, направленное на одну его часть, влечет за собой изменения в других. Поэтому даже с появлением такого тонкого инструмента, как терапевтические антитела, нельзя говорить об изобретении «идеального лекарства».
Современные протоколы уже основаны на комбинированном подходе к лечению, включая вакцины, химиотерапию и моноклональные антитела. Исследователям еще предстоит разработать такие препараты и схемы терапии, которые обеспечат эффективное и безопасное лечение пациентов.
Рисунки предоставлены российской биофармацевтической компанией «Антерикс».
Источник