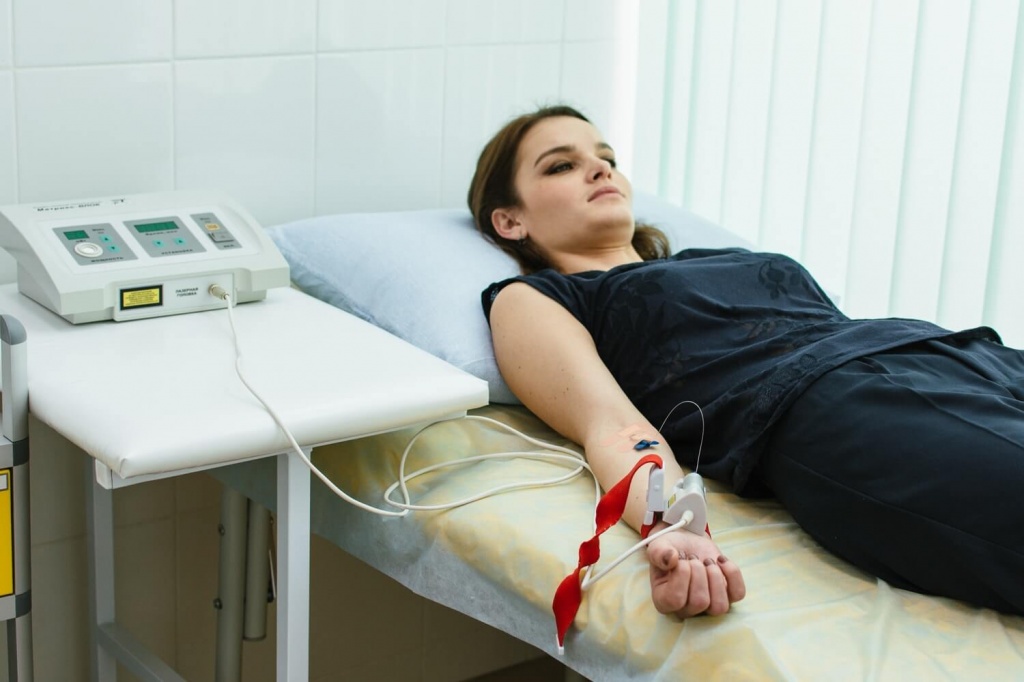
Особенности проведения внутривенной лазерной терапии
Внутривенная лазерная терапия – современная лечебная процедура, позволяющая оказывать на организм человека комплексный эффект. Считается, что подобное облучение крови может помочь в борьбе с различными заболеваниями внутренних органов и системы крови, в связи с чем метод начинает активно применяться в различных медицинских учреждениях. Важно отметить, что лазеролечение должно всегда проходить только по назначению и под контролем лечащего врача, так как процедура имеет определенные противопоказания и возможные осложнения при неправильном применении.
Внутривенная лазеротерапия используется для лечения заболеваний сердечно-сосудистой системы, эндокринных органов, кожи и пр. Метод отличается высоким уровнем безопасности для пациента и эффективностью, благодаря чему превосходит многие аналоги физиопроцедуры. Во время проведения процедуры в венозный сосуд пациента помещается лазер, который создает свет с длинной волны равной 630 нм (красный спектр).
Подобное низкоинтенсивное лазерное облучение крови позволяет обеспечить множество эффектов:
- увеличивается насыщение эритроцитов кислородом, что обеспечивает улучшение его доставки к периферическим тканям;
- активируется работа иммунной системы;
- снижается выраженность отека в биологических тканях;
- устраняются воспалительные процессы любой причинной обусловленности;
- лазерное облучение позволяет уменьшить количество свободных радикалов, играющих важную роль при большом числе заболеваний.
Подобное воздействие на клетки и ткани организма обеспечивает нормализацию функции внутренних органов и способствует выздоровлению при наличии их патологии.
Показания и противопоказания
Как и любая терапевтическая процедура, внутривенное лазерное лечение проводится со строгим соблюдением показаний и противопоказаний.
К показаниям относят следующие состояния:
- заболевания кожных покровов;
- хронические инфекционные болезни в стадии ремиссии;
- ишемическая болезнь сердца;
- хронические заболевания внутренних органов (гепатиты, простатит, панкреатит и др.);
- сахарный диабет;
- токсикозы в период беременности;
- поражения опорно-двигательного аппарата в виде артритов и артрозов.
Помимо этого, лазерное лечение можно сочетать с различными видами хирургических вмешательств. Например, высокая эффективность применения лазеров наблюдается при их одновременном использовании с аортокоронарным шунтированием сердца. Лазерная терапия может комбинироваться с другими методами физиотерапевтического лечения (магнитотерапия, лекарственный электрофорез и пр.).
При использовании лазеролечения также важно учитывать противопоказания, которые могут быть выявлены у пациента:
- наличие злокачественных новообразований;
- повышение внутриглазного давления;
- активные инфекционные заболевания как острого характера, так и в виде рецидивов хронической патологии;
- повышенная температура тела; наследственная порфирия;
- нарушенная работа свертывающей системы крови.
При наличии любого их противопоказаний, терапевт отказывается от проведения лазерной терапии в пользу других методов лечения. Ни в коем случае не стоит применять лазеротерапию при указанных состояниях, так как это чревато развитием тяжелых побочных эффектов.
- Эффективное и безопасное проведение методики требует правильной подготовки пациента. Как правило, она должна включать в себя следующие этапы:
- Лечащий врач беседует с пациентом и объясняет ему сущность предстоящей процедуры, а также нюансы ее проведения и рассказывает о возможных побочных эффектах. Подобная психологическая подготовка обеспечивает высокий уровень приверженности больного к проводимой терапии.
- Пациент должен быть обследован на возможные противопоказания, так как при наличии последних использование внутривенного лазерного лечения недопустимо.
- Перед процедурой у больного измеряют частоту сердечных сокращений и дыхания, что позволяет получить информацию о текущем состоянии сердечно-сосудистой системы. Если перед лазеролечением человек испытывает дискомфорт или отмечает появление новых жалоб, терапию следует отложить до выявления причин новых симптомов.
Виды лечения
Облучать кровь во время лазеролечения можно двумя способами: непосредственно внутривенно или же через кожный покров. Внутрисосудистое воздействие лазером проводится в процедурном кабинете, так как в этом случае необходимо соблюдать правила асептики для предупреждения инфекционных осложнений. При этом метод сопровождается болевыми или неприятными ощущениями в связи с инвазивным воздействием излучения. При выполнении внутрисосудистого способа в вену помещается игла от капельницы, в которую вводится лазерный излучатель, обеспечивающий лечебное воздействие. Подобный доступ позволяет оказать максимальный эффект на организм пациента.
Внутривенное лазерное облучение крови существенно превосходит по эффективности чрескожное воздействие. Более безопасной и безболезненной альтернативой является чрескожная лазерная терапия. В этом случае воздействие на сосуды обеспечивается специальным устройством через кожу, без нарушения ее целостности. Несмотря на подобное преимущество, эффект от процедуры значительно ниже, чем в случае внутривенного доступа излучателя. Лазеролечение всегда проводится в виде курсовой терапии. Один курс состоит из 5-10 сеансов, продолжительность каждого составляет 30-60 минут, в зависимости от имеющейся патологии и тяжести состояния.
Проведение процедуры
При назначении лазерного лечения процедура осуществляется в лечебном учреждении в рамках оказания амбулаторной или стационарной помощи. Она проводится по следующему алгоритму:
- Больного размешают на кушетке или стуле, позволяя занять ему удобное положение.
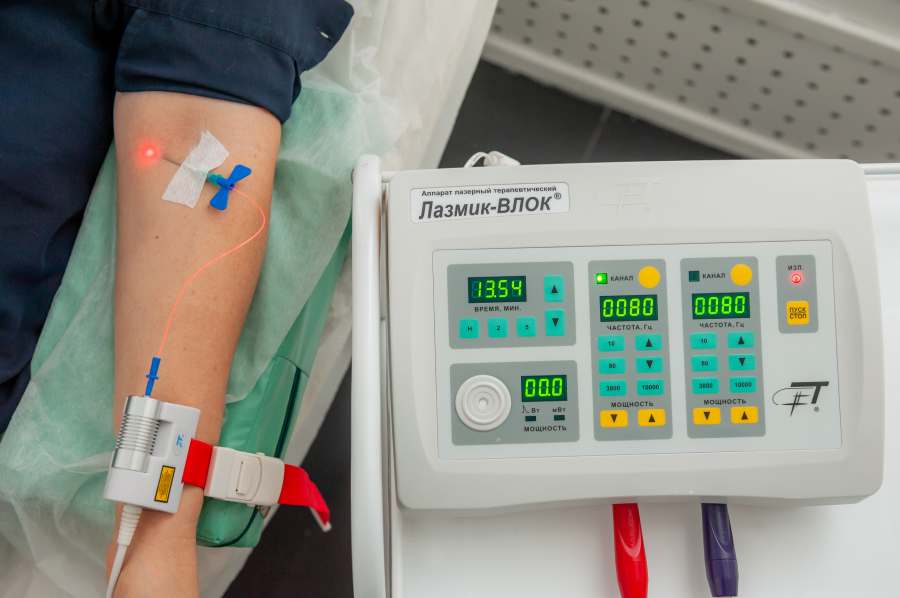
- После обработки кожи в месте предполагаемого прокола внутрь венозного сосуда вводится игла со специальным светодиодом.
- Излучающий блок устройства крепко фиксируется к руке больного.
- Доктор включает устройство, создающее лазерное излучение, устанавливая параметры процедуры.
- Через 20-60 минут аппарат выключается, а игла извлекается из вены пациента.
. Внутривенная лазерная терапия всегда проводится под контролем медицинского работника, так как во время ее выполнения у больного могут появиться побочные эффекты.
Лазеролечение отличается высоким уровнем безопасности, что является важным фактором его широкого использования в медицине. Однако у некоторых больных в процессе выполнения процедуры или непосредственно после нее могут возникнуть следующие неприятные ощущения: легкое головокружение; общая слабость; тошнота. Подобные симптомы связаны с воздействием на организм лазерного излучения, обладающего высокой биологической активностью. Как правило, в течение 20-30 минут после окончания сеанса все неприятные ощущения полностью проходят.
За 10 лет клинического применения лазерных методов терапии не было описано ни одного случая развития серьезных осложнений. В редких ситуациях, при несоблюдении правил асептики, возможно развитие инфекционного процесса в месте введения иглы через кожу. Однако при проведении лазеролечения в условиях лечебного учреждения, подобные последствия не встречаются.
Для проведения внутривенной лазерной терапии используют различные виды аппаратов, обладающие своими нюансами применения. На сегодняшний день наиболее часто применяют приборы «Лазмик-ВЛОК», «Матрикс» и «Азор». Устройство «Лазмик-ВЛОК», например, позволяет проводить не только внутривенные процедуры, но также эффективно реализовать все методы лазерной терапии: местное воздействие, акупунктуру на рефлекторные зоны и проекции внутренних органов, на сосуды и органы иммунной системы.
Проведение внутривенной лазерной терапии показано при большом спектре болезней: стенокардия, ревматоидный артрит, хронический панкреатит и другие патологии. Назначение подобного лечения позволяет улучшить и нормализовать работу внутренних органов, возвращая качество жизни пациента на прежний уровень. Применение лазеролечения должно проходить только по назначению лечащего врача, что обеспечивает эффективность и безопасность методики.
Источник
Механизмы низкочастотной лазерной терапии и светотерапии
Введение
Возможность использования низкоинтенсивного света видимого или ближнего инфракрасного диапазона в целях уменьшения боли, воспалительных процессов и отека, заживления ран и предотвращения повреждения тканей известно уже почти сорок лет с момента изобретения лазеров. К первоначальным свойствам лазерного излучения (холодный лазер) на сегодняшний день добавились и новые, включая фотобиомодуляцию и фотобиостимуляцию с использованием некогерентного света. Несмотря на многочисленные сообщения о положительных результатах экспериментов, проведенных in vitro, в моделях на животных и в рандомизированных контролируемых клинических испытаниях, вопрос о НИЛТ остается нерешенным, что, вероятно, связано с двумя основными причинами. Во-первых, не полностью понятны биохимические механизмы, лежащие в основе положительных эффектов от лазерной терапии. Во-вторых, сложность рационального выбора среди большого количества параметров излучения, таких как длина волны, плотность, интенсивность, структура импульса и продолжительность терапии, привела к публикации ряда как негативных, так и положительных отзывов. В частности, наблюдалась реакция применения двухфазной дозы облучения, когда низкоинтенсивный свет имел гораздо лучший эффект относительно высокоинтенсивного излучения. Настоящий вводный обзор будет посвящен некоторым из предложенных клеточных хромофоров, ответственных за влияние видимого света на клетки млекопитающих, включая цитохром с-оксидазу (с пиками поглощения в ближней инфракрасной спектральной области) и фотоактивные порфирины. Предполагается, что митохондрии являются вероятным сайтом начальной реакции организма на свет, приводя к увеличению синтеза АТФ, модуляции активных форм кислорода и индукции транскрипционных факторов. Эти эффекты, в свою очередь, приводят к увеличению пролиферации и миграции клеток (в частности, фибробластов), модуляции цитокинов, факторов роста и медиаторов воспаления и повышенной оксигенации тканей. Результаты этих биохимических и клеточных изменений у животных и пациентов включают такие преимущества, как ускорение заживления ран, улучшение прогнозов при спортивных травмах, уменьшение боли при артрите и невропатии, а также быструю реабилитацию после сердечных приступов, инсульта, повреждения нервной ткани.
ИСТОРИЯ
В 1967 году, спустя несколько лет после того, как был изобретен первый рабочий лазер, Эндре Местер из Университета Семмельвейса в Будапеште, Венгрия, захотел проверить, может ли лазерное излучение провоцировать рост раковых клеток у мышей [1]. Сбрив волосы на спине, Местер разделил мышей на две группы и подверг низкоинтенсивным излучением рубиновым лазером (694 нм) одну группу. К его удивлению волосы на обработанной лазерной терапией группе выросли быстрее. Это была первая демонстрация «лазерной биостимуляции». С тех пор медицинское лечение источниками когерентного света (лазерами) или некогерентным светом (светоизлучающие диоды, светодиоды) начало интенсивно развиваться в медицине. В настоящее время в области физической терапии во многих частях мира практикуется низкоинтенсивная лазерная терапия (НИЛТ), также известная как «холодный лазер», «мягкий лазер», «биостимуляция» или «фотобиомодуляция». Фактически, светотерапия является одним из самых старых терапевтических методов, используемых людьми (исторически как светотерапия у египтян, а позже как УФ-терапия, благодаря которой Нильс Финсен стал обладателем Нобелевской премии в 1904 году [2]). Использование лазеров и светодиодов в качестве источников света стало следующим шагом в технологическом развитии светотерапии. В НИЛТ вопрос уже не в том, имеет ли свет биологические эффекты, а в том, как энергия от терапевтических лазеров и светодиодов работает на клеточном и органном уровнях и каковы оптимальные параметры света для различных источников света.
Одним из важных моментов, которые были продемонстрированы в многочисленных исследованиях в клеточных культурах [3], моделях животных [4] и в клинических исследованиях, является концепция двухфазного дозозависимого эффекта, когда результат сравнивается с общей суммарной плотностью энергии света (флюенсом). Причина, по которой метод называется низкоинтенсивным, заключается в том, что существует оптимальная доза света для любого конкретного применения, а дозы ниже этого оптимального значения или, что более важно, больше оптимального значения, будут иметь уменьшенный терапевтический результат, а зачастую высокие дозы света могут привести к отрицательному результату. Возможно, существуют три основные области медицины и ветеринарной практики, в которых НИЛТ играет важную роль (рисунок 1). Это: (i) заживление ран, восстановление тканей и предотвращение клеточной смерти; (ii) облегчение воспаления при хронических заболеваниях и травмах с его ассоциированной болью и отеком; (iii) облегчение нейрогенной боли. Предлагаемые пути объяснения механизмов НИЛТ должны в идеале быть применимы ко всем этим условиям.

БИОХИМИЧЕСКИЕ МЕХАНИЗМЫ
Фотобиология тканей
В первом законе фотобиологии говорится, что для видимого света малой мощности, имеющего какое-либо влияние на живую биологическую систему, фотоны должны поглощаться электронными полосами поглощения, принадлежащими некоторому молекулярному хромофору или фотоацептору [5]. Один из подходов к нахождению идентичности этого хромофора – осуществление спектрального воздействия. Графическое изображение, представляющее биологический ответ в зависимости от длины волны, частоты или энергии фотонов должно совпадать со спектром поглощения молекулы фотоацептора. Тот факт, что структурированный спектр действия может быть построен графически поддерживает гипотезу о существовании клеточных фотоацепторов и сигнальных путей, стимулируемых светом.
Второе важное соображение касается оптических свойств ткани. Как поглощение, так и рассеяние света в ткани зависят от длины волны выше в синей области спектра, чем в красной, так и основной хромофор ткани (гемоглобин) имеет высокую поглощающую способность волн короче 600 нм. По этим причинам существует так называемое «оптическое окно». Вода начинает значительно поглощать свет при длинах волн больше 1150 нм. По этим причинам в тканях, подвергнутых воздействием красного и инфракрасного спектров, имеется так называемое «оптическое окно», где максимальное проникновение света в ткань максимизируется (рис. 2). Поэтому, хотя синий, зеленый и желтый свет может оказывать значительное влияние на клетки, растущие в оптически прозрачной культуральной среде, использование НИЛТ у животных и пациентов почти исключительно связано с красным и ближним инфракрасным светом (600-950 нм).

Рисунок 2. Оптическое окно ткани вследствие уменьшения поглощения красной и ближней инфракрасной длин волн (600-1200 нм) тканевыми хромофорами.
Спектры действия
В 1989 году было высказано предположение о том, что механизм действия НИЛТ на клеточном уровне основан на поглощении монохроматического видимого и NIR-излучения компонентами цепи переноса электронов клеток [6]. Внутренняя митохондриальная мембрана содержит 5 комплексов интегральных мембранных белков: NADH-дегидрогеназу (комплекс I), сукцинатдегидрогеназу (комплекс II), цитохром-редуктазу (комплекс III), цитохромоксидазу (комплекс IV), АТФ-синтазу (комплекс V) и двух свободно диффундирующих молекул убихинона и цитохрома с, которые перемещают электроны от одного комплекса к другому (рис. 3). Дыхательная цепь совершает ступенчатый перенос электронов от NADH и FADH2 (образующихся в цикле лимонной кислоты) к молекулам кислорода с образованием (с помощью протонов) молекул воды, используя энергию, выделяемую этим протонным переносом, на перекачку протонов (H+) от матрицы к межмембранному пространству. Протонный градиент, образованный мембранным процессом активного транспорта, образует миниатюрный аккумулятор. Протон может проходить обратно вниз по этому градиенту, возвращаясь к матрице, только через другой комплекс интегральных белков во внутренней мембране, комплекс АТФ-синтазы.

Рис 1. Структура и принцип работы цитохром с-оксидазы.
Спектры поглощения цитохром с-оксидазы, полученные в разных состояниях окисления, были зарегистрированы и оказались очень похожими на спектры действия для биологических реакций на свет. Поэтому было предложено, чтобы цитохром с-оксидаза являлась основным фотоакцептором для красного и NIR-диапазона в клетках млекопитающих [7] (рисунок 4). Цитохром с-оксидаза содержит два центра железа, haem a и haem a3 (также называемые цитохромами a и a3) и два медных центра CuA и CuB [8]. Полностью окисленная цитохромоксидаза имеет как атомы железа в степени окисления Fe(III), так и атомы меди в степени окисления Cu(II), в то время как полностью восстановленная цитохрома c-оксидаза имеет железо в степени окисления Fe(II) и меди Cu(I). Существует много промежуточных смешанно-валентных форм фермента и других координатных лигандов, таких как CO, CN и формиат. Все эти отдельные окислительно-восстановительные состояния фермента имеют разные спектры поглощения [9], что, вероятно, объясняет незначительные различия в спектрах действия НИЛТ, о которых сообщалось. В недавней работе группы Karu [10] приведены следующие диапазоны длин волн для четырех пиков в спектре действия НИЛТ: 1) 613,5 — 623,5 нм, 2) 667,5 — 683,7 нм, 3) 750,7 — 772,3 нм, 4) 812,5 — 846,0 нм.

Рисунок 5. Спектр действия НИЛТ в культуральных клетках, у животных и пациентов. Представленные данные являются объединением многих отчетов из нескольких лабораторий.
В исследовании, проведенном Pastore et al [11], изучалось влияние излучения He-Ne лазера на цитохром c-оксидазу. Было обнаружено повышенное окисление цитохрома c и увеличение скорости переноса электронов. Артюхов и его коллеги обнаружили [12] повышенную ферментативную активность каталазы после воздействия He-Ne.
Поглощение фотонов молекулами приводит к электронно-возбужденным состояниям последних и, следовательно, может привести к ускорению реакций в дыхательной цепи [13]. Ускорение электронного транспорта обязательно приводит к увеличению производства АТФ [14]. Увеличение синтеза АТФ и увеличение градиента протонов приводит к увеличению активности антипортеров Na+/H+ и Ca2+/Na+ и всех АТФ-зависимых ионных транспортеров, таких как Na+/K+ АТФаза и Са2+. АТФ является субстратом для аденилатциклазы, поэтому уровень АТФ контролирует уровень цАМФ. Оба Ca2+ и cAMP очень важны для вторичных мессенджеров. Особенно это касается ионов кальция, которые регулируют почти каждый процесс в организме человека.
В дополнение к опосредованному цитохром с-оксидазой увеличению производства АТФ НИЛТ может ускорять и другие механизмы. Первым из них мы рассмотрим «гипотезу синглетного кислорода». Некоторые молекулы, поглощающие видимый спектр, такие как порфирины, и не имеющие в активных центрах металлов с переходной валентностью [15], а также некоторые флавопротеины [16], после поглощения фотона могут на продолжительное время переходить возбужденное состояние, впоследствии имея возможность взаимодействовать с кислородом, что будет приводить к образованию реакционноспособного синглетного кислорода. Это та самая молекула, которая используется в фотодинамической терапии (PDT) для уничтожения раковых клеток, разрушения кровеносных сосудов и уничтожения микробов. Исследователи PDT давно знают, что очень низкие дозы PDT могут вызвать пролиферацию клеток и стимуляцию тканей вместо убийства, наблюдаемого при высоких дозах [17].
Следующим предложенным механизмом была «гипотеза изменения редокс-свойств» [18]. Изменение метаболизма митохондрий и активация дыхательной цепи путем светового воздействия также увеличило бы производство супероксидных анионов O2•-. Было показано, что клеточное образование O2- зависит в основном от метаболического состояния митохондрий. Другие окислительно-восстановительные цепи в клетках также могут быть активированы НИЛТ. NADPH-оксидаза представляет собой фермент, обнаруженный на активированных нейтрофилах и способный к немитохондриальной окислительной вспышке, индуцируя образование больших количеств ROS [19]. Эти эффекты зависят от физиологических параметров организма, а также от параметров излучения.
Активность цитохром c-оксидазы подавляется оксидом азота (NO). Это ингибирование митохондриального дыхания NO, являясь обратимым процессом, может быть объяснено прямой конкуренцией между NO и O2 на восстановленном двухъядерном центре CuB/a3 цитохром c-оксидазы [20]. Было предложено, что лазерное излучение способно нивелировать подобный процесс и, таким образом, повышая скорость дыхания (NO гипотеза) [21]. Недавно опубликованные данные Karu et al. [21], косвенно подтверждают эту гипотезу. Другим доказательством участия NO в ответах на НИЛТ является увеличение продукции NO-синтазы при воздействии светом (635 нм) [22]. Хотя оба наблюдения подтверждают гипотезу зависимости уровня NO в ответ на НИЛТ, отклик на разные длины волн в различных исследовательских моделях могут регулироваться различными механизмами.
Клеточный сигналинг
Комбинация продуктов окислительного потенциала и восстановительной способности связанных редокс-пар, присутствующих в клетках и тканях, представляет собой окислительно-восстановительную среду (редокс-состояние) клетки. К окислительно-восстановительным парам, присутствующим в клетке, относятся: никотинамидадениндинуклеотид (окисленные/восстановленные формы) NAD / NADH, никотинамидадениндинуклеотидфосфат NADP/NADPH, пара глутатиона/восстановленного глутатиона GSH/GSSG и пара тиоредоксина/дисульфида тиоредоксина Trx(SH)2/TrxSS [23]. Несколько важных путей регуляции опосредуются через клеточное редокс-состояние. Изменения в окислительно-восстановительном состоянии индуцируют активацию многочисленных внутриклеточных сигнальных путей, регулируя синтез нуклеиновых кислот и белка, ферментативную активность и прогрессию клеточного цикла [24]. Эти клеточные реакции, в свою очередь, индуцируют транскрипционные изменения. Некоторые факторы транскрипции регулируются изменениями редокс-состояния клетки. Среди них редокс фактор-1 (Ref-1)-зависимый активирующий белок-1 (AP-1) (Fos и Jun), ядерный фактор B (NF-B), p53, транскрипционный фактор/цАМФ-связывающего белка (ATF/CREB), фактор, индуцируемый гипоксией (HIF)-1 и HIF-подобный фактор. Как правило, окисленная форма редокс-зависимых транскрипционных факторов обладает низкой ДНК-связывающей активностью. Ref-1 является важным фактором для специфического сокращения факторов транскрипции. Однако, было также показано, что низкие уровни оксидантов, по-видимому, стимулируют пролиферацию и дифференцировку некоторых типов клеток 27.
Предполагается, что НИЛТ производит сдвиг общего окислительно-восстановительного потенциала клетки в сторону большего окисления [28]. Различные клетки в диапазоне условий роста имеют отчетливые редокс-состояния. Поэтому эффекты НИЛТ могут значительно различаться. Клетки, первоначально имеющие более низкий редокс-статус (низкий уровень внутриклеточного рН), обладают высоким потенциалом биологического ответа при воздействии НИЛТ, тогда как клетки в оптимальном редокс-состоянии реагируют слабо или не реагируют на лечение светом вообще.

Рисунок 6. Клеточный сигналинг, индуцированный НИЛТ.
РЕЗУЛЬТАТЫ IN VITRO
Типы клеток
Существуют данные о том, что несколько типов млекопитающих и микробных клеток могут реагировать на НИЛТ. Большую часть работы Karu использовала Escherichia coli [29] и клетки HeLa [30], клеточную линию карциномы шейки матки человека. Однако для клинических применений НИЛТ, подлежащих валидации, гораздо важнее изучить влияние НИЛТ на не-злокачественные типы клеток, которые могут быть эффективно стимулированы в целях устранения некоторых заболеваний или травм. Для исследований заживления ран вариация клеток, вероятно, ограничивается эндотелиальными клетками [31], фибробластами [32], кератиноцитами [33] и, возможно, некоторыми классами лейкоцитов, например, макрофаги [34] и нейтрофилы [35]. Для исследований по облегчению боли и восстановлению нервной ткани изучать следует нейроны 36 и глиальные клетки [39]. Для противовоспалительных и противоотечных эффектов лазерного излучения – макрофаги [34], тучные клетки [40], нейтрофилы [41], лимфоциты [42] и т.д. Существует литературные данные об эффектах НИЛТ in vitro для большинства из этих типов клеток.
Изолированные митохондрии
Поскольку дыхательная цепь и цитохромоксидазы расположены в митохондриях, несколько групп ученых испытали влияние НИЛТ на изолированных митохондриях. Наиболее популярной системой для изучения является влияние He-Ne лазерного облучения митохондрий, выделенных из печени крыс, в которых наблюдался повышенный электрохимический протонный потенциал и ускоренный синтез АТФ [43]. Индуцированный синтез РНК и белка был продемонстрирован при 5 Дж/см2 [44]. Pastore et al. [45] обнаружили повышенную активность цитохром с-оксидазы и полярографически измеренного увеличения утилизации кислорода при 2 Дж/см2 при применении He-Ne лазера. В облучаемых светом митохондриях обнаружена значительное повышение активности протонного насоса, около 55%-ное увеличение отношения
Источник