- Юридический статус инструкций по медицинскому применению и типовых клинико-фармакологических статей
- Клинико фармакологическая статья лекарственного препарата это
- Введение
- Заключение
- Дополнительная информация
- Литература
- COVID-19 и клиническая фармакология
- Научно-исследовательские работы в области лекарственных средств
- Стратегии изучения лекарственных средств для лечения COVID-19
- Гортизонты разработки лекарственных средств для лечения COVID-19
- Изучение действенности (efficacy) лекарственных средств при COVID-19
- Изучение эффективности лекарственных средств в реальной клинической практике
- Роль клинической фармакологии при COVID-19
- Обсуждение
- Заключение и рекомендации
Юридический статус инструкций по медицинскому применению и типовых клинико-фармакологических статей
В процессе дискуссии по поводу назначения лекарственных средств по официально незарегистрированным показаниям (off-label) возник вопрос о (1) юридическом статусе инструкции по медицинскому применению (ИМП) и типовых клинико-фармакологических статей (ТКФС), (2) легитимности назначения лекарственных средств по off-label показаниям.
Отвечая на первый вопрос необходимо обратиться к Государственному информационному стандарту лекарственного средства, утвержденному Приказом Минздрава РФ от 26 марта 2001 г. N 88 «О введении в действие отраслевого стандарта «Государственный информационный стандарт лекарственного средства. Основные положения». В данном документе дается характеристика этих двух документов: ИМП и ТКФС.
ТКФС представляет собой официальный документ, содержащий сведения об основных свойствах лекарственного средства или часто используемых (стандартных) его комбинаций, определяющих эффективность и безопасность ЛС …
Таким образом, ТКФС — это:
1. Официальный документ.
2. Содержит сведения об основных (но не всех!) свойствах ЛС, определяющих эффективность и безопасность ЛС.
Далее указано:
Типовая клинико-фармакологическая статья лекарственного средства должна содержать информацию по следующим позициям:
…
— область применения (основные показания);
— типичные противопоказания;
— типичные нежелательные побочные эффекты
…
Таким образом, ТКФС описывает основные (но не все!) показания, типичные (но не все!) противопоказания и побочные эффекты. То есть ТКФС может быть неполной, а следовательно, не содержать всех сведений, необходимых врачу для принятия взвешенного решения о назначении лекарственного препарата и его профиле безопасности.
Согласно тому же документу ИМП — официальный документ, содержащий информацию о лекарственном препарате, необходимую и достаточную для его эффективного и безопасного медицинского применения.
Таким образом, ИМП — это:
1. Официальный документ.
2. Содержит информацию о ЛП, необходимую и достаточную для…медицинского применения.
Если обратить внимание на определение, то ТКФС содержит информацию о лекарственном средстве, а ИМП о лекарственном препарате. То есть, ТКФС, как правило, содержит информацию об активных компонентах препарата. А ИМП об активных компонентах, вспомогательных веществах, а также особенностях лекарственной формы.
Например, согласно решению специализированной педиатрической комиссии Федерального государственного учреждения «Научный центр экспертизы средств медицинского применения» (экспертного учреждения, ответственного за экспертизу лекарственных средств, включая экспертизу ИМП) твердые лекарственные формы (таблетки, капсулы и др. для приема внутрь) противопоказаны у детей до 3 лет (из-за возможных нарушений при проглатывании). В ТКФС такие сведения не заносятся, так как чаще всего, они составляются без учета лекарственных форм.
Другой пример: препарат выпускается различными производителями в форме таблеток 300 мг (без риски) и таблеток 300 мг (с риской). Риска — «бороздка» на таблетке, позволяющая разделить ее на две ровные части. Если при одном из показаний доза препарата составит 150 мг 2 раза в сутки, то в ИМП для таблеток без риски данное показание будет отсутствовать, так как отсутствие риски не позволяет разделить ее на две ровные части по 150 мг. В ТКФС же данное показание будет присутствовать, так как она составляется для действующего вещества.
Еще один пример: препарат выпускается различными производителями в форме таблеток, действующие вещества одни и те же, но состав вспомогательных веществ различается. В одних таблетках в качестве вспомогательного вещества содержится лактоза и сахароза, в других целлюлоза. В этом случае в ИМП на препарат, содержащий лактозу и сахарозу в разделе «Противопоказания» появятся следующие состояния:
1. Дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция (из-за наличия лактозы).
2. Дефицит сахаразы/изомальтазы, непереносимость фруктозы, глюкозо-галактозная мальабсорбция (из-за наличия сахарозы).
К тому же в разделе «С осторожностью» для препарата, содержащего сахарозу, будет указан сахарный диабет, а в разделе «Особые указания» сведения о содержании углеводов в хлебных единицах в суточной дозе препарата.
В том же ГИСЛС указано, что «Расширение перечня показаний, изменения в разделах касающихся побочных эффектов, противопоказаний, лекарственных взаимодействий и другие изменения по сравнению с ТКФС в инструкциях на вновь регистрируемые препараты производятся в соответствии с заключением экспертного органа на основании доказательных клинических исследований и утверждаются в установленном порядке МЗ РФ.
То есть по заключению экспертного органа на основании клинических исследований между ТКФС и ИМП могут возникать различия, которые в целом не противоречат друг другу. Однако информация, содержащаяся в ИМП более полная и при назначении ЛС руководствоваться необходимо именно ей.
ТКФС дает лишь общую информацию о лекарственном средстве, ею можно руководствоваться для первичного отбора ЛС, выяснения общих сведений о нем, но она не всегда может служить точным руководством к действию, в отличие от ИМП.
С уважением,
Главный специалист сектора ведения ТКФС
Отдела унификации и обработки данных
Центра управления документооборотом и унификации данных
ФГУ «Научный центр экспертизы средств медицинского применения» Росздравнадзора
Ниязов Равиль Рашидович



Источник
Клинико фармакологическая статья лекарственного препарата это
1) Федеральный центр сердечно-сосудистой хирургии г. Челябинск, Россия, https://orcid.org/0000-0003-4810-2295; 2) Российская медицинская академия непрерывного профессионального образования, Москва, Россия, https://orcid.org/0000-0002-9307-4994
Введение
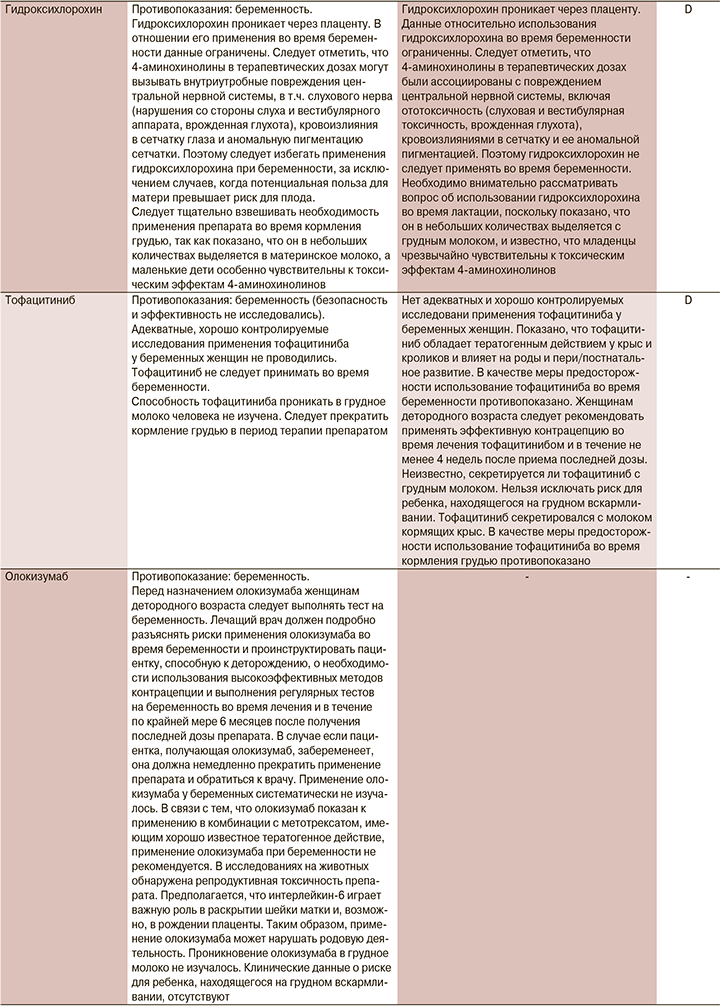
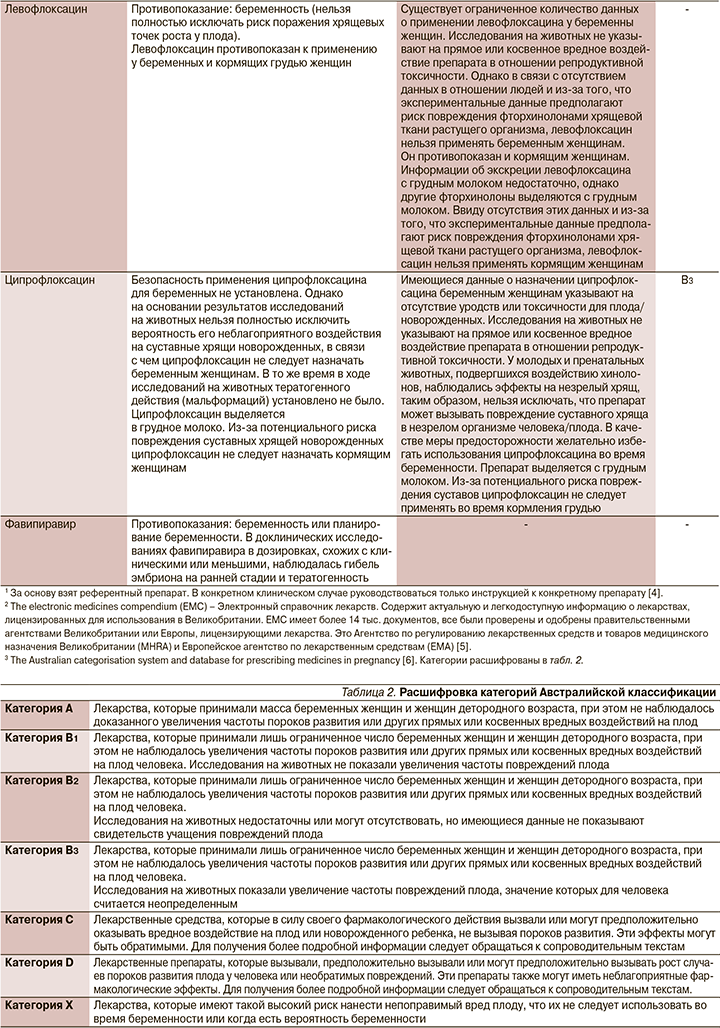
Беременность – это физиологическое состояние, предрасполагающее к респираторным вирусным инфекциям [1]. В связи с физиологическими изменениями в иммунной и сердечно-легочной системах у беременных женщин повышена вероятность тяжелого течения респираторных вирусных заболеваний [2]. Этиотропного лечения COVID-19 у женщин в период беременности и кормления грудью в настоящее время не разработано. Рекомбинантный интерферон β-1b, противомалярийные препараты противопоказаны к применению во время беременности. Однако в качестве этиотропной терапии возможно назначение противовирусных средств с учетом их эффективности против нового коронавируса по жизненным показаниям. В остальных случаях следует учитывать их безопасность при беременности и в период грудного вскармливания [1, 3]. Эмпирическая антибактериальная терапия должна быть назначена лишь в случае, если есть подозрение на бактериальную инфекцию с характерными симптомами (нейтрофильный сдвиг, долевое уплотнение на КТ или рентгенографии и т.д.). Однако отсутствие этих признаков не исключает бактериальной инфекции.
При решении о назначении антибактериальных препаратов необходимо [1]:
- начать лечение эмпирическими антибиотиками после постановки диагноза пневмонии в течение 4 часов, при тяжелой пневмонии – немедленно: в течение часа;
- не ждать результата микробиологического теста;
- начать лечение в течение часа, если есть подозрение на сепсис у больной.
Вопрос о проведении терапии противовирусными препаратами необходимо решать после детального обсуждения с клиническими фармакологами; следует подробно проконсультировать беременных по вопросу о возможных побочных эффектах противовирусных препаратов для самой женщины, а также о риске задержки внутриутробного развития плода [1]. Гепаринотерапия в настоящее время признана обоснованной в случае тяжелого течения заболевания [3].
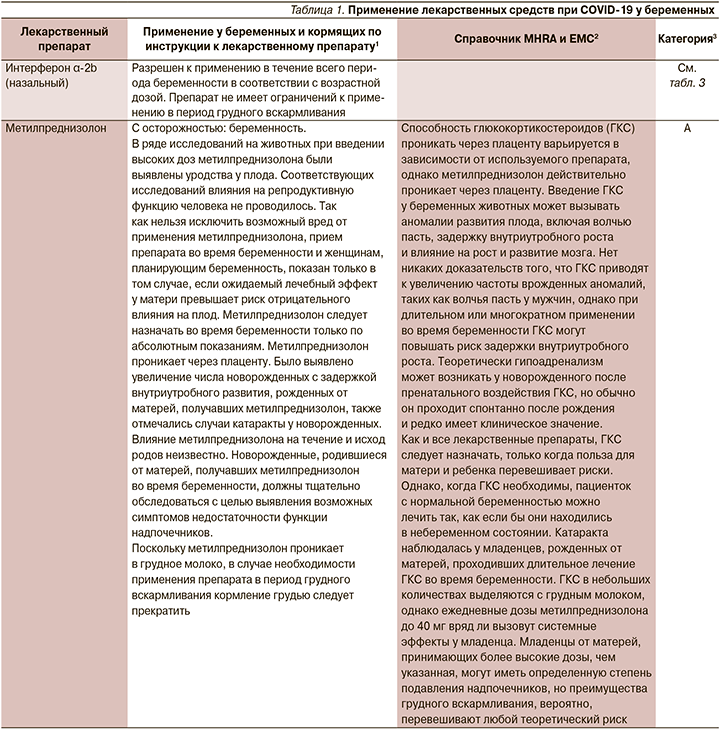
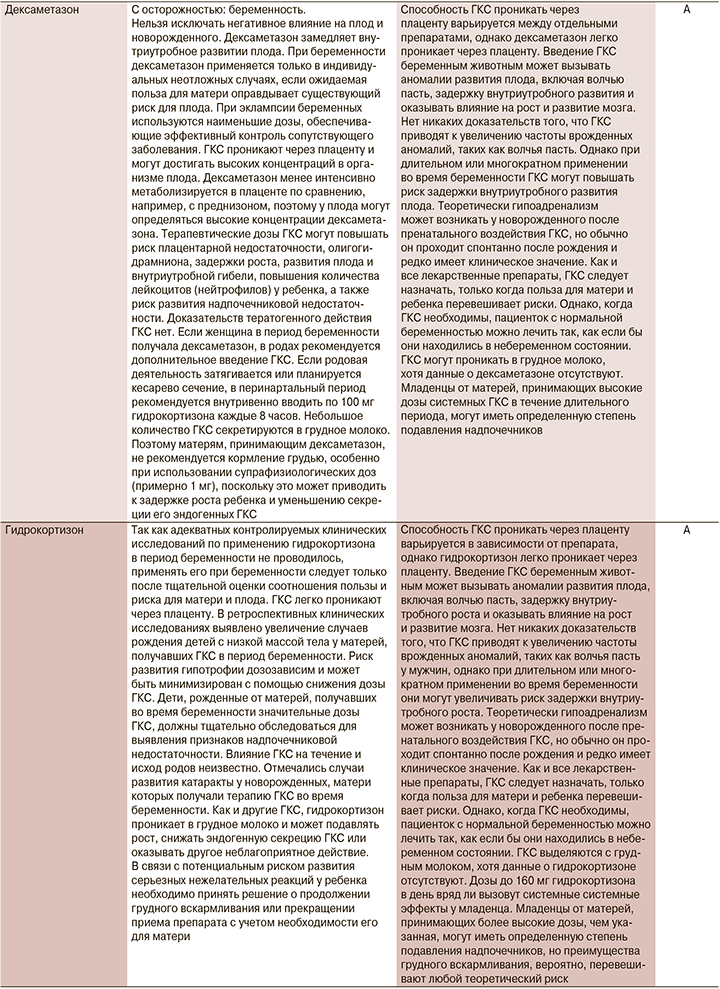
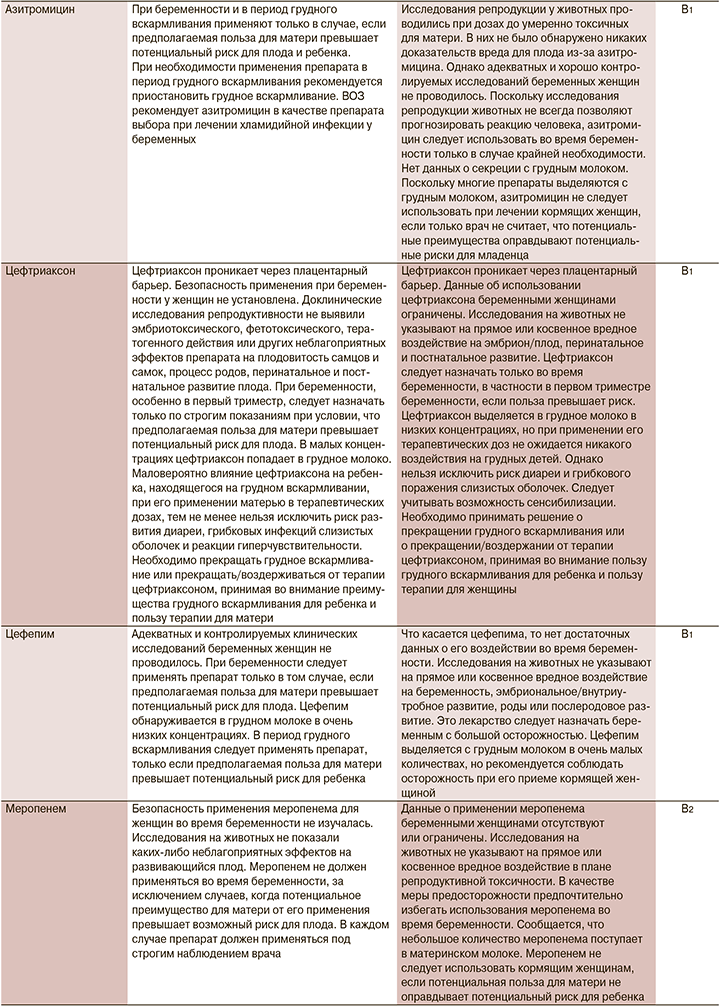
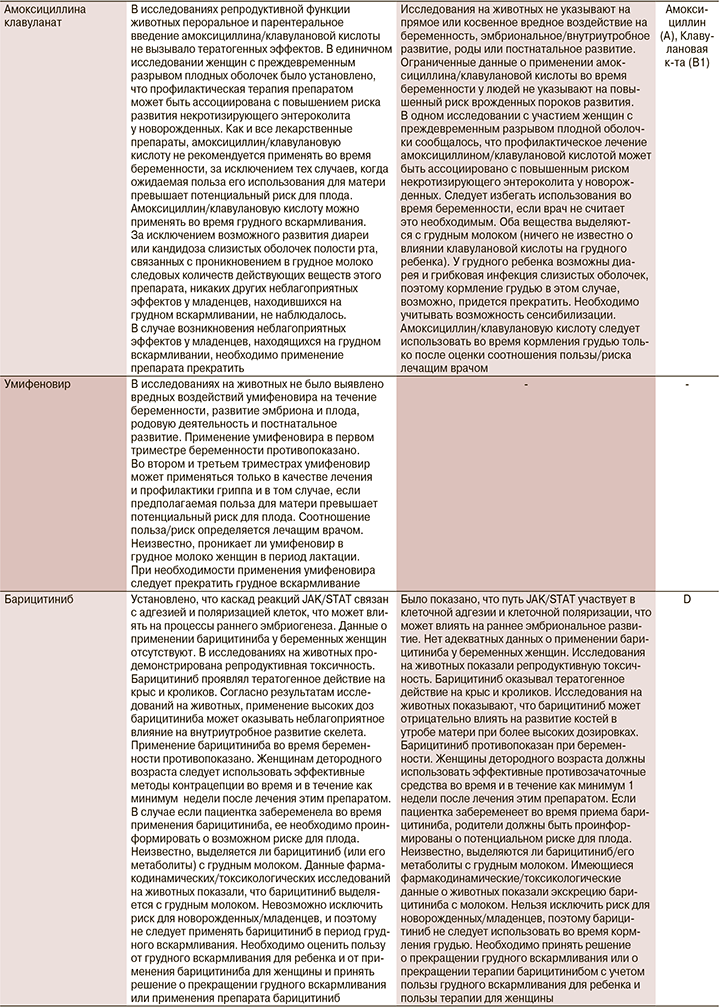
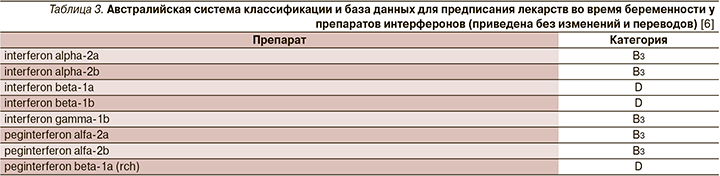
В настоящий момент информация о назначении лекарственных препаратов беременным законодательно закреплено в инструкциях по их применению. Мы решили ее расширить информацией Агентства по регулированию лекарственных средств и товаров медицинского назначения Великобритании (MHRA) и Европейского агентства по лекарственным средствам (EMA), а также Австралийской системы классификации и баз данных для предписания лекарств во время беременности (табл. 1).
Заключение
1. Назначение лекарственного препарата беременной и кормящей при COVID-19 возможно, но нужно взвешивать соотношение польза/риск.
2. При использовании препаратов беременной и кормящей необходимо использовать инструкцию к конкретному препарату. В отсутствие информации и превышения пользы над риском следует обосновывать назначение инструкцией к препарату, данными из клинических исследований различных фаз и мирового опыта использования в реальной клинической практике.
Дополнительная информация
Представленные рекомендации служат для поддержки клинических решений, принимаемых лечащим врачом, и не исключают клинического мышления врача, самостоятельный поиск последней научной информации, сверку с действующими инструкциями по медицинскому применению лекарственных препаратов. Представленная информация основана на результатах научного поиска, проведенного 27.11.2020 экспертами Центра «ФармаCOVID» на базе РМАНПО Минздрава России, Москва.
Литература
1. Методические рекомендации. Организация оказания медицинской помощи беременным, роженицам, родильницам и новорожденным при новой коронавирусной инфекции COVID-19. М.: Министерство здравоохранения Российской Федерации, 2020. 66 c.
2. Poon L.C., Yang H., Lee J.C., et al. ISUOG Interim Guidance on 2019 novel coronavirus infection during pregnancy and puerperium: information for healthcare professionals. Ultrasound Obstet Gynecol. 2020. Doi: 10.1002/uog.22013.
3. Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 8.1 (01.10.2020). М.: Министерство здравоохранения Российской Федерации, 2020. 226 c.
4. Государственный реестр лекарственных средств (Электронный ресурс).
5. The electronic medicines compendium (EMC) (Electronic resource). URL: https://www.medicines.org.uk/emc/
6. An Australian categorisation of risk of drug use in pregnancy
Источник
COVID-19 и клиническая фармакология
В статье рассматривается роль клинической фармакологии в управлении пандемией COVID-19, в частности разработке лекарственных средств, оказывающих действие на коронавирусную инфекцию. Предлагаются различные стратегии и горизонты изучения данной инфекции и анализируются отдельные группы лекарств. Подробно обсуждаются текущие клинические исследования при COVID-19, основные тренды, проблемы и задачи, стоящие перед клинической фармакологией, роль клинических рекомендаций. Приведены результаты применения различных лекарственных средств
Долгие годы коронавирус (CoV), открытый в 1960 г. D. Tyrrell, а затем описанный J. Almeida и соавт. в Nature в 1968 г., был лишь причиной острых респираторных инфекций легкого течения [1,2]. В связи с этим не было оснований для выделения человеческих и финансовых ресурсов с целью разработки этиотропной терапии коронавирусной инфекции. Если проанализировать клинические рекомендации 2018 г. по лечению простуды у детей и взрослых, все предлагаемые симптоматические средства имели крайне низкую доказательную базу, а некоторые рассматривались как нежелательные или даже опасные, например, антибиотики у взрослых или блокаторы H1-гистаминовых рецепторов у детей, соответственно [3,4]. Лекарственные средства, оказывающие действие на CoV, в этих рекомендациях отсутствовали, однако пандемия COVID-19 (COronaVIrus Disease 2019) изменила такое снисходительное отношение к коронавирусам.
Научно-исследовательские работы в области лекарственных средств
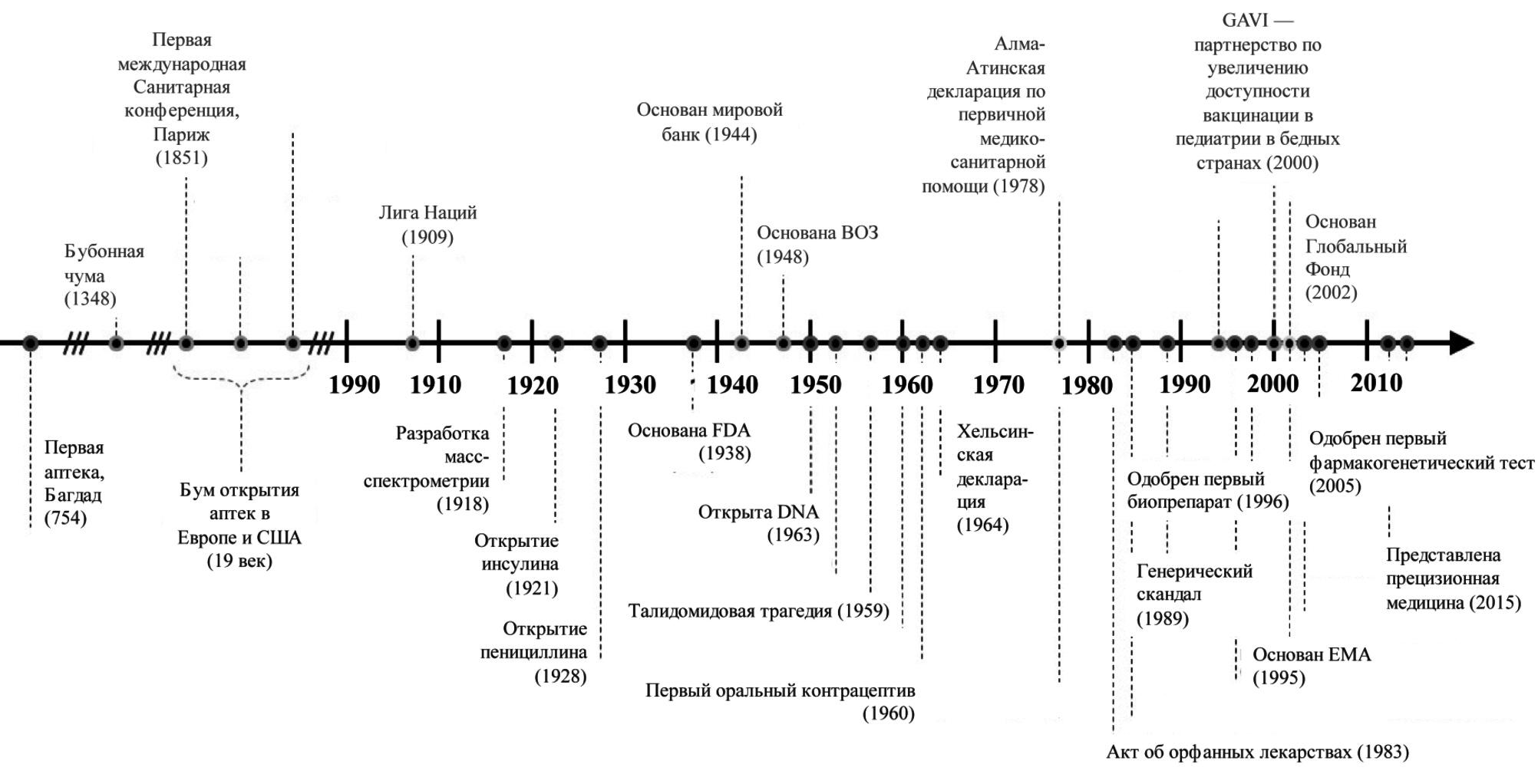
Философия создания лекарственных средств формировалась на протяжении предыдущего столетия. В основном это была реакция фармацевтической индустрии на основные вехи социально-экономического развития человечества и в чем-то системы здравоохранения (рис. 1). С целью стандартизации процесса изучения лекарственных средств в 80-е гг. прошлого столетия была предложена GCP (Good Clinical Practice, Надлежащая клиническая практика). Для разработки большинства лекарственных средств (от малых молекул до генно-инженерных биологических препаратов), включая лабораторные, доклинические и клинические исследования, и одобрения их клинического применения требуется от 8 до 10 лет [6,7]. Одним из самых длительных процессов являются клинические исследования, которые проводятся в четыре фазы и позволяют оценить действенность (efficacy) лекарственного препарата. На основании этих данных производится его регистрация регулирующими органами [8]. Как правило, действенность изучается в рандомизированных клинических исследованиях (РКИ), которые предполагают строгое выполнение утвержденного протокола исследования, соблюдение принципов GCP и высокую приверженность к лечению. Результаты таких исследований публикуются в научных журналах и доступны для медицинской общественности. Медицина, основанная на доказательствах, преимущественно, но не только, оперирует действенностью, однако на основании результатов клинических исследований нельзя в полной мере судить об эффективности лекарственного средства в общей популяции больных, в том числе в разных странах (даже в разных медицинских организациях) и разных группах, отличающихся по полу, возрасту, функции печени и почек, наличию сопутствующих заболеваний и сопутствующей терапии и т.д. [6]. Для подтверждения эффективности (effectiveness) проводят дополнительные обсервационные исследования в условиях реальной клинической практики – real world data (RWD) [9].
Стратегии изучения лекарственных средств для лечения COVID-19
Пандемии COVID-19 предшествовали вспышки тяжелого острого респираторного синдрома (Severe acute respiratory syndrome, SARS) и ближневосточного респираторного синдрома (Middle East respiratory syndrome, MERS), которые были зафиксированы в Китае (2003 г.) и Саудовской Аравии (2012 г.), соответственно. Поиск противовирусных препаратов показал, что многочисленные химические соединения могут влиять на проникновение и/или репликацию CoV в клеточной культуре [10,11]. Был накоплен и небольшой клинический опыт применения различных лекарств, в том числе рибавирина, интерферона альфа, метилпреднизолона, лопинавира/ритонавира, а также реконвалесцентной плазма и комбинации этих средств в той или иной последовательности [12]. Одновременно были предложены стратегии разработки эффективных и безопасных лекарственных средств для лечения и профилактики CoV инфекции. Первая – продолжение тестирования уже зарегистрированных противовирусных препаратов, активность которых в отношении РНК-вирусов была показана ранее в клинических исследованиях разного качества и дизайна: интерферон альфа (вирус гепатита С), рибавирин (вирус гепатита С, респираторно-синцитиальный вирус, возбудитель геморрагической лихорадки), лопинавир/ритонавир (ВИЧ), фавипиравир (вирус гриппа). Вторая – использование существующих молекулярных баз данных для скрининга молекул с различным механизмом действия, которые могут оказывать действие на коронавирус: хлорохин и гидроксихлорохин, ремдесивир. Третья стратегия предполагает целевую разработку новых противовирусных препаратов на основе изучения геномной информации и патогенных свойств различных коронавирусов [12]. Однако интенсивные научные исследования с выделением значимых финансовых и человеческих ресурсов проведены не были. Причины такого пассивного поведения будут, наверное, изучены в будущем.
Гортизонты разработки лекарственных средств для лечения COVID-19
31 декабря 2019 г. городская комиссия по здравоохранению г. Ухань (Китай) зарегистрировала несколько случаев пневмонии неизвестной этиологии, а в июне 2020 г. число случаев инфекции, вызванной SARS-CoV-2, практически во всех странах мира превысило 11 млн [13]. Выделяют три горизонта для разработки методов лечения и профилактики COVID-19, которые включают в себя не только этиотропное действие на CoV, но и лечение острого респираторного дистресс-синдрома (ОРДС), синдрома высвобождения цитокинов, или цитокинового шторма (cytokine release syndrome, CRS), сопутствующих бактериальных и грибковых инфекции [14]. Первый краткосрочный горизонт (недели – месяцы) – перепрофилирование существующих (зарегистрированных) лекарственных средств. Совпадает с первой и второй стратегиями, предложенными в 2016 г. A. Zumla и соавт. после вспышек SARS и MERS [12]. Среднесрочный горизонт (месяцы – годы) – это прежде всего создание вакцин. И, наконец, долгосрочный горизонт (годы) – разработка инновационных лекарственных веществ, обладающих новыми механизмами действия (третья стратегия, описанная выше) [14].
По данным международного реестра клинических исследований COVID-19 (Global Coronavirus COVID-19 Clinical Trial Tracker), который объединяет базы китайского реестра клинических испытаний, Сlinical-Trials.gov, информационной службы клинических исследований Республики Корея, регистра клинических испытаний Евросоюза, базы Всемирной организации здравоохранения (ВОЗ) – ISRCTN, иранского реестра клинических испытаний, сеть первичных реестров Японии, немецкий регистр клинических испытаний, данные Роздравнадзора РФ, на 20 июня 2020 г. в мире проводятся или планируются 1457 клинических исследований у пациентов с COVID-19 (табл. 1). Большинство исследований относятся к первом горизонту, т.е. первой и второй стратегиям, и предполагают попытку перепрофилирования уже известных лекарственных средств для лечения COVID-19. Долгосрочный горизонт на этапах клинических исследований не обнаружен.
| Горизонт 1 (зарегистрированные показания), кол-во исследований (первая/вторая стратегии) | Горизонт 2, кол-во исследований | Горизонт 3 (третья стратегия) |
|---|---|---|
| Примечание: В таблице указаны первые 10 исследуемых лекарственных средств. 1 Тофацитиниб, барицитиниб, 2 руксолитиниб; CAR-T — клеточная терапия через T-клетки с химерным антигенным рецептором; * можно отнести клинические исследования моноклональных антител к CoV | ||
| Гидроксихлорохин и хлорохин (малярия; системная красная волчанка; ревматоидный артрит), n=272 Лопинавир/ритонавир (ВИЧ), n=83 Азитромицин (бактериальные инфекции), n=73 Тоцилизумаб (ревматоидный артрит; цитокиновый шторм после CAR-T терапии), n=51 Интерферон альфа или бета, n=51 Кортикостероиды (множество показаний), n = 45 Фавипиравир (грипп), n=35 Витамины, n=30 Антикоагулянты, n=27 Ингибиторы янус-киназ (ревматоидный артрит 1 ; миелофиброз 2 ), n=24 Другие лекарственные средства, n=796 Всего n=1457 | Вакцины, n=49 | Не ясно* |
Фармакодинамические подходы к лечению COVID-19 можно разделить на несколько категорий (рис. 2). В 272 клинических исследованиях более чем в 400 центрах изучаются противомалярийные препараты (гидроксихлорохин или хлорохин). В основном эти исследования проводятся в США (n=112), Иране (n=46) и Испании (n=46). Завершено только 16 из них, а результаты 3 исследований опубликованы. В 308 клинических центрах проводится набор пациентов, а в 111 – он еще не начат. Многие исследования являются рандомизированными, в основном у пациентов с подтвержденным COVID-19. Необходимо отметить, что в марте 2020 г. было начато международное рандомизированное клиническое исследование SOLIDARITY, организованное ВОЗ, в котором планировалось изучение хлорохина и гидроксихлорохина, а также лопинавира/ритонавира и интерферона бета. Врачи, участвующие в этом исследовании, должны сообщать о том, какие лекарственные препараты доступны в конкретной больнице, а затем на веб-сайте ВОЗ производится рандомизация пациента в одну из соответствующих групп. Национальные исследования противомалярийных препаратов были также начаты в Великобритании (RECOVERY), США (СТАР), Франции (DISCOVERY) 17. Механизмы возможного эффекта противомалярийных средств на CoV остаются до конца неясными (рис. 2): взаимодействие, опосредованное эндосомами (нарушение созревание лизосом), ингибирование гликозилирования гликопротеинов мембраны челове ческой клетки или подавление продукции фактора некроза опухоли альфа стимулированными моноцитами/макрофагами [20,21].
Далее по числу проводимых клинических исследований следуют ингибиторы протеазы – лопинавир/ритонавир (n=83). Этот комбинированный препарат стал одним из первых средств, которые рекомендовали для лечения COVID-19 [21,22]. Завершено только 12 клинических исследований (результаты 3 из них опубликованы), в 52 исследованиях продолжается набор пациентов, а в 16 – он еще не начат. К ингибиторам протеазы относится также дарунавир, который изучается по крайней мере в одном клиническом исследованием.
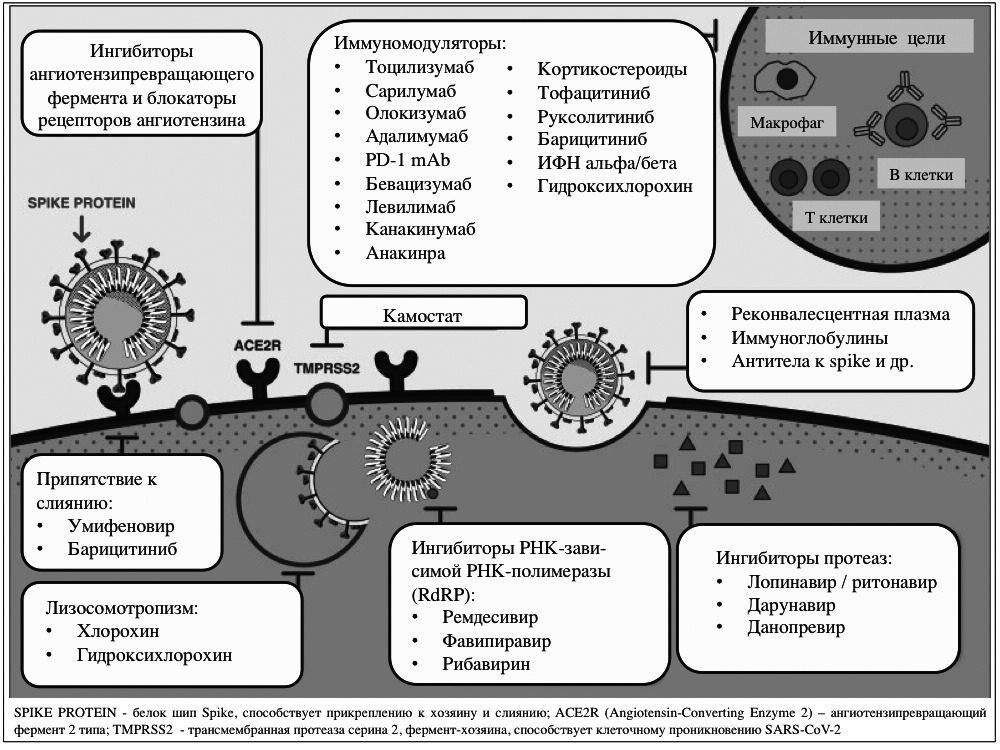
Третьей, наиболее изучаемой группой лекарственных средств, являются различные иммуномодуляторы, обладающие противовоспалительной активностью, в том числе глюкокортикостероиды, моноклональные антитела, блокирующие эффекты интерлейкина (ИЛ)-6 (тоцилизумаб, сарилумаб, олокизумаб) и ИЛ-1 (анакинра, канакинумаб), и ингибиторы янус-киназ (барицитиниб, тофацитиниб, руксолитиниб). Среди перечисленных препаратов следует прежде всего выделить тоцилизумаб (55 клинических исследований), метилпреднизолон (39) и три ингибитора янус-киназ (31). Цель применения указанных лекарственных средств – подавление синдрома высвобождения цитокинов, или цитокинового шторма, который считают одной из ведущих причин тяжелого поражения легких при COVID-19. Ранее этот синдром, ведущую роль в патогенезе которого играет ИЛ-6, был описан при лечении острого лимфобластного лейкоза CAR-T (chimeric antigen receptor) [23], а также некоторых других состояниях. Единственным зарегистрированным лекарственным средством для лечения синдрома высвобождения цитокинов является тоцилизумаб. К июню 2020 были завершены только два клинических исследования тоцилизумаба, а в 41 – продолжается набор пациентов. В многочисленных клинических исследованиях изучаются также глюкокортикоиды, которые оказывают действие на все фазы воспаления – от стабилизации мембран лизосом до угнетения продукции ИЛ (результаты 5 исследования опубликованы) [1,2].
Четвертой группой наиболее активно изучаемых лекарственных средств являются ингибиторы РНКзависимой РНК-полимеразы фавипиравир (37 исследований) и ремдесивир (19). Первый первоначально был разработан для лечения гриппа, а второй – лихорадки, вызванной вирусом Эбола. Механизм действия этих лекарственных средств теоретически позиционирует их как препараты широкого спектра, которые могут обладать активностью в отношении любых РНК-вирусов [21]. К июню 2020 г. были завершены только 1 клиническое исследование ремдесивира (в 11 продолжается набор пациентов) и 3 исследования фавипиравира (в 21 продолжается набор пациентов).
Представители других групп лекарственных средств изучаются в единичных исследованиях. Так, существует высокий интерес к ингибиторам ангиотензипревращающего фермента и блокаторам рецепторов ангиотензина II [24]. Необходимо отметить белок приманку (рекомбинантный человеческий ангиотензинпревращающий фермент 2) ACE2 APN01, разработка которого была начата после вспышки SARS-CoV в 2003 году [25]. Еще одна группа лекарственных веществ – это низкомолекулярные лиганды, вызывающие конформационные изменения ACE2 (ангиотензинпревращающего фермента 2, открытого в 2000 году) [26]. Выделяют около 10 лекарственных средств, которые могут проявлять подобную активность, например, хлорпротиксен. Известно, что CoV использует человеческий рецептор ACE2 для доступа в клетки человека при участии сериновой протеазы TMPRSS2, поэтому блокада взаимодействия между ACE2 и spike-белком вируса может препятствовать развитию вирусной инфекции. Мощ ны ми ингибиторами TMPRSS2 являются камостат и нафамостат [27].
Безусловно, нейтрализующие моноклональные антитела к CoV имеют потенциал как для терапевтического, так и профилактического применения и могут помочь при разработке вакцин. Моноклональные антитела для COVID19 готовят из В-клеток пациентов, которые восстановились после заболевания, а также производят гибридомным методом [28]. В Китае завершено клиническое исследование (NCT04275245) меплазумаба, блокирующего белковый рецептор хозяина (CD147), который способствует проникновению вируса в клетки [29].
Изучение действенности (efficacy) лекарственных средств при COVID-19
Распространение COVID-19 сопровождается беспрецедентным увеличением числа клинических исследований лекарственных средств для лечения инфекции. Например, с марта 2020 г. регистрировали до 160 клинических исследований в неделю (рис. 3). Большинство исследований проводились или проводятся в Китае, Западной Европе и США, в то время как на долю Российской Федерации в июне 2020 г. приходилось только 1% исследований. Всего в мире в клинические исследования при COVID-19 вовлечено более 110000 человек. По фазам клинические исследования в марте 2020 г. распределялись следующим образом: I фаза – 9,1% исследований, II – 34,9%, III – 27,2%, IV – 7,1%, нельзя классифицировать – 21,7%. К июню 2020 г. тренд остался тем же: I фаза – 5,8%, II – 26,7%, III – 17,5%, IV – 4,4%, нельзя классифицировать – 45,6% [22].

За 6 месяцев произошло постепенное смещение тренда от сравнения одного лекарства с плацебо к сравнению нескольких лекарственных средств друг с другом. Большинство исследований (от 63% до 71%) представляют собой интервенционные клинические испытания, хотя проводятся и обсервационные исследования, в которых изучается эффективность (effectiveness). Конечными точками клинических исследований являются выздоровление, облегчение течения заболевания (оценка симптомов, таких как лихорадка, кашель, диарея, миалгия, одышка, в баллах), отсутствие нарастания одышки, частота и длительность искусственной вентиляции легких, перевода в отделение интенсивной терапии и т.д. При проведении клинических исследований у пациентов с COVID-19 были отмечены существенные и практически непреодолимые пока проблемы [30].
Во-первых, во многих исследованиях изучаемые препараты применяются в сочетании с многочисленными другими средствами (рис. 4). При этом количество включенных больных часто ограниченное, что не позволяет провести адекватный вторичный анализ в подгруппах.
Во-вторых, дизайн части текущих исследований был разработан до появления информации о патогенезе COVID-19, многие аспекты которого до сих пор остаются неясными. Так, возможно, что противовирусные препараты могут быть эффективными на ранних этапах развития вирусной инфекции, в то время как при тяжелом течении SARS-CoV-2 пневмонии, осложнившейся ОРДС, большие надежды возлагают на иммуномодуляторы, подавляющие воспалительный каскад. Более того, хотя в некоторых исследованиях удавалось сократить продолжительность искусственной вентиляции легких или длительность пребывания в стационаре, полученные данные не позволяют сделать вывод о том, что использованные лекарственные средства «излечивают» COVID-19.

В-третьих, в клинических исследованиях у пациентов с COVID-19 нередко оценивают сроки устранения симптомов, улучшения лабораторных показателей или рентгенологических изменений или частоту использования искусственной вентиляции легких. Лишь немногие исследования будут достаточно мощными для того, чтобы установить разницу в летальности между группами сравнения, в то время как интерпретация таких результатов, как разрешение симптомов, может быть проблематичной [30].
С целью изменить такой негативный тренд в мае 2020 г. Американская администрация по контролю за пищевыми продуктами и лекарствами (FDA) предложила оценивать в клинических исследованиях III фазы следующие клинические исходы: летальность от всех причин в течение не менее 28 дней, дыхательная недостаточность, в том числе необходимость в кислоротерапии, неинвазивной вентиляции легких, искусственной вентиляции легких, экстракорпоральной мембранной оксигенации, перевод в отделение реанимации и интенсивной терапии, необходимость госпитализации на основании четких показаний, устойчивое клиническое выздоровление (например, устранение симптомов). Изучение элиминация вируса с помощью полимеразной цепной реакции (ПЦР) целесообразно только в клинических исследованиях II фазы [32].
Изучение эффективности лекарственных средств в реальной клинической практике
На фоне активного изучения действенности лекарственных средств в лечении COVID-19 в предрегистрационных клинических исследованиях параллельно во всем мире выпускаются клинические (в Российской Федерации методические) рекомендации или руководства. Данные документы случат источником информации, необходимой для принятия решений в обычной клинической практике. Если в клинических исследованиях в мире принимают участие более 100 тыс пациентов, то на практике те же лекарства получали или получают миллионы людей. Однако неясно, как часто их эффекты мониторируются и анализируются исследователями. Пока опубликованные исследования вызывали большое количество вопросов и трактовались экспертами, как правило, негативно [33].
16 января 2020 года Национальная комиссия здравоохранения Китая (National Health Commission, NHC) выпустила первый из 7 протоколов диагностики и лечения COVID-19 [34,35]. Позднее были опубликованы рекомендации ВОЗ [33]. 29 января была разработана первая версия российских временных методических рекомендаций [37]. В качестве противовирусных средств сразу были предложены ингаляции интерферона-α2b, лопинавир/ритонавир, рибавирин, хлорохин/ гидроксихлорохин и умифеновир, т.е. активно стали использовать первую стратегию – перепрофилирование лекарств с другими показаниями [34]. В первых рекомендациях фигурировали также метилпреднизолон, реконвалесцентная плазма, внутривенное введение иммуноглобулинов и тоцилизумаба. В последующем в различные клинические рекомендации в разных странах мира стали включать многочисленные лекарственные средства – от ремдесивира и фавипиравира до силденафила и талидомида [38,39]. Однако эти рекомендации основывались на результатах единичных клинических исследований низкого качества, в которых принимало участие небольшое количество пациентов. В лучшем случае их результаты можно было считать генерирующими гипотезы. Соответственно, любая терапия COVID-19, указанная в клинических или методических рекомендаций, фактически остается исследуемой [22]. В данном контексте необходимо привести позицию Центрa по контролю и профилактике заболеваний США (Centers for Disease Control and Prevention, CDC), который призвал к незамедлительным действиям в первом руководство для врачей по лечению COVID-19 [40]. Такой же позиции придерживались и регуляторные органы в других странах мира. Соответственно, список лекарственных средств, в том числе не зарегистрированных в конкретной стране, которые применяются для лечения COVID-19 off-label, т.е. по неодобренным показаниям, постоянно увеличивается. Широкие применение различных препаратов было отмечено не только в стационарах, прежде всего у пациентов с тяжелым течением заболевания, но и в амбулаторной практике [36].
Роль клинической фармакологии при COVID-19
Традиционно, клиническая фармакология оперирует таким тезисом, как «правильное лекарство в необходимой дозе для конкретного пациента» [41]. Однако в контексте пандемии COVID-19 необходимо добавить и «как можно скорее». Стремительное распространение инфекции диктует потребность в лекарственных средствах, способных как минимум прекратить передачу SARS-CoV-2 от человека к человеку, а у госпитализированных пациентов, особенно находящихся в ОРИТ, – предупредить развитие ОРДС и присоединения госпитальной бактериальной и грибковой инфекции и нормализовать показатели свертывающей системы крови.
В арсенале клинических фармакологов имеются обширные знания о различных аспектах применения лекарственных средств [14], в том числе фармакокинетике лекарств в особых группах, роли таких факторов, как возраст, пол, функция почек и печени, лекарственном взаимодействии, фармакогеномике, связи между фармакокинетикой и фармакодинамическим ответом, фармаконадзоре [42]. Результаты изучения потенциально эффективных методов лечения COVID-19 могут быть интегрированы в количественные фармакологические модели, которые, в свою очередь, могут быть использованы для моделирования и оптимизации дизайна клинических исследований, включая выбор биомаркеров, а также дозирования лекарственных средств у пациентов. Так, M.Garcia-Cremades и соавт. на основании полученных ранее и появляющихся доклинических и клинических данных о фармакокинетике, противовирусной активности и безопасности аминохинолиновых производных разработали модель дозирования гидроксихлорохина у пациентов с COVID19 [43]. По мнению авторов, их исследование имеет очевидные ограничения, связанные с тем, что на момент публикации доказательства действенности гидроксихлорохина при SARS-CoV-2 инфекции отсутствовали. Тем не менее, использование моделей позволяет интегрировать всю доступную информацию из различных источников, делает все допущения прозрачными и обеспечивает основу для количественной оценки неопределенности [14].
В некоторых странах пандемия привлекла внимание научного сообщества к исследованиям, которые уже давно входят в сферу интересов клинической фармакологии. Например, во всем мире клинических фармакологов считают лидерами в использовании байесовских методов и анализе данных реальной клинической практики (Real world evidence, RWE) [44,45]. Действительно, последние все чаще используются при принятии решений в системе здравоохранения [46,47]. В недавно опубликованном комментарии европейских регулирующих органов отмечена необходимость в изучении эффективности и безопасности лекарственных средств на основе данных, полученных в обычной клинической практике, а также указано, как сделать их приемлемыми для регулирующих органов [48]. Именно при изучении данных реальной клинической практики могут быть выделены биомаркеры и «суррогатные» конечные точки, которые крайне необходимы для разработки методов лечения новой инфекции [49,50].
Фармакогеномика – важная область клинической фармакологии. Примерами ресурсов, которые позволяют внедрять достижения фармакогеномики в систему здравоохранения, могут служить Pharmacogene Variation Consortium (PharmVar) [51], База знаний по фармакогеномике (PharmGKB) [52], Консорциум по реализации клинической фармакогенетики (CPIC) [53]. В Рос сий ской Федерации с 2015 г. издается журнал «Фармако генетика и фармакогеномика», который является официальным печатным органом Общества фармакогенетики, фармакокинетики и персонализированной терапии [54]. Необходимо отметить, что на сайте PharmGKB создана страница, ориентированная на COVID-19, где размещена информация о терапевтических вариантах лечения, опираясь на данные фармакогенетики [55]. Конечно, необходимо указать, что эксперты в области клинической фармакологии во всем мире активно создают информационные ресурсы по CОVID-19. В нашей стране примером может служить Информационный центр по вопросам фармакотерапии у пациентов с новой коронавирусной инфекцией «ФармаCOVID» на базе РМАНПО Минздрава России [56].
Обсуждение
20 января 2020 года Национальная служба здравоохранения Китая отнесла новую коронавирусную инфекцию к самому высокому уровню опасности – классу А инфекционных заболеваний [34]. 11 марта T. Gheb rey esus, генеральный директор ВОЗ, заявил, что ситуацию с распространением COVID-19 можно охарактеризовать как пандемию [13]. Коронавирусные инфекции были известны давно (с середины 60-х гг.), но долгое время оставались вне поля интересов фармакологов и представителей фармацевтической индустрии [1,2]. Даже тяжелые инфекции, сопровождающиеся развитием острого респираторного синдрома, такие как SARS и MERS, не изменили такого отношения к коронавирусам. Частично это связано с тем, что инфекции были локализованы в странах Юго-Восточной Азии и Ближнего востока и не затронули страны с высоким индексом человеческого развития (Human Development Index, HDI). Вероятно, полагали, что коронаровирусные инфекции в виде генерализованных форм не выйдут за границы этих стран.
Если рассматривать историю философии создания лекарств, безусловно, на данной хронологической карте скоро появится новая точка, обусловленная пандемией 2019-2020 г. При этом COVID-19 не просто останется в истории, инфекция изменила всю парадигму исследования лекарственных веществ. По мнению P. der Graaf и соавт., разработка лекарств для лечения COVID-19 находится на принципиально иной временной шкале [14]. Однако к июню 2020 г. почти все клинические исследования предполагали перепрофилирование уже известных лекарственных средств, хотя, как показали J. Magagnoli и соавт., такой подход скорее всего будет неэффективным, и к нему следует относиться критически с учетом экспертных мнений клинических фармакологов [57].
В условиях пандемии нет возможности дожидаться результатов классических клинических исследований, проводимых в соответствии с принципами GCP, для завершения которых требуется много времени. В связи с этим, сложилась парадоксальная ситуация, когда параллельно происходит изучение действенности лекарственных средств по установленным правилам (протокол, GCP, мониторинг клинического исследования) и отмечается широкое применение тех же препаратов off label в клинической практике, но без строго определенных правил и, зачастую, без анализа исходов. При этом, количество пациентов, получающих лекарственные средства off label, в десятки или сотни раз превышает количество больных, включенных в клинические исследования. Нельзя также забывать о безопасности лекарственных средств, учитывая высокий риск возникновения серьезных и ранее неизвестных нежелательных эффектов. Примером могут быть противомалярийные средства, вызывающие ретинопатию и оказывающие кардиотоксическое действие [58,59]. Необ ходимо подчеркнуть также важность системы фармаконадзора, учитывая регистрацию некоторых лекарственных средств по ускоренной процедуре, которая в Российской Федерации предусмотрена постановлением Правительства No441 от 3 апреля 2020 г. К июню 2020 г. в России были зарегистрированы фавипиравир (Авифарин тм и Арепливир тм ) и левилимаб (Илсира тм ). При применении первого препарата необходимо тщательно контролировать серьезные нежелательные явления типа D, учитывая тератогенность и эмбриотоксичность в опытах животных [60]. Риск развития серьезных нежелательных явлений при лечении моноклональными антителами также хорошо известен, а система фармаконадзора для них требует особых условий [61]. Опубликованы данные о высокой частоте развития грибковых инфекций при применении моноклональных антител к рецепторам ИЛ-6 при COVID-19 [62].
Чтобы свести к минимуму указанные выше риски, рекомендуют проводить адаптивные клинические исследования, имеющие относительно гибкий дизайн, который позволяет вносить изменения в ходе исследования [63]. После завершения таких клинических исследований возможна адаптивная практика регистрации лекарственных средств. Исследование лекарственного средства производится поэтапно, начиная с группы пациентов, у которых лучше потенциальное соотношение пользы и риска, с последующим переходом на другие группы больных в порядке снижения возможной пользы по сравнению с риском. Одновременно собираются доказательства эффективности и безопасности в обычной клинической практике, которые дополняют результаты клинических исследований [64]. Процесс лицензирования осуществляется при тесном сотрудничестве фармпроизводителей и государственных органов надзора. Например, 25 июня 2020 г. в Евросоюзе было выдано условное маркетинговое разрешение на применение ремдесивира (Веклури тм ). При этом производитель должен будет предоставить окончательные отчеты об исследованиях к концу года и соблюдать план управления рисками.
К июню 2020 г. лидерами среди изучаемых лекарств были противомалярийные средства. Хотя результаты единичных клинических исследований показали определенную пользу применения этих препаратов у пациентов с COVID-19, тем не менее, в целом надежды, которые возлагались на аминохинолиновые производные, не оправдались, и нельзя исключить, что в ближайшие месяцы их изучение в мире будет прекращено 68. Так, 5 июня 2020 г. в Великобритании было остановлено рандомизированное исследование гидроксихлорохина (RECOVERY), так как смертность через 28 дней не отличалась между группами сравнения (25,7% и 23,5%, соответственно) [17]. В конце июня в США также было остановлено слепое плацебо-контролируемое рандомизированное клиническое исследование гидрохлорохина (ORCHID) у 500 взрослых госпитализированных пациентов с COVID-19, учитывая отсутствие преимуществ исследуемого препарата перед плацебо [70].
К сожалению, результаты клинических исследований не подтвердили значимого позитивного эффекта лопинавира/ритонавира у пациентов с COVID-19 [71]. Это не удивительно, так как подавляющая концентрация препарата in vitro для SARS-CoV-2 более чем в 200 раз превышает таковую для ВИЧ [72] и не может быть достигнута в клинической практике [73]. Между народная организация по изучению сепсиса (SCC; The International Surviving Sepsis Campaign) заявила, что не рекомендует использовать лопинавир/ритонавир для лечения пациентов с COVID-19 [74].
Перспективным подходом к лечению COVID-19 считают применение препаратов, обладающих противовоспалительными и иммуномодулирующими свойствами. У пациентов с COVID-19 могут быть высокими уровни ряда воспалительных цитокинов, однако это не всегда следует трактовать именно как синдром высвобождения цитокинов, или цитокиновый шторм. Причинами резкого ухудшения состояния больных SARS-CoV-2 пневмонией, в том числе развития шока, могут быть бактериальные инфекции, гиповолемия, связанная с желудочно-кишечным кровотечением, или нарушение функции сердца [74,75]. Первым препаратом этой группы, который стали изучать в клинических исследованиях у пациентов с COVID-19, стал тоцилизумаб, представляющий собой моноклональное антитело к рецептору ИЛ-6 [76]. Началось же все с китайских ученых, которые первыми опубликовали обнадеживающие результаты применения тоцилизумаба у 20 пациентов [77].
Данные по применению глюкокортикостероидов при COVID-19 пока остаются крайне противоречивыми – от оптимизма до полного отрицания [39,78,79]. При мета-анализе клинических исследований у пациентов с ОРДС было показано, что препараты этой группы не влияют на позднюю смертность от всех причин (отношение шансов 0,99; 95% доверительный интервал (ДИ) от 0,64 до 1,52) и продолжительность искусственной вентиляции легких (средняя разница -4,30; 95% ДИ от -9,72 до 1,12) [80].
Ремдесивир первоначально применялся в рамках программы Сompassionate use, организованной производителем, а не в рамках клинических исследований [81]. Опубликованы крайне противоречивые результаты нескольких клинических исследований, в которых изучалась действенность ремдесивира у госпитализированных пациентов с тяжелым течением COVID-19 83. Обращает внимание, что для данного лекарственного средства часто публикуются не окончательные, а предварительные результаты, которые вызывают восторженные отзывы у регуляторных органов ряда стран, в том числе США, Евросоюза, Японии и Южной Кореи.
Фавипиравир с 2014 г. применяется в Японии для лечения гриппа [85]. По данным первых клинических исследований, фавипиравир может быть эффективным у пациентов со средне-тяжелой формой инфекции [86,87]. В Российской Федерации к июню 2020 г. фавипиравир был зарегистрирован для лечения COVID-19 под двумя торговыми названиями – Авифарин и Арепливир.
В настоящее время у пациентов с COVID-19 активно изучается гипериммунная плазма, которую получают от пациентов, перенесших вирусную инфекции. В крупнейшем исследовании М. Joyner и соавт. вводили от 1 до 2 единиц реконвалесцентной плазмы 5000 пациентам с тяжелой или опасной для жизни SARS-CoV-2 инфекцией. Частота тяжелых нежелательных явлений составила всего 1%, а летальность в течение 7 дней – 14,9%, что соответствует естественному течению тяжелой инфекции [88]. Ранее было показано, что использование реконвалесцентной плазмы уменьшает выделение вируса, но не влияет на выживаемость крайне тяжелых больных. Это может указывать на целесообразность более раннего ее введения [89]. По данным систематического обзора Cochrane, опубликованного 14 мая 2020 г., благоприятное влияние реконвалесцентной плазмы на летальность и клинические симптомы остается недоказанным [90].
Одним из самых удивительных событий в области клинической фармакологии стало беспрецедентно широкое использование off label лекарственных средств при COVID-19 во всем мире, когда различные препараты были включены в клинические (методические) рекомендации и руководства, не дожидаясь результатов клинических исследований, в том числе на фоне отрицательного отношения к некоторым из них профессиональных экспертных организаций [39,75]. Понимая потенциальную опасность широкого применения лекарственных средств off label, в ряде стран были выпущены рекомендации по минимизации возможных рисков. Например, FDA разрешила применение противомалярийных препаратов для лечения COVID-19 (Emergency Use Authorization, EUA), однако указала, что их можно назначать только госпитализированным пациентам, а также рекомендовала всем медицинским работникам и пациентам извещать о нежелательных явлениях национальную систему фармаконадзора (MedWatch) [91]. Однако учитывая сомнительную пользу этих препаратов при COVID-19 и сообщения о серьезных нежелательных реакциях со стороны сердца и других органов и систем, позднее это разрешение в США было отозвано. 16 апреля 2020 г. в Российской Федерации вышло Распоряжение Правительства No1030-р, в котором указана необходимость обязательного мониторинга эффективности и безопасности лекарств, используемых при COVID-19 [92]. Роль и место вакцин в настоящей статье не обсуждается.
Заключение и рекомендации
1. Целый ряд международных экспертов в области клинической фармакологии считают, что пандемия COVID-19 может стать определяющим моментом для развития клинической фармакологии и «нет никаких оснований полагать, что дисциплина не готова принять этот вызов» [14]. Безусловно, отечественная клиническая фармакология должна соответствовать данным трендам.
2. В настоящее время нет этиотропной и патогенетической терапии, которая обладала бы доказанными действенностью, эффективностью и безопасностью при COVID-19. Проводимые сейчас в мире клинические исследования предполагают в основном перепрофилирование лекарственных средств, зарегистрированных по другим показаниям. Ускоренная публикация предварительных данных, которые лишь «намекают» на то, что окончательные результаты могут быть положительными, выгодны только фармацевтическим компаниям и не приносят пользы клиницистам.
3. Скорее всего, пациенты с более тяжелым течением COVID-19 нуждаются в комбинированном лечении, в том числе противовирусными и иммуносупрессивными средствами.
4. За 6 месяцев пандемии остается высокой частота применения лекарственных средств off label, что определяет необходимость строгого мониторинга их эффективности и безопасности. Возможный механизм – создание регистров пациентов с COVID-19 и наблюдение за ними после выздоровления. Безусловно, крайне важен российский практический опыт применения лекарств в условия коронавирусной инфекции.
5. Пандемия предоставляет уникальную возможность для продвижения парадигмы RWD/RWE, науки о дизайне клинических испытаний с акцентом на исследования у пациентов с инфекциями.
Источник