О нестероидных противовоспалительных средствах
Нестероидные противовоспалительные средства (НПВС) являются наиболее широко назначаемой группой лекарств во всем мире. Ежедневно свыше 30 млн. людей в мире принимают какой-либо НПВС, из них 40% — в возрасте старше 60 лет.
Нестероидные противовоспалительные средства (НПВС) являются наиболее широко назначаемой группой лекарств во всем мире. Ежедневно свыше 30 млн. людей в мире принимают какой-либо НПВС, из них 40% — в возрасте старше 60 лет.
Рекомендательный перечень основных (жизненно необходимых) лекарственных средств ВОЗ (Essential Drug List. WHO, 1999) включает в себя только несколько средств, относящихся к классу неопиоидных анальгетиков, в том числе два НПВС (см. таблицу).
Отбор этих средств для перечня основных лекарственных средств объясняется не только их высокой терапевтической активностью, но и, что наиболее важно, гарантированной безопасностью, проверенной многолетним опытом работы многих врачей всего мира. В то же время эксперты ВОЗ подчеркивают, что приводимый перечень не является «застывшим» документом, он должен регулярно пересматриваться и адаптироваться к условиям конкретных стран; необходимо принимать во внимание квалификацию и опыт врачей, а также новые научные исследования.
Как известно, весь класс неопиоидных анальгетиков может быть условно разделен на две большие группы — кислотные и некислотные производные. И если во вторую, более узкую, входят такие средства, как ацетоминофен (парацетамол), метамизол (анальгин)*, обладающие только анальгетической и антипиретической активностью, то в первую — все так называемые нестероидные противовоспалительные средства, обладающие полным спектром фармакологической активности — анальгетическим, противовоспалительным и антипиретическим действием.
Вся группа НПВС также условно подразделяется на ряд основных «семей» (подклассов) в соответствии с активным веществом, производными которого они являются.
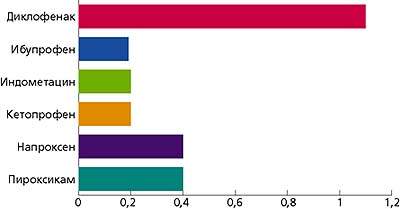
Эксперты разных стран едины во мнении, что различия в эффективности НПВС относительно невелики (Fries J. F., Williams C. A., Bloch D. A., 1991). Обзоры нескольких десятков клинических испытаний различных НПВС при остеоартрите и ревматоидном артрите не дают оснований ранжировать эти лекарства по степени их эффективности (Fries J., 1996). Хотя количество НПВС постоянно увеличивается, ни один из новых препаратов не может быть доказательно признан более эффективным, чем аспирин или ибупрофен. Частота побочных эффектов, возникающих при приеме этих лекарств, также примерно одинакова; возможно, исключением является ибупрофен в низких дозах (Brooks P. M., 1988). В то же время систематизация данных рандомизированных исследований (McQuay H., Moore A., 1998), с использованием критерия максимального полного купирования боли, который до некоторой степени позволяет объективизировать потенциальную значимость различных анальгетиков в обезболивании, дает основание говорить об определенной иерархии в противоболевой активности многих лекарственных средств.
Если эффективность лекарств примерно эквивалентна, то основанием для их выбора могла бы стать относительная безопасность. Однако, за несколькими исключениями, выбора практически нет. Прием НПВС является одной из самых типичных причин нежелательных реакций на фармакотерапию. В Великобритании НПВС составляют 5% всех назначаемых лекарств, однако на их долю приходится 25% всех побочных эффектов, о которых сообщается в Комитет по безопасности медикаментов. По официальным оценкам, в Великобритании 3-4 тыс. смертельных случаев ежегодно обусловлены побочными эффектами НПВС. В США использование НПВС ежегодно приводит к более 70 тыс. госпитализаций и 7 тыс. смертельных случаев.
Для НПВС типичны четыре основных типа побочных эффектов: гастроинтестинальные реакции, включая язву желудка; гиперчувствительность; почечная недостаточность после длительного применения; нарушение функций ЦНС, включая забывчивость, неспособность сосредоточиться, бессонницу, паранойю и депрессию. Реже наблюдается поражение печени, иногда тяжелое.
| Рисунок 1. Данные о частоте нефротоксических побочных реакций при терапии НПВС (Current Problems in Pharmacovigilance, 1994) |
 |
| Число собщений, приходящихся на 100000 выписанных рецептов в год |
Все лекарственные средства в той или иной степени могут быть ассоциированы с нежелательными побочными реакциями. НПВС как класс лекарств характеризуются целым рядом нежелательных реакций, а различие в их выраженности крайне незначительны. Кроме того, эти проблемы потенциально важны для всех пациентов без исключения, независимо от длительности терапии и возраста.
Гастроинтестинальные реакции как проявление нежелательных реакций на прием НПВС являются наиболее частыми и общими для данного класса лечебных препаратов. Клинически эти проявления протекают наиболее тяжело и являются основным фактором риска смертельного исхода.
Прием НПВС оказывает токсическое действие по двум независимым механизмам — локальному (узконаправленному) и общему генерализованному (системному) действию.
Одна из наиболее обоснованных точек зрения на патогенез НПВС-обусловленных поражений гастроинтестинальной системы состоит в том, что эти специфические осложнения терапии обусловлены неселективным подавлением синтеза простагландинов**.
Приблизительно у 50% больных, страдающих НПВС-гастропатией (язвеннно-эрозивными поражениями слизистой желудка и двенадцатиперстной кишки, кровотечениями), заболевание может протекать практически без симптомов, а значит, выявляться с большим запозданием. Такие жизненно опасные состояния могут быть первым и единственным признаком патологических изменений желудочно-кишечного тракта (эта особенность НПВС-гастропатии особенно ярко проявляется у пожилых больных). Более того, достаточно часто нестероидные противовоспалительные средства благодаря особенностям антипростагландиновой активности могут «затушевывать» симптомы патологии желудочно-кишечного тракта, затрудняя тем самым постановку диагноза и лечение заболевания. В то же время у определенной части больных (около 30%) единственным симптомом гастропатии являются абдоминальные боли без патологических соматических изменений. Между язвами, образовавшимися в результате приема НПВС, и возникшими спонтанно, произвольно (язвенная болезнь), существует некоторая разница. Во-первых, язвы, появившиеся в результате приема НПВС, чаще всего протекают бессимптомно. Во-вторых, слизистая оболочка желудка «адаптируется» к длительному воздействию НПВС, так что после 2-8 недель приема лекарства острые поражения уменьшаются, а ряд экспериментов показал, что наиболее опасными могут считаться первые месяцы приема этих средств.
Считается, что риск возникновения гастроинтестинальных кровотечений достаточно высок как при целевом кратковременном, так и при длительном приеме НПВС. В то же время есть все основания полагать, что именно длительностью приема в наибольшей степени обусловлена основная опасность даже безрецептурных НПВС. Длительное ретроспективное исследование (Kurata J. H., Abbey D. E., 1984), проведенное у 4524 больных, показало, что ежедневное использование аспирина в дозе 1000 мг (МДД — 6000 мг) в целях профилактики инфаркта миокарда на протяжении 4 лет повышает риск появления неспецифического язвенного поражения в 10,7 раза по сравнению с контрольной группой (не принимавших аспирин). При этом надо учитывать, что и минимальные дозы салицилатов могут быть достаточно опасны. Исследования (Naschitz J., 1989) наглядно продемонстрировали, что даже такая минимальная доза аспирина, как 75-250 мг, может быть главной причиной возникновения кровотечений в верхних отделах гастроинтестинального тракта у 8,2% пациентов. В то же время одно из проспективных исследований (Lanza F., 1984) показало, что кратковременное трехдневное регулярное применение наиболее безопасного из НПВС препарата — ибупрофена — в суточной дозе 1600 мг (МДД — 2400 мг) не способно вызвать морфологически достоверных изменений слизистой желудка.
Реакции гиперчувствительности. Одним из важнейших критериев использования НПВС в качестве анальгезирующего средства при острой боли (травматического или хирургического происхождения) является аллерго-иммунологический статус больного, риск развития бронхоспазма (Szczeklik A., 1992). Острые приступы аспиринзависимой астмы развиваются примерно у 8-20% взрослых астматиков. У части больных это может быть первым симптомом начинающейся астматической болезни. Отмеченная перекрестная зависимость между аспиринзависимой астмой и бронхоспазмом относится не только к салицилатам, но практически ко всем НПВС. А рассматривая вопрос еще шире, следует признать, что назначение всех кислотных производных НПВС противопоказано пациентам, имеющим в анамнезе любые проявления так называемой «аспириновой триады» — астмы, полипоза в носовых ходах или непереносимости аспирина (Power I., 1993).
| Рисунок 2. Данные о частоте гепатотоксических побочных реакций при терапии НПВС (Current Problems in Pharmacovigilance, 1994) |
 |
| Число собщений, приходящихся на 100000 выписанных рецептов в год |
Нарушение функции почек. Считается, что побочные реакции со стороны почек могут быть обусловлены системным неселективным подавлением синтеза простагландинов, влияющих на регуляцию клубочковой фильтрации, поддержание водно-электролитного баланса. Эти реакции, как правило, проявляются у больных, имеющих в анамнезе какие-либо почечные заболевания. В таких случаях основными симптомами побочных реакций могут стать острая почечная недостаточность, задержка жидкости, гиперкалиемия.
Кроме того, надо учитывать и возможность перекрестных реакций при назначении НПВС на фоне приема мочегонных препаратов, особенно у пожилых больных. Большинство НПВС тормозят действие и повышают нефротоксичность «петлевых» диуретиков, снижают гипотензивное действие бензотиазидов (Johnson A.G., Seideman P., Day R.D., 1993), что также значительно увеличивает риск появления нежелательных реакций.
Нарушение функции печени. Риск развития лекарственного гепатита при приеме НПВС сравнительно невелик. Описаны эксклюзивные случаи острых гепатотоксических реакций с развитием летального исхода (Masana P. et al., 1986). Все они связаны со значительными передозировками препарата и неоправданной длительностью лечения. В то же время в 1-4% случаев может наблюдаться бессимптомное умеренное повышение уровня печеночных ферментов (Насонов Е. Л., Лебедева О. В., 1991).
Нарушение функции центральной нервной системы. Реакции нейротоксичности, проявляющиеся головными болями, некоторой дезориентацией, спутанностью сознания, могут наблюдаться при приеме всех НПВС, однако наиболее часто они возникают, когда речь идет о лекарственных средствах, легко минующих гематоэнцефалический барьер (Goodwin J.S., Regan. M.,1982). Все эти реакции наиболее заметны у пожилых пациентов, что обусловлено их возрастными и физиологическими особенностями. Кроме того, именно эта категория пациентов в связи с нарушением внимания и памяти находится в группе риска по случайной передозировке (так называемой «аспириновой интоксикации»), которую легко оставить без внимания.
Обобщенные данные по безопасности основных НПВС. Так как до 1997 года исследований относительной переносимости аспирина, ибупрофена и парацетамола (наиболее широко используемых в повседневной практике для лечения слабой/умеренной острой боли у взрослых) не проводилось, эта проблема признана достаточно актуальной для общественного здравоохранения. Исходя из этого в 1997-1999 годах было проведено глобальное рандомизированное мультицентровое исследование, ориентированное на получение достоверных данных по объективному сравнению переносимости аспирина, ибупрофена и парацетамола в стандартных рекомендуемых дозах и при эпизодическом приеме по поводу острой боли различной этиологии (The PAIN Study: Paracetamol, Aspirin and Ibuprofen New Tolerability Study // Clin. Drug. Invest, 1999, vol. 18, №2, р. 88-98; Moore N., Van Ganse E., et al. A comparison of the tolerability of Ibuprofen, Acetominophen and Aspirin for short-term analgesia // Proceedings of the 9th World Congress on Pain/Eds. M. Devor, M. C. Rowbotham, Z. Wiesenfeld-Hallin. Seatle: IASP Press, 2000, p. 809-817).
Результаты исследования показали, что все основные характеристики переносимости ибупрофена равнозначны показателям переносимости парацетамола и выше показателей переносимости аспирина. В связи с этим, возможно, следует пересмотреть приоритеты, касающиеся применения анальгетиков первой линии для кратковременного лечения состояний, сопровождающихся болевым синдромом, в общей практике. В первую очередь рекомендуется назначать ибупрофен ввиду худшей переносимости аспирина и потенциальной опасности передозировки парацетамола.
И последнее, на чем стоит остановиться: большинство более новых лекарств стоят значительно дороже, чем появившиеся достаточно давно. Так, известно, что использование простого воспроизведенного анальгетика, такого как ибупрофен, обходится в 2–8 раз дешевле, чем применение нового, «современного» НПВС. Если НПВС назначается вместе с мизопростолом для снижения риска язвенного поражения желудка и кишечника, то стоимость лечения оказывается еще выше. Это лишний раз доказывает, что использовать давно известные НПВС, такие как аспирин и ибупрофен, гораздо выгоднее.
* Препарат как в чистом виде, так и в составе комбинированных средств выведен из обращения в большинстве стран мира по причине высокой токсичности. Исключен из списка жизненно важных и основных лекарственных средств с 2000 г.
** Простагландины играют важную физиологическую роль в защите слизистой оболочки. Такое защитное действие простагландинов включает в себя ряд механизмов:
1) увеличение секреции слизи и щелочи;
2) сохранение целостности эндотелиальных клеток внутри микрососудов слизистой оболочки, способствующее поддержанию кровотока в слизистой;
3) сохранение целостности гранулоцитов и, таким образом, структурной целостности слизистой оболочки.
Источник
Правовые основы обращения медицинских изделий
В настоящее время судебная практика стала все чаще пополняться делами, связанными с нарушениями в сфере обращения медицинских изделий. О том, какие риски несут медицинские работники и медицинские организации, допуская нарушения при обращении медицинских изделий и как на практике использовать механизмы контроля за обращением медицинских изделий, чтобы предотвратить нарушения в этой сфере, рассказывает, Ирина Наделяева, начальник отдела организации исследований ФГБНУ «РНЦХ им. акад. Б.В. Петровского».
Обращение медицинских изделий. Основные понятия
В статье 38 Федерального закона № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» дается определение медицинских изделий и основные аспекты их обращения. В частности, в нем говорится, что «медицинскими изделиями являются любые инструменты, аппараты, приборы, оборудование, материалы и прочие изделия, применяемые в медицинских целях отдельно или в сочетании между собой… функциональное назначение которых не реализуется путем фармакологического, иммунологического, генетического или метаболического воздействия на организм человека», т.е. медицинскими изделиями считается все, чем пользуется врач и медицинская организация, и что не является лекарствами – это могут быть и аппараты МРТ, и бинты, и шприцы и даже, программное обеспечение необходимое для диагностики и лечения.
Разрешается обращение только зарегистрированных медицинских изделий. С другой стороны, в России не подлежат регистрации определенные медицинские изделия. Например, индивидуальные медицинские изделия, привезенные на территорию РФ для личного пользования, медицинские изделия, которые специально изготовлены для пациента – ортопедическая обувь, стоматологические изделия, протезы и т.п. Все остальные медицинские изделия должны быть зарегистрированы в порядке, установленном Правительством РФ. В порядках, стандартах медицинской помощи и в клинических рекомендациях указаны медицинские изделия, применяемые при оказании медицинской помощи, которые должны иметь соответствующие регистрационные удостоверения.
И только медицинские изделия имеют право на применение в медицинской организации. Например, перчатки, могут быть как медицинскими, так и бытовыми, последние не могут применяться в медицинской организации.
Медицинская организация обязана предоставлять пациентам достоверную информацию о медицинских изделиях, об этом говорится в статье 79 ФЗ №323 «Об основах охраны здоровья граждан РФ».
Мониторинг безопасности
Органом, который осуществляет контроль за обращением медицинских изделий, является Росздравнадзор.
В статье 95 ФЗ №323-ФЗ «Об основах охраны здоровья граждан РФ» подробно перечислено, что именно входит в государственный контроль. В частности, проверяющие органы контролируют наличие регистрации медицинских изделий, проводят проверки правил обращения, контролируют выдачу разрешений на ввоз на территорию России медицинских изделий в целях их государственной регистрации, проводят контрольные закупки для того, чтобы проверить как соблюдается запрет реализации фальсифицированных, недоброкачественных и контрафактных медицинских изделий и проводят мониторинг безопасности медизделий.
Мониторинг безопасности медицинских изделий осуществляется на всех этапах их обращения. Его основная цель – выявить и предотвратить побочные действия, не указанные в инструкции по применению или в руководстве по эксплуатации медицинского изделия. Подробно о том, как проводится мониторинг, что представляет собой мониторинг говорится в статье 96 ФЗ «Об основах охраны здоровья граждан в Российской Федерации».
В отличие от мониторинга безопасности лекарственных препаратов, мониторинг безопасности медицинских изделий подразумевает и учитывает возможность причинения вреда или возникновения нежелательных явлений не только у пациентов, у которых применяется это медицинское изделие, но и у персонала.
Работа в медицинских организациях должна быть выстроена таким образом, что все случаи выявления побочных действий, нежелательных реакций при применении, особенностей взаимодействия медицинских изделий между собой, о фактах и об обстоятельствах, создающих угрозу жизни и здоровью граждан, которые не зафиксированы в инструкции по применению или руководстве по эксплуатации медицинского изделия, должны быть документально оформлены и предоставлены в Росздравнадзор. За несообщение или сокрытие таких случаев может последовать привлечение к ответственности.
После получения и подтверждения информации о побочных действиях, Росздравнадзор принимает решение о приостановлении их применения или об изъятии из обращения такого медицинского изделия. В случае, если информация о побочных действиях, нежелательных реакциях не подтверждается, то применение и обращение такого медицинского явления возобновляется. Информация по результатам мониторинга размещается на сайте Росздравнадзора.
Порядок организации мониторинга безопасности медицинских изделий определен в письме Росздравнадзора «О порядке проведения мониторинга безопасности медицинских изделий для организаций здравоохранения». Он подразумевает, что в штате каждой медицинской организации необходим уполномоченный сотрудник, который собирает информацию о выявлении нежелательных явлений и сообщает о них в Росздравнадзор.
В письме прописан порядок его действий, и сроки, которые установлены для информирования Росздравнадзора. В отдельных случаях на передачу сообщения отводится 7 или 15 суток, в других – это следует сделать незамедлительно. Медицинская организация должна быть зарегистрирована на сайте Росздравнадзора, при регистрации она получает доступ в личный кабинет, откуда отсылаются сообщения о нежелательных явлениях.
В настоящее время разработан проект документа об утверждении нового порядка осуществления мониторинга безопасности медицинских изделий, который должен вступить в силу с января 2021 года.
Существует Приказ Минздрава России от 06.06.2012 №4н «Об утверждении номенклатурной классификации медицинских изделий», который определяет класс медицинского изделия и степень риска. Эта информация важна не только для медицинских работников, но и для производителей, дистрибьютеров медицинских изделий, в том числе для закупщиков подразделений, которые обеспечивают работу медицинских организаций. Все медицинские изделия подразделяют в зависимости от степени потенциального риска их применения в медицинских целях на четыре класса: с низкой, со средней, с повышенной и с высокой степенью риска.
Ответственность за нарушения при обращении медицинских изделий
Приказов и нормативных актов, которые регулируют вопросы ответственности за применение медицинских изделий очень много. Медики должны знать и соблюдать основные из них.
Это приказ Минздравсоцразвития России №502н «Об утверждении порядка создания и деятельности врачебной комиссии медицинской организации» в котором говорится, что в полномочия врачебной комиссии входит использование медицинских изделий не по назначению, или соответствие использования медицинских изделий порядкам, стандартам и клиническим рекомендациям.
Это Федеральный закон № 532-ФЗ «О внесении изменений в отдельные законодательные акты Российской Федерации в части противодействия обороту фальсифицированных, контрафактных, недоброкачественных и незарегистрированных лекарственных средств, медицинских изделий и фальсифицированных биологически активных добавок», который находит свое отражение также в одной из статей УК РФ.
Важный приказ Минздрава России № 203н «Об утверждении критериев оценки качества медицинской помощи» — по данному документу оценивается полнота и правомерность применения медицинских изделий в соответствии с законодательством.
И, наконец, это приказы Росздравнадзора №10449 от 20 декабря 2017 г. и № 10450 приказ Росздравнадзора №10450 от 20 декабря 2017 г., которые касаются утверждения форм проверочных листов (списков контрольных вопросов), используемых Росздравнадзором при проведении плановых проверок.
В приказах Росздравнадзора есть разделы, которые поясняют на какие вопросы обращает внимание Росздравнадзор при проведении проверок. В перечень интересов Росздравнадзора входят хранение, маркировка, правильность применения, утилизация, наличие зарегистрированных или незарегистрированных медицинских изделий и др. В соответствии с этим списком, можно подготовить медицинскую организацию и избежать нарушений во время плановых и внеплановых проверок.
За нарушение обращения медицинских изделий медицинским работникам может грозить уголовная и административная ответственность.
В частности, статья 238.1 УК РФ об обращении фальсифицированных, недоброкачественных, незарегистрированных лекарственных средств, медицинских изделий и фальсифицированных биологических добавок подразумевает серьезные наказания. Как практически во всех статьях Уголовного кодекса, тяжесть наказания идет по нарастающей. Так за производство, сбыт или ввоз на территорию России фальсифицированных, недоброкачественных, незарегистрированных медицинских изделий, если эти деяния совершены группой лиц, предусматривается лишение свободы на срок от 5 до 8 лет, а штраф может доходить до 3 миллионов.
В судебной практике нередко рассматриваются дела о подделках документов на медицинские изделия, что попадает под действия статьи 327.2 УК РФ «Подделка документов на лекарственные средства или медицинские изделия или упаковки лекарственных средств или медицинских изделий». За изготовление в целях использования или сбыта либо использование заведомо поддельных документов на медицинские изделия может грозить лишение свободы до трех лет, если эти же деяния совершены организованной группой, то срок лишения свободы — от 5 до 10 лет.
Учитывая важность применения качественных и безопасных медицинских изделий, в России введена административная ответственность в сфере обращения медицинских изделий. Она регулируется Кодексом Российской Федерации об административных правонарушениях (КоАП). К медицинским организациям наиболее часто применяются статья 6.28 КоАП «Нарушение установленных правил в сфере обращения медицинских изделий», что влечет наложение административного штрафа на граждан в размере от двух тысяч до четырех тысяч рублей; на должностных лиц — от пяти тысяч до десяти тысяч рублей; на юридических лиц — от тридцати тысяч до пятидесяти тысяч рублей. И статья 6.33. КоАП «Обращение фальсифицированных, контрафактных, недоброкачественных и незарегистрированных лекарственных средств, медицинских изделий и оборот фальсифицированных биологически активных добавок», которая влечет наложение очень серьезных штрафов. Так, например за производство, реализацию или ввоз контрафактных, фальсифицированных или недоброкачественных медицинских изделий, на медицинскую организацию может быть наложен штраф от 1 000 000 до 5 000 000 рублей и административное приостановление деятельности на срок до 90 суток, если те же действия были совершены с использованием средств массовой информации или информационно-телекоммуникационных сетей, в том числе Интернета, то размер штрафа уже варьируется от 2 000 000 до 6 000 000 рублей.
Чтобы избежать нарушений и штрафов, необходимо хорошо понимать терминологию, которая используется в законе. Фальсифицированное медицинское изделие – это медицинское изделие, сопровождаемое ложной информацией о его характеристиках и (или) производителе (изготовителе). Недоброкачественное медицинское изделие — медицинское изделие, не соответствующее требованиям нормативной, технической и (или) эксплуатационной документации производителя (изготовителя) либо в случае ее отсутствия требованиям иной нормативной документации. Контрафактное медицинское изделие — медицинское изделие, находящееся в обороте с нарушением гражданского законодательства. Незарегистрированное медицинское изделие, – изделие, которое не прошло установленную законом процедуру регистрации.
Проверяем медицинские изделия
Проверить является ли медицинское изделие зарегистрированным и разрешенным к применению можно по Государственному реестру медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий, который ведет Росздравнадзор. Найти эту информацию можно на сайте Росздравнадзора в разделе «Медицинские изделия» ВАЖНО! Государственный реестр медицинских изделий и организаций – единственный официальный реестр и источник официальной информации.
Сверяясь с реестром, представители медицинских организаций могут проверить поставщиков медицинских изделий, посмотреть давность или наличие на рынке изделия; конструктивные особенности изделия и т.п. Этот этап деятельности чрезвычайно важен, так как, если у пациента возникнут какие-либо нежелательные явления и будет установлено, что медицинские манипуляции производились с использованием незарегистрированного медицинского изделия, то медицинская организация понесет ответственность.
Информацию о наличии регистрационного удостоверения необходимо проверять заранее, до заказа! Иногда данные достаточно сложно найти в связи с тем, что, производитель или дистрибьютер присылают медицинской организации не полное наименование в соответствии с каталогом или с артикулом, а общее. Необходимо запрашивать полные названия или артикулы у производителя или дистрибьютера, чтобы выявить наличие или отсутствие этого медицинского изделия в Государственном реестре.
Росздравнадзор в этом же разделе регулярно публикует информационные письма об отзыве с рынка или приостановлении обращения тех или иных медицинских изделий.
Материал подготовлен в рамках гранта президента Российской Федерации, предоставленным Фондом президентских грантов (в соответствии с Указом Президента Российской Федерации от 30 января 2019 г. No 30 «О грантах Президента Российской Федерации, предоставляемых на развитие гражданского общества»)
Метариал предоставлен Национальной Медицинской Палатой.
Другие новости данной тематики:
Источник


