Классификация опасности лекарственных препаратов
Назначение лекарственных препаратов (ЛП) беременным женщинам представляет сложную задачу для врача, поскольку предписываемый им препарат будут принимать два пациента: мать и ребенок. Поэтому необходимо, чтобы лечение было эффективно и безопасно для обоих.
В то же время отказ от лекарственной терапии, в связи с беременностью, приводит к ухудшению состояния здоровья матери и, соответственно, оказывает отрицательное воздействие и на развитие плода.
Почти все ЛП, которые принимает мать, проходят через плаценту и, следовательно, оказывают непосредственное влияние на плод. Среди применяющихся на нынешний день ЛП (включая те, безопасность которых для беременных доказана) многие обладают способностью вызвать аномалии развития внутренних органов плода, структурные или функциональные изменения (например, умственную отсталость). Сегодня большинство врачей не советуют принимать ЛП во время беременности, если от этого не зависит здоровье матери.
Объекты и методы исследования
Для выяснения фактического потребления ЛП беременными были проанализированы врачебные назначения (357) и произведено сопоставление этих назначений с категориями риска FDA.
Для обозначения потенциальной опасности лекарственных препаратов для плода в разных странах разрабатывают классификации категорий риска при беременности. Наиболее широко применяется классификация FDA (США), классификация FASS (Швеция) и классификация ADEC (Австралия). Категории риска, разработанные FDA, приводятся в настоящее время в отечественном Государственном реестре лекарственных средств, «Справочнике лекарственных средств, отпускаемых по рецепту врача», а также в описаниях препаратов.
При изучении безопасности фармакотерапии использовалась классификация риска применения ЛП при беременности, разработанная FDA, где все препараты распределены в различные категории безопасности от А (безопасные при беременности) до Х (противопоказанные, ввиду доказанной тератогенности) [2,4].
Однако у этой классификации есть свои недостатки. Она редко обновляется, очень упрощена и больше акцентирована на тератогенном воздействии лекарственных препаратов, чем на фетотоксическом, не учитывает дозу препарата и клинические ситуации. Большинство ЛП характеризуются лишь данными, полученными в экспериментах на животных, их относят к категории С. Кроме того, многие ЛП (некоторые спазмолитики, местные антисептики, системные антибиотики, гормональные, метаболические средства) не используются в США и поэтому в классификацию FDA не включены. И всё же в настоящее время это единственный систематизированный источник информации по опасности лекарственных препаратов во время беременности [1,5].
Классификация препаратов в зависимости от степени безопасности их применения во время беременности, разработанная Американским Советом по безопасности продуктов питания и лекарств (FDA-Food and Drug Administration), имеет следующий вид:
Категория A
Контролируемые исследования не выявили риска для плода. Вероятность вредного воздействия на плод мала.
Категория B
Опыты на животных не выявили риска для плода, исследования на беременных отсутствуют. В эту же категорию входят лекарственные препараты, оказывающие вредное воздействие на плод у животных, но не влияющие на человеческий плод.
Категория C
Исследования на животных выявили неблагоприятное действие на плод, данные о влиянии на человеческий плод отсутствуют. Также в эту группу относятся препараты, исследование которых не проводилось ни на человеке, ни на животных. Препараты категории С должны назначаться только тогда, когда ожидаемая польза от их применения превышает потенциальный риск для плода.
Категория D
Имеются данные о риске для плода, но польза от применения данного препарата оправдывает возможное негативное воздействие на плод. К этой категории препаратов относятся средства, применение которых необходимо при угрозе жизни беременной женщины, либо при наличии серьезного сопутствующего заболевания, когда менее безопасные препараты отсутствуют или неэффективны.
Категория X
Исследования на животных или людях свидетельствуют о развитии аномалий плода на фоне приема препаратов этой группы, либо есть свидетельства о риске для плода на основании человеческого опыта. Риски применения препаратов категории Х при беременности значительно перевешивают возможную пользу от его использования. Препараты противопоказаны беременным женщинам или женщинам, которые планируют беременность.
Эта классификация отражает потенциальную вредность лекарственных препаратов для плода в разные сроки беременности.
Результаты и обсуждение
По результатам исследования установлено, что только треть (30,8 %) среди всех проанализированных назначений ЛП были безопасными для беременных (категория А); 11,1 % — относительно безопасны, риск для плода окончательно не установлен (категория В); 13,5 % — представляют потенциальный риск для плода (категории C, D и Х); 44,6 % всех назначений ЛП не включены в классификацию FDA, их риск при беременности неизвестен (НИ).
Рисунок 1. Распределение показаний для назначений ЛП по категориям безопасности FDA
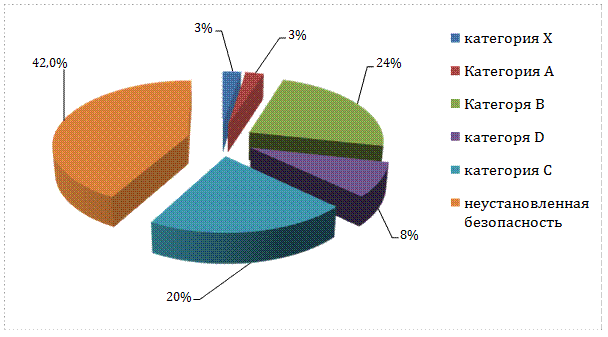
Как показано на рисунке 1, 27,0 % пациенток получали безопасные при беременности ЛП (категория А и В). Тем не менее большому числу (42,0 %) беременных женщин назначались препараты с неустановленной безопасностью, 20,0 % пациенток употребляли ЛП с возможным риском для плода (категория С), а 11,0 % принимали препараты с доказанным риском для плода (категории D и Х).
По результатам исследования только 3 % среди всех назначений ЛП были безопасными — категория А (препараты клотримазол, альмагель, маалокс и др.), 24 % — относительно безопасны, риск для плода окончательно не установлен — категория В (гепарин, ацикловир, азитромицин, диклофенак и др.), 32 % — представляют потенциальный риск для плода — категории С, D, X (дексаметазон, дюфастон, доксициклин, тетрациклин, мочегонные препараты и др. ) и 42 % — препараты с неустановленной безопасностью.
Заключение
Как показал анализ справочной литературы, в настоящее время в РФ в Государственном реестре лекарственных средств, в справочниках лекарственных средств, отпускаемых по рецепту врача, в описаниях препаратов приводятся категории риска, разработанные FDA.
Нами установлено, что многие практические врачи часто назначают ЛП, не отвечающие требованиям безопасности при приеме во время беременности. Большинство препаратов оказывают отрицательное влияние как на мать, так и на плод. Это можно объяснить тем, что некоторые специалисты незнакомы с множеством других ценных источников информации об эффектах ЛП при беременности, в том числе доступных в Интернете. Большинство источников являются англоязычными, а как показали исследования, специалистов со знанием английского языка всего 30 % опрошенных. Выявлено, что Интернетом пользуются только 57,4 % врачей.
Очевидно, что использование ЛП во время беременности должно быть предметом регулярного мониторинга и основываться на современных руководствах, составленных в соответствии с принципами доказательной медицины. Результаты нашего исследования могут служить в качестве референтного источника для медицинских учреждений.
Рецензенты:
- Пафрейников Сергей Алексеевич, доктор фармацевтических наук, профессор, заведующий кафедрой управление и экономика фармации факультета послевузовского образования ГБОУ ВПО Пятигорской государственной фармацевтической академии Минздравсоцразвития Российской Федерации, г. Пятигорск.
- Андреева Ирина Николаевна, доктор фармацевтических наук, профессор кафедры управление и экономика фармации факультета послевузовского образования ГБОУ ВПО Пятигорской государственной фармацевтической академии Минздравсоцразвития Российской Федерации, г. Пятигорск.
Источник
Классификация опасности лекарственных препаратов
Профилактика и лечение сосудистых заболеваний головного мозга является в настоящее время важной и актуальной задачей во всем мире. Инсульт – это серьезная проблема общественного здравоохранения, поскольку ежегодно около 15 миллионов человек во всем мире переносят инсульт [1; 2]. В нашей стране инсульт поражает более 450 000 человек в год, заболеваемость и смертность от острых нарушений мозгового кровообращения находится на 2-м месте среди других заболеваний. Для того чтобы избежать высокой смертности и инвалидности, необходимо раннее выявление и адекватное лечение инсульта, а также обязательное проведение реабилитационных мероприятий, которые препятствуют возникновению рецидива. Одним из компонентов реабилитации является медикаментозная терапия с использованием церебропротекторных, ноотропных и стресс-протекторных препаратов. Одним из перспективных направлений создания новых препаратов, обладающих церебропротекторным действием, является разработка инновационных соединений на основе пептидных биорегуляторов.
Новое потенциальное лекарственное средство (ЛС) на основе пептидэргического нейро- и стресс-протектора Nα-ацетил-D-лизил-лизил-аргинил-аргинил-амид является кандидатным препаратом для лечения нарушений мозгового кровообращения. Проведенные ранее доклинические исследования специфической фармакологической активности потенциального ЛС показали его высокую нейропротекторную эффективность in vivo [3]. Было показано, что данное потенциальное ЛС обладает антиишемической, антигипоксической, ноотропной и актопротекторной активностями [4]. Выявлено, что Nα-ацетил-D-лизил-лизил-аргинил-аргинил-амид, являющий активным фармакологическим ингредиентом потенциального ЛС, оказывает интегральное нейропротекторное действие, нормализует уровень провоспалительных цитокинов IL-1β и TNF-α, а также повышает содержание противовоспалительного интерлейкина-4 в головном мозге. Защитное действие пептида при церебральной ишемии характеризуется также нейротрофическим компонентом.
Целью данной работы являлись доклинические исследования острой и хронической токсичности потенциального ЛС «Лизаргам» на основе пептидэргического нейро- и стресс-протектора для лечения нарушений мозгового кровообращения.
Материалы и методы исследования
Исследуемое потенциальное ЛС «Лизаргам, спрей назальный дозированный 0,5% и 1,0%» (далее потенциальное ЛС «Лизаргам»), один флакон потенциального ЛС содержит активный фармацевтический ингредиент («D-лизаргам, ацетат») – 15 (0,5%) или 30 (1,0%) мг; физиологический раствор (ФР) — 3,0 мл; D-маннит — 30 мг. «D-лизаргам, ацетат» представляет собой синтетический тетрапептид последовательности Nα-ацетил-D-лизил-лизил-аргинил-аргинил-амид в виде ацетатной соли. Терапевтическая доза потенциального ЛС у человека составляет 20 мкг/кг. Эта доза рассчитывалась исходя из данных по изучению специфической активности потенциального ЛС на экспериментальных животных и коэффициента экстраполяции доз мышей и крыс на человека в соответствии с руководством Т.А. Гуськовой [9].
Доклинические исследования были выполнены на основе рекомендаций действующих методических документов 7. Животные поступили из питомника РАМН «Рапполово» Ленинградской области. Основные правила содержания и ухода соответствовали правилам, принятым Европейской конвенцией по защите позвоночных животных (Страсбург, 1986 г.). Объем работ и перечень процедур был одобрен биоэтической комиссией института. Исследования проводили на 3 видах животных: белых беспородных крысах обоего пола (масса 180-200 грамм, возраст 9–10 недель), белых беспородных мышах обоего пола (19–21 г, 9–10 недель) и на кроликах породы шиншилла обоего пола (2-2,5 кг, 2-3 месяца).
Острая токсичность потенциального ЛС была изучена на мышах, крысах и кроликах. Период наблюдения после введения возрастающих доз составил 14 дней, для достижения высоких доз потенциальное ЛС вводили многократно в течение 10 часов. Эксперименты были проведены при интраназальном (и/н) и внутривенном (в/в) введении потенциального ЛС по одинаковым схемам. Мыши и крысы были случайным образом разделены на группы (по 5 самок и 5 самцов). В опытных группах мышам и крысам и/н вводили потенциальное ЛС в дозах 2, 20, 50 мг/кг; в/в — в дозах 20, 200, 500 мг/кг. И/н потенциальное ЛС вводилось животным при помощи автоматической одноканальной пипетки 10-100 мкл с соответствующим наконечником, введение осуществлялось в каждый носовой ход. В/в введение производилось в соответствии с требованиями [6], в максимальной дозе 500 мг/кг (50 мл/кг) каждой крысе вводили не более 2 мл за раз с интервалом 2 часа в течение 10 часов. Кролики были случайным образом разделены на группы (по 3 самки и по 3 самца в каждой). Кроликам в опытной группе потенциальное ЛС вводили и/н в дозе 25 мг/кг, в/в — в дозе 400 мг/кг. В контрольных группах животным по тем же схемам вводили ФР.
Во всех экспериментах проводили наблюдение за лабораторными животными в течение 14 суток после введения потенциального ЛС. Проводили клинический осмотр (ежедневно) до начала эксперимента (фоновые значения), а также выполняли взвешивание на 2, 7 и 14-й день после введения. У крыс и кроликов измеряли частоту сердечных сокращений (ЧСС) и частоту дыхательных движений (ЧДД). На 14-е сутки все животные были подвергнуты эвтаназии и патоморфологическому исследованию.
Оценка местнораздражающего действия была проведена на 3 кроликах-самцах. На слизистую оболочку правого глаза наносили 0,1 мл 1% потенциального ЛС, на слизистую оболочку левого глаза — 0,1 мл ФР. Наблюдение проводили в течение 24 часов с момента нанесения потенциального ЛС.
Испытания на пирогенность были проведены на кроликах-самцах и соответствовали требованиям ГФ XIII, ОФС 1.2.4.0005.15 [8]. Потенциальное ЛС вводили в ушную вену в объеме 0,2 мл/кг. Температуру измеряли 2 раза до начала исследования и каждые 30 минут в течение 3 часов после введения потенциального ЛС.
Хроническая токсичность потенциального ЛС была изучена на крысах, случайным образом разделенных на 4 группы (по 15 самок и 15 самцов в каждой). Потенциальное ЛС вводили и/н ежедневно, в течение 90 дней в 3 дозах: 1 мг/кг (50-кратная терапевтическая доза для человека, минимально возможная для экспериментального введения крысам), 3 и 5 мг/кг. Хроническая токсичность потенциального ЛС была также изучена на кроликах, самцах и самках, которые были случайным образом разделены на группы (по 3 самки и 3 самца в каждой). Потенциальное ЛС вводили и/н ежедневно, в течение 90 дней в 3 дозах: терапевтической дозе для кролика — 0,06 мг/кг (доза рассчитана путем умножения терапевтической дозы для человека на коэффициент пересчета по площади поверхности тела кролика 3,2); 3 мг/кг и максимальной — 5 мг/кг (более чем в 250 раз превышающей терапевтическую дозу для человека). Крысам и кроликам в контрольных группах по той же схеме вводили ФР.
Клинический осмотр животных выполняли ежедневно, в течение эксперимента регистрировали интегральные показатели состояния организма всех животных, а также патоморфологическое и патогистологическое исследования по окончании эксперимента. Физиологические исследования проводили до начала исследования, а также на 30-й и на 90-й день после начала введения потенциального ЛС.
Офтальмологическое исследование проводили на тех же сроках, оценивая состояние слизистых оболочек, наличие правильных роговичных рефлексов и измеряя величину зрачка и ширину глазной щели. Для лабораторных исследований собирали образцы крови и костный мозг.
Клинический анализ крови выполняли на автоматическом гематологическом анализаторе Abacus Junior vet5 (Diatron, Венгрия) и на мазках крови, окрашенных по Романовскому-Гимзе. Биохимические показатели в сыворотках крови (аланинаминотрансфераза (АлАТ), аспартатаминотранфераза (АсАТ), билирубин, глюкоза, креатинин, мочевина, общий белок, холестерин, щелочная фосфатаза) оценивали на полуавтоматическом биохимическом анализаторе Chem-7 (Erba, Чехия). Исследование мочи выполняли на экспресс-анализаторе мочи DocUReader (ANALYTICON Biotechnologies AG, Германия). Кроме того, проводили микроскопический анализ миелограммы на мазках смывов костного мозга и подсчет количества клеток костного мозга. Все тесты выполнялись по стандартным протоколам и инструкциям производителей наборов.
На основании результатов эксперимента по изучению хронической токсичности рассчитывали расчетный безопасный курс (РБК) и индекс безопасности (ИБ) потенциального ЛС при клиническом применении в соответствии с инструкцией Т.А. Гуськовой [9].
Патоморфологическое исследование после завершения экспериментов включало в себя некропсию, макроскопическое исследование и взвешивание внутренних органов. Также рассчитывали отношение массы органа к массе тела.
Патогистологическое исследование было выполнено с использованием образцов тканей, полученных от животных, которым вводили потенциальное ЛС в максимальной дозе, а также образцов тканей от животных контрольных групп. Материал фиксировали в 10%-ном формалине, обезвоживали, заключали в парафин и изготовляли гистологические срезы, которые окрашивали гематоксилином и эозином («Биовитрум», Россия). Препараты изучали в световом микроскопе DMLB (Leica Microsystems AG, Германия).
Статистический анализ проводили с помощью программы Microsoft Excel 2007 (Microsoft Corporation). Подсчитывали средние значения и ошибки среднего (М±m). Сравнение показателей между группами проводили с помощью непарного Т-критерия Стьюдента с неравными отклонениями, а также по U-критерию Манна-Уитни. Отличия считали достоверными при р 5) потенциальное ЛС «Лизаргам, спрей назальный» относится к III классу малотоксичных лекарственных препаратов.
- Изучение хронической токсичности на кроликах
Ежедневный клинический осмотр кроликов всех экспериментальных групп не выявил каких-либо значимых различий между группами, гибели подопытных животных не наблюдалось. Измерение массы тела показало, что данный параметр равномерно увеличивался на протяжении всего срока исследования как в контрольной, так и во всех опытных группах. Анализ показателей массы тела, потребления корма и воды, а также физиологических параметров (ЧДД, ЭКГ и ЧСС и АД) показал, что достоверные различия между всеми экспериментальными группами отсутствуют. Офтальмологическое исследование не выявило различий между экспериментальными группами, получавшими потенциальное ЛС или ФР.
Представленные в таблице 6 данные подтверждают, что ежедневное и/н введение потенциального ЛС в дозах 0,06-5 мг/кг в течение 30 и 90 дней не оказывало значительного влияния на количественный и качественный состав периферической крови кроликов. Также не было выявлено влияния потенциального ЛС на состояние красного костного мозга, биохимический состав крови, мочи и функциональную активность почек.
Оценка влияния ежедневного интраназального введения потенциального лекарственного средства «Лизаргам» на показатели периферической крови кроликов-самцов
Источник