Тесты по фармхимии. Анализ группы хинолина, пиримидина
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Тесты по фармхимии. Анализ хинолина, изохинолина, пиримидина, пурина, птеридина, изоаллоксазина, фенотиазина и бензодиазепина
ТЕМА 14. Анализ лекарственных средств группы хинолина и изохинолина
Одна из приведенных формул соответствует ципрофлоксацину: ответ В
Антибактериальным ЛС широкого спектра является:
+ ципрофлоксацин;
б) дротаверина гидрохлорид;
в) кодеина фосфат;
г) апоморфина гидрохлорид.
Лекарственным веществом, имеющим окрашивание, является;
а) папаверина гидрохлорид;
+ дротаверина гидрохлорид;
в) промедол;
г) хинина сульфат.
Амфотерными свойствами обладает:
а) кодеин;
б) папаверина гидрохлорид;
в) этилморфина гидрохлорид;
+ апоморфина гидрохлорид.
Лекарственное вещество — белый кристаллический порошок, зеленеющий на воздухе и на свету:
а) нитроксолин;
+ апоморфина гидрохлорид;
в) нофлоксацин;
г) атропина сульфат.
В избытке натрия карбоната растворяется:
а) хинина сульфат;
+ хинозол;
в) морфина гидрохлорид;
г) кодеин.
Азокраситель с солями диазония в определенных условиях образует:
а) хлорохина фосфат;
б) ципрофлоксацин;
в) хинина гидрохлорид;
+ нитроксолин,
При добавлении к водному раствору какого лекарственного вещества раствора аммиака выпадает осадок, растворимый при дальнейшем добавлении раствора натрия гидроксида:
а) папаверина гидрохлорида;
б) офлоксацина;
в) промедола;
+ морфина гидрохлорида.
При добавлении раствора натрия ацетата к водному раствору какого лекарственного вещества выпадает осадок;
а) хлорохина фосфата;
б) хинина дигидрохлорида;
+ папаверина гидрохлорида;
г) кодеина фосфата.
При нагревании на водяной бане нескольких кристаллов ка кого лекарственного вещества в 2-3 мл смеси ангидрида уксусного и кислоты серной концентрированной (1:1) возникает желтое окрашивание с зеленой флуоресценцией:
а) ломефлоксанина;
б) хлорхиналвдола;
+ папаверина гидрохлорида;
г) хлорохина фосфата.
При добавлении к раствору какого лекарственного вещества (1:50) 5 мл раствора кислоты хлороводородной, разведенной и 1 мл железа (III) хлорида, появляется черно-зеленое окрашивание:
а) хлорохина фосфата;
б) морфина гидрохлорида;
в) ципрофлоксацина;
+ нитроксолина.
При добавлении к раствору какого лекарственного вещества (1:1000) бромной воды до слабого желтого окрашивания и нескольких капель аммиака возникает зеленое окрашивание:
а) офлоксацина;
б) ципрофлоксацина;
в) промедола;
+ хинина сульфата.
Количественное определение какого лекарственного вещества проводят методом кислотно-основного титрования в среде кислоты уксусной ледяной с добавлением ртути (II) ацетата (титрант — 0,1 М раствор кислоты хлорной):
а) хинозола;
б) атропина сульфата;
+ морфина гидрохлорида;
г) нитроксолина.
Морфина гидрохлорид с натрия нитритом в кислой среде вступает в реакцию:
а) осаждения;
б) диазотирования;
в) солеобразования;
+ электрофильного замещения.
При расчете М (1/z) при количественном определении хинина сульфата методом кислотно-основного титрования в среде кислоты уксусной ледяной (титрант – 0,1 М раствор кислоты хлорной) значение z равно;
При количественном определении какого лекарственного вещества методом кислотно-основного титрования в среде кислоты уксусной ледяной (титрант – 0,1М раствор кислоты хлорной) требуется добавление ртути (II) ацетата:
а) хинина сульфата;
+ хинина гидрохлорида;
в) кодеина;
г) хлорохина фосфата.
ТЕМА 15. Анализ лекарственных средств группы пиримидина
Рациональное название: 1,5-диметил-5-циклогексеи-1-ил барбитурат натрия соответствует химической структуре: ответ Г
Производным 4,6-пиримидиндиона является: ответ А
Установите соответствие: А-б; Б-а; В-в; Г-а;
Барбитураты по химическому строению являются:
б) сложными эфирами;
Взаимодействие барбитуратов с солями тяжелых металлов обусловлено свойствами:
Дифференцирующим реактивом для барбитуратов является раствор:
а) кобальта нитрата;
б) серебра нитрата;
г) железа (III) хлорида.
Общегрупповыми для барбитуратов являются реакции:
+ соле- и комплексообразования с солями тяжелых металлов;
+ с растворами альдегидов в серной кислоте концентрированной;
Принадлежность барбитуратов к классу уреидов можно доказать, используя;
а) раствор меди сульфата;
б) раствор натрия гидроксида;
+ сплавление с кристаллической щелочью;
г) раствор n-диметиламинобензальдегида в серной кислоте концентрированной.
В реакции с катионами меди для натриевых солей барбитуратов используют реактивы:
а) вода, раствор NаОН, раствор СаС12;
б) вода, карбонатный буферный раствор, раствор СаС12;
+ вода, карбонатный буферный раствор;
г) спирт этиловый, раствор СаС12.
Реакция образования азокрасителя для фенобарбитала обусловлена наличием в его структуре:
а) этильного радикала;
в) амидной группы;
г) имидной группы.
Взаимодействовать с бромной водой будут лекарственные средства: ответ А, В, Г
Общими реактивами для гексенала и метилурацила являются:
б) раствор соляной кислоты;
+ раствор серебра нитрата;
г) раствор β-нафтола.
Уменьшение растворимости в воде натриевых солей барбитуратов связано с процессом:
Образование осадка наблюдается при действии на водные растворы солевых форм барбитуратов раствора:
б) натрия гидроксида;
г) натрия карбоната.
Содержание примесей монозамешенных производных барбитуровой кислоты регламентируется для:
а) кислотных и солевых форм барбитуратов;
г) данные примеси в барбитуратах не определяют.
Содержание примеси свободной щелочи в барбитуратах учитывается при количественном определении:
а) кислотных форм;
в) солевых и кислотных форм;
г) не учитывается.
Наиболее целесообразным методом количественного определения гексамидина является:
г) метод Кьельдаля.
При количественном определении кислотных форм барбитуратов методом кислотно-основного титрования в неводных средах в качестве растворителя используется:
б) кислота уксусная ледяная;
в) уксусный ангидрид;
Для количественного определения солевых форм барбитуратов используется метод:
+ алкалиметрии в неводной среде;
б) алкалиметрии в водной среде;
в) ацидиметрии в неводной среде;
г) ацидиметрии в водной среде.
В виде таблеток выпускаются:
а) гексенал, гексамидин, тиопентал-натрий;
+ гексамидин, бензонал, фенобарбитал;
в) бензонал, гексенал, фторуранил;
г) тиопентал-натрий, фенобарбитал, гексенал.
ТЕМА 16. Анализ лекарственных средств группы пурина
Ядро пурина включает гетероциклы:
Кофеин в отличие от теобромина:
+ легко растворим в горячей воде;
+ растворим в кислотах;
в) растворим в щелочах;
+ легко растворим в хлороформе.
Реакция водного раствора эуфиллина:
г) эуфиллин не растворяется в воде.
Кофеин проявляет свойства:
а) сильные основные;
б) слабые кислотные;
Образование осадка перйодида кофеина наблюдается:
а) в нейтральной среде;
в) в щелочной среде;
г) кофеин не образует нерастворимого перйодида.
Кофеин не образует осадка с:
а) реактивом Люголя;
б) кислотой кремне-вольфрамовой;
в) реактивом Драгендорфа;
При взаимодействии эуфиллина с раствором меди сульфата идет реакция:
+ образования хелатного комплекса.
Теофиллин можно отличить от кофеина реакциями с:
+ раствором натрия гидроксида;
в) реактивом Марки;
+ раствором кобальта хлорида,
Фиолетовое окрашивание с последующим образованием осадка серовато-голубого цвета дает с кобальта хлоридом:
Для образования серебряной соли теобромина необходимы реагенты:
+ раствор натрия гидроксида;
+ раствор серебра нитрата;
г) кислота азотная.
Общегрупповая реакция на производные пурина – мурексидная проба – основана на химических процессах:
б) электрофильного замещения;
г) нуклеофильного присоединения.
Для количественного определения кофеина можно использовать методы:
в) кислотно-основного титрования в среде протофильных растворителей;
+ кислотно-основное титрование в среде протогенного растворителя.
Изменение растворимости эуфиллина в воде происходит под действием:
б) кислорода воздуха;
в) азота воздуха;
ТЕМА 17. Анализ производных пиримидино-тиазола, птеридина, изоаллоксазина, фенотиазина и бензодиазепина
Из перечисленных лекарственных веществ к азотсодержащим органическим основаниям относятся:
а) кислота аскорбиновая,
в) ретинола ацетат:
Из перечисленных лекарегвенных веществ все легко растворимы в воде, кроме:
в) тиамина хлорида;
г) кислоты аскорбиновой.
Одно из приведенных лекарственных веществ растворяется как в щелочах, так и в кислотах: ответ Б
Установите соответствие перечисленных лекарственных веществ и гетероциклических систем, производными которых они являются: А-в; Б-а; В-г; Г-б
Указанные лекарственные вещества взаимодействуют со щелочью в различных типах реакций. Выберите соответствие: А-в; Б-а; В-г; Г-а
Среди перечисленных лекарственных веществ укажите одно, не имеющее окрашивания:
в) кислота фолиевая;
Реакция образования тиохрома характерна для;
в) атропина сульфата;
Реакцию образования азокрасителя можно применить для всех препаратов, кроме одного:
б) кислоты фолиевой;
Для количественного определения перечисленных лекарственных веществ, кроме одного, возможно применение флуориметрического метода количественного определения:
а) тиамина бромида;
в) хинина сульфата;
ТЕМА 18. Анализ лекарственных смесей в условиях аптек
Положительную реакцию с аммиачным раствором серебра оксида дают лекарственные вещества:
в) кислота никотиновая;
Окрашивание пламени в зеленый цвет при прокаливании на одной проволоке характерно для:
Натрия салицилат и гексаметилентетрамин реагируют между собой с образованием окрашенного соединения в присутствии:
а) раствора натрия гидроксида;
+ кислоты серной концентрированной;
в) раствора натрия нитрита.
Обнаружению адреналина гидрохлорида по реакции с раство ром железа (III) хлорида мешают:
б) пилокарпина гидрохлорид:
Реакцией образования ауринового красителя можно обнаружить:
в) кислоту салициловую;
г) натрия бензоат.
Для идентификации бензоат- и салицилат-ионов при совместном присутствии используют:
а) раствор меди (II) сульфата;
б) раствор кальция хлорида;
+ раствор железа (III) хлорида;
г) раствор кобальта (II) нитрата.
Идентификация глюкозы и кислоты аскорбиновой при совместном их присутствии основана на:
а) различии кислотно-основных свойств препаратов;
+ различии их окислительно-восстановительных свойств;
в) гидролитическом разложении;
г) их различной растворимости в воде и органических растворителях.
Натрия и калия хлориды в составе кровезамещающих жидкостей количественно можно определить методами:
+ аргентометрии по Мору;
б) аргентометрии по Фаянсу — Ходакову;
в) аргентометрии по Кольтгофу;
+ аргентометрии по Фольгарду.
Прямым тетраметрическим методом количественного определения гексаметилентетрамина является:
+ титрование кислотой хлороводородной;
б) титрование раствором натрия гидроксида;
в) титрование раствором натрия нитрита;
г) титрование раствором натрия тиосульфата.
Укажите общий метод количественного определения ингредиентов смеси:
Источник
Тесты по фармхимии. Общие методы и приемы анализа
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
ТЕСТЫ ПО ФАРМХИМИИ
ТЕМА 1. Общие методы и приемы анализа качества лекарственных средств
1. Хлорид-ионы обнаруживают:
а) раствором серебра нитрата водным;
б) раствором серебра нитрата в присутствии аммиака;
+ раствором серебра нитрата в присутствии кислоты азотной;
г) раствором серебра нитрата в присутствии кислоты серной.
2. Один из перечисленных ионов дает белый осадок с раствором бария хлорида в присутствии кислоты хлороводородной:
а) нитрат-ион;
+ сульфат-ион;
в) фосфат-иои;
г) сульфид-ион.
3. Синее окрашивание раствора в присутствии аммиака дает:
а) ион серебра;
б) ион цинка;
в) ион железа;
+ ион меди.
4. Розовая окраска кадия перманганата исчезает:
а) в присутствии кислоты азотной;
б) в присутствии кислоты серной;
в) в присутствии натрия сульфата и кислоты серной;
+ в присутствии натрия нитрита и кислоты серной.
5. Из перечисленных лекарственных веществ проявляют как окислительные, так и восстановительные свойства:
а) калия перманганат;
+ водорода пероксид;
в) натрия нитрит;
г) кадия йодид.
6. Ион аммония можно обнаружить:
а) раствором бария хлорида;
+ реактивом Несслера;
в) раствором калия йодида;
г) раствором кадия перманганата.
7. Кислую реакцию среды имеет раствор;
а) натрия гидрокарбоната;
б) кальция хлорида;
+ цинка сульфата;
г) натрия хлорида.
8. Одно из лекарственных веществ темнеет при действии восстановителей;
а) кадия иодид;
+ серебра нитрат;
в) натрия бромид;
г) фенол.
9. Одно из лекарственных веществ при хранении розовеет вследствие окисления:
+ резорцин;
б) натрия хлорид;
в) серебра нитрат;
г) бария сульфат для рентгеноскопии.
10. Внешний вид «резорцина» изменился при хранении вследствие окисления. Метод для определения допустимого предела изменения данного лекарственного вещества:
а) определение pH;
б) определение степени мутности;
+ определение окраски;
г) определение золы.
11. Одним из перечисленных реактивов можно определить примесь йодидов в ЛС калия бромид, основываясь на различной способности этих двух веществ к окислению:
а) калия перманганат;
+ железа (III) хлорид;
в) раствор йода;
г) серебра нитрат.
12. Одно из перечисленных лекарственных веществ при хранении изменяет внешний вид вследствие потери кристаллизационной воды:
а) кальция хлорид;
+ меди сульфат;
в) натрия йодид;
г) калия хлорид.
13. Одним из перечисленных реактивов можно открыть примесь броматов в ЛС калия бромид;
а) серебра нитрат;
+ кислота серная;
в) бария хлорид;
г) аммония оксалат.
14. ГФ требует определять цветность Л С калия бромид, так как данное вещество может:
а) восстанавливаться;
+ окисляться;
в) подвергаться гидролизу;
г) взаимодействовать с углекислотой воздуха с образованием окрашенных продуктов.
15. Одним из перечисленных реактивов можно открыть примесь йодатов в ЛС калия йодид:
а) аммония оксалат;
б) натрия гидроксид;
в) раствор аммиака;
+ кислота хлороводородная.
ТЕМА 2. Анализ лекарственных средств неорганической природы. Препараты водорода пероксида. Производные галогенов. Натрия нитрит. Натрия тиосульфат
Тестовые задания
1. Окрашенным лекарственным веществом является:
+ йод;
б) калия хлорид;
в) натрия хлорид;
г) натрия йодид,
2. При добавлении к раствору лекарственного вещества кислоты азотной разведенной и раствора серебра нитрата образуется белый творожистый осадок, растворимый в растворе аммиака:
а) натрия йодид;
б) калия йодид;
+ натрия хлорид;
г) раствор йода спиртовый 5%.
3. При добавлении к раствору лекарственного вещества раствора хлорамина в присутствии кислоты хлороводородной и хлороформа (при взбалтывании) хлороформный слой окрашивается в желто-бурый цвет:
а) калия йодид;
б) натрия хлорид;
в) натрия фторид;
+ натрия бромид.
4. При взаимодействии кислоты хлористоводородной разведенной с марганца (IV) оксидом выделяется:
а) кислород;
+ хлор;
в) хлора (I) оксид;
г) хлора (VII) оксид.
5. Примесь йодидов в препаратах калия бромид и натрия бромид определяют реакцией с:
а)серебра нитратом;
б) хлорамином;
в) кислотой серной концентрированной;
+ железа (III) хлоридом.
6. В химических реакциях проявляют свойства как окислителя, так и восстановителя:
а) калия йодид;
+ натрия нитрит;
+ раствор водорода пероксида;
г) натрия хлорид.
7. При добавлении растворов ализаринсульфоната натрия и циркония нитрата к раствору какого лекарственного вещества возникает красное, переходящее в желтое, окрашивание:
а) натрия хлорида;
б) калия хлорида;
+ натрия фторида;
г) натрия йодида.
8. При добавлении растворов кислоты виннокаменной и натрия ацетата к раствору какого лекарственного вещества постепенно выпадает белый кристаллический осадок, растворимый в разведенных минеральных кислотах и щелочах:
+ калия хлорида;
б) натрия фторида;
в) кислоты хлористоводородной разведенной;
г) натрия бромида.
9. От прибавления к подкисленному раствору калия бромида нескольких капель раствора железа (III) хлорида и раствора крахмала появляется синее окрашивание. Это свидетельствует о наличии в лекарственном средстве примеси:
а) сульфатов;
+ йодидов;
в) броматов;
г) хлоридов.
10. От прибавления к раствору натрия бромида кислоты серной концентрированной раствор окрашивается в желтый цвет. Это свидетельствует о наличии примеси:
+ броматов;
б) йодидов;
в) сульфатов;
г) хлоридов.
11. От прибавления к раствору калия хлорида кислоты серной разведенной наблюдается помутнение. Это свидетельствует о наличии в ЛС следующей примеси:
+ солей бария;
б) солей железа;
в) солей аммония;
г) хлоридов.
12. К раствору ЛС прибавляют раствор йодида калия и титруют раствором натрия тиосульфата до обесцвечивания без индикатора. Это метод количественного определения:
+ раствора йода спиртового 10%;
б) кислоты хлористоводородной разведенной;
в) натрия хлорида;
г) натрия бромида.
13. К раствору лекарственного вещества добавляют уксусный ангидрид, кипятят, охлаждают и титруют кислотой хлорной. Это метод количественного определения:
а) натрия хлорида;
+ натрия фторида;
в) натрия бромида;
г) натрия йодида.
14. Необходимым условием титрования лекарственных веществ группы хлоридов и бромидов методом Мора является:
а) кислая реакция среды;
б) щелочная реакция среды;
в) присутствие кислоты азотной;
+ реакция среды близкая к нейтральной.
ТЕМА 3. Анализ натрия гидрокарбоната, лития карбоната, солей магния и кальция, бария сульфата, производных бора
1. Щелочную реакцию среды водного раствора имеют:
а) натрия хлорид;
б) магния сульфат;
+ натрия тетраборат;
г) натрия гидрокарбонат.
2. Кислую реакцию среды водного раствора имеют:
а) натрия тетраборат;
+ кислота хлористоводородная;
в) кальция хлорид;
+ кислота борная.
3. Выделение пузырьков газа наблюдают при добавлении кислоты хлороводородной к:
+ лития карбонату;
б) магния сульфату;
в) натрия тетраборату;
г) раствору водорода пероксида,
4. Примесь минеральных кислот в кислоте борной можно определить по:
а) фенолфталеину;
б) лакмусу красному;
+ метиловому оранжевому;
+ лакмусу синему.
5. Количество примеси карбонатов в натрия гидрокарбонате устанавливают:
а) титрованием кислотой;
б) по реакции с насыщенным раствором магния сульфата;
в) по окраске фенолфталеина;
+ прокаливанием,
6. Бария сульфат для рентгеноскопии:
а) растворим в кислоте хлороводородной;
б) растворим в щелочах;
в) растворим в аммиаке;
+ нерастворим в воде, кислотах и щелочах.
7. Количественное определение натрия гидрокарбоната проводят методом:
а) алкалиметрии;
+ ацидиметрии (прямое титрование);
в) ацидиметрии (обратное титрование);
г) комплексонометрии.
8. При растворении в воде подвергаются гидролизу:
+ натрия нитрит;
б) кальция хлорид;
в) натрия гидрокарбонат;
+ натрия тетраборат.
9. Количественное определение ацидиметрическим методом (обратное титрование) проводят для:
а) натрия тетрабората;
б) натрия гидрокарбоната;
+ лития карбоната;
г) натрия нитрита.
10. В препаратах кальция катион Са2+ можно доказать по:
+ окрашиванию пламени;
б) реакции с аммиакаом;
+ реакции с аммония оксалатом;
г) реакции с кислотой хлороводородной.
11. Общими реакциями на препараты бора являются:
+ образование сложного эфира с этанолом;
б) реакция с кислотой хлороводородной:
+ реакция с куркумином;
г) реакция с аммония оксалатом.
12. При неправильном хранении изменяют свой внешний вид:
+ натрия тетраборат;
+ калия йодид;
+ кальция хлорид;
+ магния сульфат.
13. В виде инъекционных растворов применяются:
+ магния сульфат;
+ кальция хлорид;
+ натрия хлорид;
г) натрия тетраборат.
14. С помощью метода комплексонометрии количественно определяют:
+ магния сульфат;
+ кальция хлорид;
в) лития карбонат;
г) натрия тетраборат.
15. Завышенный результат количественного определения вследствие неправильного хранения может быть у:
а) кальция хлорида;
+ натрия тетрабората;
в) магния сульфата;
г) кислоты борной.
16. При количественном определении кислоты борной для усиления кислотных свойств добавляют:
+ глицерин;
б) спирт этиловый;
в) раствор аммиака;
г) хлороформ.
17. Не пропускает рентгеновские лучи и применяется при рентгенологических исследованиях:
а) лития карбонат;
б) натрия тетраборат;
+ бария сульфат;
г) кислота борная.
18. Доказательство иона лития проводят реакцией с:
а) сульфат-ионом;
б) фосфат-ионом в кислой среде;
в) фосфат- ионом в щелочной среде;
+ фосфат-ионом в нейтральной среде.
19. Общей реакцией на натрия гидрокарбонат и лития карбонат является реакция с:
+ кислотой хлороводородной;
б) раствором натрия гидроксида;
в) раствором аммиака;
г) реакция окрашивания пламени в желтый цвет.
20. В отличие от натрия гидрокарбоната, используемого для приема внутрь, натрия гидрокарбонат, используемый в инъекционных растворах, должен:
а) не содержать примеси хлоридов;
+ быть бесцветным;
+ быть прозрачным;
г) иметь нейтральную реакцию среды.
21. Для доказательства бария сульфата для рентгеноскопии препарат предварительно:
а) растворяют в кислоте;
б) растворяют в щелочи;
в) кипятят с кислотой;
+ кипятят с натрия карбонатом.
22. Характерную окраску пламени дают:
+ кальция хлорид;
+ натрия гидрокарбонат;
+ лития карбонат;
г) магния сульфат.
23. Осадки гидроксидов с аммиаком дают:
+ мантия сульфат;
б) кальция хлорид;
в) лития карбонат;
г) бария сульфат.
24. С кислотой хлороводородной реагируют:
+ натрия тиосульфат;
+ натрия гидрокарбонат;
в) бария сульфат;
+ лития карбонат.
25. Примесь фосфатов в бария сульфате для рентгеноскопии определяют с:
а) молибдатом аммония;
б) молибдатом аммония в щелочной среде;
+ молибдатом аммония в азотнокислой среде;
г) сульфатом магния.
ТЕМА 4. Анализ соединений висмута, цинка, меди, серебра, железа, комплексных соединений железа, платины и гадолиния
Тестовые задания
1. Кислую реакцию среды водного раствора имеют препараты:
+ цинка сульфат;
+ серебра нитрат;
в) натрия гидрокарбонат;
г) кальция хлорид.
2. В химическом отношении продуктом гидролиза является:
а) натрия тиосульфат;
+ висмута нитрат основной;
в) бария сульфат;
г) натрия тетраборат.
3. Перечисленные лекарственные вещества, кроме одного, могут проявлять в химических реакциях свойства восстановителя:
а) водорода пероксид;
б) железа (II) сульфат;
в) калия йодид;
+ серебра нитрат.
4. С раствором аммиака комплекс синего цвета образует лекарственное вещество:
а) серебра нитрат;
б) цинка сульфат;
в) висмута нитрат основной;
+ меди сульфат.
5. С калия йодидом в водном растворе образует осадок, растворяющийся в избытке реактива:
+ висмута нитрат основной;
б) серебра нитрат;
в) меди сульфат;
г) железа сульфат.
6. Для проведения испытания подлинности и количественного определения препарата требуется предварительная минерализация:
а) висмута нитрата основного;
+ протаргола;
в) цинка оксида;
г) бария сульфата.
7. При количественном определении железа сульфата, цинка сульфата, натрия тетрабората, меди сульфата, натрия тиосульфата завышенный результат может быть получен из-за:
а) поглощения влаги;
+ потери кристаллизационной воды;
в) гидролиза;
г) поглощения оксида углерода (IV).
8. Методом комплексонометрии в кислой среде количественно определяют:
а) цинка оксид;
б) магния оксид;
в) магния сульфат;
+ висмута нитрат основной.
9. Метолом комплексонометрии в присутствии гексаметилентетрамина количественно определяют:
а) магния сульфат;
+ цинка оксид;
в) кальция хлорид;
г) висмута нитрат основной.
10. По списку А хранят:
а) бария сульфат;
б) цинка сульфат;
+ серебра нитрат;
г) натрия тетраборат.
11. Серебра нитрат по НД количественно определяют методом:
а) меркуриметрии;
б) аргентометрии;
в) йодометрии,
+ тиоцианатометрии.
12. Метолом перманганатометрии можно количественно определить все лекарственные вещества, кроме:
а) железа сульфата;
б) натрия нитрита;
+ серебра нитрата;
г.) раствора пероксида водорода.
13. Заниженный результат при количественном определении железа (II) сульфата был получен в результате:
а) восстановления препарата;
+ окисления препарата;
в) гигроскопичности препарата;
г) выветривания препарата.
14. Для цинка оксида, магния сульфата, висмута нитрата основного, кальция хлорида общим методом количественного определения является:
а) гравиметрия;
б) перманганатометрия;
в) йодометрия;
+ комплексономстрия.
15. Описание свойств: «белый аморфный или кристаллический порошок; практически нерастворимый в воде: смоченный водой окрашивает синюю лакмусовую бумагу в красный цвет» соответствует лекарственному веществу:
а) магния сульфату;
б) колларголу;
+ висмута нитрату основному:
г) цинка оксиду.
16. В химических реакциях проявляют свойства как окислителя, так и восстановителя ЛС:
а) калия йодид;
+ натрия нитрит;
+ раствор водорода пероксида;
г) серебра нитрат.
17. При количественном определении меди сульфата, магния сульфата, натрия тетрабората, цинка сульфата завышенный результат может быть получен в следствие:
а) поглощения влаги;
+ потери кристаллизационной воды;
в) гидролиза;
г) поглощения диоксида углерода.
18. Одно из лекарственных веществ не может быть использовано в качестве и ЛС, и реактива, и титрованного раствора:
а) кислота хлороводородная;
б) калия перманганат;
+ раствор аммиака;
г) натрия нитрит.
ТЕМА 5. Анализ лекарственных средств группы алифатических алканов, их галогено- и кислородсодержащих соединений
Тестовые задания
1. Формальдегид легко вступает в реакции:
+ присоединения;
+ окислительно-восстановительные:
в) замещения;
г) обмена.
2. Все лекарственные вещества представляют собой белые кристаллические порошки, кроме:
а) лактозы;
б) хлоралгидрата;
+ фторогаяа;
г) гексаметилентетрамина.
3. Наличие перекисных соединений как недопустимой примеси в эфире для наркоза определяют по реакции с:
а) калия перманганатом в кислой среде;
б) натрия гидроксидом;
+ калия йодидом;
г) кислотой хромотроповой.
4. И соли аммония, и параформ определяют в одном из ЛС:
а) спирте этиловом;
б) растворе формальдегида;
+ гесаметилентетрамине;
г) глюкозе.
5. Реакцию образования йодоформа нельзя использовать для определения:
а) подлинности этанола;
б) примеси хлоралкоголята в хлоралгидрате;
в) подлинности лактат-иона
+ примеси метанола в спирте этиловом
6. Формула для расчета концентрации раствора С = n-n0 / F применяется при использовании:
+ рефрактометрии;
б) поляриметрии;
в) полярографии;
г) спектрофотометрии
7. Удельный показатель поглощения это:
+ оптическая плотность раствора, содержащего 1 г вещества в 100 мл раствора при толщине слоя 1 см;
б) показатель преломления раствора;
в) угол поворота плоскости поляризации монохроматического света на пути длиной в 1 дм и условной концентрации 1 г/мл;
г) фактор, равный величине прироста показателя преломления при увеличении концентрации на 1%.
8. Для обнаружения альдегидов как примеси в других ЛС используют наиболее чувствительную реакцию с:
а) реактивом Фелинга;
б) реактивом Толленса;
в) кислотой салициловой в присутствии кислоты серной;
+ реактивом Несслера.
9. При хранении раствора формальдегида в нем образовался белый осадок. Это обусловлено:
а) хранением препарата при температуре выше 9 °С;
+ хранением при температуре ниже 9 °С;
в) хранением при доступе влаги;
г) хранением в посуде светлого стекла.
10. Натрия гидрокарбонат и натрия метабисульфит одновременно добавляют для стабилизации раствора для инъекций:
+ кислоты аскорбиновой;
б) магния сульфата;
в) гексаметилентетрамина:
г) глюкозы.
11. С реактивом Фелинга не реагирует:
а) глюкоза;
б) раствор формальдегида;
в) лактоза;
+ калия ацетат.
12. В реакцию Малапрада вступает лекарственное вещество:
а) хлоралгидрат;
б) калия ацетат;
в) гексаметилентетрамин;
+ глицерин.
13. Количественное определение кислоты аскорбиновой можно
проводить методами:
а) ацидиметрии;
+ алкалиметрии;
+ йодометрии;
+ йодатометрии.
14. Количественное определение калия ацетат можно проводить методами:
а) йодометрии;
б) нитритометрии;
+ кислотно-основного титрования в неводной среде;
+ ацидиметрии.
15. Значение величины М (1/z) кислоты аскорбиновой при йодатометрическом количественном определении равно:
а) 1 М кислоты аскорбиновой;
+ 1/2 М кислоты аскорбиновой;
в) 1/3 М кислоты аскорбиновой;
г) 1/4 М кислоты аскорбиновой.
ТЕМА 6. Анализ лекарственных средств группы алифатических карбоновых кислот и оксикислот, кислоты аскорбиновой, алифатических аминокислот и их производных
Тестовые задания
1. Комплексонометрическим методом определяют лекарственные вещества:
а) кислоту аскорбиновую;
б) калия ацетат;
+ кальция глюконат;
+ магния сульфат.
2. Выражеными восстановительными свойствами обладают ЛС:
+ калия йодид;
+ кислота аскорбиновая;
в) натрия хлорид;
+ раствор формальдегида.
3. Кислота аскорбиновая образует соль с реактивом:
а) железа (III) хлоридом;
б) серебра нитратом;
в) железа (II) сульфатом;
+ натрия гидрокарбонатом.
4. Методом кислотно-основного титрования количественно определяют:
+ калия ацетат;
б) серебра нитрат;
+ аминалон;
г) раствор тетацина кальция.
5. Для консервирования крови используют:
а) кислоту глутаминовую;
б) кальция хлорид;
+ натрия цитрат для инъекций;
г) калия ацетат.
6. Витаминным средством является:
а) аминалон:
б) пирацетам;
в) кислота глутаминовая;
+ кислота аскорбиновая.
7. Для количественного определения аминалона можно использовать:
+ метод кислотно-основного титрования в неводных средах;
б) комплексонометрию;
+ алкалиметрию в присутствии формальдегида;
г) аргентометрию.
8. С раствором меди сульфата в определенных условиях реагируют:
+ кислота глутаминовая;
+ глюкоза:
+ калия йодид;
г) магния сульфат.
9. Кислоту аскорбиновую количественно можно определить:
+ алкалиметрически;
б) аргентометрически;
+ йодометрически;
+ йодатометрически.
10. Щелочную реакцию среды водного раствора имеет;
а) натрия хлорид;
б) калия бромид;
+ калия ацетат;
г) натрия гидрокарбонат.
11. Кислую реакцию среды водного раствора имеют:
+ кислота аскорбиновая;
б) аминалон;
+ кислота глутаминовая;
г) кальция лактат.
12. С раствором железа (III) хлорида реагируют:
+ кислота аскорбиновая;
+ кальция глюконат;
+ калия ацетат;
+ калия йодид.
13. Амфолитами являются:
+ цинка оксид;
+ аминалон;
в) кислота аскорбиновая;
г) калия ацетат.
14. Реакции окисления используют в анализе лекарственных веществ:
+ калия йодида;
+ глюкозы;
+ хлоралгидрата;
+ кислоты аскорбиновой.
15. Метод йодометрии используют для количественного определения:
а) натрия бромида;
+ метионина;
+ цистеина;
+ кислоты аскорбиновой.
16. Серосодержащими аминокислотами являются:
а) кислота аскорбиновая;
б) аминалон;
+ метионин;
+ цистеин.
17. Метод Кьельдаля используют для количественного определения:
а) нитроглицерина;
+ пирацетама;
в) раствора формальдегида:
+ аминалона.
18. Гидроксамовую реакцию дают:
а) кальция лактат;
б) аминалон;
+ пирацетам:
г) калия ацетат.
19. Кислотные свойства кислоты аскорбиновой обусловлены наличием в структуре:
а) фенольных гидроксилов;
б) одного енольного гидроксила;
+ 2 енольных гидроксилов;
г) лактонного кольца.
20. При количественном определении метионина йодометрическим методом образуется:
а) сероводород;
б) дисульфид метионина;
+ сульфоксид метионина;
г) сульфат метионина.
21. Оптически активными веществами являются:
+ кислота глутаминовая;
+ метионин;
+ кислота аскорбиновая;
г) калия ацетат.
22. Щелочному гидролизу подвергаются:
а) калия ацетат;
+ нитроглицерин;
в) кислота аскорбиновая;
+ пирацетам.
23. При сплавлении со щелочью меркаптаны образует:
а) аминалон;
+ метионин;
в) кислота глутаминовая;
г) раствор тетацина кальция для инъекций.
24. Значение удельного вращения определяют у:
+ метионина;
б) калия ацетата;
в) спирта этилового;
+ кислоты глутаминовой.
25. Двухосновной аминокислотой является:
а) аминалон;
б) пирацетам;
+ кислота глутаминовая;
г) метионин.
ТЕМА 7. Анализ производных б-лактамидов и аминогликозидов
Тестовые задания
1. Солью азотсодержащего органического основания является:
+ стрептомицина сульфат;
б) феноксиметилпенициллин;
в) оксациллина натриевая соль;
г) цефалотина натриевая соль.
2. По химическому строению гликозидом является:
а) цефалексин;
б) феноксиметилпенициллин;
+ амикацина сульфат;
г) карбенициллина динатриевая соль.
3. К группе б-лактамидов относится:
а) канамицина сульфат:
+ цефалексин;
в) амикацина сульфат;
г) гентамицина сульфат,
4. Полусинтетическим пенициллином не является:
а) оксациллина натриевая соль;
+ феноксиметилпенициллин;
в) клоксациллина натриевая соль;
г) ампициллин.
5. Лекарственное вещество белого цвета, растворимо в воде, при взаимодействии с I-нафтолом и натрия гипохлоритом дает красное окрашивание. Это;
а) цефалотина натриевая соль;
б) оксациллина натриевая соль:
+ стрептомицина сульфат;
г) феноксиметилпенициллин,
6. Лекарственное вещество белого цвета, растворимо в воде, при нагревании с натрия гидроксидом и последующем добавлении кислота хлороводородной и железа (III) хлорида образуется фиолетовое окрашивание. Это:
+ стрептомицина сульфат;
б) амоксициллина тригидрат;
в) бензилпенициллина натриевая соль;
г) карбенициллина динатриевая соль.
7. Амфотерный характер проявляют лекарственные вещества:
а) бензилпенициллина натриевая соль;
+ феноксиметилпенициллин;
в) стрептомицина сульфат;
г) цефалексин,
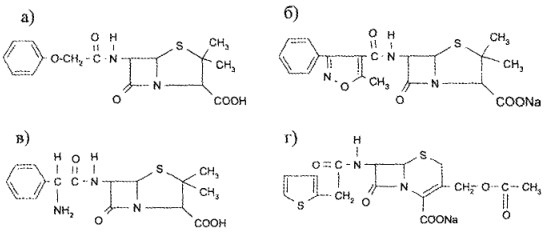
8. На основании приведенных химических структур лекарственных веществ укажите те, которые дают реакцию с нингидрином: ответ В
9. Получение гидроксаматов железа (III) или меди (II) возможно для:
+ оксациллина натриевой соли;
+ цефалексина;
+ бензилпенициллина;
+ феноксяметилпенициллина.
10. Изменение химической структуры под действием щелочей происходит у лекарственных веществ:
а) канамицина сульфата;
+ цефалексина;
+ феноксиметилпенициллина;
г) стрептомицина сульфата.
11. Феноксиметилпенициллин можно отличить от бензилпенициллина натриевой соли по:
+ реакции с кислотой хромотроповой;
б) внешнему виду;
в) растворимости в воде;
г) гидроксамовой реакции.
12. Укажите лекарственные вещества, в анализе которых используется метод УФ-спектроскопии:
+ феноксиметилпенициллин;
+ цефалексин;
+ бензилпенициллина калиевая соль;
+ оксациллина натриевая соль.
13. Для количественного определения бензилпенициллина натриевой соли можно применить методы:
+ гравиметрический;
+ йодиметрический;
+ микробиологический;
г) нитритометрический.
14. Для количественного определения оксациллина натриевой соли можно применить методы:
а) нейтрализации;
б) УФ-спектрофотометрии;
в) ФЭК;
г) нитритометрии.
15. Бензилпенициллина калиевая соль несовместима в водных растворах с:
а) натрия хлоридом;
б) натрия гидрокарбонатом;
в) новокаином;
+ адреналина гидрохлоридом.
Источник