- Методы лечения аллергии
- Возможности этиотропной терапии в снижении рисков развития тяжелого или осложненного течения ОРВИ и гриппа
- Актуальность
- Этиология и патогенез, клиническая картина ОРВИ
- Клиническая эффективность энисамия йодида
- Клиническое наблюдение
- Заключение
- Этиотропная терапия острых респираторных инфекций бактериальной этиологии
Методы лечения аллергии
В основе аллергического заболевания лежит особая форма воспалительной реакции, развивающаяся в результате неадекватного ответа иммунной системы на специфический агент – аллерген. Ключевое слово здесь – СПЕЦИФИЧЕСКИЙ. Именно с целью его выявления необходимо проведение СПЕЦИФИЧЕСКОЙ аллергодиагностики.
Если устранён контакт с аллергеном, вызывающим аллергическую реакцию, то устраняется и причина воспаления.
Лечение аллергических заболеваний может быть этиотропным, патогенетическим и симптоматическим.
Этиотропное лечение
Этиотропное лечение заключается в устранении (элиминации) и дальнейшем предотвращении контакта организма с причинно-значимым аллергеном.
Как правило, этиотропная терапия заключается в элиминация аллергенов. При пищевой аллергии из рациона исключают продукты, вызывавающие патологические реакции, при медикаментозной — лекарственные препараты, при бытовой – проводят мероприятия, направленные на создание гипоаллергенного быта.
Патогенетическая терапия
Патогенетическая терапия представляет собой комплекс методов, направленных на механизмы развития заболевания, ослабление воспалительной реакции, достижение гипо- или десенсибилизации организма. Как правило, она включает в себя применение антигистаминных препаратов, иммунодепрессантов, мембраностабилизаторов.
Важнейшим методом патогенетической терапии аллергических заболеваний является
аллерген-специфическая иммунотерапия (АСИТ) заключающаяся во введении в организм пациента возрастающих доз причинно-значимого аллергена.
Симптоматическая терапия
Симптоматическая терапия имеет своей целью устранение симптомов заболевания. Она может быть представлена отвлекающей терапией, назначением обезболивающих, седативных средств и др.
Учитывая сложность механизмов аллергии, лечение должно быть максимально персонифицированным. При необходимости проводится активация адаптивных реакций и процессов с использованием адаптогенов, микроэлементов, витаминов, ферментов, иммуномодуляторов и других лекарственных средств.
Аллергологическая служба Городской больницы №40 функционирует в рамках мощного многопрофильного стационара и имеет в своём распоряжении все диагностические и лечебные возможности учреждения.
ПРОФИЛАКТИКА АЛЛЕРГИЧЕСКИХ ЗАБОЛЕВАНИЙ
Чем больше Вы знаете о своей аллергии, тем лучше можете справиться с ней.
Профилактика аллергических заболеваний может быть первичной, вторичной и третичной.
Первичная профилактика заключается в предупреждении возникновения аллергического заболевания, путем предотвращения или ограничения контакта с аллергеном.
Вторичная профилактика заключается в ранней диагностике и адекватном лечении возникшего аллергического заболевания.
Чем раньше выявлена аллергия и начаты мероприятия по её лечению и профилактике, тем лучше прогноз. Дело в том, что если у пациента сохраняется контакт с причинно-значимым аллергеном, тем выше вероятность расширения спектра сенсибилизации, то есть развития аллергии к новым и новым аллергенам. Таким образом, аллергия становится поливалентной, а лечение её – более сложным и менее эффективным.
Третичная профилактика – профилактика повторных обострений аллергического заболевания, чему способствует адекватное и своевременное лечение возникших обострений. Для этого необходим контакт с аллергологом и знание пациентом алгоритма действий в случае обострения аллергии.
Источник
Возможности этиотропной терапии в снижении рисков развития тяжелого или осложненного течения ОРВИ и гриппа
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
Респираторные вирусные инфекции распространены повсеместно и занимают до 90% от числа всех инфекционных заболеваний в России. Из них около 20% приходится на вирусы гриппа. Часто острые респираторные вирусные инфекции (ОРВИ) и грипп вызывают обострение сопутствующих хронических заболеваний, таких как астма, хроническая обструктивная болезнь легких, хронический гепатит или почечная недостаточность, диабет или сердечно-сосудистые нарушения, и могут стать причиной тяжелых осложнений. Это требует проведения эффективной терапии для снижения риска осложнений и обострений хронических заболеваний. На фармацевтическом рынке в настоящее время имеется большое количество препаратов, рекомендуемых для лечения и профилактики ОРВИ, что говорит о трудностях создания препаратов с высокой эффективностью.
Идет поиск новых препаратов, в частности, рассматривается возможность применения препарата Нобазит ® (энисамия йодид) для лечения ОРВИ и гриппа у пациентов с высоким риском развития осложнений. Нобазит ® имеет ряд преимуществ перед препаратами других групп. Он оказывает не только прямое противовирусное действие, но и обладает выраженными интерфероногенными свойствами, способствует повышению концентрации эндогенного интерферона (ИНФ-α и ИНФ-γ) в плазме крови в 3–4 раза, повышает резистентность организма к вирусным инфекциям, снижает вероятность развития осложнений и их тяжесть.
Ключевые слова: острые респираторные вирусные инфекции, ОРВИ, грипп, профилактика, противовирусные препараты, энисамия йодид, Нобазит.
Для цитирования: О.А. Паевская, С.Н. Зуевская, В.В. Никифоров и др. Возможности этиотропной терапии в снижении рисков развития тяжелого или осложненного течения ОРВИ и гриппа. РМЖ. 2019;1(II):77-80.
Etiotropic therapy possibilities for risk reduction during severe or complicated ARVI and influenza courses
O.A. Paevskaya 1 , S.N. Zuevskaya 1 , V.V. Nikiforov 2 , O.F. Belaya 1 , N.V. Kolaeva 1 , E.A. Nemilostiva 1 , N.N. Kashina 1 , K.A. Turkadze 1
1 Sechenov University, Moscow
2 Pirogov Russian National Research Medical University, Moscow
Viral respiratory infections have a common nature and take up to 90% of all infectious diseases in Russia. Of these, about 20% are influenza viruses. Acute respiratory viral infections (ARVI) and influenza usually cause exacerbation of concomitant chronic diseases such as asthma, chronic obstructive pulmonary disease, chronic hepatitis or kidney failure, diabetes or cardiovascular disorders. In addition, these pathologies can cause severe complications. Thus, this requires an effective therapy to reduce the risk of chronic diseases complications and their exacerbations. Currently, there are a large number of marketed drugs recommended for ARVI treatment and prevention, which indicates the difficulties of creating highly effective drugs.
In this regard, the possibility of using Nobazit ® (enisamium iodide) in high-risk patients with developing complications (during or after the influenza course) is considered at the time of searching for new drugs. Nobazit ® has a number of advantages over the other preparation groups. It has not only a direct antiviral effect but also an anti-inflammatory, immunostimulating, analgesic effect.
Keywords: acute respiratory viral infections, ARVI, influenza, prophylaxis, antiviral drugs, enisamium iodide, Nobazit.
For citation: Paevskaya O.A., Zuevskaya S.N., Nikiforov V.V. et al. Etiotropic therapy possibilities for risk reduction during severe or complicated ARVI and influenza courses. RMJ. 2019;1(II):77–80.
Статья посвящена возможностям применения этиотропной терапии с целью снижении рисков развития тяжелого или осложненного течения ОРВИ и гриппа
Актуальность
Этиология и патогенез, клиническая картина ОРВИ
Заболеваемость ОРВИ обусловлена преимущественно вирусами негриппозной этиологии (вирусы парагриппа, аденовирусы, респираторно-синцитиальный вирус и др.) [2]. Эти вирусы циркулируют и вне сезона гриппа, вызывая круглогодичную заболеваемость органов дыхательной системы.
Последний пандемический штамм вируса гриппа А — pH1N1 в результате реассортации приобрел комплементарность к рецепторам эпителия бронхиол и альвеол, что привело к появлению тяжелых форм гриппа с развитием респираторного дистресс-синдрома. Для развития инфекционного процесса в макроорганизме необходимы определенные условия: восприимчивость организма (наличие клеток, имеющих рецепторы, способные связаться с вирусом), ослабление иммунной системы (активности факторов специфической и неспецифической защиты). При воздействии вируса на клетку макроорганизма запускаются процессы, с помощью которых организм освобождается от вирусного агента: активация клеточного и гуморального иммунитетов, секреция провоспалительных и противовоспалительных цитокинов, активация клеточного апоптоза.
Для респираторных вирусов входными воротами является слизистая дыхательной системы (носовая полость, трахея, бронхи). Сиаловые кислоты защищают слизистые оболочки от механических и химических повреждений и являются компонентами клеточных рецепторов, специфичных для вирусов гриппа. Секреторный иммуноглобулин А обладает способностью предупреждать адгезию вирусов с поверхностью эпителиальных клеток слизистых оболочек. Доказано, что недостаточное количество иммуноглобулинов приводит к возникновению частых ОРВИ [4].
К местным факторам защиты относится и фагоцитоз, осуществляемый клетками мононуклеарно-макрофагальной системы (макрофагами, полиморфноядерными лейкоцитами, моноцитами), при котором реализуется цитолитический потенциал по отношению к возбудителям. Наблюдается увеличение числа этих клеток, особенно нейтрофилов, с усилением их фагоцитарной активности и перестройкой их метаболизма: увеличением ионной проницаемости мембран, усилением окисления глюкозы и резким возрастанием (в десятки раз) потребления кислорода, что приводит к гиперпродукции свободных радикалов, галогенов, перекисей [5].
С одной стороны, повышение кислородозависимого метаболизма — это проявление защитных реакций. Однако длительная активация нейтрофилов с накоплением большого количества свободных радикалов и перекисей
может привести к их повреждающему действию на ткани,
в т. ч. и на сами фагоциты в результате перекисного окисления липидов, протеолипидов, белков клеточных структур и даже нуклеиновых кислот. Запускается процесс нарушения липидного слоя клеточных мембран эпителия верхних отделов респираторного тракта и легких, его сурфактантного слоя, нарушаются матричные и барьерные свойства внутриклеточных мембран, увеличивается их проницаемость и развивается дезорганизация жизнедеятельности клетки вплоть до ее гибели. С активностью генераций свободных радикалов связаны в основном мутагенез, протеолитическая активность и цитопатический эффект вирусной инфекции.
Разрушительному действию свободных радикалов и перекисных соединений препятствует сложная многокомпонентная буферная противоокислительная система антиоксидантной защиты (АОЗ). Она снижает скорость их образования, прерывает цепные реакции, уменьшает концентрацию продуктов их трансформации, тем самым предотвращая развитие болезни. Чрезмерная активация свободнорадикальных процессов может привести к истощению АОЗ, что неизбежно отразится на развитии инфекционного процесса.
Одномоментно или последовательно относительно этих процессов наблюдается значительный выброс иммунокомпетентными клетками широкого спектра провоспалительных цитокинов (интерлейкинов IL-1β, IL-6, IL-8, фактора некроза опухоли α), направленных на инактивацию и ликвидацию возбудителя. В значительной степени в реализации стресс-реакции принимает участие IL-1β, индуцирующий острофазовые реакции — лихорадку, лейкоцитоз, продукцию и секрецию острофазных белков, экспрессию интегринов, хемотаксис гранулоцитов.
При недостаточном образовании их антагонистов (IL-4, IL-10, IL-13) развивается цитокиновый взрыв, являющийся пусковым механизмом развития синдрома системной воспалительной реакции с риском формирования синдрома полиорганной недостаточности (заключительного этапа тяжелых инфекционных процессов), преимущественно имеющего место при гриппе.
При проникновении вируса клетка начинает активно продуцировать интерфероны (ИНФ-α, -β, -γ). Попадая в кровь и межклеточную жидкость, ИНФ связываются с рецепторами зараженных или поврежденных клеток и запускают сложный каскад реакций с образованием специфических белков. В результате клетка перестает воспроизводить вирусные частицы, расщепляет их генетическую структуру, а поверхность ее становится менее проницаемой для вирусов. На начальном этапе инфицирования адекватный уровень ИНФ может прервать репликацию вирусов и остановить развитие инфекционного процесса. ИНФ также стимулируют активность гуморального иммунитета [6].
ИНФ, обладая широким спектром антивирусной активности, как и естественные киллеры, нарушают любой из этапов репродукции вирусов, оказывают антипролиферативное, иммуномодулирующее (раннее иммуностимулирующее — ИФН-α, -β и позднее иммуносупрессирующее — ИФН-γ) действие. Установлено, что при тяжелых острых респираторных инфекциях продукция ИНФ повышается с повышением активности процессов перекисного окисления липидов и одновременно угнетаются интерфероногенез и продукция естественных киллеров. Недостаточность системы ИНФ приводит к манифестации респираторной вирусной инфекции и развитию клинических проявлений патологического процесса, требующего медикаментозного лечения.
В исследованиях последних лет показана роль толл-рецепторов (TLR) в противовирусной защите организма. TLR экспрессированы на моноцитах, макрофагах, нейтрофилах, NK-клетках и, в меньшей степени, эозинофилах, Т- и В-лимфоцитах. Предполагают, что дефекты TLR могут являться одной из причин развития тяжелой формы и летального исхода при многих вирусных инфекциях [7].
Клиническая картина гриппа характеризуется острым началом заболевания, интоксикационным синдромом (озноб, повышение температуры от субфебрильной до гиперпиретической, головная боль, боль в мышцах и при движении глазных яблок, инъекция сосудов склер, выраженная слабость), который, как правило, опережает катаральные проявления. Для гриппа в первые сутки заболевания характерен сухой катар (отечность слизистой носа, затрудненное носовое дыхание, без выделений из носа, сухость, першение в горле, гиперемия зева, сухой кашель). К концу первых суток от начала заболевания появляются слизистые выделения из носа, усиливается кашель, появляется осиплость голоса. При отсутствии осложнений, интоксикационный синдром длится до 5 сут, катаральные проявления могут сохраняться до 7–10 сут от начала заболевания.
Наиболее часто встречающиеся осложнения гриппа — это пневмония, бронхит, синусит, отит и т. д. Осложненное течение гриппа чаще встречается при хронических заболеваниях дыхательной (бронхиальная астма, хроническая обструктивная болезнь легких — ХОБЛ) и сердечно-сосудистой систем. Осложненное или тяжелое течение гриппа встречается также у людей молодого возраста, не имеющих в анамнезе хронической патологии [15].
Клиническая эффективность энисамия йодида
Клиническое наблюдение
Заключение
Только для зарегистрированных пользователей
Источник
Этиотропная терапия острых респираторных инфекций бактериальной этиологии
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
В статье рассмотрены аспекты этиотропной терапии острых респираторных инфекций бактериальной этиологии у детей
Для цитирования. Зверева Н.Н. Этиотропная терапия острых респираторных инфекций бактериальной этиологии // РМЖ. 2015. No 22. С. 1322–1327.
ГБОУ ВПО «РНИМУ им. Н.И. Пирогова» Минздрава России
Острые респираторные инфекции (ОРИ) продолжают оставаться серьезной проблемой для здравоохранения в связи с их широкой распространенностью. В России, несмотря на достижения современной медицины, болезни органов дыхания у детей занимают 3-е место в структуре причин смерти после внешних причин и пороков развития [4]. ОРИ – это этиологически разнородная группа инфекционных болезней дыхательных путей, имеющих сходные эпидемиологические и клинические характеристики. Выделяют острые заболевания верхних дыхательных путей – воспаление слизистых оболочек (СО), расположенных выше голосовых связок (ринит, синусит, фарингит, тонзиллит, отит), и острые заболевания нижних дыхательных путей – поражение дыхательного тракта ниже голосовых связок (ларингит, трахеит, бронхит, пневмония). ОРИ могут вызываться как вирусами, так и пневмотропными бактериями.
Основными возбудителями ОРИ у детей являются вирусы, имеющие тропность к определенным отделам дыхательного тракта. Вирусные инфекции нарушают деятельность цилиарного аппарата, создавая тем самым условия для попадания микробной флоры в дыхательные пути с развитием в них воспалительного процесса. Бактериальные агенты могут колонизировать различные отделы дыхательных путей и без помощи вирусов. При развитии бактериальной ОРИ вне больницы у ребенка, не получавшего в течение 1 мес. до заболевания антибиотиков, наиболее вероятна этиологическая роль условно-патогенных пневмотропных возбудителей, чувствительных к препаратам первого выбора. Внутрибольничная инфекция часто вызывается устойчивой флорой, характер которой во многом зависит от «антибактериального анамнеза» ребенка [7]. Своевременная диагностика и рациональная терапия инфекций дыхательных путей бактериальной этиологии могут значительно улучшить прогноз данных заболеваний.
Синуситы
Синусит (от лат. sinus – пазуха) – острое или хроническое воспаление придаточных пазух носа. Наиболее часто регистрируется воспаление СО верхнечелюстной (гайморовой) пазухи – гайморит, на 2-м месте по частоте встречаемости стоит этмоидит – воспаление решетчатого лабиринта, затем фронтит – воспаление лобной пазухи и сфеноидит – воспаление клиновидной пазухи (рис. 1). Заболевание может быть одно- или двусторонним, с вовлечением в процесс одной пазухи или поражением всех придаточных пазух носа с одной (гемисинусит) или обеих сторон (пансинусит) [15].
По характеру течения различают острый и хронический синусит, по происхождению синуситы могут быть риногенными, одонтогенными, нозокомиальными, грибковыми.
Бактериальный синусит чаще всего вызывают Haemophilus (H.) influenzaе, Streptococcus (S.) pneumoniae, реже Moraxella (M.) catarrhalis, стрептококки, стафилококки. Изменения в придаточных пазухах носа в первые 2 нед. острой респираторной вирусной инфекции (ОРВИ) требуют лишь симптоматической терапии. Сохранение затруднения носового дыхания на фоне лихорадки через 10–14 дней после начала ОРВИ, а также головная боль, болезненность в точках выхода V пары черепных нервов, выявление при риноскопии гноя в общих и средних носовых ходах, затемнение пазух или утолщение СО на рентгенограмме позволяют диагностировать бактериальный (негнойный) синусит. Для клинической картины острого гнойного синусита характерны острое развитие лихорадки, симптомы интоксикации, гиперемия и отек тканей орбиты и щеки [3, 8].
При бактериальном (негнойном) синусите следует назначить курс антибактериальной терапии: внутрь амоксициллин, амоксициллин/клавулановую кислоту, цефуроксим или азитромицин (при непереносимости β–лактамов). Отсутствие эффекта в течение 3-х дней от начала противомикробной терапии является показанием к смене терапии на антибиотик, активный против пенициллин-резистентных S. pneumoniae и штаммов H. influenzae, продуцирующих β-лактамазы (фермент, расщепляющий β-лактамное кольцо антибиотиков, относящихся к группе пенициллинов и цефалоспоринов). Гнойный синусит требует проведения неотложной антибактериальной терапии: парентерально цефтриаксон, оксациллин, цефазолин. При отсутствии эффекта – ванкомицин, оперативное вмешательство [3, 8].
Отиты
Острый средний отит – наиболее частое осложнение ОРИ. Для клинической картины отита характерны повышение температуры тела, беспокойство ребенка, жалобы на боль в ухе. Для подтверждения диагноза необходимо проведение отоскопии.
Основными возбудителями острого среднего отита являются S. pneumoniae и нетипируемые штаммы H. influenzae, реже – M. сatarrhalis, еще реже S. pyogenes, Staph. аureus, могут быть ассоциации перечисленных микроорганизмов. При этом более 34% штаммов H. influenzae и 70% M. catarrhalis продуцируют β-лактамазу [16]. Острый средний отит – показание для назначения антибактериальной терапии (табл. 1).
Тонзиллиты
Тонзиллит – воспаление небных миндалин. Из бактериальных возбудителей основным является S. рyogenes, а если точнее, то β-гемолитический стрептококк группы А (БГСА). Заболевание начинается обычно остро – с повышения температуры тела, болей в горле, появления гиперемии СО ротоглотки и налета на миндалинах, увеличения и болезненности регионарных лимфоузлов. Обострения хронического тонзиллита могут быть связаны как с активацией микробной флоры (стрептококки групп А, С, G), так и с вирусной инфекцией. Для постановки диагноза хронического тонзиллита необходимо наличие 3-х из 4-х приведенных ниже симптомов [3]:
– гнойные фолликулы или детрит в ретротонзиллярных карманах вне обострения;
– рубцовое изменение миндалин, их сращение с дужками;
– стойкое увеличение лимфоузла вне обострения;
– частые обострения.
Диагноз инфекции, вызванной БГСА, следует подтверждать результатами посева мазка из зева или экспресс-тестом на стрептококковый антиген, а также определением уровня антистрептолизина-О в крови. При отсутствии возможности провести данные исследования диагноз ставится клинически. Для клинического анализа крови характерно наличие нейтрофильного лейкоцитоза при отсутствии атипичных мононуклеаров.
Антибактериальная терапия БГСА-тонзиллитов проводится обязательно. Длительность приема антибиотиков составляет не менее 7–10 дней. Помимо устранения острых проявлений и предотвращения нагноений необходима эрадикация БГСА как условие профилактики ревматизма. Препаратами выбора для лечения БГСА-тонзиллита служат пенициллины, цефалоспорины, макролиды.
Пневмонии
По данным Всемирной организации здравоохранения (ВОЗ), в 2013 г. от пневмонии умерло около 1 млн детей в возрасте до 5 лет [1].
Признаки острого поражения нижних дыхательных путей: лихорадка, учащенное и/или затрудненное дыхание, втяжение грудной клетки, укорочение перкуторного звука (схема 1).
Повышение температуры тела у ребенка с кашлем (особенно в ночное время) и хрипами в легких в первую очередь требует исключения пневмонии. Для пневмонии характерно повышение температуры тела до фебрильных цифр, за исключением атипичных форм в первом полугодии жизни. Влажный (реже сухой) кашель также является постоянным признаком пневмонии. Что касается физикальных данных, то пневмония маловероятна при наличии только сухих и разнокалиберных влажных хрипов, которые равномерно выслушиваются с обеих сторон. Подобная аускультативная картина в легких типична для диффузного поражения бронхиального дерева при бронхитах. Для пневмонии характерны локализация хрипов над определенным участком легкого, а также выявление жесткого или ослабленного дыхания, укорочение перкуторного звука в области скопления хрипов [3].
По условиям инфицирования пневмонии подразделяют на вне- и внутрибольничные, а у новорожденных – на внутриутробные и приобретенные. Пневмонии у детей, находящихся на искусственной вентиляции легких (ИВЛ), делят на ранние (первые 72 ч ИВЛ) и поздние (4 сут и более ИВЛ). Выделяют также пневмонии у лиц с иммунодефицитными состояниями [7].
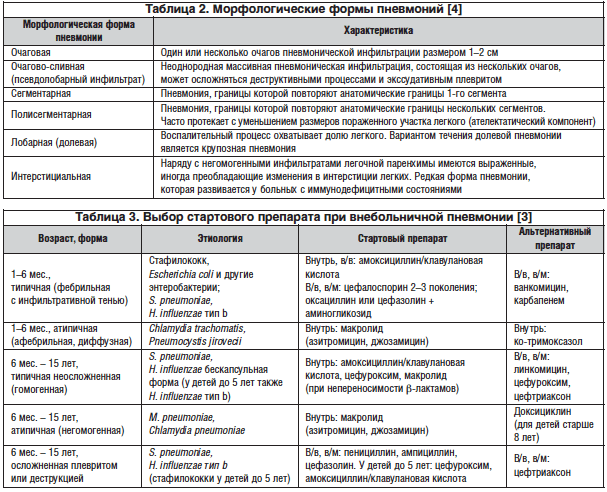
На основании клинико-рентгенологических данных выделяют очаговую, очагово-сливную, сегментарную, долевую и интерстициальную пневмонии (табл. 2).
К основным осложнениям пневмоний относятся: плеврит, легочная деструкция, инфекционно-токсический шок.
При рациональной терапии большинство неосложненных пневмоний рассасывается через 2–4 нед. Этиология пневмоний у больных разного возраста отличается, что следует учитывать при выборе противомикробных средств (табл. 3).
При лечении неосложненных нетяжелых пневмоний предпочтительно назначение оральных форм антибактериальных препаратов. Если терапию начинают с парентерального введения антибиотиков, то после нормализации температуры тела следует перейти на оральный препарат. При отсутствии клинического эффекта в течение 36–48 ч от начала противомикробной терапии при нетяжелой и 72 ч при тяжелой пневмонии, а также при развитии нежелательных побочных эффектов необходимо перейти на альтернативные препараты [3].
Побочные эффекты противомикробных средств
Открытие А. Флемингом пенициллина изменило мир современной медицины. Благодаря этому открытию были спасены миллионы человеческих жизней. В то же время необходимо помнить о тех нежелательных побочных эффектах, к которым может привести бесконтрольное и нерациональное использование антибиотиков. Назначая противомикробное средство, врач должен знать все возможные его побочные эффекты и состояния, при которых данный препарат следует применять с осторожностью.
Помимо риска развития побочных эффектов установлено влияние антибиотиков на иммунную систему ребенка, что особенно выражено в период новорожденности. Дети первых месяцев жизни дают преимущественно иммунный ответ Т-хелпер-2-типа, что объясняет у них большую частоту аллергических реакций. Созревание иммунной системы ребенка с развитием преимущественно ответа Т-хелпер-1-типа происходит под влиянием в первую очередь микробных воздействий. Подавление размножения эндогенной микрофлоры антибиотиками, применяемыми нерационально, может способствовать замедлению созревания ответа Т-хелпер-1-типа, что в свою очередь повышает риск развития у ребенка астмы [3].
Проблема резистентности
Проблема устойчивости микроорганизмов к противомикробным препаратам в настоящее время актуальна как никогда. Недвусмысленно об этом говорит помощник генерального директора ВОЗ по безопасности здравоохранения доктор К. Фукуда: «В связи с отсутствием оперативных и согласованных действий многих заинтересованных сторон наш мир вступает в эпоху, когда антибиотики теряют эффективность, и обычные инфекции и небольшие травмы, которые можно было излечивать в течение многих десятилетий, сейчас могут снова убивать» [6]. Устойчивость к антибиотикам приводит к увеличению длительности заболевания, повышает вероятность смертельного исхода. Так, например, вероятность смерти людей, инфицированных MRSA (метициллин-устойчивые бактерии Staphylococcus aureus), на 64% выше по сравнению с таковой у людей с лекарственно-чувствительной формой инфекции. Устойчивость также приводит к увеличению расходов на медицинскую помощь в результате более длительного пребывания в стационарах и предполагает необходимость более интенсивного лечения [19].
В России циркулируют чувствительные к β-лактамам штаммы S. pneumoniae (89% к пенициллину, 99% к амоксициллину, цефтриаксону). В то же время много штаммов со сниженной чувствительностью циркулирует в детских дошкольных учреждениях, особенно в детских домах. Достаточно высокая чувствительность S. pneumoniae сохраняется и к макролидам (92% у азитромицина, 96% у джозамицина), однако в ряде городов 10% штаммов S. pneumoniae нечувствительны к азитромицину, эритромицину и другим 14-членным макролидам. S. pneumoniae полностью резистентны к аминогликозидам, что не допускает их использования в качестве монотерапии респираторных инфекций. H. influenzae в 95% чувствительна к амоксициллину и в 100% случаев – к амоксициллину/клавуланату и цефалоспоринам 3–4 поколений. Данный возбудитель также чувствителен к аминогликозидам, хлорамфениколу, тетрациклинам и рифампицину, но устойчив к ко-тримоксазолу (>30%). Большинство внебольничных стафилококков продуцируют β-лактамазу, но сохраняют чувствительность к метициллину, оксациллину, амоксициллину/клавуланату, линкомицину, цефалоспоринам (в основном 1 поколения), аминогликозидам и рифампицину. При внутрибольничных инфекциях значительная часть стафилококков чувствительна к ванкомицину и резистентна к метициллину. Микоплазмы и хламидии высокочувствительны к макролидам, тетрациклинам и фторхинолонам [8].
В борьбе между людьми и патогенными микроорганизмами неусыпная бдительность – цена выживания. К сожалению, пока микроорганизмы опережают нас в этой борьбе: скорость формирования устойчивости микроорганизмов во много раз превышает скорость открытия и регистрации новых антибактериальных препаратов [9]. В этой «гонке вооружений» человек в борьбе с бактериями может использовать их древнейших природных врагов – бактериофаги, т. к. к ним микробы резистентность не вырабатывают.
Бактериофаготерапия
Бактериофаги – это вирусы, избирательно поражающие бактерии. Бактериофаги – высокоэффективные иммунобиологические препараты антимикробного действия, антибактериальный эффект которых основан на внедрении генома фага в бактериальную клетку с последующим его размножением и лизисом инфицированной клетки. Вышедшие во внешнюю среду в результате лизиса бактериофаги повторно инфицируют и лизируют другие бактериальные клетки, действуя до полного уничтожения патогенных бактерий в очаге воспаления [13, 14].
История применения фагов началась задолго до открытия антибиотиков. В конце XIX в. известный российский микробиолог Н.Ф. Гамалея сообщил о лизисе возбудителя сибирской язвы неизвестным перевиваемым агентом [18]. В начале XX в. независимо друг от друга английский бактериолог Ф. Туорт и французский микробиолог Ф. Д’Эррель сообщили об открытии бактериофагов – фильтрующихся, передающихся агентов разрушения бактериальных клеток [23]. Открытие пенициллина и других антибиотиков в 1940-х гг. привело к некоторому снижению интереса к изучению возможностей бактериофагов. Однако уже в 1980-е гг. многочисленные побочные эффекты антибиотиков, развитие резистентности микроорганизмов к антибактериальным препаратам привели к новым исследованиям в области фаготерапии в России, Грузии, Польше, Франции, Германии, Финляндии, Канаде, США, Великобритании, Израиле, Австралии и других странах [23]. Фаготерапия имеет несколько важных преимуществ по сравнению с традиционной антимикробной терапией. Бактериофаги являются естественными природными средствами, которые не могут длительно циркулировать в организме человека. Они остаются в нас до тех пор, пока не уничтожат микробы-субстраты, после чего выводятся из организма. Фаги крайне точны и нападают только на конкретный штамм бактерий [18]. Учитывая современные достижения диагностических технологий (метод полимеразной цепной реакции и др.), достаточно быстро можно установить этиологию инфекционного заболевания, что значительно облегчает выбор соответствующих фагов. При этом в процессе терапии сообщества полезных бактерий в организме затронуты не будут. В этом свете фаготерапия представляет собой своего рода биомедицинскую «умную бомбу», поражающую определенную цель при минимальном сопутствующем ущербе [10, 12, 13].
Бактериофаги выпускают в жидком виде, таблетированных формах. Их можно использовать в виде аппликаций, орошений, путем введения в полости носа, а также в дренированные полости, в т. ч. плевральную [14].
Вероятность развития побочных токсических и аллергических реакций при применении бактериофагов минимальна, что позволяет использовать их при лечении различных инфекционных заболеваний у детей начиная с рождения, беременных женщин и кормящих матерей. Следует отметить, что побочные реакции в результате употребления фагов обычно связаны с массивным распадом бактериальных клеток под действием бактериофага и выделением эндотоксина. Нивелировать данные нежелательные явления можно при помощи включения в комплекс терапии энтеросорбентов [14].
Бактериофаги эффективны в монотерапии, но могут быть также использованы и в комбинации с антибиотиками. При использовании фагов в сочетании с терапевтическими дозами антибиотиков отмечается взаимное потенцирование их терапевтического эффекта. Установлено, что воздействие фагов на антибиотикоустойчивые штаммы бактерий может быть более активным по сравнению с воздействием на антибиотикочувствительные штаммы того же вида [18, 23].
Особенно эффективна фаготерапия при лечении хронических воспалительных состояний на фоне иммунодепрессивных состояний, т. к. использование бактериофагов стимулирует активизацию факторов специфического и неспецифического иммунитета (табл. 4) [14].
Может быть предложена следующая схема бактериофаготерапии: до определения фагочувствительности возбудителя назначается поливалентный пиобактериофаг, обладающий активностью в отношении основных возбудителей бактериальных инфекций. Далее, при обнаружении монокультур патогенных бактерий, проводится коррекция терапии (например, стафилококковый бактериофаг и др.).
Одним из комбинированных препаратов является Секстафаг® (пиобактериофаг поливалентный жидкий), производимый ФГУП НПО «Микроген» Минздрава России. Стоит отметить, что препараты производства НПО «Микроген» – единственные препараты бактериофагов, зарегистрированные на территории РФ как лекарственные препараты.
Пиобактериофаг поливалентный (Секстафаг®) обладает широким спектром действия и может применяться при заболеваниях, вызванных стафилококками, стрептококками, энтерококками, протеем, синегнойной и кишечной палочками. Помимо антибактериальных свойств данный препарат обладает иммуностимулирующим действием. Показаниями к применению поливалентного пиобактериофага в педиатрии служат: синуситы, отиты, фарингиты, тонзиллиты, ларингиты, трахеиты, бронхиты, пневмонии.
По данным исследований, фаготерапия безопасна и эффективна при лечении хронических лекарственно-устойчивых инфекций уха [11]. При лечении риносинуситов пиобактериофагом путем его местного введения в пазухи было отмечено значительное улучшение состояния больных, нормализовались показатели завершенности фагоцитоза, что указывало на снижение интенсивности воспаления с восстановлением адекватного иммунного ответа СО носа [17, 18]. Хорошие результаты были получены и при введении местного бактериофага в комплекс терапии хронического аденоидита [20]. В результате монотерапии специфическим бактериофагом больных с хроническим тонзиллитом отмечались клиническое улучшение и уменьшение высеваемости Staph. aureus со СО миндалин [21]. Использование в комплексном лечении хронического ларингита специфического бактериофага в виде инстилляций в гортань, а в случае тяжелого обострения – путем приема внутрь позволило существенно сократить продолжительность лечения, достичь более длительной ремиссии болезни и снизить частоту обострений [22]. Применение небулайзеротерапии бактериофагами (Балянова Е.Г., 2003) в комплексном лечении острых и хронических обструктивных бронхолегочных заболеваний показало высокую клиническую эффективность данных препаратов, позволило сократить сроки лечения антибиотиками. Путем ингаляций вводили моно- или поливалентные бактериофаги, в т. ч. пиобактериофаг, детям в возрасте от 14 дней до 3 лет с тяжелыми гнойно-воспалительными заболеваниями бронхолегочной системы с наличием в мокроте синегнойной и кишечной палочек, клебсиеллы, энтерококка, стафилококка [18].
Лекарственные препараты бактериофагов могут стать хорошей альтернативой для пациентов, имеющих противопоказания к приему антибактериальных препаратов (аллергии, дисбиозы, антибиотикоассоциированные диареи, антибиотикорезистентность, новорожденные). В связи с этим необходимо дальнейшее изучение возможностей бактериофаготерапии как одного из интересных и перспективных направлений борьбы человечества с инфекциями.
Источник