- Простатит: какие меры необходимо предпринять
- Маленькая железа большого страха
- Структура статьи
- Миф первый. Аденома предстательной железы — удел каждого второго мужчины старше 50-ти лет
- Миф второй. Аденома – следствие снижения половой активности.
- Миф третий. Аденома – это предраковое состояние.
- Миф четвертый. Аденома рассасывается.
- Миф пятый. После удаления аденомы предстательной железы можно забыть об интимной жизни.
- Клинический случай нефропатии обусловленной приемом репешка обыкновенного (agrimonia eupatoria)
Простатит: какие меры необходимо предпринять
Oзнакомиться с услугами по этому направлению
Предстательная железа не только создает приятное ощущение оргазма, но и участвует в процессе регуляции тестостерона. Однако главная ее задача – это выработка простатической жидкости, являющейся основой для спермы. Поэтому проблемы с простатой нужно решать не откладывая.
Причины возникновения простатита могут быть самыми разными. Это и болезнетворные бактерии – стрептококки, стафилококки,- и хламидии, которые попадают в предстательную железу чаще всего восходящим путем по мочеиспускательному каналу. Или венозный застой, являющийся следствием частых и привычных запоров. Среди причин, вызывающих болезнь, врачи выделяют еще геморрой, общее переохлаждение, наличие хронических инфекционных очагов на корнях зубов или в миндалинах.
Большое значение в появлении простатита имеет условно патогенная микрофлора организма. Эти бактерии у обычного человека не вызывают абсолютно никаких болезненных признаков, мирно существуя долгое время. Патогенность микробов проявляется только в тех случаях, когда иммунные силы организма истощены, и он не способен оказать стойкое сопротивление.
Частая причина возникновения простатита – не налаженная половая жизнь. И здесь не столько важно наличие постоянного партнера, сколько регулярность. Редкий, от случая к случаю, или слишком активный «интим» может способствовать появлению простатита.
Основные симптомы заболевания – это боли в области крестца, ануса, напоминающие геморроидальные, и половые расстройства.
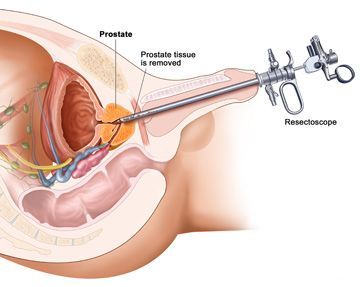
При обращении к врачу урологу-андрологу нужно быть готовым к неожиданным и неприличным вопросам. Более того, необходимо настроиться на пальцевое исследование предстательной железы и трансректальное УЗИ, проводимое внутриполостным датчиком, введенным в прямую кишку. Это неприятные моменты, но они необходимы для точной диагностики и выявления наиболее болезненных уплотнений простаты.
Эффективное лечение хронического простатита включает в себя обширный комплекс лекарств, которые нужно принимать одновременно.
При лечении простатита показано употребление трав с мощным уросептическим действием и мочегонным эффектом: толокнянка, брусника, можжевельник, пижма, полевой хвощ и золотарник. Еще одна группа полезных лекарственных трав – противовоспалительные: конопля посевная, ромашка, лабазник вязолистный, почки черного тополя. А кипрей узколистный, известный еще как иван-чай, благотворно влияет на потенцию, улучшает эрекцию.
Траволечение простатита, в первую очередь, ориентировано на полное восстановление половой функции и продвижение неизбежно к лечению болезни. И здесь очень хорошо помогают природные адаптогены: элеутерококк, большеголовник и женьшень. Заметное улучшение циркуляции крови в железе и ликвидации застойных явлений обеспечивает прием настоев из цветков каштана и льнянки обыкновенной. Для того чтобы избавиться от застойных явлений в предстательной железе, также важно восстановить регулярный стул и избавиться от запоров.
Учитывая разностороннее действие лекарственных трав, можно составить лечебный курс фитотерапии. Хороший лечебный эффект дает сборследующих трав: в равных частях смешиваются цветки каштана, листья кипрея, тысячелистник, фиалка и почки черного тополя. 1 столовая ложка сбора заливается стаканом горячей воды и прогревается на водяной бане 15 минут. Пить остывший настой нужно по схеме: одна треть стакана три раза в сутки. Одновременно на ночь нужно делать клизму с отваром календулы или ромашки. Такого лечебного курса нужно придерживаться в течение двух месяцев с двухнедельным перерывом.
Однако при лечении уповать только на фитотерапию не стоит. Ее эффект проявится при соблюдении комплексного подхода, включающего антибиотики, витамины и противовоспалительные препараты, которые вам сможет прописать только опытный уролог.
Источник
Маленькая железа большого страха
Структура статьи
Миф первый. Аденома предстательной железы — удел каждого второго мужчины старше 50-ти лет
На самом деле, статистика заболеваемости выглядит иначе. После 50 лет аденома предстательной железы встречается у 20-25% мужчин. Правда, с годами процент страдающих этим заболеванием увеличивается, к 60-тилетнему возрасту достигая 50%. Что вполне объяснимо: в стареющем организме возникает целая цепочка возрастных (в том числе и гормональных) изменений, в результате которых происходит увеличение предстательной железы.
Однако болезнью этот естественный, в общем-то, процесс считается лишь тогда, когда увеличившаяся в размерах железа, расположенная между мочевым пузырем и мочеиспускательным каналом, начинает нарушать его опорожнение, сдавливая его и без того узкое отверстие. При этом клинические проявления болезни (а она может развиваться годами и даже десятилетиями) зависят не только от размеров, но и от локализации опухоли, которая долгое время может никак себя не проявлять.
Миф второй. Аденома – следствие снижения половой активности.
Вопреки этому, довольно распространенному мнению, качество интимной жизни на заболеваемость аденомой предстательной железы сильно не влияет. Чего нельзя сказать о других, предрасполагающих к болезни факторах, таких, как застой крови в малом тазу (в немалой степени этому способствует ограничение двигательной активности), а также переохлаждение и алкоголь, которые провоцируют отек простаты.
Миф третий. Аденома – это предраковое состояние.
Ничего общего с раком аденома, которая является доброкачественной гиперплазией (опухолью) предстательной железы, не имеет. Это два различных заболевания. Другое дело, что их симптомы во многом схожи. В первую очередь – это нарушение мочеиспускания, которое выражается в частых позывах, с монотонным постоянством приключающихся в ночное время.
Конечный период заболевания печален: мочевой пузырь настолько перекрывается опухолью, что перестает опорожняться совсем. А посему, если вы чувствуете, что ваш мочевой пузырь опорожняется не полностью, если мочитесь с перерывами в несколько минут, если напор вашей струи слабый, двух мнений быть не может. Скорее к врачу! В противном случае, вы рискуете заработать осложнение, чреватое острой задержкой мочеиспускания и срочной установкой специальной цистостомической дренажной трубки, с которой придется ходить несколько недель, а то и месяцев, чтобы разгрузить мочевой пузырь и почки. Которые также страдают. Образование камей в мочевом пузыре, пиелонефрит, почечная недостаточность – частые спутники запущенных форм аденомы.
Еще страшнее пропустить рак предстательной железы – заболеваемость, которым в последнее время вышла на первое место среди онкологических заболеваний в мужской популяции. Чтобы грозный диагноз исключить, помимо УЗИ и пальцевого исследования предстательной железы, необходимо сдать анализ на уровень специфического простатического антигена (ПСА) в крови – главного маркера злокачественного заболевания простаты.
Миф четвертый. Аденома рассасывается.
- Стоимость: 125 000 — 165 000 руб.
- Продолжительность: 40 — 90 минут
- Госпитализация: 3-4 дня в стационаре
Увы. На сегодняшний день нет ни одного препарата, который бы полностью излечивал эту доброкачественную опухоль. Но есть лекарства (в том числе – растительного происхождения), которые снижают спазм и отек предстательной железы, а значит — и неприятные симптомы заболевания. Иногда – на довольно продолжительное время.
В некоторых случаях на помощь приходят и такие неоперационные методы лечения, как СВЧ-гипертермия, во время которой предстательная железа нагревается до 70 градусов, благодаря чему разросшиеся железистые клетки простаты уменьшаются. Но подобная процедура показана далеко не всем и эффективна лишь на начальных стадиях заболевания.
- Стоимость: 100 000 — 180 000 руб.
- Продолжительность: 30-60 минут
- Госпитализация: 2-3 дня в стационаре
Миф пятый. После удаления аденомы предстательной железы можно забыть об интимной жизни.
И это не так. После операции (открытой и щадящей) у 90% пациентов половая функция восстанавливается в полном объеме. Проблемы могут возникнуть лишь с зачатием, поскольку у 30% перенесших операцию по удалению аденомы, развивается так называемая ретроградная эякуляция, когда семяизвержение происходит не наружу, а в мочевой пузырь. Но и эта беда поправима. Если мужчина мечтает о наследнике, на помощь приходит другое изобретение медицины – экстракорпоральное оплодотворение. Только в данном случае процессу искусственного зачатия предшествует довольно сложная процедура – специальное центрифугирование мочи, позволяющее отделить сперму. И уже затем ее водят женщине. Конечно, приятного в этом мало. Но мужчины не ропщут: жить с постоянной оглядкой на туалет или с трубкой в мочевом пузыре намного хуже.
Подготовила Татьяна ГУРЬЯНОВА
АиФ-Здоровье от 30. 07. 2009 г.
Источник
Клинический случай нефропатии обусловленной приемом репешка обыкновенного (agrimonia eupatoria)
Батюшин М.М. 1 , Садовничая Н.А. 1 , Руденко Л.И. 1 , Повилайтите П.Э. 2
1 Кафедра внутренних болезней с основами физиотерапии №2, Нефрологическое отделение ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону
2 Ростовское областное патологоанатомическое бюро Министерства здравоохранения Ростовской области, г.Ростов-на-Дону
Адрес: 344022, г. Ростов-на-Дону, пер. Нахичеванский, 29, тел. (863)2014423 Эл.почта: batjushin-m@rambler.ru, sadovnichaya@list.ru, nephr-roon@rambler.ru
За прошедшее десятилетие отмечен значительный рост популярности «нетрадиционной медицины». Это объясняется такими факторами, как неудовлетворенность методами и эффективностью ранее проводимого лечения, бесконтрольным использованием информации о неблагоприятных побочных действиях фармацевтических препаратов, ростом цен на фармакопейные лекарственные средства и низким уровнем общей культуры населения. В отношении использования сбора лекарственных растений в литературе имеются указания на ограничения их применения, так как их прием при определенных заболеваниях может вызывать нежелательные побочные эффекты. В Европе, США и Канаде постоянно увеличивается доля населения, регулярно использующего фитотерапевтические средства и биологически активные добавки, в странах Азии и Африки более 30% всех случаев острого почечного повреждения развивается как осложнение лечения растительными препаратами [1, 2]. По данным исследования импортированных патентованных азиатских аюрведических растительных продуктов в Калифорнии, было установлено, что 32% из них содержали не декларированные фармацевтические средства и тяжелые металлы (свинец, ртуть, кадмий, мышьяк). Среди не декларированных веществ наиболее часто встречаются: эфедрин, хлорфениламин, колхицин, метилтестостерон, глюкокортикостероиды, нестероидные противовоспалительные препараты [3, 4, 5, 6, 7, 8]. Сегодня в Европе зарегистрировано более 100 препаратов, содержащих растительные флавоноиды. Они обладают антиоксидантной активностью и применяются в основном в лечении нарушений периферического кровообращения.
Потенциальное значение этой проблемы чрезвычайно велико, в частности остается неясной степень взаимодействия фармацевтического препарата с травами и растительными продуктами [9, 10]. Неконтролируемый прием лекарственных трав может превышать потенциальный положительный эффект, особенно среди лиц с заболеваниями почек [11, 12, 13, 14], что связано с непосредственным воздействием растительных препаратов на клетки канальцев и их активной реабсорбцией с достижением высокой концентрации в мозговом слое. Результатом такого воздействия на почки является острое канальцевое повреждение, папиллярный некроз, острый и хронический интерстициальный нефрит, синдром Фанкони, нефролитиаз, артериальная гипертензия, рабдомиолиз [15, 16].
К фитотоксинам, обладающим прямым нефротропным действием относят аристохолиевую кислоту, сапонины, метилсалицилат, флавоноиды, ореллаин, алкалоиды эфедры, охратоксин [17]. На территории России наиболее часто с целью лечения и профилактики заболеваний почек применяются такие лекарственные травы как: пижма, барбарис, берѐза, бессмертник песчаный, брусника, бузина, календула, кукуруза (рыльца), можжевельник, толокнянка, хвощ, шиповник, репешок обыкновенный (Argimonia Eupatoria), а также марена красильная грузинская (Rubia tinctorum var. iberica), дикорастущая трава.
Репешок обыкновенный (Argimonia Eupatoria) – многолетнее травянистое растение, широко распространенное в европейской части России, на территории Западной и Восточной Сибири, Дальнего Востока [18]. В народной и традиционной медицине все части растения применяются при широком спектре заболеваний в качестве желчегонного, противовоспалительного, антиаритмического, гипогликемического, антигельминтного, анальгетического, гемостатического, антигипертонического, антитоксического и антиканцерогенного средства. В европейских странах некоторые виды Agrimonia являются официальными лекарственными растениями и используются в практической медицине как вяжущее, противовоспалительное средство [19]. При проведении биохимического анализа структуры растения в надземной части A.Eupatoria обнаружены вещества фенольной природы (филавоноиды, дубильные вещества, кумарины, изокумарины, оксикоричные кислоты), тритерпеноиды, эфирное масло, полисахариды и др., а в подземных органах растения обнаружены медь, цинк, железо, ванадий, никель, хром, титан, марганец, стронций, цирконий, серебро [20].
Токсические эффекты А. Eupatoria в большей степени связаны не со специфическими токсикантами, а с наличием в нем большого количества гликозидов кумарина и его метаболитами. В 1994 г. на основании углубленного анализа токсикологических исследований экспертами Европейского Совета сделаны рекомендации о снижении допустимого уровня содержания кумарина в продуктах питания до 0,5 мг/кг вследствие его канцерогенного и мутагенного действия.
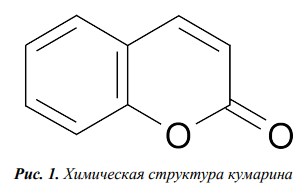
КУМАРИН (2-хроменон) имеет молекулярную массу 146,14 и представляет собой бесцветные кристаллы с запахом свежего сена и горьким вкусом (рисунок 1).
Рис. 1. Химическая структура кумарина
Сообщения о гепатотоксических эффектах для человека, развивающихся вследствие приема кумарин-содержащих лекарственных препаратов, часто противоречивые, вызвали значительный интерес исследователей к изучению его метаболизма и механизма токсического действия [20, 21].
Современные представления о метаболизме кумарина предполагают наличие двух основных путей трансформации данного соединения в организме млекопитающих. Первый этап трансформации кумарина реализуется по двум направлениям: в результате 7-гидроксилирования кумарина образуется малотоксичный 7-гидроксикумарин, элиминирующийся из организма млекопитающих с мочой; в процессе 3-гидроксилирования образуется 3-гидроксикумарин, промежуточным метаболитом в данном процессе является токсичный 3,4-эпоксид, подвергающийся дальнейшей трансформации с образованием о-гидроксифенилальдегида, окисляющегося до о-гидроксиэтанола и о-гидроксифенилуксусной кислоты. Рядом авторов было показано, что доминирование одного из двух направлений метаболизма кумарина в организме обусловливает межвидовые различия в проявлении гепатотоксических свойств данного соединения [22, 23]. Риск осложнений при приеме кумарина возрастает при сочетанном приеме НПВС, антикоагулянтов прямого и непрямого действия.
В экспериментальных работах [24, 25] установлено, что кумарин при однократном введении в больших дозах крысам вызывает центрилобуллярный некроз гепатоцитов. Это свидетельствует о том, что метаболизм кумарина [3-l4C] в данном случае проходил с образованием более токсичных метаболитов. Исследования in vitro показали, что химически активные [3-l4C]-кумариновые метаболиты, образующиеся при участии цитохром P450-зависимых энзимов, способны ковалентно связывать микросомальные протеины [26]. Было сделано предположение, что токсическим метаболитом в данном случае может выступать 3,4-эпоксид.
Нами представлен случай нефротоксического действия алкалоидов кумарина и его метаболитов при употреблении отваров и настоев Репешка обыкновенного.
Пациентка А. 43 лет, поступила в нефрологическое отделение клиники РостГМУ с жалобами на легкую ноющую боль в поясничной области с обеих сторон, усиливающуюся при физической нагрузке, пастозность голеней и стоп, периодически повышающееся артериальное давление до 220/140 мм рт. ст., не связанное с психоэмоциональными и/или физическими нагрузками, сопровождающееся головной болью и головокружением. Из анамнеза известно, что в 1990 году в течение всего периода первой беременности выявлялась протеинурия до 3,3 г/л, не сопровождающаяся отечным синдромом и артериальной гипертензией, в течение 5 лет после родов протеинурия сохранялась на уровне 0,5-1,0 г/л. В 1995 г. впервые зарегистрирован высокий уровень артериального давления (АД) – 150/100 мм рт. ст. Антигипертензивную терапию не получала, однако с 1999 г. артериальная гипертензия приобрела злокачественный характер, с повышением уровня системного АД до 200/120 мм рт. ст., по поводу чего в 2000 году проходила обследование в стационаре, где был поставлен диагноз гипертонической болезни II стадии, 3 степени, риск 3 (высокий), тогда же была подобрана антигипертензивная терапия, позволявшая контролировать АД на уровне 130-150/80-90 мм рт. ст., но пациентка данные рекомендации не соблюдала, а самостоятельно приобрела фитопрепарат (Репешок обыкновенный), отвар и настои которого, принимала более полугода непрерывно по несколько раз в сутки. В 2001 году, во время прохождения планового медицинского осмотра выявлен нефросклероз справа, дальнейшего наблюдения и лечения не проходила. В 2008 году при выполнении ультразвукового исследования почек выявлен конкремент правой сморщенной почки, по данным реносцинтиграфии функция правой почки отсутствует.
Помимо приема фитопрепаратов постоянно использует дипиридамол в дозе 75 мг/сутки, эналаприл 10 мг/сутки с 2001 года, в 2011 году уровень протеинурии составил 0,044 г/л, уровень артериального давления до 240/140 мм ртутного столба.
По данным клинико-лабораторного обследования в нефрологическом отделении клиники РостГМУ со стороны ОАК на себя обращали внимание ускорение СОЭ до 32 мм/час, признаки анемии легкой степени тяжести (эритроцитов 2,52х1012/л, гемоглобин 100 г/л), снижение количества тромбоцитов (75х103 /л), со стороны свертывающей системы крови по данным коагулограммы выявлены признаки гипокогуляции, характеризующиеся снижением АПТВ до 20 сек., протромбиновое время 10 сек., МНО 0,5, тромбиновое время 6 сек., фибриноген 1,98 г/л, со стороны биохимических показателей крови отмечалась гиперхолестеринемия до 10,79 мМ/л, гиперазотемия (креатинин крови 129 мкМ/л, мочевина 14,9 мМ/л), уровень АСТ достигал 68 Ед/л, АЛТ – 51 Ед/л. В ОАМ – протеинурия, характерная для нефритического синдрома (до 0,4 г/л). Снижение концентрационной функции почек, проявляющееся снижением СКФ до 45,5 мл/мин (по формуле MDRD), изостенурией (по данным пробы Фольгарда). Суточная протеинурия не превышала 0,495 г/сутки, по данным суточной экскреции солей с мочой отмечается высокая экскреция кальция до 9,73 мМ/сутки, и мочевой кислоты до 9,13 мМ/сутки. За все время наблюдения состояние пациентки оставалось стабильным, уровень АД в пределах 130-140/70-80 мм рт. ст., суточный диурез около 1500-1700 мл. По данным УЗИ почек отмечаются диффузные изменения паренхимы почек, уменьшение размеров, микролит правой почки.
Таким образом, клиническая картина болезни соответствовала аутоиммунному заболеванию почек, на что указывали наличие протеинурии, мочевой синдром, характеризующийся микрогематурией, снижением азотвыделительной функции почек, наличием артериальной гипертензии, тем не менее, нельзя было исключить наличие хронического повреждения канальцевого эпителия, преимущественно в проксимальных отделах, с нарушением реабсорбции, без формирования клиники острого канальцевого некроза, что позволило заподозрить наличие специфического патологического процесса, связанного с токсическим влиянием метаболита кумарина на канальцевый эпителий почек. Следует также учесть наличие процесса нефросклероза в правой почке, вероятно, обусловленного мочекаменной болезнью в анамнезе.
Пациентке была выполнена пункционная нефробиопсия левой почки с последующим морфологическим исследованием биоптата с целью верификации патологического процесса и определения тактики терапии. В результате получены следующие данные.
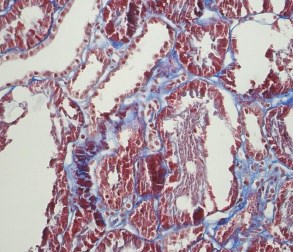
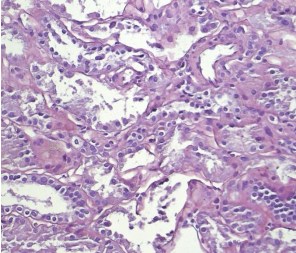
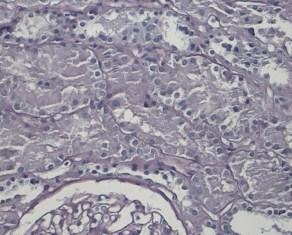
Светооптически 1 из 9 клубочков склерозирован полностью, остальные гипертрофированы. В одном клубочке выраженная интракапиллярная гиперклеточность и пролиферация базальных мембран. Остальные клубочки не имеют признаков выраженных пролиферативных изменений, за исключением сегментарного расширения парамезангиальных зон. Сегментарного склероза капиллярных пучков не наблюдается. В интерстиции слабый диффузный и мелкоочаговый фиброз. Резко выраженная гидропическая дистрофия эпителия канальцев вплоть до вакуолизации (рисунки 2, 3, 4).
Рис. 2. Х20 массон1 – резко выраженные дистрофические изменения эпителия канальцев, его слущивание
Рис. 3. Х20 ШИК – резко выраженные повреждения эпителия канальцев – слущивание фрагментов цитоплазмы и целых клеток в просвет канальцев
Рис. 4. Х20 ШИК – расширение и гиперклеточность мезангиальных зон
Окраска на амилоид отрицательна. Иммуноморфологически: IgA в клубочках: отрицательно, в канальцах: отрицательно, IgG в клубочках: отрицательно, в канальцах: отрицательно, IgM в клубочках: единичное редкое пунктирное, в канальцах: единичные цилиндры, C3 комплимент: единичные зерна в клубочках и в капсуле, а также зернистое в стенках артериол, C1q комплимент: отрицательно. Каппа: отрицательно в клубочках, единичные очаги в интерстиции. Лямбда: отрицательно в клубочках, единичные очаги в интерстиции. Электронномикроскопически: толщина и структура базальных мембран в пределах нормы, депозитов не обнаружено. Имеются протяженные очаги распластывания малых отростков подоцитов, пролиферация мезангиальных клеток отсутствует. Результаты были интерпретированы как очаговое распластывание малых отростков подоцитов, а также тубулопатия неясного генеза. Особое внимание в клинической картине на себя обращало постепенное нарастание протеинурии, артериальной гипертензии на фоне снижения фильтрационной функции почек и канальцевой дисфункции. Подобная двойственность клинических проявлений препятствовала пониманию сути патологического процесса в почках, и не позволяла в полной мере проводить медикаментозную терапию, отвечающую патогенетическим и этиологическим принципам. Указание в анамнезе на длительный прием фитопрепаратов позволило предположить токсическое воздействие метаболитов кумарина на функциональное состояние почек, однако в доступной литературе нет прямых указаний на прямое нефротоксическое действие кумарина. Исследователи ограничивают область токсических влияний кумарина и его метаболитов на функцию печени и гемостаза. Действительно, в рассматриваемом клиническом примере отмечаются как нарушения гемостаза, характеризующиеся гипокоагуляцией, так и печеночная дисфункция. Однако по данным нефробиопсии отмечаются признаки токсического процесса на уровне канальцев почки, характеризующегося резко выраженной гидропической дистрофией эпителия канальцев вплоть до вакуолизации, слабым диффузным и мелкоочаговым фиброзом интерстиция. Эти изменения соотносятся с изменениями клубочков, характеризующимися выраженной интракапиллярной гиперклеточностью и пролиферацией базальных мембран, сегментарным расширением парамезангиальных зон, наличием очагов распластывания малых отростков подоцитов.
Таким образом, впервые в литературе описан случай прямого нефротоксического воздействия кумарина и его метаболитов. Повреждение канальцевого эпителия почек метаболитами кумарина обуславливается во многом изначальным повреждением гломерулярной базальной мембраны, а также дисморфизмом подоцитов, что обуславливает повышенную готовность канальцевого эпителия к повреждению на фоне усиления процессов реабсорбции в связи с дефектами гломерулярной базальной мембраны и подоцитов. В свою очередь, низкая молекулярная масса кумарина и его метаболитов позволяет свободно проникать через гломерулярный фильтр, что, в условиях повреждения базальной мембраны и подоцитов, приводит к критическому повышению его в первичной моче и обуславливает токсическое действие на уровне канальцев почки.
Литература
1. Ермоленко, В.М. Острая почечная недостаточность / В.М. Ермоленко, А.Ю. Николаев – М.: Гэотар-Медиа, 2010. – 400 с.
2. Angell, M. Alternative medicine – the risks of untested and unregulated remedies / M. Angell, J.P. Kassirer // N. Engl. J. Med. – 1998. – V.339. – P.839-841.
3. Fugh-Berman, A. Herb-drug interactions / A. Fugh-Berman // Lancet. – 2000. – V.355. – P.134-138.
4. Recent patterns of medication use in the ambulatory adult population of the United States: the Spone survey / D.W. Kaufman, J.P. Kelly, L. Rosenberg et al. // JAMA. – 2002. –V.287. – P.337-344.
5. Screening methods for drugs and heavy metals in Chinese patent medicines / A. Au, R. Ko, F. Boo et al. // Bull. Environ. Contam. Toxicol. – 2000. – V.5. – P.112-119.
6. Chopra, A. Ayurvedic medicine: core concept, therapeutic principles, and current relevance/ A. Chopra, V. Doiphode. // Med. Clin. North. Am. – 2002. – V.86. – P.75-89.
7. Ernst, E. Heavy metals in traditional Indian remedies / E. Ernst // Eur. J. Clin. Pharmacol. – 2002. – V.57. – P.891-896.
8. The use and safety of non-allopathic Indian medicines / N. Gogtay, H. Bhatt, S. Dalvi, N. Kshirsagar // Drug Saf. – 2002. – V.25. – P.1005-1019.
9. Indian herbal remedies for diabetes as a cause of lead poisoning / R.W. Keen, A.C. Deacon, H.T. Delves et al. // Postgraduate Medical Journal. – 1994. – V.70. – P.113-114.
10. Ko, R.J. Adulterants in Asian patent medicines / R.J. Ko // N. Engl. J. Med. – 1998. – V.339. – P.847.
11. Arlt, V. Aristolochic acid as a probable human cancer hazard in herbal remedies: a review / V. Arlt, M. Stiborova, H. Schmeiser // Mutagenesis. – 2002. – V.17. – P.265-277.
12. Trends in alternative medicine use in the United States, 1990-1997: results of a follow-up national survey / D.M. Eisenberg, R.B. Davis, S.L. Ettner et al. // JAMA. – 1998. – V.280. – P.1569-1575.
13. Ernst, E. Adulteration of Chinese herbal medicines with synthetic drugs: a systematic review / E. Ernst // J. Intern. Med. – 2002. – V.252. – P.107-113.
14. Foote, J. Medicinal herb use and the renal patient / J. Foote, B. Cohen // J. of Renal Nutrition. – 1998. – V.8. – P.40-42.
15. International Agency for Research on Cancer (IARC). Some traditional herbal medicines, some mycotoxins, nafhtalene and styrene. In IARC Monographs on the Evaluation of Carcinogenic Risks of Chemicals to Humans. Lyon. France: IARC, 2002. – Р.82.
16. Herbs and the kidney/ C. Isnard Bagnis, G. Deray, A. Baumelou et al. // Am. J. Kidney Dis. – 2004. – V.44. – №1. – P.1-11.
17. Morris L. Side-effects of coumarin / L. Morris, P.D. Welsby // Postgrad. Med. J. – 1995. – №71. – P.701-702.
18. British Herbal Pharmacopoeia. – 1996. – 212 p.
19. Advances in research on chemical constituents and pharmacological activities of Agrimonia pilosa / G. Hong, Y.H. Dai, P.X. Liu et al.// Pharm. Care and Research. – 2008. – V.8. – № 5. – P.362-366.
20. Карташова, Г.С. Содержание дубильных веществ в Agrimonia pilosa Ledeb. / Г.С. Карташова, И.В. Гравель, Е.Г. Таран // Растительные ресурсы. – 1991. – Т.27. – №1. – С.139-143.
21. Wei, Y. Isolation of hyperoside and luteolin-glucoside from agrimonia pilosa ledeb using stepwise elution by high-speed countercurrent chromatography / Y. Wei, Y. Ito // J. of Liquid Chromatography and Related Technologies. – 2007. – V.30. – №9-10. – P.1465–1473.
22. Separation and determination of flavonoids in Agrimonia pilosa Ledeb. by capillary electrophoresis with electrochemical detection / X. Xu, X. Qi, W. Wang, G. Chen // J. of Separation Science. – 2005. – V.28. – №7. – P.647-652.
23. Analysis of the volatile components of Agrimonla Pilosa Ledeb by gas chromatography-mass spectrometry / Y.W. Li, L.F. Huang, C. Liang et al. // J. of Central South University (Science and Technology). – 2007. – V.38. – №3. – P. 502-506.
24. Фитохимическое исследование растений флоры Сибири / Д.Л. Макарова, В.В. Величко, Н.Е. Ким и др.// Фармация. – 2008. – №3. – С.19-22.
25. 500 важнейших лекарственных растений / В.К. Лавренов, Г.В. Лавренова. – М., 2003. – 510 с. 26. Comparative metabolism and kinetics of coumarin in mice and rats / S.L. Born, A.M. Api, R.A. Ford et al. // Food Chem. Toxicol. – 2003. – №41. – P.247-258.
Статья опубликована в журнале «Вестник урологии». Номер №3/2013 стр. 30-39
Источник