- Обзор современных концепций кишечной метаплазии желудка и рака желудка
- Обзор современных концепций кишечной метаплазии желудка и рака желудка.
- Эндоскопический скрининг и наблюдение
- Лечение пищевода Барретта
- Лечение пищевода Барретта без неоплазии
- Лечение пищевода Барретта с неоплазией низкой степени
- Лечение пищевода Барретта с неоплазией высокой степени, интраэпителиальной аденокарциномой.
- Лечение и наблюдение пищевода Барретта с неоплазией высокой степени, интраэпителиальной аденокарциномой после эндоскопического лечения
- Лечение пищевода Барретта с инвазивной аденокарциномой
- Как вылечить метаплазию народными средствами
Обзор современных концепций кишечной метаплазии желудка и рака желудка
Обзор современных концепций кишечной метаплазии желудка и рака желудка.
Кишечная метаплазия желудка является предраковым изменением слизистой оболочки желудка и связана с повышенным риском дисплазии и рака. В патогенезе прогрессирования от предраковых состояний к аденокарциноме желудка кишечного типа, согласно предложенного каскада Correa, считают переход от нормального эпителия желудка через воспаление, атрофию, внутрислизистую карциному, и наконец, к инвазивной карциноме. Множественные факторы риска были связаны с развитием взаимосвязи кишечной метаплазии желудка, включая инфекцию желудка H. pylori, генетических факторов, экологической среды, ревматических болезней, табакокурения, питания, желчного рефлюкса и кишечной микробиоты. Во всем мире в странах с высоким уровнем заболеваемости разработаны руководящие принципы скрининга.
Кишечная метаплазия желудка определяется как замена поверхностного, фовеолярного, и/или железистого эпителия кислотопродуцирующей или антральной слизистой желудка кишечным эпителием. Кишечная метаплазия желудка характеризуется анатомически как ограниченный процесс, если он находится в одной области желудка или как обширный, если вовлечены две области желудка. Гистологически кишечная метаплазия желудка считается либо полной, либо неполной. Полный (I тип) кишечная метаплазия определяется слизистой оболочкой тонкой кишки со зрелыми абсорбирующими клетками, бокаловидными клетками (Гоблета) и щеточной каймой. Неполная (II тип) кишечная метаплазия секретирует сиаломуцины и сходна с толстокишечным эпителием с цилиндрическими “промежуточными” клетками на различных стадиях дифференцировки, неравномерными каплями муцина и отсутствием щеточной каймы.
Самый высокий риск развития рака желудка связан с неполным и/или обширной кишечной метаплазией желудка. Систематический обзор, который включал 10 наблюдательных исследований по всей Европе, Азии и Латинской Америке в диапазоне от 10 месяцев до 19 лет наблюдения, показал, что риск рака желудка составляет в 4-11 раз выше при наличии неполной метаплазии по сравнению с ее отсутствием.
Первым изменением в гистологическом каскаде является либо активное хроническое воспаление неатрофического хронического гастрита, характеризующегося наличием желез, либо мультифокальный атрофический гастрит. Последующие гистологические изменения прогрессируют через появление полной метаплазии, неполной метаплазии, дисплазии низкой и высокой степени с последующей карциномой. В Нидерландах было проведено общенациональное когортное исследование для оценки риска развития рака желудка, связанного с различными предраковыми поражениями желудка. Атрофический гастрит, кишечная метаплазия, умеренно выраженная дисплазия, и высокая дисплазия были связаны с ежегодной заболеваемостью рака желудка в 0,1%, 0,25%, 0,6%, и 6,0%, соответственно. Заболеваемость раком желудка, ассоциированным с кишечной метаплазией желудка, в систематических обзорах колеблется от 0% до 10%, причем переменный диапазон обусловлен различными размерами выборки и периодами наблюдения.
Эндоскопический скрининг и наблюдение
Пациентам с высоким риском рекомендовано пройти эндоскопическое обследование с картированием биопсий по модифицированной Сиднейской системе (MSS) из 5 точек – антрального отдела (большая кривизна, малая кривизна), угол желудка и тело желудка (большая кривизна, малая кривизна). Следует отметить, что биопсии тела особенно ценны после длительного лечения ингибиторами протонной помпы, так как кислотопродуцирующая слизистая оболочка может быть изолировано инфицирована H. pylori. Биопсии с угла желудка также особенно важны, так как они, скорее всего, выявят максимальную атрофию, кишечную метаплазию и предраковую дисплазию. De Vries и его коллеги провели проспективное многоцентровое исследование в 2010 году. Золотым стандартом считалось получение 12 биопсий. На основе MSS (5 биопсий) выявили 90% пациентов с кишечной метаплазией желудка и 50% пациентов с дисплазией, в отличие от 97% и 100%, соответственно, когда было получено не менее 7 биопсий. De Vries и его коллеги пришли к выводу, что по крайней мере 9 биопсий, в том числе из кардии, необходимы для адекватного наблюдения предраковых поражений в популяции с низкой частотой рака желудка, к которым относятся европеоиды и белые американцы не испанского, африканского или восточноазиатского происхождения.
В настоящее время ASGE не рекомендуют общее наблюдение за людьми с кишечной метаплазией желудка, если не присутствуют другие факторы риска рака желудка, например, семейного анамнеза рака желудка и азиатского происхождения. Однако, европейский партнер, ESGE, рекомендует лечение H. pylori, если установлено, что пациент заражен бактериями, с последующим картированием биопсий по выявлению дисплазии каждые 3 года. Если слабая дисплазии (LGD) обнаруживается у пациента с кишечной метаплазией желудка, то ЭГДС с картированием необходима в течение 1 года для оценки эндоскопически видимых поражений. Пациентам с подтвержденной дисплазией высокой степени (HGD) при отсутствии эндоскопически видимого поражения рекомендуется повторное ЭГДC через 6-12 месяцев для наблюдения видимых поражений. Эти пациенты с поражениями должны пройти надлежащее либо хирургическую, либо эндоскопическую резекцию из-за высокой вероятности сосуществования инвазивной аденокарциномы, так как 25% пациентов с дисплазией высокой степени могут спрогрессировать до аденокарциномы в течение 1 года.
David S. Jencks, Jason D. Adam, Marie L. Borum, Joyce M. Koh, Sindu Stephen, David B. Doman. Overview of Current Concepts in Gastric Intestinal Metaplasia and Gastric Cancer. Gastroenterol Hepatol (NY). 2018 Feb; 14(2): 92–101.
Источник
Лечение пищевода Барретта
Лечение пищевода Барретта без неоплазии
Задачей терапии пищевода Барретта является эффективный контроль гастроэзофагеального рефлюкса.
На сегодняшний день общепринятым стандартом лечения цилиндроклеточной метаплазии является терапия ингибиторами протонной помпы (PPI). К безусловным достоинствам терапии данной группой препаратов относятся их широкий выбор, неплохие результаты в большинстве случаев, и высокая безопасность.
Недостатком медикаментозной терапии цилиндроклеточной метаплазии следует считать отсутствие в арсенале современной фармакологии средств, эффективно нивелирующих повреждающее действие дуоденального содержимого на эпителий пищевода. Подавление секреции соляной кислоты не исключает полностью биологическую активность ферментов желудочного, панкреатического и дуоденального происхождения, а также солей желчных кислот, играющих важную роль в инициации и прогрессии неопластического процесса.
Постоянный (пожизненный) прием PPI при пищеводе Барретта, несмотря на высокую безопасность данной группы препаратов, является нецелесообразным. У пациентов с клиническими проявлениями гастроэзофагеального рефлюкса предпочтение должно отдаваться терапии курсами или «по требованию» (symptom control management). При купировании симптомов желудочно-пищеводного заброса длительное применение антисекреторных средств является неоправданным.
Альтернативным подходом является хирургическое лечение пищевода Барретта. Основное достоинство антирефлюксных операций при цилиндроклеточной метаплазии, в сравнении с фармакологической терапией, заключается в возможности эффективной редукции ключевого условия ее развития и прогрессии — желудочно-пищеводного заброса.
Недостатком хирургического лечения цилиндроклеточной метаплазии слизистой оболочки пищевода является высокая частота рецидива гастроэзофагеального рефлюкса в отдаленные сроки после антирефлюксной операции.
Сравнительные клинические исследования демонстрируют сопоставимую эффективность контроля гастроэзофагеального рефлюкса при медикаментозной терапии и хирургическом лечении.
В качестве показаний к антирефлюксной хирургии при цилиндроклеточной метаплазии слизистой оболочки пищевода следует рассматривать неэффективность медикаментозной терапии PPI или неполный контроль гастроэзофагеального заброса на фоне фармакологического лечения.
Лечение пищевода Барретта с неоплазией низкой степени
В настоящее время не существует единого мнения о необходимости выполнения абляции при цилиндроклеточной метаплазии с интраэпителиальной неоплазией низкой степени.
Однако теоретические представления о высоком риске прогрессии неоплазии низкой степени в высокую, а затем – в аденокарциному, обосновывают целесообразность проведения превентивной циторедукции. Для лечения пищевода Барретта с интраэпителиальной неоплазией низкой степени могут применяться аргоно-плазменная коагуляция (APC), криодеструкция (CDT), фотодинамическая терапия (PDT), лазерная (LA), мультиполярная электротермическая (MPEC) и радиочастотная (RFA) аблация.
Общим недостатком всех методик абляции является невозможность получения материала для морфологического исследования, позволяющего оценить наличие или отсутствие инвазии более глубоких слоев пищевода. Данное обстоятельство является важным, поскольку вероятные ошибки при оценке выявленных до циторедукции изменений, несут риск дальнейшего прогрессирования инвазивной неоплазии (аденокарциномы). Применение специальных методик эндоскопического исследования (эндосонографии – EUS, конфокальной лазерной эндомикроскопии – CLM) и экспертная оценка биопсийного материала консилиумом патологов позволяет снизить вероятность ошибки .
Лечение пищевода Барретта с неоплазией высокой степени, интраэпителиальной аденокарциномой.
Выявление при пищеводе Барретта неоплазии высокой степени или интраэпителиальной аденокарциномы является показанием к удалению измененной части слизистой оболочки (части пищевода) в пределах здоровых тканей.
В настоящее время при цилиндроклеточной метаплазии с неоплазией высокой степени и интраэпителиальной аденокарциномой применяются как классические методы хирургического лечения, так и эндоскопические методики резекции слизистой оболочки пищевода.
В сравнительных клинических исследованиях последнего десятилетия доказана сопоставимая долгосрочная эффективность эндоскопических методик удаления внутрислизистых новообразований (без инвазии в подслизистый слой) и хирургического лечения — резекции пищевода/эзофагэктомии .
Преимущество эндоскопических методик заключается в возможности сохранения естественной анатомической и функциональной полноценности пищеварительного тракта. Существенно меньшими являются показатели осложнений и летальности эндоскопического лечения данной патологии по сравнению с резекцией пищевода/эзофагэктомией .
Достоинство хирургического лечения (трансхиатальной эзофагэктомии, сегментарной резекции пищевода по Merendino, резекции пищевода с сохранением блуждающих нервов) заключается в возможности устранения риска развития аденокарциномы пищевода в перспективе.
Для лечения неоплазии высокой степени и интраэпителиальной аденокарциномы пищевода могут применяться резекция слизистой оболочки (EMR, EMR-C), диссекция новообразования в подслизистом слое (ESD), а также различные способы внутрипросветной абляции (PDT, RFA и др.).
Важное преимущество резекционных эндоскопических технологий, по сравнению с аблационными процедурами, заключается в возможности получения полноценного материала для морфологического исследования, позволяющего оценить радикальность оперативного вмешательства.
Обязательными условиями эндоскопического лечения пищевода Барретта с неоплазией высокой степени и внутрислизистой аденокарциномой является оценка глубины инвазии новообразования до выполнения процедуры на основании данных эндосонографии (EUS) или конфокальной лазерной эндомикроскопии (CLM). При интраэпителиальной аденокарциноме применение внутрипросветных методик резекции является радикальным при T1a стадии (инвазии на глубину не более 500 мкм послизистого слоя). Окончательно радикальность резекции новообразования должна оцениваться при морфологической экспертизе удаленного материала.
Лечение и наблюдение пищевода Барретта с неоплазией высокой степени, интраэпителиальной аденокарциномой после эндоскопического лечения
В случае подтверждения при морфологическом исследовании удаленного в ходе эндоскопической резекции/диссекции новообразования неоплазии высокой степени или интраэпителиальной аденокарциномы необходимо выполнение полной абляции метаплазии в связи в высокой (до 80%) вероятностью повторного возникновения подобных изменений в других участках метаплазированного эпителия.
Для циторедукции в подобной ситуации могут использоваться все методики внутрипросветной абляции, а также — пошаговая резекция/диссекция цилиндроклеточной метаплазии слизистой оболочки пищевода.
После окончательного выполнения циторедукции и подтверждения при контрольной эзофагоскопии регенерации плоского эпителия пищевода целесообразно проведение стандартной терапии гастроэзофагеального рефлюкса или антирефлюксной операции с динамическим эндоскопическим осмотром раз в пять лет.
Подобная тактика повышает общую эффективность лечения неоплазии/ интраэпителиальной аденокарциномы, и минимизирует риск развития инвазивного железистого рака пищевода при цилиндроклеточной метаплазии.
Лечение пищевода Барретта с инвазивной аденокарциномой
Лечение инвазивной аденокарциномы пищевода (стадии T1b и выше) должно осуществляться по стандартной программе, предусматривающей резекцию органа/эзофагэктомию и, при необходимости, дополнительные методы противоопухолевого воздействия.
Эндоскопические методики абляции или резекции слизистой оболочки пищевода при инвазивной аденокарциноме (стадии T1b и выше) являются нерадикальными методами лечения.
Организация наблюдения и лечения пищевода Барретта
Создание системы долгосрочного динамического наблюдения и оказания специализированной медицинской помощи пациентам с пищеводом Барретта требует их аккумуляции в специализированных клинических центрах, обладающих необходимым диагностическим и лечебным оборудованием.
Преемственность теоретических взглядов и клинических подходов врачей различных специальностей (гастроэнтеролога, патолога, эндокскописта, хирурга, онколога) на всех этапах наблюдения и лечения пищевода Барретта, понимание патогенеза цилиндроклеточной метаплазии и факторов развития интраэпителиальной неоплазии/аденокарциномы, являются важными условиями повышения эффективности оказания медицинской помощи пациентам с данной патологией.
Источник
Как вылечить метаплазию народными средствами
Рак желудка остается одним из самых распространенных заболеваний в мире. Ежегодно регистрируется почти 800 тыс. новых случаев и 628 тыс. смертей от этого заболевания. В числе стран-«лидеров» находится и Россия. Заболеваемость данным видом новообразований значительно возрастает в возрасте после 50 лет, т.е. у лиц пожилого и старческого возраста. Вероятность возникновения опухоли у мужчин в 2 раза выше, чем у женщин [1–3, 5].
Проведенными клиническими исследованиями было достоверно доказано, что риск возникновения злокачественного образования в здоровом желудке крайне низок. Более 99% больных с раком желудка до постановки этого диагноза имели различные предраковые заболевания. Наиболее распространенные предраки – это хронический атрофический гастрит, язва желудка , полипы желудка. Кроме того, к предопухолевым заболеваниям желудка относят метаплазии и дисплазии II, III степеней. Все эти заболевания, постепенно развиваясь, повышают риск развития злокачественного образования [6, 7].
Лечение рака желудка на сегодняшний день основывается на комплексном подходе. Наряду с хирургической тактикой и лучевой терапией используется консервативное ведение больных с предраковыми заболеваниями желудка и раком желудка. При этом социальное положение людей пожилого возраста не позволяет приобретать дорогие препараты, а также использовать дорогостоящие эндоскопические операции.
Цель работы
Разработать эффективный и безопасный фитотерапевтический метод лечения больных пожилого и старческого возраста, способствующий регрессии предраковых и ранних стадий злокачественных образований желудка; на примере состояния липидного метаболизма доказать отсутствие отрицательного его влияния на организм в целом.
Материалы и методы исследования
Клинико-лабораторные исследования проведены у 58 больных возрастом от 60 до 89 лет с различными предраковыми заболеваниями желудка. Больные были разделены на 2 группы. Первая группа (группа сравнения) – больные (n=16), которым после обнаружения изменений в слизистой оболочке желудка проводилась симптоматическая терапия (они отказывались от какого-либо другого лечения). Пациентам второй группы (основная группа) (n=42) назначалось комбинированное терапевтическое лечение. Средний возраст обследуемых в первой группе составлял 62,3±5,4 лет, во второй – 63,7±4,9 года. Полипы желудка в первой группе больных диагностированы у 7 мужчин (из них аденоматозные – у 2, гиперплазиогенные – у 5 больных) и 3 женщин (из них аденоматозные – у 1, гиперплазиогенные – у 2 больных), дисплазии III степени – у 4 больных (1 мужчина, 3 женщины), доброкачественные подслизистые опухоли – у 2 пациентов (1 мужчина, 1 женщина). Полипы желудка во второй группе больных диагностированы у 11 мужчин (из них аденоматозные – у 3, гиперплазиогенные – у 8 больных) и 22 женщин (из них аденоматозные – у 13, гиперплазиогенные – у 9 больных), дисплазии III степени – у 5 больных (3 мужчины, 2 женщины), ранние раки – у 4 больных (4 женщины).
При подтверждении предракового заболевания желудка (метаплазии, дисплазии) больным предлагалось комбинированное лечение в несколько этапов.
I этап направлен на ликвидацию раздражающего фактора, эрадикацию геликобактер пилори, состоял из двух антибактериальных препаратов: кларитромицина 500 мг 2 раза в день и метронидазола 250 мг 3 раза в день с добавлением препарата висмута – викаира по 1 т. 3 раза в день (предпочтение викаиру отдавалось из-за дешевизны: он дешевле Де-Нола в десятки раз). С целью эрадикации геликобактер пилори длительность лечения составляла 7–8 дней. Микроорганизмы в ряде случаев по-прежнему оставались на слизистой оболочке, но количество их значительно уменьшалось. Это отмечалось визуально по интенсивности окраски геликотест-полосок, а также при микроскопическом исследовании. При дуоденогастральном рефлюксе назначали антирефлюксные препараты, в частности церукал, мотилиум в таблетированном или в инъекционном виде. Одновременно с антибактериальными препаратами назначался настой чистотела большого по 2 ст. л. 3 раза в день за 40 мин до еды лежа 15 мин 7 дней.
II этап: настойка золотого уса по 1 ч. Л. 3 раза в день за 40 мин до еды 18–20 дней.
III этап: настой чистотела большого по 2 ст. л. 3 раза в день за 40 мин до еды 3 недели.
IV этап: настойка золотого уса по 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели.
Настой чистотела большого и настойка золотого уса приготавливались по рецепту, их дозировка была щадящей для организма человека (патент на изобретение № 2467758 от 27.11.2012 г.) [4].
Научные исследования проводились при информированном согласии больного согласно международным требованиям ВОЗ (правила GCP – Good Clinical Practice), предъявляемым к медицинским исследованиям с участием человека (Женева, 1993).
Больным проводилось эндоскопическое обследование верхних отделов желудочно-кишечного тракта. Использовалось эндоскопическое оборудование: эзофагогастрофиброскопы японских фирм «Olympus»-Gif-E и «Pentax» PG-29P, для взятия биопсийного материала применялись биопсийные щипцы. При подозрении на предраковое заболевание желудка обязательно производилась биопсия. Биоптат помещался в 10%-ный раствор формалина. Также производился забор (биопсия) тканей на микрофлору желудка биопсийными щипцами. Для оценки микрофлоры в момент эндоскопии брались два кусочка тканей со слизистой оболочки средней трети и антрального отдела желудка. Определяли геликобактер пилори (Нр) и дрожжеподобный мицелий. Нр оценивался и по геликотесту с помощью специальных тест-полосок. Гистологические исследования проводились в патологоанатомических отделениях Республиканской клинической больницы № 4 г. Саранска и в Республиканском онкологическом диспансере.
Методы исследования
Больным выполняли общеклинические и биохимические исследования. Биохимические анализы крови больным проводились до и после комбинированного лечения в динамике с целью определения возможного токсического воздействия разработанной лечебной схемы на организм.
Оценивали состояние липидного обмена в плазме крови. Липиды из плазмы крови экстрагировали хлороформметаноловой смесью (Хиггинс Дж. А., 1990). Липиды фракционировали методом тонкослойной хроматографии (Хиггинс Дж. А., 1990; Vaskovsky V.E. et al., 1975). Молекулярный анализ проводили на денситометре Model GS-670 (BIO-RAD, США) с соответствующим программным обеспечением (Phosphor Analyst/PS Sowtware). Контрольные сроки оценки биохимических показателей и показателей липидного обмена: до лечения, 5-е, 10-е, 15-е, 30-е сутки в процессе лечения.
Полученные цифровые экспериментальные данные обработаны методом вариационной статистики с использованием t-критерия Стьюдента и χ2.
Результаты исследования и их обсуждение
Проведенные исследования показали, что чаще предраковые заболевания локализуются в антральном отделе желудка (31 (73,8%) больной), реже (11 (26,2%) больных) – в верхней трети тела или свода желудка по данным эндоскопической диагностики. Макровизуальная эндоскопическая картина слизистой оболочки желудка определялась в виде ее истончения, на фоне которой могли быть гиперплазии разных оттенков или разной высоты, протрузии, полипы, дефекты в виде эрозий или язвенных поражений.
У всех обследованных больных, как в основной группе, так и в группе сравнения, на тест-полосках определялся геликобактер пилори. При микроскопическом исследовании же Нр не всегда (12 (28,6%) больных) регистрировался визуально. В ряде случаев (19 (42,5% больных) геликобактер пилори в пищеводе в количественном отношении определялся больше, чем в желудке.
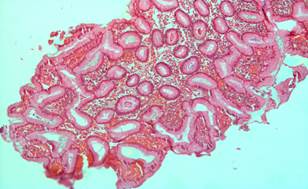
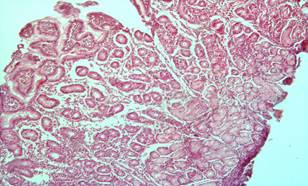
По данным эндоскопических исследований желудка после первого сеанса комбинированного терапевтического лечения в 32 (76,2%) наблюдениях у больных основной группы полипы исчезали полностью, в остальных – уменьшались в размерах. Дисплазии тяжелой степени (III степени), а также ранние стадии злокачественных образований регрессировали после одного сеанса лечения. Это подтверждалось и при гистологических исследованиях. В биоптатах микроскопически не обнаруживалась патологическая картина в виде аденоматозных или гиперпластических полипов, дисплазий, а также аденокарцином. Подчеркнем, что после трех сеансов комбинированной терапии полипы до 2,0 см высотой полностью регрессировали (рис. 1, 2).
Клинические примеры приведены ниже.
Больная П., 62 лет. 4.05.07г. жалобы на тяжесть в эпигастрии, отрыжку воздухом. ЭГДФС: Полушаровидный полип (0,8×0,8см) большой кривизны середины тела желудка. Смешанный гастрит. Дуоденит. НР (+++). Микроскопия от 7.05.2007 г.: аденоматозный полип слизистой желудка с признаками полиморфизма желез, осклизнением эпителия, очагами поверхностных эрозий и элементами грубой интестинальной перестройки. Лечение: I этап — Пилобакт 1 полоска утр., 1 полоска на ночь 7 дней, чистотел большой по 2 ст. л. 3 раза в день за 40 мин до еды 7 дней. II этап — золотой ус 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели. III этап — чистотел большой по 2 ст. л. 3 раза в день за 40 мин до еды 3 недели; IV этап – золотой ус 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели.ЭГДФС: Регрессия полипа. Субатрофический гастрит. НР (+) с антрального отдела желудка. Микроскопия от 9.08.2007 г.: слизистая желудка с признаками очаговой атрофии желёз, слабовыраженной полиморфноклеточной инфильтрацией в строме.
Больная М., 60 лет. Жалобы на тошноту после еды и тяжесть в эпигастрии. 12.05.2009 г. ЭГДФС: Афтозные гиперплазии антрального отдела (эрозии до 0,2 см, гиперемированные гиперплазии до 0,7 см) желудка. Смешанный гастрит. Поверхностный дуоденит. Дуоденогастральный рефлюкс. НР (+++). Микроскопия от 17.05.2009 г.: картина гиперпластического полипа желудка. Лечение: I этап — Викаир по 1 таб. 3 раза в день, метронидозол по 1 таб. 3 р. за 30 мин. до еды 7 дней, Чистотел большой по 2 ст. л. 3 раза в день 7 дней. II этап — золотой ус 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели. III этап — чистотел большой по 2 ст. л. 3 раза в день за 40 мин до еды 3 недели; IV этап – золотой ус 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели. 16.10.2009 г.: жалоб нет. ЭГДФС: Полная регрессия полипа. Атрофический гастрит. Микроскопия от 16.10.2009 г.: фрагмент слизистой желудка с диффузной умеренно выраженной воспалительной инфильтрацией в строме.
Рис. 1. Фрагменты гиперпластического (аденоматозного) полипа слизистой желудка (до лечения).
Окраска гематоксилин эозином. × 200
Рис. 2. Фрагменты слизистой желудка с признаками гиперплазии отдельных желёз, участками атрофии желёз, полиморфноклеточной инфильтрацией в строме (после лечения). Окраска гематоксилин эозином. × 200
Эндоскопический контроль в отдаленном периоде (до 5 лет) удалось провести 34 (81,0%) больным. Рецидивов не выявлено ни в одном случае.
Положительный эффект терапии выражался и в том, что на ее фоне не отмечались существенные расстройства гомеостаза, подтвержденные биохимическими исследованиями. В биохимических показателях крови до лечения и после проведенного комбинированного лечения по специальной схеме не было значительных отклонений от нормы. Общее состояние больных при проведении терапии и после нее не страдало, а в конце терапии субъективно отмечалось улучшение состояния.
В патогенезе различных заболеваний, в том числе и предопухолевой патологии, значительную роль играют нарушения липидного обмена, что обусловлено важностью липидов в молекулярной организации и функционировании живых структур. Проведенные нами исследования показали, что предопухолевые заболевания желудка тесно сопряжены с липидными дестабилизациями в плазме крови (табл. 1).
Содержание некоторых липидов в плазме крови (M±m)
Источник