Как определить концентрацию лекарственного вещества
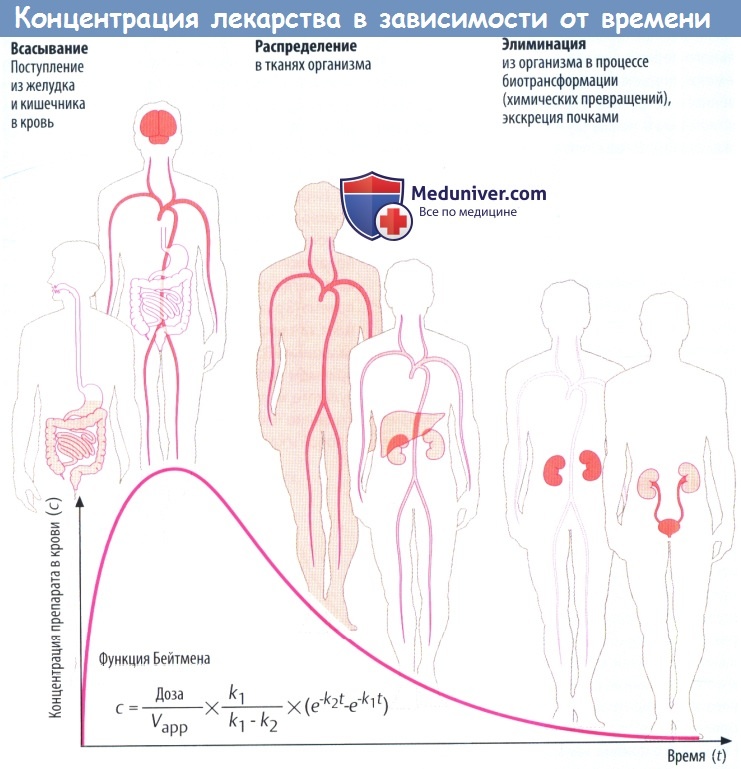
(А) Лекарственные средства попадают в организм и выводятся из него разными путями. Таким образом, организм представляет собой открытую систему, в которой фактическая концентрация препарата отражает взаимодействие между его поступлением (приемом) и эвакуацией (элиминацией).
Скорость всасывания препарата в желудке и кишечнике зависит от множества факторов: скорости растворения вещества (в случае приема твердой лекарственной формы) и транзита по ЖКТ, проницаемости слизистой для препарата, его градиента концентрации на границе слизистой и крови,кровоснабжения слизистой оболочки.
Всасывание из кишечника приводит к повышению концентрации лекарственного вещества в крови. Препарат разносится с кровью к различным органам (распределение), которые поглощают его в количестве, соответствующем его химическим свойствам и скорости кровотока через орган.
Например, органы с хорошим кровоснабжением, такие как головной мозг, получают большее количество препарата, чем органы с низким кровоснабжением. В результате поглощения тканями происходит снижение концентрации лекарственного вещества в крови. По мере снижения градиента на границе слизистой оболочки и крови всасывание в кишечнике замедляется. Пик концентрации в крови достигается тогда, когда количество вещества, покидающего кровь за единицу времени, равно количеству всосавшегося.
Поступление вещества в ткани печени и почек представляет собой перемещение в органы выведения. Концентрация препарата в крови в различные периоды времени представляет собой совокупность процессов абсорбции, распределения и элиминации, которые пересекаются во времени.
Если распределение происходит значительно быстрее, чем элиминация, снижение концентрации в крови вначале происходит быстро, а затем замедляется. Фаза быстрого снижения обозначается как α-фаза (фаза распределения), медленного — как β-фаза (фаза элиминации). Если препарат распределяется быстрее, чем абсорбируется, концентрацию препарата в крови можно описать математически упрощенной функцией Бейтмена (k1 и k2 — константы скорости для абсорбции и элиминации соответственно).
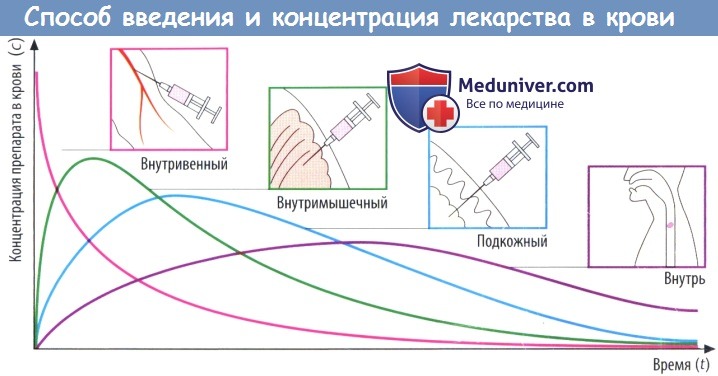
(В) Скорость абсорбции зависит от способа введения препарата. Чем выше скорость абсорбции, тем короче будет время (tmax), которое требуется для достижения пика концентрации в плазме (cmax), тем выше будет cmax и тем раньше уровень препарата в крови снова начнет снижаться.
Площадь под кривой, описывающей зависимость концентрации препарата в крови от времени (AUC), не зависит от пути введения препарата при условии, что доза и биодоступность остаются теми же (закон соответственных состояний). Таким образом, AUC можно использовать для вычисления биодоступности (F) препарата.
Значение AUC, измеренное после приема внутрь и в/в введения определенной дозы конкретного лекарственного вещества, соответствует проценту вещества, попавшего в системный кровоток после приема внутрь: F = AUCприем внутрь/AUCв/в введение.
Определение концентрации препарата в крови позволяет сравнить различные патентованные лекарственные средства, содержащие одно и то же действующее вещество в одинаковой дозе. Идентичные кривые зависимости концентрации в крови от времени для препаратов различных производителей (при условии стандартных лекарственных форм) означают биоэквивалентность стандартного вещества и нового исследуемого препарата.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Как определить концентрацию лекарственного вещества
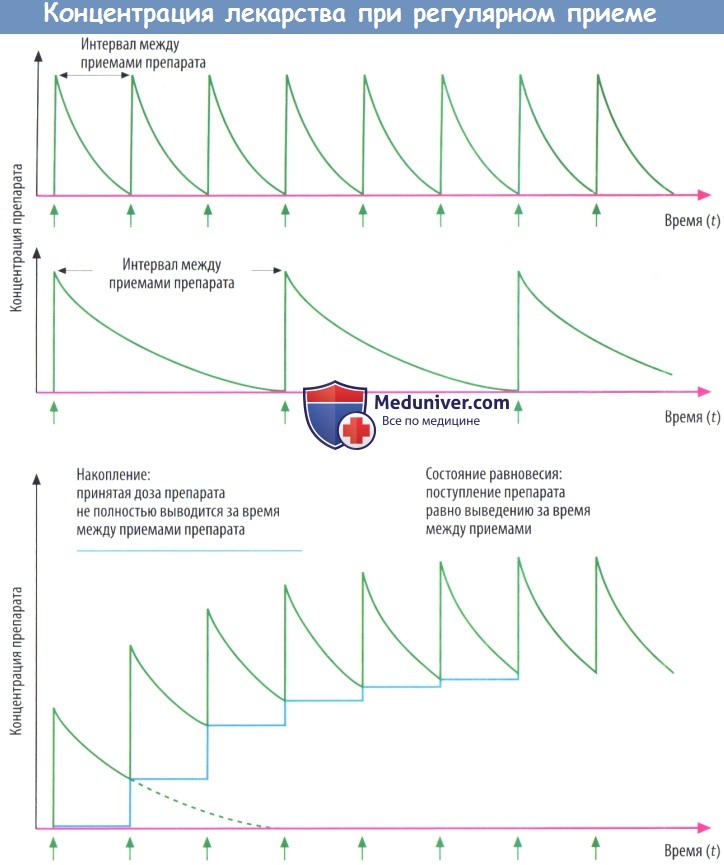
а) Концентрация препарата в крови при повторном введении. Если больной принимает препарат в течение длительного периода через одинаковые промежутки времени, подъем и падение концентрации лекарственного вещества в крови определяется взаимоотношением между t1/2 и временным интервалом между дозами.
В том случае, если количество препарата, поступившего в организм, элиминируется прежде, чем принята следующая доза, концентрация вещества при повторных приемах через равные промежутки времени будет постоянной.
Если препарат поступает в организм прежде, чем предыдущая доза полностью элиминируется, следующая доза «добавляется» к остаточному количеству препарата, все еще присутствующему в организме, т. е. вещество накапливается.
Чем короче интервал между дозами по отношению к t1/2, тем выше остаточное количество препарата, к которому прибавляется очередная доза, и тем активнее препарат накапливается в организме.
Однако при фиксированном интервале межу приемами препарат не накапливается бесконечно, в итоге наступает состояние равновесия (концентрация Css), или равновесное накопление. Так происходит потому, что активность процессов элиминации зависит от концентрации. Чем выше концентрация препарата, тем большее его количество элиминируется за единицу времени.
После приема нескольких доз концентрация достигает уровня, при котором количество препарата, выведенного и поступившего в организм за единицувремени, становится одинаковым, т. е. достигается состояние равновесия.
В пределах этого диапазона концентрации уровень вещества в крови продолжает повышаться (пик) и падать (низшая точка) в процессе приема лекарственного средства через равные промежутки времени.
Максимальное значение равновесной концентрации (Css) зависит от количества препарата (D), принятого за время между введениями (τ), и клиренса (Cl): C55 = D/(τ x Cl).
Скорость, с которой достигается равновесное состояние, соответствует скорости элиминации препарата. Время, необходимое для достижения 90%-го плато концентрации, примерно в 3 раза превышает t1/2 элиминации.
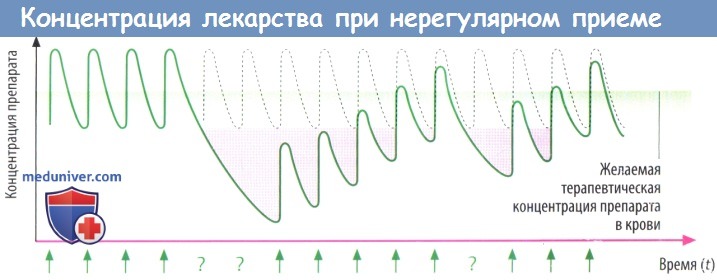
б) Концентрация препарата в крови при приеме через неравные промежутки времени. На практике бывает трудно добиться такого уровня препарата в крови, который колебался бы равномерно около желаемой эффективной концентрации. Например, если пропущены две дозы подряд, концентрация препарата в крови падает ниже терапевтической, и требуется больше времени, чтобы она вновь повысилась до желаемого уровня.
Нередко пациенты не соблюдают режим приема препарата (приверженность к лечению — строгое выполнение рекомендаций врача).
Кроме отсутствия приверженности к лечению та же проблема возникает, когда общую суточную дозу разделяют на три приема (3 раза в сутки) и первую дозу пациент принимает за завтраком, вторую — за обедом, а третью — за ужином. В таких условиях ночной интервал между приемом препарата в 2 раза выше дневного.
В результате концентрация препарата в крови в предутренние часы может опускаться ниже желаемой, а порой и крайне необходимой.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Как определить концентрацию лекарственного вещества
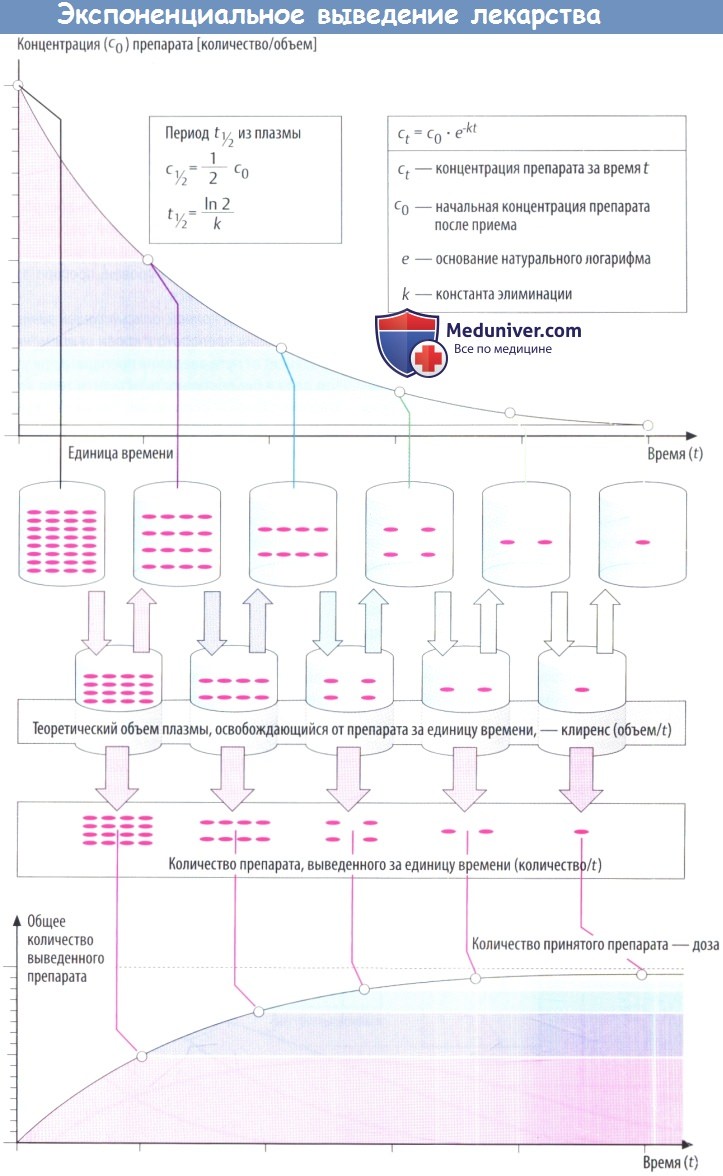
Такие процессы, как всасывание и выведение, обладают экспоненциальными характеристиками. В отношении всасывания это следует из простого факта: количество препарата, перемещающегося за единицу времени, зависит от разности концентраций (градиента) на границе двух тканей (закон Фика).
В процессе всасывания из пищеварительного тракта содержимое кишечника и кровь представляют собой ткани с изначально высокой и низкой концентрациями соответственно. При выведении лекарственного вещества через почки экскреция часто зависит от скорости клубочковой фильтрации, т. е. от количества препарата, попавшего в первичную мочу.
По мере снижения концентрации в крови количество лекарственного вещества, экскретируемого через почки за единицу времени, уменьшается. В результате происходит экспоненциальное снижение, показанное на рисунке ниже. Время экспоненциальногоснижения — постоянный интервал, в течение которого концентрация снижается в 2 раза.
Этот интервал представляет собой период полувыведения (t1/2) и связан с константой скорости элиминации (k) уравнением: t1/2 = (ln2)/k. Эти два параметра вместе с исходной концентрацией (с0) описывают скорость реакции первого порядка (экспоненциальную).
Поскольку эта скорость постоянная, она дает возможность вычислить объем плазмы, освобожденной от лекарственного вещества, учитывая, что оставшееся количество не распределено равномерно в общем объеме плазмы (условие, невозможное в реальности). Теоретический объем плазмы, освобождающейся от лекарственного вещества за единицу времени, называется клиренсом.
В зависимости от того, снижается концентрация в плазме в результате экскреции с мочой либо в результате разрушения в процессе метаболизма, клиренс называют почечным или печеночным. Почечный и печеночный клиренсы суммируются, образуя общий клиренс (Cltot) в случае, если препараты выводятся в неизмененном виде через почки и подвергаются биотрансформации в печени.
Cltot представляет собой сумму всех процессов, участвующих в выведении; он связан с периодом полувыведения (t1/2) и объемом распределения препарата (Vapp) формулой:
Чем меньше объем распределения и чем больше общий клиренс, тем короче период полувыведения.
Для препаратов, выводимых почками в неизмененном виде, t1/2 можно вычислить на основании кумулятивной экскреции с мочой; итоговое общее количество выведенного препарата соответствует количеству всосавшегося препарата.
Печеночная элиминация происходит по экспоненте, т. к. ферменты, катализирующие реакции метаболизма, действуют в квазилинейной области своей кривой активности концентрации; следовательно, количество вещества, подвергшегося метаболизму за единицу времени, уменьшается параллельно снижению концентрации в крови.
Самое известное исключение из экспоненциального закона — выведение алкоголя (этанола), которое происходит по линейному закону (кинетика нулевого порядка), во всяком случае, при концентрации в крови менее 0,02%. Это происходит потому, что лимитирующий скорость фермент алкогольдегидрогеназа достигает полунасыщения при очень низких концентрациях вещества — примерно 80 мг/л (0,008%).
Таким образом, при концентрации этанола в крови на уровне примерно 0,02% скорость реакции выходит на плато, при концентрациях выше этого уровня количество лекарственного вещества, выведенного за единицу времени, остается постоянным.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Как определить концентрацию лекарственного вещества
Результаты исследований локального постинъекционного действия растворов лекарственных средств на живые ткани человека и животных показали важную роль концентрации и других физико-химических показателей качества растворов в формировании ятрогенного воспаления и повреждения тканей в месте инъекции. [3, 5, 9]. Было установлено, что подкожные и внутримышечные инъекции высококонцентрированных лекарственных растворов, величина концентрации которых превышала 10 %, чаще приводили к образованию воспалительных инфильтратов. Также обнаружено, что развитие флебитов и тромбозов подкожных вен пациентов может быть обусловлено локальным действием высококонцентрированных растворов при их длительном и многократном внутривенном введении [4, 6]. Микроскопические исследования мазков крови после смешивания ее с растворами лекарственных средств, имеющих разные показатели концентрации активного вещества также показали наличие агрессивных свойств высококонцентрированных растворов на клетки крови [2].
Таким образом, высокая концентрация может придавать растворам лекарственных средств агрессивные раздражающие свойства по отношению к инъецируемым тканям, вызывая развитие в них воспаления и повреждения, вплоть до необратимого повреждения [1, 7]. Однако, было замечено, что раздражающим действием на ткани могут обладать растворы не только с высокими, но и с низкими показателями концентрации активного вещества, значение которой указаны на ампуле с раствором лекарственного средства, например растворы нестероидных противовоспалительных средств [8, 10]. Поскольку величина концентрации, указанная на ампуле или флаконе с раствором отражает лишь содержание активного инградиента в единице объема, то изучение концентрации вспомогательных ингредиентов в готовом растворе и определение их роли в формировании суммарной концентрации и осмотической активности раствора является актуальным.
Цель исследования – изучить влияние концентрации активных и вспомогательных инградиентов готовых растворов лекарственных средств на их активность.
Материалы и методы исследования
Проведено изучение состава и свойств растворов нестероидных противовоспалительных лекарственных средств, предназначенных для инъекций. Показатели концентрации действующих и вспомогательных веществ, входящих в состав растворов для инъекций, определяли по данным Паспортов лекарственных средств. С помощью осмометра марки VAPRO 5600 (USA) были исследованы показатели осмотической активности лекарственных растворов. В качестве контроля был использован раствор 0,9 % натрия хлорида. Для оценки биологической активности лекарств в экспериментах на 10 здоровых 2-месячных поросятах породы ландрас изучена динамика изменений температуры и спектра инфракрасного излучения кожи над в области медикаментозных инфильтратов, образованных подкожным введением в области передней брюшной стенки растворов нестероидных противовоспалительных лекарственных средств разной концентрации в объеме 0,5 мл. В качестве контроля были использованы значения температуры кожи над поверхностью инфильтрата, образованного подкожным введением 0,5 мл раствора 0,9 % натрия хлорида. Растворы лекарственных средств имели показатели температуры + 24 ± 0,8 ºС. Состояние поверхности кожи поросят в области инъекции оценивали в видимом и инфракрасном спектре излучения с помощью тепловизора марки ThermoTracer TH9100XX (NEC, USA) в диапазоне температур от + 25 до + 36 °С с последующей обработкой полученной информации с применением программ Thermography Explorer и Image Processor.
С помощью статистической программы BIOSTAT на персональном компьютере Lenovo R60 (USA) вычисляли среднюю арифметическую (M), ошибку средней арифметической (m), коэффициент достоверности (±). Степень различий показателей определяли в каждой серии по отношению к исходным показателям в контрольной серии. Разницу значений считали достоверной при Р ≤ 0,05.
Результаты исследования и их обсуждение
Для исследования нами были выбраны растворы нестероидных противовоспалительных лекарственных средств с разными показателями концентрации активного вещества. Ими оказались растворы нестероидных противовоспалительных средств, а именно 5 % раствор для инъекций Кетопрофен® (ОАО «Синтез», г. Курган, Россия), 3 % раствор для инъекций Кеторол® (Д-р Редди̕с Лабораторис Лтд., г.Хайдерабад, Андхра Прадеш, Индия) и 50 % раствор для инъекций Анальгин (ОАО «Ереванская химико-фармацевтическая фирма», г. Ереван, Республика Армения).
Результаты наблюдений за изменением температуры и спектра ифракрасного излучения поверхности кожи поросят в области инъекций показали, что инфильтрат, образованный подкожным введением 0,9 % натрия хлорида не вызывал развития локальной гипертермии на протяжении 60 минут после инъекции, а восстановление исходной температуры после первоначального охлаждения, вызванного введением «холодного» раствора, наступало через 5-7 минут. В то же время, растворы выбранных для исследования лекарственных средств вызывали локальное повышение температуры кожи в области инъекции на 0,3-1,8 °С, при этом локальная гипертермия регистрировалась на экране тепловизора в течении 15-60 минут после инъекции. Таким образом, все исследуемые растворы лекарственных средств, независимо от величины концентрации активного вещества, проявили раздражающие действие для мягкие ткани передней брюшной стенки, вызвав в них развитие воспаления, проявляющееся в первую очередь локальной гипертермией.
Исследования осмотической активности указанных растворов показали, что 50 % раствор анальгина имею величину осмолярности 4638 ± 12,5*мОсм/л воды, 5 % кетопрофен – 4767 ± 11,5*мОсм/л воды, а 3 % кеторол – 2971 ± 9,8*мОсм/л воды (достоверно при Р ≤ 0,05, n = 5 по сравнению с контролем), свидетельствующие о том, что низкая концентрация действующего вещества, указанная на ампуле или флаконе с раствором лекарственного средства, не исключает наличия у раствора высокой суммарной осмотической активности.
Дальнейший анализ паспортов и инструкций к применению данных лекарственных средств показал, что в состав изучаемых растворов входит от 2 до 7 различных вспомогательных веществ (таблица).
Качественный и количественный состав растворов
Источник



