- Стафилококк
- Причины
- Симптомы
- Фитотерапевтические методы лечения
- Дополнительные материалы
- Советы врача
- Вопрос #58270 24.05.21
- Людмила
- Ответ:
- Антибиотики прямо под нашим носом
- Антибиотики прямо под нашим носом
- Семейные разборки
- Золотистый стафилококк
- Секретное оружие
- Нерибосомные пептиды
- Строение
- Синтез
- Испытания в боевых условиях
- Перспективы
Стафилококк
Стафилококковой инфекцией называют группу заболеваний, возбудителями которых является золотистый стафилококк. Данные патологии могут протекать в легкой форме (воспалительные заболевания кожи) или в тяжелой форме (пневмония, сепсис и ряд других). Опасность стафилококков заключается в их способности вырабатывать токсины, которые оказывают сильнейшее отрицательное действие на человеческий организм.
Причины
Источник инфекции – больные люди и бактерионосители, которые сами не болеют, но в их организме содержатся патогенные формы стафилококков.
Практически у всех здоровых людей на поверхности слизистых оболочек и коже можно обнаружить золотистый стафилококк в небольших количествах. Когда человек здоров, то эта бактерия не доставляет ему никаких проблем, но стоит иммунитету ослабнуть, как стафилококки начинают усиленно размножаться, что приводит к развитию различных заболеваний.
- через пищу
- воздушно-капельный
- контактный
К провоцирующим факторам относят:
- прием антибиотиков
- частые простуды
- снижение иммунитета
- наличие в анамнезе пациента хронических заболеваний
- дисбактериоз кишечника
Симптомы
Клиническая картина зависит от того, какой именно орган поражен инфекцией, состояния иммунитета.
К общим симптомам стафилококковой инфекции относят:
- повышение температуры
- общая слабость
- нарушение сна
- снижение аппетита, боли в животе
- головные боли
- экзема, акне, пиодермия и другие заболевания кожи
- нарушение работы органов и тканей, в которые попала инфекция
Фитотерапевтические методы лечения
Лекарственные травы широко используют в составе комплексной терапии стафилококковой инфекции. Наибольший эффект дают травяные сборы, в состав которых входят зверобой, ромашка, календула, подорожник, чистотел, шалфей, эхинацея.
Выраженное антибактериальное действие оказывают абрикос, лук, шиповник, чеснок, черная смородина, сок алоэ. Противовоспалительным действием обладают корень солодки, цветки подсолнечника, липа, черная бузина.
Дополнительные материалы
Советы врача
Вопрос #58270 24.05.21
Людмила
Панкреатина в порошке нигде нет, взяла Креон 10000, и нашла Ветом только в капсулах, можно добавить в сбор еще корни одуванчика?
Вы знаете, еще у меня постоянно пробки на миндалинах стали, может это инфекция, сдавала на стафилококк — все в норме.
Ответ:
Креон даже лучше! Капсулы Ветома я не очень приветствую, но это лучше, чем ничего.
Гнойные пробки надо удалить механически. Лучше всего для этого подойдут интенсивные полоскания с раствором календулы лекарственной:
— 1 ч.л. спиртовой настойки развести в 150,0 мл питьевой воды, добавить 3 капли йода.
Полоскать не менее 5 раз в день в течение 10 дней.
Источник
Антибиотики прямо под нашим носом
16 августа 2016
Антибиотики прямо под нашим носом
Структурная формула нового пептидного антибиотика.
Автор
Редакторы
Немецкие ученые обнаружили новое оружие для борьбы с больничным монстром — мультирезистентным золотистым стафилококком. Долгие годы оно скрывалось не в вечной мерзлоте или Марианской впадине, а прямо под нашим носом. Вернее — в нём.
В последние годы во всем мире увеличилось количество инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. Организмы с множественной лекарственной резистентностью (multidrug-resistant organisms, MDRO), такие как метициллин-резистентный золотистый стафилококк, нечувствительные к ванкомицину энтерококки или резистентные к цефалоспоринам третьего поколения грамотрицательные бактерии, в ближайшие десятилетия могут стать более частыми причинами смерти, чем рак [1].
Доступные населению антибиотики теряют эффективность, а их частое и необоснованное применение приводит к отбору устойчивых форм бактерий внутри организмов людей и животных. MDRO в человеческом микробиоме трудно выявить, ведь обычно их носительство бессимптомно. Однако в стрессовых условиях (после хирургических операций, при травмах или иммуносупрессии) оно может перерасти в агрессивную инфекцию, побороть которую будет крайне сложно. А если еще учесть и частую устойчивость подобных бактерий к классическим дезинфектантам, становится понятным, почему MDRO считают настоящим бичом стационаров и роддомов. Они — куда более осязаемая угроза для населения всех континентов, чем тот же вирус Эбола, поэтому огромные усилия сейчас направляются на поиск и производство новых антибиотиков, способных «взломать» защитные системы MDRO.
Несколько лет назад удалось обнаружить, что представители человеческой микробиоты способны производить бактериоцины, поражающие близкородственных бактерий [2]. Например, в 2014 году из человеческого комменсала Lactobacillus gasseri выделили и описали новый синтезируемый рибосомами тиопептидный антибиотик — лактоциллин [3].
Может показаться странным, что человеческая микробиота производит антибиотики, ведь индустрия поиска противомикробных веществ всегда была сосредоточена на почвенных бактериях: считалось, что именно там бурлит жизнь и активно идет борьба за существование. Однако в микробиоме человека насчитывается более тысячи видов бактерий, конкурирующих за место и питательные вещества. Это способствует появлению настоящего «оружия массового поражения» — бактериоцинов, производимых с помощью ферментов двух типов — поликетидсинтаз и нерибосомных пептидсинтетаз [5].
Семейные разборки
Немецкий исследователь Александр Ципперер со своими сотрудниками в июле 2016 года сообщил о том, что обнаружил в человеческом носу бактерию Staphylococcus lugdunensis IVK28, которая подавляет рост метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) [1].
Золотистый стафилококк
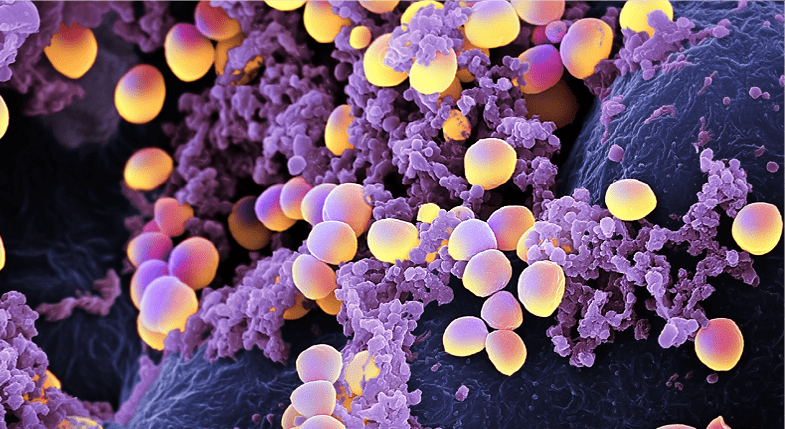
Стафилококки относятся к типичным бактериям-комменсалам, колонизирующим кожу и поверхности слизистых оболочек. Staphylococcus aureus — шаровидные грамположительные бактерии, вырабатывающие каротиноидный пигмент, который придает их клеткам золотистый цвет (рис. 1). Эти микроорганизмы чрезвычайно устойчивы к внешним воздействиям и выживают в воздухе, пыли, почве, продуктах питания, на оборудовании пищевых производств и предметах быта [6], [7].
Рисунок 1. Staphylococcus aureus и лейкоциты.
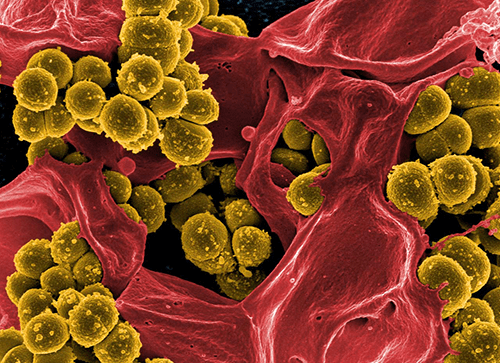
Рисунок 2. Метициллин-резистентные золотистые стафилококки.
Staphylococcus aureus — бактерия условно-патогенная, проявляющая свои патологические свойства только в благоприятных условиях, а создает их, как правило, ослабление иммунитета носителя. Активная жизнедеятельность стафилококка может привести к разнообразным заболеваниям [5], [7], [8]:
- кожи (прыщи, фурункулы, синдром ошпаренной кожи);
- органов дыхания (плеврит, пневмония);
- костной и соединительной тканей (артрит, остеомиелит);
- нервной системы и органов чувств (отит, менингит);
- сердечно-сосудистой системы (эндокардит, флебит, стафилококковая бактериемия).
Факторы патогенности S. aureus — это микрокапсула, компоненты клеточной стенки, ферменты агрессии и токсины. Микрокапсулы защищают клетки бактерий от фагоцитоза, способствуют их адгезии и распространению по организму хозяина. Составляющие клеточной стенки (например пептидогликан, тейхоевые кислоты и белок А) вызывают развитие воспаления, обездвиживают фагоциты и нейтрализуют иммуноглобулины. Коагулаза, главный фермент агрессии, вызывает свертывание плазмы крови [7], [9].
Наиболее опасны метициллин-резистентные стафилококки (methicillin-resistant S. aureus, MRSA) (рис. 2). Метициллин — это модифицированный пенициллин, с помощью которого еще недавно успешно боролись со стафилококковой инфекцией. MRSA устойчивы не только к метициллину, но и к другим антибиотикам пенициллиновой группы (диклоксациллину, оксациллину, нафциллину и др.), а также к цефалоспоринам. В последнее время выявлены штаммы и с более широким спектром устойчивости: ванкомицин-резистентные (VRSA) и гликопептид-резистентные (GISA) [6], [9], [10].
Основные источники заражения золотистым стафилококком — больные со стертой формой инфекции и бессимптомные носители. Наибольшая опасность исходит от медицинского персонала: по некоторым данным, носительство среди медиков может достигать 35% и, в сравнении с основной популяцией, они гораздо чаще «населены» антибиотикорезистентными штаммами. S. aureus может передаваться через руки медперсонала и нестерильные медицинские инструменты, при использовании внутривенных катетеров и проведении искусственной вентиляции легких. После госпитализации носителями золотистых стафилококков становятся 20–30% пациентов, принимавших антибиотики, больных сахарным диабетом или проходивших гемодиализ [7], [10]. В том числе поэтому грамотные врачи призывают обдуманно подходить к госпитализации — прибегать к ней только в случае реальной необходимости и выписываться как можно скорее. Помимо стафилококка и других потенциально мультирезистентных бактерий, среди пациентов, посетителей и персонала там молниеносно распространяются очень неприятные вирусы — рото- и норо-, — только вот предупреждать о внутрибольничных вспышках «туалетных» инфекций редко где считают нужным. Поэтому «пойти полежать для профилактики, прокáпаться» может обернуться немного неожиданной стороной.
Штамм S. lugdunensis IVK28 эффективно боролся со своим вредоносным родственником лишь в условиях недостатка железа и только на твердых агаризованных средах (рис. 3, слева). Механизм противостояния был неясен, а потому Ципперер провел транспозонный мутагенез клеток выделенного штамма — чтобы выявить ген, ответственный за синтез смертельного для S. aureus вещества.
Рисунок 3. Антибактериальная активность S. lugdunensis против метициллин-резистентного S. aureus. Слева — дикий штамм IVK28 образует зону лизиса на культуре S. aureus. В центре — штамм IVK28ΔlugD (с «выключенным» встраиванием транспозона геном lugD) не оказывает влияния на золотистого стафилококка. Справа — штамм с восстановленной активностью гена lugD снова лизирует клетки конкурента.
В итоге удалось получить мутанта IVK28, который не мог подавлять рост MRSA. Анализ места встройки транспозона показал, что тот нарушил структуру гена предполагаемой нерибосомной пептидсинтетазы (НРПС). Оказалось, что этот ген вместе с другими последовательностями, связанными с биосинтезом антибиотиков, входит в состав оперона размером 30 т.п.н. Это указывало на то, что предполагаемая молекула ингибитора может быть комплексом нерибосомных пептидов.
Оперон методом ПЦР обнаружили во всех культурах S. lugdunensis, а значит, он характерен для всего вида, а не только для штамма IVK28. Однако GC-состав оперона (26,9%) отличался от GC-состава остального генома S. lugdunensis (33,8%), что свидетельствовало о возможном заимствовании этого полезного генетического кластера у других видов бактерий — путем горизонтального переноса .
Разношерстные участники и пикантные подробности бактериального горизонтального генетического переноса описаны в статье «Мобильные генетические элементы прокариот: стратификация „общества“ бродяжек и домоседов» [11].
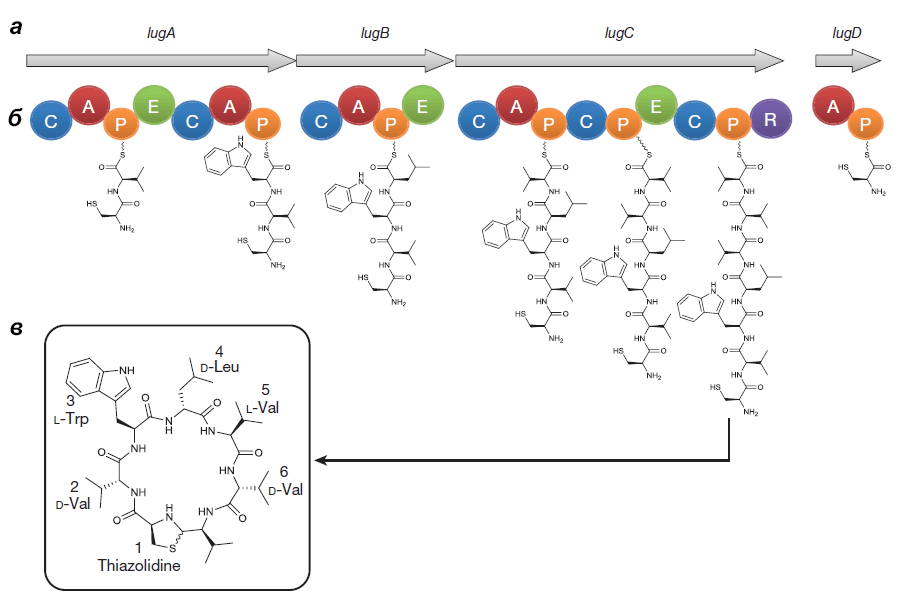
Оперон состоит из генов lugA, B, C и D, кодирующих пептидсинтетазные белки (см. врезку ниже), а также из других генов, чьи продукты необходимы для синтеза и транспорта нерибосомного пептида.
Чтобы окончательно вменить оперону участие в антибактериальной деятельности S. lugdunensis, наименьший ген (lugD) удалили. Мутант ΔlugD, как и ожидалось, не мог подавлять рост золотистого стафилококка, но когда в него ввели плазмиду с работающим геном lugD, агрессивный фенотип восстановился (рис. 3, в центре и справа).
Секретное оружие
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.
Рисунок 4. Кластер генов, биосинтетический путь и химическая структура лугдунина. а — Гены «субъединиц» (не модулей!) нерибосомной пептидсинтетазы S. lugdunensis: lugA, B, C и D. б — Функциональные домены продуктов оперона: А — аденилирующий, Р — пептидильный, С — конденсирующий, Е — эпимеризующий, R — редуктазный. Их специфические комбинации составляют модули — обособленные каталитические единицы фермента. Биосинтез лугдунина начинается, видимо, в инициирующем модуле LugD и продолжается последовательно с помощью LugA-C. в — Структурная формула лугдунина.
Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров — белков, ДНК и пептидогликанов [5].
Нерибосомные пептиды
Этот класс пептидов синтезируется в клетках низших грибов и бактерий без участия рибосом. Нерибосомные пептиды (НРП) также встречаются и у высших организмов, которые имеют бактерий-комменсалов [12].
НРП подразделяются на несколько функциональных групп [13]:
- антибиотики (ванкомицин);
- предшественники антибиотиков (ACV-трипептид — предшественник пенициллина и цефалоспорина);
- иммуносупрессоры (циклоспорин);
- противоопухолевые пептиды (блеомицин);
- сидерофоры (пиовердин);
- токсины (HC-токсин);
- сурфактанты (сурфактин).
Строение
Нерибосомные пептиды имеют длину от 2 до 50 аминокислот и часто циклическую или разветвленную структуру. Они содержат как «обычные», протеиногенные, так и непротеиногенные аминокислоты — D-формы или остатки, модифицированные присоединением N-метильных и N-формильных групп, гликозилированием, гидроксилированием, ацилированием или галогенированием. Циклизация происходит путем образования в пептидном остове оксазолинов и тиазолинов [12].
Синтез
НРП синтезируются нерибосомными пептидсинтетазами (НРПС), которые в своей работе не следуют «чужим» инструкциям, то есть обходятся без мРНК. НРПС — это гигантские мультимодульные ферменты, каждый из которых может синтезировать только один вид пептидов. Отдельный модуль фермента отвечает за включение одной аминокислоты в пептидную цепь, поэтому количество модулей соответствует длине пептида [14].
Каждый модуль состоит как минимум из трех доменов:
- конденсирующего (принимающего пептидную цепь из предыдущего модуля);
- аденилирующего (выбирающего нужную аминокислоту);
- пептидильного (образующего пептидную связь).
Нередко модули включают и другие домены, в том числе эпимеризующий, который преобразует L-аминокислоты в D-формы [14].
По аналогии с триплетным рибосомным кодом для синтеза белка существует и нерибосомный, код НРПС, определяемый 10 остатками аминокислот в субстрат-связывающем кармане аденилирующего домена. От комбинации этих остатков зависит то, какая аминокислота будет встроена в пептид конкретным модулем НРПС. Зная этот код, можно предсказывать субстратную специфичность аденилирующих доменов и даже произвольно изменять ее посредством замены аминокислот в домене [14].
В экспериментах немецких ученых лугдунин действовал не только на метициллин-резистентных стафилококков, но и на гликопротеин-резистентных, и даже на других грамположительных бактерий типа листерии и ванкомицин-резистентного энтерококка (табл. 1). Минимальная ингибирующая концентрация (МИК) нового бактериоцина — 1,5–12 мкг × мл −1 , что говорит о высокой активности вещества. При этом такие концентрации никак не влияли на человеческую сыворотку, не вызывали лизис нейтрофилов или эритроцитов и не ингибировали метаболическую активность моноцитов. Бактериальные же клетки под действием лугдунина в концентрации даже ниже МИК прекращали синтезировать ДНК, РНК, белки и компоненты клеточной стенки. В этом отношении лугдунин напоминает даптомицин, дающий такой же эффект, но способ действия которого пока не изучен. Не было отмечено возникновения резистентности клеток S. aureus к лугдунину даже после их месячного выращивания на малых концентрациях.
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл −1 ) |
|---|---|---|
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 |
| + 50% человеческой сыворотки крови | 1,5 | |
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 |
| Staphylococcus aureus Mu50 | GISA | 3 |
| Staphylococcus aureus SA113 | 3 | |
| Staphylococcus aureus RN4220 | 3 | |
| Enterococcus faecium BK463 | VRE | 3 |
| Enterococcus faecalis VRE366 | VRE | 12 |
| Listeria monocytogenes ATCC19118 | 6 | |
| Streptococcus pneumoniae ATCC49619 | 1,5 | |
| Bacillus subtilis 168 (trpC2) | 4 | |
| Pseudomonas aeruginosa PAO1 | >50 | |
| Escherichia coli DH5α | >50 | |
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. | ||
Испытания в боевых условиях
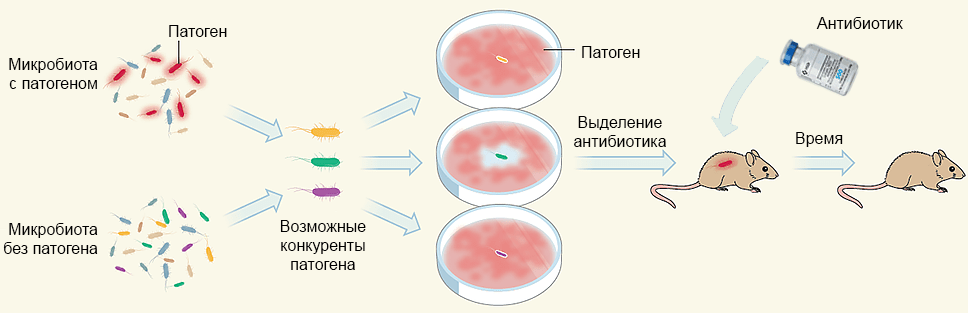
Как и полагается, способность лугдунина лечить стафилококковые инфекции продемонстрировали in vivo на мышиной модели (рис. 5). У шести мышей сбрили шерсть на спине и, повредив кожу многократным приклеиванием/отклеиванием пластыря, нанесли на это место золотистого стафилококка. Затем кожу обработали мазью, содержащей 1,5 мкг лугдунина, и спустя шесть часов оценили результат. Обработка новым антибиотиком сильно сокращала или даже полностью уничтожала популяцию S. aureus. Причем не только на поверхности кожи, но и в более глубоких ее слоях.
Рисунок 5. Общая схема подхода к идентификации природного антибиотика. Из бактериальных популяций человеческого тела отбирают представителей, которые не могут сосуществовать с интересующими патогенными бактериями. Этих возможных конкурентов тестируют по отдельности на средах с инфекционным агентом. Из культуры, успешно подавляющей рост патогенов, выделяют антибиотик, действие которого проверяют на животных моделях.
[5], рисунок модифицирован и адаптирован
Чтобы понять, может ли S. lugdunensis помешать колонизации носовой полости позвоночных животных золотистым стафилококком в естественных условиях, ученые провели следующий эксперимент. В носы хлопковых хомяков ввели два вида смешанных культур (S. aureus + S. lugdunensis IVK28 и S. aureus + S. lugdunensis IVK28ΔlugD) и каждую по отдельности. В контрольных случаях, когда вводили по одному штамму, все три культуры стабильно колонизировали носовую полость. Однако при введении смеси S. aureus + S. lugdunensis IVK28 количество золотистого стафилококка через 5 дней значительно уменьшилось по сравнению со смесью S. aureus + S. lugdunensis IVK28ΔlugD. Этот эксперимент показал, что продукция лугдунина позволяет штамму IVK28 эффективно конкурировать с золотистым стафилококком in vivo.
Оставалось разобраться, предотвращает ли присутствие S. lugdunensis в носу человека колонизацию бактериями S. aureus. Ципперер и его коллеги исследовали мазки из носовых ходов 187 госпитализированных больных. Из них у 60 человек (32,1%) обнаружили золотистого стафилококка и у 17 человек (9,1%) — S. lugdunensis. И только у одного пациента с S. lugdunensis в носу обитал S. aureus. У всех выделенных штаммов S. lugdunensis ПЦР-анализ продемонстрировал наличие lug-оперона, а все обнаруженные штаммы S. aureus оказались восприимчивы к лугдунину.
Перспективы
Из-за высокой эффективности лугдунина авторы обсуждаемой работы предлагают использовать S. lugdunensis в борьбе с золотистым стафилококком, особенно у пациентов с высокими рисками развития инфекции — после операций, иммуносупрессии или гемодиализа. Ранее пробиотическими, как правило, называли бактерий, активно действующих на благо макроорганизма в желудочно-кишечном тракте. Группа Ципперера выступает за расширение понятия «пробиотики» — включение туда бактерий, борющихся с инфекциями и в других местах человеческого тела, таких как носовая полость или кожа.
В очень редких случаях и сам S. lugdunensis может вызывать заболевания, но если удастся создать мутантов, полностью утративших факторы вирулентности, или встроить lug-оперон в абсолютно «мирные» бактерии, можно разработать безопасный пробиотический препарат.
Лугдунин оказался первым обнаруженным бактериоцином нового класса — макроциклических тиазолидиновых пептидных антибиотиков. Все проверенные штаммы S. aureus (как природные, так и лабораторные) не смогли выработать резистентности к нему. Это дает надежду на то, что лугдунин в будущем станет коммерческим препаратом для борьбы с золотистым стафилококком.
И наконец, сам факт обнаружения нового антибиотика у представителя человеческой микробиоты должен послужить стимулом для активизации поиска других продуцентов бактериоцинов в составе именно таких сообществ. В дальнейшем это поможет медикам успешнее сдерживать наступление мультирезистентных патогенов.
Источник