Как лечить лучевой проктит народными средствами
Острые и хронические побочные эффекты возникают после облучения таза, как правило, по поводу рака предстательной железы или женских половых органов. Обычные дозы: рак простаты — 64-74 Гр, рак шейки матки — 45 Гр, рак эндометрия — 45-50 Гр, рак прямой кишки — 25-50,4 Гр, рак мочевого пузыря — 64 Гр.
Очаговое поражение прямой кишки может являться результатом брахитерапии: имплантации радиактивных зерен или внутриполостного облучения. Лучевое поражение может возникать в областях, располагающихся за пределами полей облучения: например, рассеянное облучение может привести к диффузному лучевому энтериту!
Повреждения зависят от общей дозы (обычно > 40 Гр), энергии пучка и очаговой дозы, размера фракции и поля, времени подведения, пролиферации и оксигенации тканей.
В развитии лучевых повреждений выделяют две фазы:
1. Острая: обычно самоограничивающаяся цитотоксичность радикалов и индуцированных повреждений ДНК быстро обновляющихся клеточных популяций (эпителий кишечника, костный мозг, придатки кожи и т.д.).
2. Хроническая: постоянные и необратимые повреждения, связанные с микроишемией в результате облитерирующего эндартериита, дегенерации эндотелия, неоваскуляризации, интерстициального фиброза, разрушения эпителия.
Роль превентивных препаратов (балсалазид, мизопростол, сукральфат и т.д.) при назначении лучевой терапии остается спорной.

а) Эпидемиология:
• Ранние повреждения: 30-70% больных, подвергнутых облучению таза в сроки 
в) Дифференциальный диагноз:
• Рецидив опухоли, ВЗК (язвенный колит, болезнь Крона, недетерминированный колит), ишемический колит, инфекционный колит (включая псевдомембраиозный колит, обусловленный С. difficile), проктиты при ЗППП (например, гонорейный, венерическая лимфогранулема), СРК.
• Внимание: избегайте «быстрого» диагноза/лечения по поводу «геморроя» у больных с облученной прямой кишкой!
г) Патоморфология лучевого проктита и энтерита
Макроскопическое исследование:
• Гиперемированная/отечная слизистая, некрозы, изъязвления/свищевые отверстия, телеангиэктазии, стриктуры, укорочение кишки.
Микроскопическое исследование:
• Острое повреждение: изъязвление эпителия, мегануклеоз, воспаление собственной пластинки, отсутствие митотической активности.
• Хроническое повреждение: фиброз субинтимы артериол (облитерирующий эндартериит), дегенеративные изменения эндотелия, фиброз собственной пластинки, повреждение крипт, гипертрофия Ауэрбаховского сплетения мышечного слоя кишки.
д) Обследование при воспалении кишки после лучевой терапии
Необходимый минимальный стандарт:
• Ригидная или фибросигмоидоскопия: обычно достаточна для установления диагноза, полный осмотр кишки выполняется по общим показаниям.
• Внимание: биопсия патологических образований/язвы передней локализации противопоказана в связи с риском образования ятрогенного ректовагинального/ректовезикального свища!
Дополнительные исследования (необязательные):
• Рентгеноконтрастные исследования (с барием или гастрографином) в случаях невозможности выполнения колоноскопии (например, стриктура) или необходимости определения свищевого хода.
• Виртуальная колоноскопия: роль не определена, имеется риск перфорации.
• МРТ, ПЭТ, ПЭТ-КТ: роль не определена.
• Физиологические исследования: определение функции аноректум (например, адаптационная способность прямой кишки и т.д.).
• Лабораторные исследования: пищевой статус.
• Пассаж по тонкой кишке: признаки «короткой» кишки (укорочение?).
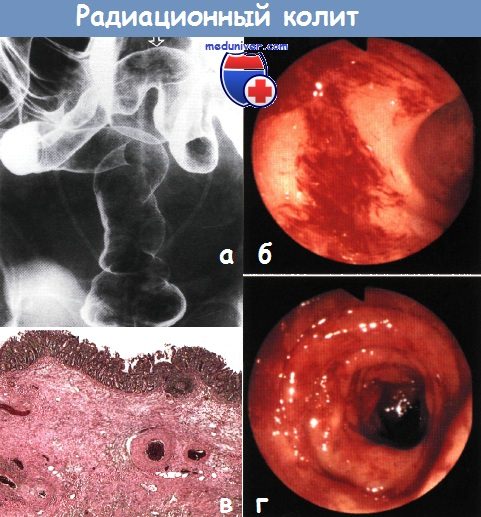
Слизистая оболочка ректосигмоидного соединения и дистальной части сигмовидной кишки (показано стрелкой) мелкозернистая. Стенты мочеточников в правильном положении. Клизма с барием, двойное контрастирование.
б,г — Эндоскопическая картина радиационного колита. Диагноз подтвержден наличием множественных телеангиэктазий.
в — Гистологическая картина лучевого энтерита. Наблюдаются подслизистый фиброз и утолщение стенки сосудов без признаков воспаления.
е) Классификация:
• Лучевой проктит: острый или хронический, локализованный или диффузный.
• Лучевой энтерит: острый или хронический, локализованный или диффузный.
• Вторичные осложнения, связанные с облучением (стриктура, свищ и т.д.).
ж) Лечение без операции воспаления кишки после лучевой терапии:
— Острый лучевой проктит: временные меры (регуляция стула, антидиарейные препараты, уход за перианальной кожей) и терпение; местные лекарственные препараты (сукральфат, стероиды или клизмы с ацетилсалициловой кислотой), отключение кишки при тяжелом, плохо переносимом заболевании.
— Хронические лучевые повреждения: лечение отсутствует, плохое состояние тканей => симптоматическая терапия:
• Антидиарейные препараты и спазмолитики.
• Местные противовоспалительные препараты: свечи/клизмы со стероидами, ацетилсалициловой кислотой, сукральфат, мизопростол.
• Пероральные антибиотики: метронидазол.
• Витаминные добавки: витамины С и Е.
• Потенциальные преимущества полного парентерального питания в домашних условиях.
• Восстановление целостности слизистой толстой кишки: клизма с жирными кислотами с короткой цепью (химически нестабильные соединения, малоприменимые на практике).
• Лазерная аблация: необходимость множественных сеансов.
• Инстилляция формалином: нанесение 50 мл 4% раствора формалина на 2-3 минуты на область поражения с последующим обильным промыванием физраствором. Обычно дает быстрые результаты, могут потребоваться повторные сеансы.
з) Операция при лучевом проктите и энтерите
Показания:
• Выраженные и устойчивые к лечению симптомы: кровотечение, тенезмы, отделяемое, инконтиненция.
• Обструкция: формирование стриктуры.
• Формирование свища.
• Невозможность исключения вероятного рецидива опухоли.
Хирургический подход:
• Иссечение области лучевых повреждений с реконструкцией или без (может быть очень сложным).
• Облегчение симптомов без резекции пораженных тканей: отключение пассажа кала/мочи.
и) Результаты лечения воспаления кишки после лучевой терапии:
• Острые лучевые реакции: самокупирующиеся обычно в течение 6-12 недель.
• Хронические лучевые повреждения: часто можно добиться ответа на консервативное лечение, требуются повторные сеансы лечения. В будущем ожидается снижение тяжелых повреждений (более совершенная техника облучения).
• Анастомозы в области облучения: повышенный риск несостоятельности => рекомендуется формирование временной отключающей стомы.
• Отключение кишки: некоторые симптомы (выделение слизи, крови, болевой синдром) могут сохраняться.
к) Наблюдение. Частые визиты до тех пор, пока сохраняется симптоматика. В дальнейшем — обычное наблюдение.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Как лечить лучевой проктит народными средствами
М.Ф. Осипенко, Е.А. Бикбулатова, А.Б. Логинова
Новосибирский государственный медицинский университет, кафедра пропедевтики внутренних болезней, Новосибирск, Россия
Введение
Радиационно-индуцированное поражение кишечника является одной из наиболее частых проблем пациентов, получающих лучевую терапию по поводу онкологических заболеваний желудочно-кишечного тракта (ЖКТ), гинекологических заболеваний, мочевыводящего тракта. Для описания этого состояния используются различные термины: радиационная энтеропатия, радиационный мукозит, тазовая лучевая болезнь, но чаще – радиационный колит или энтерит. Радиационный проктит используется для описания поражения прямой и сигмовидной кишки. Проявления различной степени тяжести, по данным разных исследований, встречаются у 5–25% пациентов [1–3]. Радиационный энтерит/колит может быть острым или хроническим, при этом хроническая форма может развиваться в сроки от 3 месяцев до 30 лет после лечения, что иногда затрудняет диагностику. Наибольшей чувствительностью обладает эпителий тонкой кишки, поэтому энтерит встречается чаще и протекает тяжелее. При направлении воздействия на малый таз максимуму воздействия подвергается прямая и сигмовидная кишка из-за фиксированного положения. В поздние сроки может возникать постлучевой колоректальный рак [4]. Начальные изменения в кишечнике образуются уже через 2–3 часа после воздействия радиации: ингибирование апоптоза эпителия в криптах, потеря ворсин. Облучение нормальных тканей приводит к образованию реактивных ионов, которые, вступая в реакцию с внутриклеточными молекулами воды, образуют свободные радикалы, такие как гидроксил. Эти радикалы приводят к разрушению ДНК и гибели клеток. Вторично происходит активация генов, способствующих фиброзу путем активации синтеза коллагена и фибронектина. Чем быстрее идут процессы пролиферации в тканях, тем выше их чувствительность к облучению, следовательно, идет быстрее процесс разрушения клеточной мембраны и гибели клеток. Эпителиальные клетки тонкой кишки являются более радиочувствительными по сравнению с толстой кишкой и прямой кишкой [3].
Радиация способствует и функциональным изменениям кишечника: гиперчувствительности к стимулирующим влияниям секретогенных компонентов, росту проницаемости эпителия, изменениям моторики, нарушениям чувствительности к гормонам ЖКТ, нарушению процессов всасывания.
Развитие и степень тяжести радиационного энтерита/колита зависят от следующих факторов: радиационной дозы, длительности облучения, предварительной хирургии брюшной полости, индекса массы тела, коморбидных состояний, таких как сахарный диабет или артериальная гипертензия, параллельная химиотерапия [5].
Клинические проявления лучевого поражения кишечника
Клиника обусловлена не только повреждением слизистой оболочки кишечника, но и замедлением или усилением моторики, избыточным ростом микробной флоры (СИБР – синдром избыточного бактериального роста), уменьшением всасывания желчных кислот, увеличением кишечной проницаемости, мальабсорбции лактозы. Острые повреждения обычно возникают на второй неделе лучевой терапии, пик приходится на 4–5-ю неделю.
К наиболее распространенным симптомам лучевого поражения кишечника относятся диарея, боль в животе, ректальная боль, кишечные кровотечения, мальабсорбция [5]. Более тяжелыми проявлениями, иногда требующими хирургического вмешательства, могут быть кишечная непроходимость, перфорация кишки, свищи. Пациенты с диареей, болями в животе или вздутием должны пройти тестирование на предмет СИБР [3, 5].
Оценка степени тяжести поражения кишечника
Предлагалось много критериев и индексов для оценки степени тяжести поражения кишечника у пациентов, проходящих лучевую терапию, но ни один из них не доказал своей пригодности [3]. Ориентируются на клинику и связь во времени симптомов с облучением, для диагностики осложнений применяются эндоскопия, ультразвуковое исследование, компьютерная и магнитно-резонансная томографии.
К наиболее характерным гистологическим изменениям при взятии биопсии относятся наличие участков гиалиноза в собственной пластинке слизистой оболочки, эктазии капилляров с гиалинозом стенок, наличие облитерирующего эндартериита мелких артерий и артериол со скоплением фибробластов. Дифференциальная диагностика проводится с кишечными инфекциями, рецидивом опухоли, СИБР, внешнесекреторной недостаточностью поджелудочной железы, дебютом воспалительных заболеваний кишечника, псевдомембранозным колитом [3].
Любые мероприятия, направленные на более точное воздействие при облучении уменьшают риск радиационного поражения кишечника. Есть мнение, согласно которому положение на животе с использованием специальной доски под живот во время сеанса лучевой терапии уменьшает радиационную нагрузку на тонкую кишку по сравнению с положением на спине. Вечерние сеансы лучевой терапии приводят к уменьшению частоты и выраженности острого повреждения тонкой кишки.
Подходы к лечению острых и хронических лучевых поражений кишечника
К сожалению, нет никаких достоверных доказательств уменьшения лучевого поражения кишечника при применении каких-либо диет, о чем свидетельствует обзор 22 исследований, касающихся эффективности различных пищевых продуктов. Рассматривались диеты с низким или измененным содержанием жира, диеты с низким или высоким содержанием клетчатки, диеты с низким содержанием лактозы, содержанием пробиотиков и симбиотиков. Что касается пищевых добавок, то было показано, что антиоксиданты, такие как глутамин, аргинин, витамин Е и селен, оказывают защитное действие на слизистую оболочку кишечника крыс, получавших лучевую терапию [5, 6].
Проводятся исследования, направленные на поиск препаратов, уменьшающих поражение кишечника при лучевой терапии. Исследования in vitro подтвердили противовоспалительный, антифибротический и антитромботический потенциал статинов в облученных клетках человека [7]. Например, низкие дозы ловастатина обладают радиозащитным эффектом в отношении эндотелиальных клеток человека [8]. Ретроспективное нерандомизированное когортное исследование 308 пациентов с лучевой терапией таза оценило влияние статинов и ингибиторов ангиотензинпревращающего фермента (АПФ) на развитие симптомов поражения ЖКТ [9]. Симптомы регистрировались проспективно до лучевой терапии, еженедельно во время лечения и 1 год спустя с использованием опросника. Применение статина или статина+ингибитора АПФ во время радикальной лучевой терапии таза значительно уменьшило острые симптомы радиационного колита/энтерита [6]. Предполагается, что комбинация пентоксифиллина как производного ксантина и витамина Е может снизить радиационно-индуцированный фиброз за счет антиоксидантных эффектов [6, 7, 10].
Определенный интерес вызывают пробиотики. Так, было проведено 5 рандомизированных контролируемых исследований различных пробиотиков при радиационно-индуцированной болезни тонкой кишки. Исследовали пробиотический препарат VSL#3 (пробиотик, содержащий 8 штаммов живых молочнокислых бактерий и бифидобактерий), Lactobacillus acidophilus, Bifidobacterium bifidum. Хотя некоторые из исследований показали значительное улучшение в отношении диареи, дизайн исследования и число пациентов пока не позволяют в полной мере рекомендовать пробиотики для профилактики в настоящее время [6, 11].
Предварительные исследования показали протективное действие амифостина – цитопротективного адъюванта, используемого в химиотерапии рака, тедуглютида – аналога человеческого глюкагоноподобного пептида-2, которые показали увеличение выживаемости интестинальных стволовых клеток крипт во время облучения мышей. Флавоноиды гесперидин и кверцетин продемонстрировали снижение уровня фактора некроза опухоли α (ФНО-α) и каспаз у облученных крыс [1, 6].
Подходы к лечению острых и хронических лучевых поражений кишечника имеют некоторые особенности, но в целом носят в основном симптоматический характер (см. таблицу). Проявления острого лучевого энтерита/колита легкой степени тяжести часто проходят самостоятельно в течение нескольких недель. При диарее назначаются лоперамид, дифеноксилат или препараты висмута, а также препараты, воздействующие на моторику кишечника при достаточном употреблении жидкости. При болевом синдроме назначаются спазмолитики или анальгетики, при тошноте или рвоте – противорвотные средства [5, 6].
В более тяжелых случаях применяются синтетический аналог соматостатина октреотид, стероидсодержащие суппозитории, рекомбинантный гранулоцитарный колониестимулирующий фактор при нейтропении, эпидермальный фактор роста. В настоящее время в стадии исследования находятся следующие препараты: Elk-1 ингибиторы, Р-селектин, анти-IL-6R, ингибиторы циклооксигеназы-2, ингибиторы Rho-киназы, маломолекулярные ингибиторы ФНО-α, рекомбинантный человеческий интерлейкин-11 (ИЛ-11) [12].
Высокий потенциал для цитопротекции слизистой оболочки ЖКТ от реактивного кислорода и активированных нейтрофилов имеет препарат ребамипид. Ребамипид в исследованиях нормализировал число бокаловидных клеток, удалял гидроксильные радикалы и ингибировал активацию нейтрофилов. Ребамипид значительно (дозозависимо) индуцировал экспрессию мРНК в радиационно поврежденной ткани толстой кишки мышей, восполнял потери клаудинов-3 и -4 [13].
Пероральные антибиотики назначают пациентам с подозрением на СИБР, при этом наиболее распространенными изолятами из тощей кишки являются виды Escherichia coli, Streptococcus, Lactobacillus, Bacteroides и Enterococcus. Используются антибиотики широкого спектра действия: тетрациклин, ко-амоксиклав, ципрофлоксацин и рифаксимин.
При проктитах эффективны клизмы с сукральфатом – высокосульфатированным полианионным дисахаридом. Он стимулирует заживление эпителия и образует защитный барьер на поврежденной поверхности слизистой оболочки, уменьшает кровоточивость, что подтверждено в рандомизированных исследщваниях [3, 6]. Но сукральфат не применяется в лечении радиационно-индуцированной болезни тонкой кишки.
Глюкокортикостероиды и аминосалицилаты используются только при тяжелых и среднетяжелых формах. Как средства выбора широко применяют преднизолон и метилпреднизолон в дозе 0,5–1 мг/кг массы тела с последующим снижением дозы.
При наличии мальабсорбции рекомендуются питание с высокой калорийностью и повышенным уровнем белка, большой объем жидкости, безлактозная низкожировая диета, диета с низким содержанием волокон, среднецепочечные триглицериды (MCFA – medium chain fatty acids), энтеральное и парентеральное питание. Госпитализация требуется только при необходимости парентерального питания.
При неэффективности консервативной терапии применяется лазеротерапия – аргоноплазменная коагуляция, особенно хорошо зарекомендовавшая себя в коррекции радиационной проктопатии, или эндоскопическое прижигание с использованием нагревателя, зонда BICAP [5, 6, 14]. Хирургические вмешательства, иногда повторные, требуются вследствие образования кишечных стриктур, свищей, кровотечений и перфораций. Хирургический подход к лечению радиационного энтерита имеет высокий риск послеоперационных осложнений (около 30%): внутрибрюшной абсцесс, свищи, послеоперационный перитонит [3, 5, 12].
Заключение
Ведение пациентов с постлучевыми поражениями кишечника требует полидисциплинарного подхода. Лучевой энтерит ведет к длительной (или постоянной) потере трудоспособности и прогностически расценивается как неблагоприятный. Прогноз при лучевом поражении толстой кишки более благоприятен, но при развитии язвенно-некротических изменений нередко сопровождается осложнениями, требующими хирургического лечения (у 20%). Наличие одновременного поражения всех отделов кишечника ухудшает прогноз заболевания, но при своевременно начатом и интенсивном лечении 80% пациентов удается добиться облегчения состояния и даже длительной ремиссии заболевания. К летальным исходам могут приводить перфорации кишки, перитониты, межкишечные свищи и рецидивирующие массивные кровотечения, а также осложнения в виде злокачественных заболеваний кишечника [15].
Литература
1. Guven B., Can M., Piskin O., et al. Flavonoids protect colon against radiation induced colitis. Regul. Toxicol. Pharmacol. 2019;104:128–32. Doi: 10.1016/j.yrtph.2019.03.006.
2. Gerassy-Vainberg S., Blatt A., Danin-Poleg Y., et.al. Radiation induces proinflammatory dysbiosis: transmission of inflammatory susceptibility by host cytokine induction. Gut. 2018;67(1):97–107. Doi: 10.1136/gutjnl-2017-313789.
3. Waheed A., Fatima R., Aziz M. Radiation Enteritis. Source Stat Pearls. Treasure Island (FL): StatPearls Publishing. 2019.
4. Sasaki K., Ishihara S., Hata K., et al. Radiation-associated colon cancer: A case report. Mol. Clin. Oncol. 2017;6(6):817–20. Doi: 10.3892/mco.2017.1252.
5. Andreyev H., Davidson S., Gillespie C., et al. Practice guidance on the management of acute and chronic gastrointestinal problems arising as a result of treatment for cancer. Gut. 2012;61:179–92.
6. Rhodri S., John T. Green. Radiation-induced small bowel disease: latest developments and clinical guidance. Ther Adv Chronic Dis. 2014;5(1):15–29. Doi: 10.1177/2040622313510730.
7. Gaugler M., Vereycken-Holler V., Squiban C., et al. Pravastatin limits endothelial activation after irradiation and decreases the resulting inflammatory and thrombotic responses. Radiat Res. 2005;163(5):479–87.
8. Hülsenbeck J., Herzog M., Schad A., et al. Lovastatin attenuates ionizing radiation-induced normal tissue damage in vivo. Radiother Oncol. 2009;92:492–99.
9. Silia F., Benton B., Lalji A., Thomas K., et al. Evaluating the efficacy of statins and ACE-inhibitors in reducing gastrointestinal toxicity in patients receiving radiotherapy for pelvic malignancies. Eur J Cancer. 2012;48:2117–24.
10. Delanian S., Monceau V., Vozenin M. Therapeutic management of intestinal fibrosis induced by radiation therapy: from molecular profiling to new intervention strategies et vice et versa. Fibrogen Tiss Repair. 2012;5(Suppl. 1):S13.
11. Spyropoulos B., Misiakos E., Fotiadis C., et al. Antioxidant properties of probiotics and their protective effects in the pathogenesis of radiation-induced enteritis and colitis. Dig Dis Sci. 2011;56(2):285–94. Doi: 10.1007/s10620-010-1307-1.
12. Kountouras J., Zavos С. Recent advances in the management of radiation colitis. World J Gastroenterol. 2008;14(48):7289–301. Doi: 10.3748/wjg.14.7289.
13. Jang H., Park S., Lee J., et al. Rebamipide alleviates radiation-induced colitis through improvement of goblet cell differentiation in mice. J Gastroenterol Hepatol. 2018;33(4):878–86. Doi: 10.1111/jgh.14021.
14. Qadeer M., Vargo J. Approaches to the prevention and management of radiation colitis. Curr Gastroenterol Rep. 2008;10(5):507–13.
Источник



