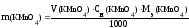Использование перманганатометрии для анализа лекарственных веществ
4.6. ОСНОВНЫЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ МЕТОДЫ АНАЛИЗА
Перманганатометрия – один из наиболее часто применяемых методов окислительно-восстановительного титрования. В качестве титранта используют раствор перманганата калия, окислительные свойства которого можно регулировать в зависимости от кислотности раствора.
Особенности и возможности метода
Наибольшее распространение в аналитической практике получил перманганатометрический метод определения в кислых средах: восстановление М n О4 — до М n 2+ проходит быстро и стехиометрично:
М n О4 — + 8Н + + 5 е — → М n 2+ + 4Н2О.
Особенностью метода является сильное влияние pH на Е о системы (М n О4 — + 8Н + )/М n 2+ . При титровании в сильно кислых средах чаще всего используют серную кислоту. Хлороводородную и азотную кислоты применять не следует, так как в их присутствии могут идти конкурирующие окислительно-восстановительные реакции. Восстановление перманганат-иона в щелочной среде протекает последовательно: сначала до мангант-иона М nO 4 2- , а затем до диоксида марганца М n О2:
Количественно восстановление перманганата в щелочной среде до манганата протекает в присутствии соли бария. Ва(М n О4)2 растворим в воде, в то время как ВаМ n О4 – нерастворим (ПРВаМ n О4 = 2,46 . 10 -10 ), поэтому дальнейшего восстановления до MnO 2 из осадка не происходит.
Перманганатометрически в щелочной среде, как правило, определяют органические соединения: формиаты, формальдегид, муравьиную, коричную, винную, лимонную кислоты, гидразин, ацетон и др.
Признаком окончания титрования служит бледно-розовая окраска избытка титранта КМ n О4 (одна капля 0,004 моль/л раствора титранта придает заметную окраску 100 мл раствора). Поэтому, если титруемый раствор бесцветен, о достижении точки эквивалентности можно судить по появлению бледно-розовой окраски избытка титранта КМ n О4 при титровании прямым способом или по исчезновению окраски при обратном титровании. При анализе окрашенных растворов рекомендуется использовать индикатор ферроин.
К достоинствам перманганатометрического метода относят: 1) возможность титрования раствором КМ n О4 в любой среде (кислой, нейтральной, щелочной); 2) применимость растворов перманганата калия в кислой среде для определения многих веществ, которые не взаимодействуют с более слабыми окислителями; 3) стехиометричность и достаточно высокую скорость большинства окислительно-восстановительных реакций с участием М n О4 — при оптимально выбранных условиях ; 4) возможность титрования без индикатора; 5) доступность перманганата калия.
Наряду с перечисленными достоинствами, метод перманганатометрии имеет ряд недостатков: 1) титрант КМ n О4 готовят как вторичный стандарт, поскольку исходный реагент – перманганат калия – трудно получить в химически чистом состоянии; 2) реакции с участием М n О4 — возможны в определенных условиях (рН, температура и т.д.); 3) титрование раствором КМ n О4 не рекомендуется проводить в присутствии С1 — , что затрудняет определение некоторых веществ, поскольку НС1 часто применяют для растворения минеральных объектов.
Перманганатометрию используют в следующих целях :
1 Определение восстановителей. Если окислительно-восстановительная реакция между определяемым восстановителем и М n О4 — протекает быстро, то титрование проводят прямым способом. Так определяют оксалаты, нитриты, пероксид водорода, железо ( II ), ферроцианиды, мышьяковистую кислоту и др., например:
5[ Fe ( CN )6] 4- + М n О4 — + 8Н + → 5 [ Fe ( CN )6 ] 3- + М n 2+ + 4Н2О,
5А s III + 2М n О4 — + 16Н + → 5А s v + 2М n 2+ + 8Н2О.
В случае замедленных реакций определение проводят способом обратного титрования избытка перманганата.
Так определяют муравьиную, поли- и оксикарбоновые кислоты, альдегиды и другие органические соединения, например:
НСОО — + 2MnO4 — + 3OH — → CO3 2- + 2MnO4 2- + 2 Н 2 O
Затем избыток перманганата оттитровывают щавелевой кислотой или оксалатами:
2 Определение окислителей. Добавляют избыток стандартного раствора восстановителя и затем титруют его остаток раствором KMnO 4 (способ обратного титрования). Например, дихроматы, персульфаты, хлориты и другие окислители можно определять перманганатометрическим методом, подействовав сначала избытком стандартного раствора Fe 2+ , а затем оттитровав непрореагировавшее количество Fe 2+ раствором KMnO 4:
Cr2O7 2- + 6Fe 2+ + 14H + → 2Cr 3+ + 6Fe 3+ + 7H 2O
Титрование избытка ионов Fe 2+ проводят перманганатом (вспомогательным рабочим раствором):
5Fe 2+ + MnO — 4 + 8H + → 5Fe 3+ + Mn 2+ + 4H2O.
3 Определение веществ, не обладающих окислительно-восстановительными свойствами, проводят косвенным способом, например титрованием по замещению. Для этого определяемый компонент переводят в форму соединения, обладающего восстановительными или окислительными свойствами, а затем проводят титрование. Например, ионы кальция, цинка, кадмия, кобальта осаждают в виде малорастворимых оксалатов
Осадок отделяют от раствора, промывают и растворяют в H 2 SO 4:
4 Определение органических соединений. Отличительной особенностью реакций органических соединений с MnO 4 — является их малая скорость. Определение возможно, если использовать обратное титрование: анализируемое соединение предварительно обрабатывают избытком сильнощелочного раствора перманганата и дают возможность реакции протекать необходимый период времени. Остаток перманганата титруют раствором оксалата натрия. Например, при определении глицерина протекают реакции:
Приготовление и стандартизация раствора перманганата калия
Титрованный раствор перманганата калия по точной навеске кристаллического препарата приготовить невозможно, так как в нем всегда содержится некоторое количество MnO 2 и другие продукты разложения. Перед установлением точной концентрации раствор KMnO 4 выдерживают в темной склянке в течение 7…10 дней. За это время происходит окисление восстановителей, присутствие которых в дистиллированной воде полностью исключить не удается (пыль, следы органических соединений и т.д). Для ускорения этих процессов раствор перманганата калия иногда кипятят. Необходимо учитывать, что вода обладает окислительно-восстановительными свойствами и может восстанавливать перманганат. Эта реакция идет медленно, но MnO 2 и прямой солнечный свет катализирует процесс разложения KMnO 4, поэтому через 7…10 дней осадок MnO 2 необходимо удалить. Раствор KMnO 4 обычно осторожно сливают с осадка или фильтруют через стеклянный фильтр. Приготовленный таким образом раствор KMnO 4 не слишком низкой концентрации (0,05 н. и выше, f = 1/5) не изменяет титр продолжительное время. Титр раствора перманганата калия устанавливают по безводному оксалату натрия Na 2 C 2 O 4 или дигидрату щавелевой кислоты Н2С2О4 . 2Н2О. Реакция взаимодействия перманганата калия со щавелевой кислотой относится к типу автокаталитических
Она катализируется ионами Mn 2+ . Первые капли перманганата даже в горячем растворе обесцвечиваются очень медленно. В ходе титрования концентрация ионов Mn 2+ возрастает, и скорость реакции увеличивается: реакция сама себе поставляет катализатор.
Титр перманганата калия можно установить также по оксиду мышьяка ( III ) или металлическому железу. Использование для установки титра металлического железа особенно целесообразно, если в дальнейшем предполагается перманганатометрическое определение этого элемента.
В перманганатометрии применяют также растворы восстановителей – соли Fe ( II ), щавелевую кислоту и некоторые другие – для определения окислителей методом обратного титрования. Соединения Fe ( II ) на воздухе медленно окисляются, особенно в нейтральном растворе. Подкисление замедляет процесс окисления, однако обычно рекомендуется перед применением раствора F е( II ) в анализе проверить его титр. Оксалаты и щавелевая кислота в растворе медленно разлагаются:
Этот процесс ускоряется на свету, поэтому растворы оксалатов рекомендуется хранить в темных склянках. Подкисленные растворы оксалатов более устойчивы, чем нейтральные или щелочные.
Источник
12. Перманганатометрия: сущность метода, общая характеристика, область применения.
Перманганатометрический метод анализа основан на реакциях окисления восстановителей перманганатом калия. Перманганат калия является одним из сильнейших окислителей.
В зависимости от концентрации ионов водорода в растворе, восстановление перманганат-иона протекает различным образом.
В сильнокислой среде МnO4 − восстанавливается до Мn 2+ :
МnO4 − + 8Н + + 5е Мn 2+ + 4Н2О (2.1)
Е 0 (MnO4 – /Mn 2+ ) = + 1,51 В,
В слабощелочной, нейтральной или слабокислой среде МnO4 − восстанавливается до МnO2:
В анализе некоторых органических веществ используется титрование в сильнощелочной среде:
Е 0 (MnO4 – / MnO4 2– ) = + 0,56 В
Перманганатометрия широко используется для определения:
— восстановителей: Fe 2+ , Sn 2+ , SO3 2− , S2O3 2− , NO2 − , S 2− , I − , Br − , различных органических соединений и др. (обычно используется метод прямого титрования):
5Fe 2+ + MnO4 – + 8H + = 5Fe 3+ + Mn 2+ + 4H2O (2.4)
Если восстановитель с перманганатом взаимодействует медленно, применяют обратное титрование. Для этого к раствору восстановителя приливают точно измеренный объем перманганата калия, заведомо взятого в избытке; после завершения окислительно-восстановительной реакции избыток не вступившего в реакцию перманганата оттитровывают стандартным раствором другого восстановителя (щавелевая кислота, оксалаты, соли железа (II) и т.п.)
— окислителей: Fe 3+ , NO3 − , ClO3 − , Cr2O7 2− , H2O2 и др. (метод обратного титрования). Окислители восстанавливают титрованным раствором восстановителя и избыток последнего оттитровывают перманганатом калия. Например, к раствору К2Cr2O7 (окислителя) добавляют избыток соли Мора (восстановителя), бихромат восстанавливается по уравнению:
6 Fe 2+ + Cr2O7 2− + 14 H + → 6 Fe 3+ + 2 Сr 3+ + 7 H2O
Избыток соли Мора, не вступившей в реакцию, титруют раствором перманганата по реакции (2.4).
— веществ, не проявляющих окислительно-восстановительных свойств, но способных реагировать с окислителями или восстановителями: Ca 2+ , Sr 2+ , Ba 2+ , Pb 2+ , Zn 2+ и др. (метод обратного титрования или метод замещения). Например, при определении кальция в анализируемый раствор, содержащий ионы Ca 2+ , добавляют вспомогательный реагент – оксалат натрия или аммония; при этом образуется эквивалентное количество осадка оксалата кальция:
В методе обратного титрования оксалат берут заведомо в избытке, осадок обычно отделяют, избыток оксалата титруют перманганатом:
При использовании метода замещения осадок оксалата кальция отфильтровывают, промывают водой и растворяют на фильтре серной кислотой:
Выделяется эквивалентное количество щавелевой кислоты, которую титруют раствором перманганата по реакции (2.5).
Обычно в перманганатометрии применяют титрование в кислой среде т.к. в этом случае окислительная способность перманганата калия значительно выше. Кроме того, в кислой среде образуются бесцветные ионы Мn 2+ , а в нейтральной и щелочной средах – бурый осадок МnO2, который затрудняет фиксирование точки эквивалентности. Для создания среды при определении концентрации титруемых растворов чаще всего применяют серную кислоту, т. к. азотная кислота сама является сильным окислителем и может способствовать протеканию нежелательных побочных процессов, а соляная кислота окисляется перманганатом калия до свободного хлора.
Однако, многие вещества (особенно органические) определяют в нейтральной и щелочной средах, т. к. они количественно окисляются только в присутствии щелочи, а в кислых растворах такие соединения окисляются лишь частично (например, сульфиты, сульфиды, тиосульфаты, гидразин и др.). При определении органических соединений используется восстановление перманганата по схеме (2.3). Органические соединения при этом обычно окисляются до карбоната. По окончании реакции восстановления перманганата в щелочной среде раствор подкисляют и титруют избыток MnO4 − раствором подходящего восстановителя. Например, метанол в щелочной среде окисляется перманганатом по реакции:
Для осаждения манганат-иона в раствор заранее вводят BaCl2 . Этим методом можно определить также муравьиную, винную, лимонную, салициловую и другие кислоты, глицерин, фенол, формальдегид и другие органические соединения.
При титровании перманганатом в большинстве случаев не требуется индикатор, т.к. даже очень разбавленные растворы его интенсивно окрашены, и одна лишняя капля KMnO4 окрашивает раствор в розовый цвет, появление которого свидетельствует о завершении реакции титрования.
По сравнению с другими методами окислительно-восстановительного титрования рассматриваемый метод отличается рядом достоинств.
1. Т.к. одна капля раствора KMnO4 даже при концентрации его, равной 0,01 н., окрашивает в конце титрования 50 мл раствора в отчетливый розовый цвет, титрование можно проводить, не прибегая к использованию индикаторов по появлению розовой окраски при прямом титровании или по её исчезновению при обратном.
2. Титрование перманганатом можно осуществлять в кислой и щелочной средах.
3. Перманганат имеет очень высокий окислительно-восстановительный потенциал (в кислой среде Е 0 (MnO4 – /Mn 2+ ) = + 1,51 В). Поэтому многие вещества, которые невозможно оттитровать более слабыми окислителями, можно определять методом перманганатометрии.
4. Перманганат является дешевым и легкодоступным реагентом.
5. Перманганат можно применять для определения веществ, не обладающих окислительно-восстановительными свойствами (см. выше).
Перманганатометрический метод имеет и некоторые недостатки.
1. Перманганат калия трудно получить в химически чистом виде, поэтому точную концентрацию приготовленного раствора необходимо устанавливать путем стандартизации.
2. Растворы перманганата со временем меняют свой титр, поэтому в процессе использования их необходимо периодически проверять.
3. Титрование не следует проводить в солянокислых растворах, т.к. перманганат окисляет ионы Cl − до свободного хлора.
4. Некоторые реакции окисления перманганатом протекают при комнатной температуре очень медленно, поэтому иногда требуется нагревание растворов.
Приготовление раствора перманганата калия.
Основным рабочим раствором метода является 0,1 н. или 0,05 н. раствор KMnO4. Перманганат калия реактивной квалификации (ч.д.а. – чистый для анализа или х.ч. – химически чистый) всегда содержит примеси продуктов восстановления МnO2, следовые количества иона Мn 2+ . При растворении перманганата калия в воде в присутствии Мn 2+ происходит реакция:
2 МnO4 − + 3 Мn 2+ + 2 Н2О 5 МnO2 + 4 Н + ,
но даже в отсутствии Мn 2+ реакция разложения перманганата калия катализируется твердым диоксидом марганца. Разложение KMnO4 протекает по уравнению:
Кроме того, органические вещества, находящиеся в дистиллированной воде или на поверхности сосуда для хранения, восстанавливают перманганат-ион до МnO2 . Вследствие этого концентрация раствора KMnO4 в первое время после приготовления несколько уменьшается. Отсюда следует, что приготовить титрованный раствор перманганата по точной навеске нельзя. Обычно свежеприготовленный раствор перманганата выдерживают 7-10 дней (или кипятят в течение 1-2 часов) для завершения окислительно-восстановительных процессов. По истечении этого времени выделившийся осадок МnO2 отфильтровывают через невосстанавливающийся фильтр (пористый стеклянный или воронку со стеклянной ватой) или сливают раствор при помощи сифона. Приготовленный раствор хранят в темных бутылях со стеклянными пробками.
Навеска перманганата калия для приготовления раствора рассчитывается по формуле:
Из уравнения МnO4 − + 8 Н + + 5е Мn 2+ + 4 Н2О следует, что
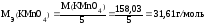
Точную концентрацию приготовленного раствора перманганата калия устанавливают путем стандартизации. Наиболее удобными стандартными веществами являются щавелевая кислота H2C2O4 ˙ 2H2O и ее соли – оксалаты, т.к. они легко могут быть очищены от примесей перекристаллизацией из раствора.
Стандартизация раствора перманганата калия по щавелевой кислоте
Реакция окисления щавелевой кислоты перманганатом калия выражается суммарным уравнением
MnO4 − + 8 H + +5e → Mn 2+ + 4 H2O ↑ 2
В действительности процесс протекает значительно сложнее, с образованием промежуточных соединений и для его начала необходимо присутствие в растворе хотя бы следов Mn 2+ . Анионы MnO4 − медленно реагируют с ионами щавелевой кислоты непосредственно, но быстро – с ионами Mn 2+ :
Манганат-ион MnO4 2− в кислом растворе быстро диспропорционирует:
Mn (VI) + Mn (II) = 2 Mn (IV)
Mn (IV) + Mn (II) = 2 Mn (III)
Марганец (III) образует оксалатные комплексы состава Mn(C2O4)n (3−2 n )+ , где n = 1, 2, 3; они медленно разлагаются с образованием Mn 2+ и CO2.
Таким образом, реакция (3.4) является автокаталитической, катализатором которой служат ионы Mn 2+ . Пока в растворе присутствует незначительное количество Mn 2+ , реакция протекает очень медленно. Когда же концентрация Mn 2+ достигает определенной величины, реакция начинает протекать с большой скоростью.
Сложный характер процесса обуславливает ряд особенностей при титровании щавелевой кислоты перманганатом калия. Установлено, что наиболее воспроизводимые и точные результаты получаются, если около 90 % необходимого количества перманганата добавлять при комнатной температуре и слабом перемешивании, затем повысить температуру до 70-80 0 С и закончить титрование при 55-60 0 С.
Источник