- Институт сертификации лекарственных средств
- Институт сертификации лекарственных средств
- Об институте
- Институт сертификации лекарственных средств
- Сертификат GMP: подтверждение качества лекарственных средств
- К каким производствам применима эта процедура?
- Нормативная база
- Преимущества обладания сертификатом
- Стандарт GMP в международной практике
- Правила GMP в России
- Процедура получения сертификата в России
- Документы для сертификации
- Сроки сертификации
- Стоимость получения сертификата
Институт сертификации лекарственных средств
- ФГБУ «ВГНКИ»
- Руководство
- Структура
- Испытательный центр
- Структурные подразделения
- Служба экспертизы лекарственных средств, кормовых добавок и фармаконадзора
- Орган инспекции
- Отдел «Клинико-диагностический центр»
- Орган по сертификации
- Информационно-методический центр по обеспечению аккредитации
- Отдел инспекции производства на соответствие требованиям надлежащей производственной практики
- Служба капитального строительства
- Юридическая служба
- О нас
- История
- Основные направления деятельности
- Деятельность
- Лицензии, санитарно-эпидемиологические заключения, сертификаты, аттестаты аккредитации
- Метрологическая экспертиза документов и аттестация методик измерений
- Наука
- МСИ
- Рабочая группа по разработке фармакопейных статей в ФГБУ «ВГНКИ»
- Бланк заявки
- Анкета качества обслуживания
- Отдел «Всероссийская коллекция штаммов микроорганизмов»
- Пресс-центр
- Новости
- Видео
- Фотоотчеты
- Пресса о нас
- Полезные ссылки
- Контакты
- База знаний
- COVID-19
- В ФГБУ «ВГНКИ» прошел обучающий семинар по принципам ХАССП в пищевой промышленности
- Вакансии
- Реконструкция территории
- Реконструкция территории ФГБУ «ВГНКИ»
- Реконструкция территории «Манихино»
- Для сотрудников
- Запросы о необходимости регистрации
- Охрана труда
- Контакты
- Испытательный центр
- О нас
- Область аккредитации
- Структурные подразделения
- Испытательный центр
- Отдел качества
- Отдел приема образцов и учета результатов исследований
- Отдел «Всероссийская коллекция штаммов микроорганизмов»
- Сектор биобезопасности и санитарного режима
- Сектор договорной работы
- Подать заявку
- Порядок обращения в ИЦ
- Схема движения образца
- Прайс
- Типовой договор
- Анкета
- Подать жалобу/претензию
- Вопрос-ответ
- Контакты
- Клинико-диагностический центр
- Услуги и цены
- Образование
- Дополнительное профессиональное образование
- Отдел «Научно-методический базовый центр»
- Учебные программы
- Дистанционное обучение
- Планы мероприятий
- Ближайшие обучающие мероприятия
- Аспирантура
- Диссертационный совет
- Дополнительное профессиональное образование
- Подготовка к аккредитации
- Информационно-методический центр по обеспечению аккредитации
- Противодействие коррупции
Федеральное государственное бюджетное учреждение «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ») осуществляет научную и научно-техническую деятельность, направленную на обеспечение качества лекарственных средств для ветеринарного применения, кормов и безопасности в ветеринарно-санитарном отношении продукции животного и растительного происхождения, а также стандартизации и обеспечения качества, проведения экспертизы и сертификации лекарственных средств для ветеринарного применения и кормов, кормовых добавок, в том числе содержащих ГМО.
Федеральное государственное бюджетное учреждение «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ») является Центром Международной организации по охране здоровья животных (МЭБ) по безопасности пищевой продукции, диагностике и борьбе с болезнями животных для стран Восточной Европы, Центральной Азии и Закавказья.
ФГБУ «ВГНКИ» является основателем Системы сертификации ветеринарных препаратов в Российской Федерации и разработчиком организационно-методических документов системы, в том числе «Правил проведения сертификации ветеринарных препаратов».
Источник
Институт сертификации лекарственных средств
Об институте
ФБУ «Государственный институт лекарственных средств и надлежащих практик» (ФБУ «ГИЛС и НП») является подведомственным учреждением Министерства промышленности и торговли Российской Федерации, уполномоченным с 2015 года на проведение инспектирования производителей лекарственных средств для медицинского применения, производство которых осуществляется за пределами Российской Федерации, на соответствие требованиям правил GMP в целях выдачи заключений о соответствии производителя лекарственных средств требованиям правил надлежащей производственной практики.
Институт был основан в 1973 году как Всесоюзный НИИ технологии кровезаменителей и гормональных препаратов и по сей день является крупным научно-исследовательским центром в области R&D.
Помимо инспектирования производственных площадок на соответствие GMP и разработки новых лекарственных форм, «ГИЛС и НП» осуществляет следующие виды деятельности:
- Инженерные практики и квалификация чистых помещений
- Мониторинг отраслевых рынков и государственных программ:
- Организационно-аналитическое сопровождение и мониторинг хода реализации государственной программы Российской Федерации «Развитие фармацевтической и медицинской промышленности»
- Сбор и анализ данных по производству лекарственных средств и медицинских изделий на территории Российской Федерации, анализ продуктового портфеля российских и зарубежных предприятий
- Сбор и обработка информации для формирования информационных баз по проектным задачам
- Мониторинг перехода производителей лекарственных средств к маркировке лекарственных препаратов средствами идентификации с использованием криптографической защиты.
В структуру «ГИЛС и НП» входит медицинский центр. В конце 2017 года разработана и запущена в реализацию «Совместная программа содействия внедрению лучших образцов надлежащих практик в российской фармацевтической отрасли», направленная на интенсификацию работы по анализу опыта инспектирования и развитие соответствующих компетенций сотрудников инспектората, проработку проблемных ситуаций, связанных с применением стандартов GMP, подготовку тематических модулей и создание обучающих кейсов, а также на организацию дальнейшей эффективной трансляции результатов этой работы на российские предприятия.
Инспекторат «ГИЛС и НП» ведет регулярную работу в области установления сотрудничества с регуляторами других стран. На конец 2020 года ФБУ «ГИЛС и НП» Минпромторга России подписало 12 соглашений о двустороннем сотрудничестве с иностранными инспекторатами. Также Институт осуществляет международное сотрудничество с ключевыми отраслевыми международными организациями.
Источник
Институт сертификации лекарственных средств
Национальный научный центр фармацевтической оценки и экспертизы
Национальный научный центр фармацевтической оценки и экспертизы ФБУ «ГИЛС и НП» Минпромторга России (далее Центр экспертизы) создан с целью оказания комплексной экспертизы проектов для государственных органов, инвестиционных фондов, фармацевтических предприятий, производителей лекарственных средств и медицинских изделий.
Согласно распоряжению Правительства Российской Федерации от 12.04.2020 г. № 994-р, ФБУ «ГИЛС и НП» Минпромторга России является научной организацией, имеющей право проводить научные исследования рынка лекарственных препаратов, выдавать экспертные научные заключения по вопросам обращения лекарственных средств. Центр экспертизы создан с целью поддержки реализации государственной программы «Развитие фармацевтической и медицинской промышленности» (согласно Постановлению Правительства Российской Федерации от 15 апреля 2014 года № 305, с изменениями на 29 марта 2019 года), а также с целью повышения научно-технического потенциала отрасли.
Национальный научный центр фармацевтической оценки и экспертизы проводит экспертизу качества, безопасности и эффективности лекарственных препаратов, медицинских изделий, лекарственных препаратов для ветеринарного применения и парфюмерно-косметической продукции. Оценка перспективности проектов.
Ключевой задачей Центра экспертизы является реализация государственного курса на экспертную оценку всех финансируемых проектов, а также удовлетворение потребности фармацевтической отрасли в едином независимом отраслевом экспертном центре.
Источник
Сертификат GMP: подтверждение качества лекарственных средств
Сертификат GMP — это соблюдение изготовителем лекарственных препаратов требований надлежащей производственной практики. В России они сформулированы в национальном стандарте ГОСТ Р 52249-2009, который идентичен правилам, действующим в Европейском Союзе.
К каким производствам применима эта процедура?
В настоящее время в странах, которые контролируют соответствие стандарту GMP на своих территориях, его правила применяются для проверки качества следующих категорий продукции:
- лекарственные препараты;
- медицинские изделия различного назначения, включая те из них, которые применяются в диагностических целях;
- продукты питания и ингредиенты для их производства;
- биологически активные добавки.
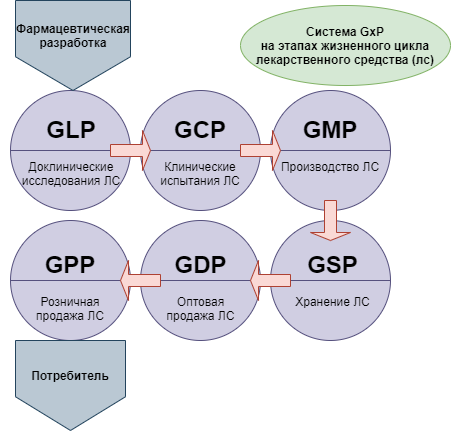
При этом для понимания ситуации следует принимать во внимание, что новая версия сертификации GMP — это не единственная система требований, которые в международной практике применяются в целях стандартизации медицинского обслуживания населения. Кроме них, производителям, работающим в такой сфере как фармация, необходимо соответствовать требованиям комплекса правил, объединенных под общим наименованием GxP:
- GLP — Good Laboratory Practice (надлежащая лабораторная практика);
- GCP — Good Clinical Practice (надлежащая клиническая практика);
- GDP — Good Distributon Practice (надлежащая дистрибьюторская практика);
- GACP — Good Agricultural and Collection Practice (надлежащая практика культивирования и сбора лекарственных растений).
Нормативная база
В Российской Федерации получение сертификата GMP осуществляется на основании действующей нормативной базы, включающей следующие основные правовые акты:
- национальный стандарт РФ ГОСТ Р 52249-2009, устанавливающий правила изготовления и контроля качества лекарственных препаратов;
- постановление Правительства от 5 июня 2008 года N 438 с рядом изменений, внесенных за последние годы, которое утверждает полномочия Министерства промышленности и торговли в этой области;
- постановление Правительства от 3 декабря 2015 года N 1314, устанавливающее порядок оценки соответствия производителей требованиям стандарта надлежащей практики;
- приказ Минпромторга от 14 июня 2013 года N 916, утверждающий правила применения надлежащей производственной практики в соответствии с актуальным стандартом;
- приказ Минпромторга от 26 мая 2016 года N 1714, определяющий административный регламент предоставления государственной услуги по выдаче документации, подтверждающей соответствие изготовителя установленным нормам надлежащей производственной практики;
- приказ Минпромторга России от 17.12.2015 N 4119, утверждающий правила ведения реестра сведений о том, какие лекарства имеют сертификат качества GMP в России.
При этом необходимо принимать во внимание, что в настоящий момент наша страна вместе с другими государствами, входящими в состав Евразийского экономического союза, находится на этапе становления общего рынка, объединяющего фармацевтическое и косметическое производство в границах Союза. Это предполагает в том числе введение в действие единых требований к качеству и безопасности таких продуктов. В соответствии с принятым в мире порядком они реализуются в форме внедрения стандартов надлежащей производственной практики. Применение таких стандартов регулируется следующими нормативными документами:
- Решение Совета ЕЭК от 3 ноября 2016 года N 77, утверждающее правила надлежащей производственной практики в границах ЕАЭС;
- Приказ Минпромторга от 4 сентября 2020 года N 2945, которым введен административный регламент предоставления госуслуги по выдаче документации, подтверждающей соответствие производств установленным правилам.
Обратите внимание!
Для полноценного применения разработанного административного регламента необходимо решение Правительства о порядке реализации некоторых процедур, связанных с проведением фармацевтических инспекций. Приказ № 2945 вступит в силу только после принятия соответствующего постановления: пока этого не произошло.
Преимущества обладания сертификатом
Несмотря на необходимость проведения достаточно сложной и дорогостоящей процедуры, производители знают, что сертификация по стандартам GMP является весьма важной для представителей фармацевтической отрасли. В частности, оно обеспечивает продукции и производству следующие серьезные преимущества:
- стабильное качество продукции, не зависящее от внешних факторов;
- повышение доверия потребителей, включая крупных оптовых покупателей, которые всегда отслеживают, какие производители имеют сертификат соответствия GMP на их продукцию;
- возможность вывода продукции на международные рынки, где ее может купить гораздо больше потребителей;
- возможность привлечения инвесторов для реализации проектов по расширению производства;
- получение преимуществ при участии в конкурсном отборе поставщиков, в том числе для государственных закупок.
КОММЕНТАРИЙ ЭКСПЕРТА АТТЭК
Каков срок действия сертификата?
Срок действия российских сертификатов составляет 3 года. При этом срок действия иностранного сертификата GMP составляет от 1 до 3 лет. По истечении этого периода сертификацию потребуется проходить заново. Кроме того, это означает, что на протяжении всего этого срока компании необходимо обеспечить соответствие своего производства и продукции требованиям комплекса правил GMP.
Кто в России занимается сертификацией по стандартам GMP?
Сейчас сертификация контролируется департаментом развития медицинской и фармацевтической промышленности Министерства промышленности и торговли РФ. Он является организацией, ответственной за обеспечение надлежащего контроля за качеством, безопасностью и эффективностью лекарственных средств. Осуществлением требуемых сертификационных процедур занимается Государственный институт лекарственных средств и надлежащих практик (ФГБУ «ГИЛС и НП»).
Стандарт GMP в международной практике
Процесс сертификации на соответствие лекарственного препарата стандартам GMP в международной практике имеет комплексный характер, а ее основной целью является подтверждение безопасности и действенности продукции. В этой связи для достижения поставленной цели специалисты аккредитованных сертификационных организаций не ограничиваются оценкой ряда выборочных образцов лекарственных препаратов, как это часто предусматривается другими стандартами. В процедуру установления требуемого уровня качества лекарств любой международный центр сертификации лекарственных средств включает оценку предприятия, занимающегося его выпуском. В результате эксперты, занимающиеся проведением сертификации, анализируют конкретный препарат и процесс его выпуска в следующих областях:
- оценка производства на соответствие критериям безопасности, включая проведение его проверки в отношении вероятности попадания в продукт посторонних примесей и веществ;
- оценка производства на соблюдение технических требований к выпуску продукции, включая выполнение условий относительно влажности, температуры и других параметров в производственных помещениях;
- оценка качества, безопасности и действенности лекарственных средств, производимых на конкретном предприятии;
- оценка соответствия параметров производства и характеристик лекарственного средства нормативной документации, принятой в рамках процедуры GMP.
Правила GMP в России
Порядок и сроки проведения всех операций в рамках этой процедуры, список лиц и организаций, ответственных за их осуществление, размер платы за проведение экспертной оценки и другие аспекты выполнения сертификации определены постановлением Правительства № 1314.
Процедура получения сертификата в России
Первым шагом для производителя, который желает пройти сертификацию, является подача соответствующего заявления в Минпромторг. В течение 10 рабочих дней специалисты ведомства проводят проверку корректности представленных в заявлении сведений и определяют возможность проведения сертификации.
В случае необходимости они вправе запросить у заявителя дополнительные документы, которые он обязан предоставить в течение 20 рабочих дней. В случае, если в отношении данного препарата принято положительное решение о проведении процедуры сертификации, необходимые данные направляются в ФГБУ «ГИЛС и НП», который в течение 20 рабочих дней с момента их получения обязан определить дату проведения сертификационных мероприятий и внести ее в график. Такая дата должна наступить не позднее 160 рабочих дней со дня, когда специалисты Минпромторга приняли положительное решение о сертификации, а сама экспертиза и расшифровка ее результатов должны занимать не более 10 рабочих дней.
На подготовку итогового отчета по результатам ее проведения исполнителю отводится 30 рабочих дней, а на его направление заявителю — 3 рабочих дня. Копия такого отчета также направляется в Минпромторг. На основании отчета формируется окончательное заключение, которое в случае положительного характера сопровождается выдачей сертификата производителю лекарственного препарата.
Документы для сертификации
Чтобы получить сертификат GMP в России, производитель обращается в уполномоченный орган с заявлением, к которому прилагает пакет документов, включающий:
- копию документа, подтверждающего наличие у заявителя полномочий по взаимодействию с контролирующей организацией;
- копия основного досье используемого производственного объекта;
- информация о фактах несоответствия препарата действующим требованиям к качеству и безопасности и о фактах отзыва медикамента из оборота за период не менее 2 лет;
- полный список лекарств, который изготавливаются на данном производственном объекте;
- копия лицензии на производство лекарств;
- письмо о согласии на проведение инспекции производства.
Важнейшие документы предоставляются заявителем в копиях, поскольку при утере их восстановить невозможно или очень сложно. Правила регламентируют, что если заявление подает иностранный производитель, и некоторые документы в составе пакета представлены на другом языке, они должны быть переведены на русский язык и заверены в установленном порядке.
Сроки сертификации
Общая продолжительность процедуры сертификации складывается из следующих сроков.
Этап сертификационной процедуры
Максимальная допустимая продолжительность
Проверка полноты пакета документации, представленной с заявлением о сертификации, и правильности ее оформления, назначение инспекции
10 рабочих дней
Направление информации о назначении инспектирования в уполномоченное учреждение, которое проводит проверку
Инспектирование и анализ лекарственного средства
160 рабочих дней
Принятие решения о выдаче заключения по результатам инспекционного отчета
10 рабочих дней
160-дневный период инспектирования включает внесение производителя в график инспекций, ожидание процедуры и проведение самой инспекции. Она должна занимать не более 10 рабочих дней.
Такой порядок действует, если в документации, поданной производителем, не обнаружат ошибок и недочетов, из-за которых ее могут направить на доработку. В этом случае вся процедура займет немногим более 180 рабочих дней, то есть свыше 8 месяцев.
Стоимость получения сертификата
Обязательной для всех производителей лекарственных средств, претендующих на получение сертификата, подтверждающего соответствие их продукции стандартам GMP, является оплата государственной пошлины за рассмотрение соответствующего заявления в Министерстве промышленности и торговли. Ее размер составляет 7500 рублей. Оплатить данную сумму необходимо еще до подачи заявления в ведомство, а ее размер никак не зависит от результатов рассмотрения документа.
Однако данная пошлина — это далеко не единственный и не самый крупный платеж, который потребуется осуществить производителю лекарств. Другой значительной статьей расходов станет плата за проведение экспертной оценки производства и продукции заявителя. Такая процедура выполняется специалистами ФГБУ «ГИЛС и НП»: для каждого из них предварительно проводится аттестация эксперта по GMP в России.
При этом размер платы за проведение оценки не является строго установленным, а определяется в зависимости от объема, характера и сложности необходимых процедур в соответствии с положениями приказа Министерства промышленности и торговли Российской Федерации от 11.01.2016 № 9 «Об утверждении методики определения размера платы за оказание услуги по инспектированию GMP». В случае, если проверка потребует проведения значительного объема работы и привлечения большого количества высококвалифицированных экспертов, размер платы за ее проведение может превышать 2,5 миллиона рублей.
Источник