Иммунологические лекарственные препараты определение классификация
Арсенал современных иммунобиологических препаратов огромен. К ним относятся:
1. Препараты для профилактических прививок: вакцины живые и убитые; анатоксины-вакцины комбинированные (ассоциированные).
2. Иммуноглобулины (моно- и полиглобулины) и иммунные (главным образом антитоксические) сыворотки, применяемые для лечения инфекционных больных и экстренной профилактики некоторых ИБ.
3. Бактериальные аллергены, применяемые для аллергодиагностики ИБ и лечения отдельных больных хроническими локализованными формами (бруцеллез, туберкулез, токсоплазмоз), не поддающихся другим методам лечения.
4. Эубиотики, препараты приготовленные из микроорганизмов и их компонентов и дериватов, используемые для лечения последствий ИБ — восстановления нарушенного в процессе болезни и лечения естественного биоценоза.
5. Бактериофаги, используемые для лечения отдельных больных (чаще детей) с антибиотикорезистентными возбудителями и непереносимостью других этиотропных средств (антибиотики, химиопрепараты) и при длительном остром постинфекционном носительстве.
6. Иммуномодуляторы эндогенного (иммуноцитокины, интерфероны) и экзогенного (продигиозан и др.) происхождения.
В соответствии с целевым назначением и основным механизмом действия все биопрепараты, применяемые для иммунопрофилактики, делятся на три группы: 1. Создающие активный иммунитет (вакцины, анатоксины). 2. Создающие дополнительную иммунологическую защиту организма в связи с наличием в них готовых антител (антитоксические, реже антибактериальные сыворотки и иммуноглобулины) 3. Блокирующие размножение возбудителя в инфицированном организме (антирабические вакцины) и вырабатывающие дополнительный активный иммунитет в инфицированном организме (анатоксины столбнячный и ботулинический), применяемые для экстренной профилактики и превентивного лечения.
Вакцины прочно вошли в профилактическую медицину в конце XIX столетия как надежное средство предупреждения ИБ. Число их с каждым годом увеличивается, а качество совершенствуется по мере развития новейших технологий и накопления знаний о природе ИБ. В связи с ростом количества вакцин при одной и той же болезни возникает необходимость оценить, какие из них и в каких условиях следует применить и каково место вакцинации в системе мер профилактики конкретного инфекционного заболевания.
Вопрос о роли и месте иммунизации в системе профилактики ИБ является главным в конкретной эпидемической ситуации. К сожалению, ответ на него и тем более активные практические действия не всегда адекватны и соразмерны эпидемической опасности. Как правило упускается из виду важнейший критерий при решении этого вопроса’ оценка соотношения иммунологической эффективности данной вакцины и массовости заболеваний (в расчете на количество населения данной местности).
При вакцинации против гриппа, например, не всегда учитываются группы риска в отношении этого заболевания (например, перенесшие инфаркт миокарда, больные сахарным диабетом, гипертонической болезнью и др.), которые прежде всего должны быть вакцинированы. Иммунизация по сезонным эпидпоказаниям, например, гриппа, носит, как правило, бессистемный характер, без учета групп риска, исходного состояния организма, что лишено часто здравого смысла.
Источник
Иммунобиологические лекарственные препараты – особенности хранения, перевозки и реализации

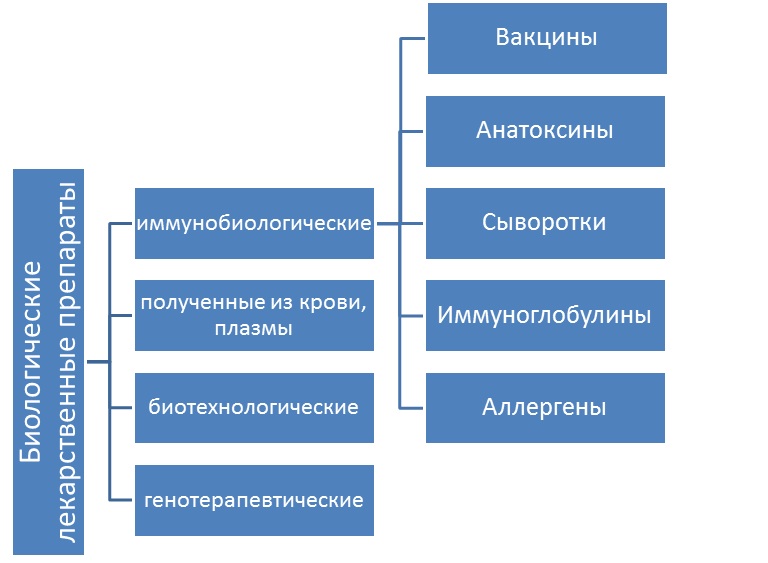
Иммунобиологические лекарственные препараты — лекарственные препараты, предназначенные для формирования активного или пассивного иммунитета либо диагностики наличия иммунитета или диагностики специфического приобретенного изменения иммунологического ответа на аллергизирующие вещества. В различных официальных источниках эти лекарственные средства именуются также аббревиатурой МИБП – медицинские иммунобиологические препараты. Особенностями работы с данной группой препаратов является движение по товаропроводящей цепи с обязательным соблюдением температурного режима, то есть по «холодовой цепи».
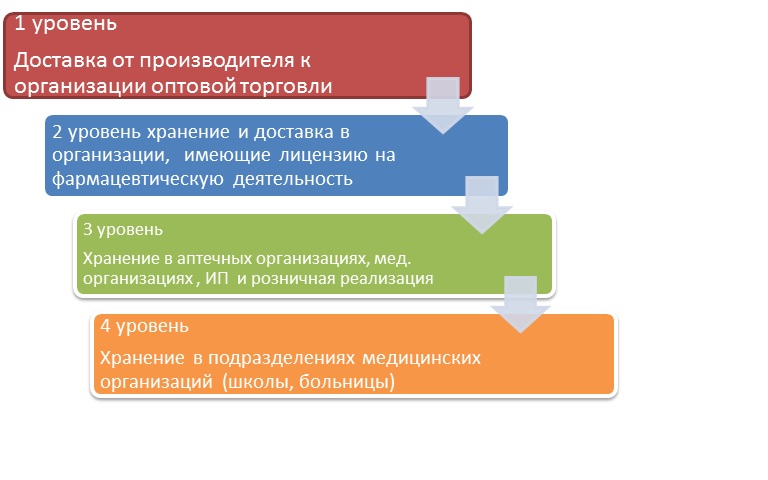
Из четырёх уровней «холодовой цепи» на первом уровне находится движение МИБП от производителя к организации оптовой торговли лекарственными средствами, на втором — движение от дистрибьютора к аптечным учреждениям, на третьем — хранение в аптечных организациях и реализация МИБП. Четвёртый уровень к деятельности аптек не относится — это хранение МИБП в прививочных кабинетах школ, санаториев и т.п.
Для обеспечения требуемой температуры используется специальное холодильное оборудование, для контроля отклонений температурного режима применяются термоиндикаторы, а также ведутся записи в журнал учета поступления и расхода вакцин 1 .
Согласно требованиям Государственной Фармакопеи 13-го издания, хранение иммунобиологических лекарственных препаратов должно осуществляться при температуре не выше 8 °С. К каждой упаковке иммунобиологического лекарственного препарата в холодильнике должен быть обеспечен доступ охлажденного воздуха. Не допускается совместное хранение в холодильнике иммунобиологических лекарственных препаратов с другими лекарственными средствами.
У работников аптек часто возникает вопрос, относится ли то или иное лекарственное средство к МИБП, и, соответственно, нужно ли вести учёт движения того или иного лекарственного средства. Информация об этом доступна в Государственном реестре лекарственных средств, где в разделе «фармакотерапевтическая группа» отмечена принадлежность лекарственного средства к МИБП 2 .
К МИБП относятся только вакцины, анатоксины, сыворотки, иммуноглобулины и аллергены. К МИБП не относятся пробиотики (синоним – эубиотики), средства, содержащие непатогенные бактерии и нормализующие микрофлору организма человека. Например, Фемафлор, содержащий эубиотик, эстриол и прогестерон, относится, согласно информации из Государственного реестра лекарственных средств, к другим препаратам для лечения гинекологических заболеваний. А лекарственные средства «Бифиформ», «Бифидумбактерин сухой» относятся к фармакотерапевтической группе «Антидиарейные микроорганизмы». Цитокины (например, интерфероны) также не относятся к МИБП, соответственно их перевозка и хранение осуществляются по другим правилам.

Источник
Лекция № 17 Иммунобиологические медицинские препараты.
Иммунобиологические препараты (ИМП) – это препараты, которые оказывают влияние на иммунную систему или действие которых основано на иммунологических реакциях.
Эти препараты применяют для профилактики, лечения и диагностики инфекционных заболеваний и тех неинфекционных заболеваний, в развитии которых участвует иммунная система.
К иммунобиологическим препаратам относят:
1. Вакцины и другие (анатоксины, фаги, эубиотики) лечебные и профилактические препараты из живых микробов или микробных продуктов.
2. Иммунные сывороточные препараты.
4. Диагностические препараты, в том числе аллергены.
ИМП применяют для активации, подавления или нормализации деятельности иммунной системы.
Вакцины.
Вакцины – это препараты для создания активного искусственно приобретенного иммунитета. Вакцины применяют для профилактики, реже – для лечения заболеваний.
Действующее начало вакцин – специфический антиген.
1. Живые вакцины:
2. Неживые вакцины:
— корпускулярные: а) цельноклеточные и цельновирионные; б) субклеточные и субвирионные; в) синтетические, полусинтетические.
3. Ассоциированные вакцины.
Характеристика живых вакцин.
Живые аттенуированные вакцины – препараты из ослабленных микробов, потерявших вирулентность, но сохранивших иммуногенность. Ослабленные микробы – это вакцинные штаммы.
Способы получения вакцинных штаммов:
а) метод отбора мутантов с ослабленной вирулентностью;
б) метод направленного (искусственного) снижения вирулентности (выращивание на неблагоприятных питательных средах, длительное пассирование (последовательное заражение) через организм маловоспримчивых лабораторных животных);
в) метод генной инженерии (инактивация гена, который отвечает за образование факторов вирулентности патогенных микробов).
Вакцинные штаммы микробов сохраняют способность размножаться в месте введения и распространяться по организму. В результате этого возникает вакцинная инфекция (заболевание протекает в легкой форме). Вакцинная инфекция всегда приводит к формированию иммунитета к патогенным микробам данного вида, к которым относится вакцинный штамм.
Дивергентные вакцины – препараты из живых микробов, не болезнетворных для человека, но сходных по антигенным свойствам с болезнетворными микробами. Например, для прививки против оспы человека используют вирус оспы коров.
Векторные рекомбинантные вакцины получают методом генной инженерии. Для этого в геном вакцинного штамма встраивают ген (вектор), контролирующий образование антигенов другого возбудителя (чужеродного антигена). Например, в штамм вируса оспенной вакцины встраивают антиген вируса гепатита В(HBs – антиген). Такая векторная вакцина создает иммунитет и против оспы и против гепатита В.
Получение живых вакцин:
1) выращивают вакцинный штамм в асептических условиях на оптимальной питательной среде;
2)биомассу микробов концентрируют, стандартизуют (определяют титр – количество микробов в 1мл), добавляют стабилизатор (сахарозожелатиновый агар, человеческий альбумин), который защищает антигены от разрушения, лиофильно высушивают, фасуют в стерильные ампулы или флаконы.
После получения вакцины проходят государственный контроль – проверяется реактогенность, безвредность и иммуногенность.
Преимущества живых вакцин:
1) создание прочного (напряженного) и длительного иммунитета (5-7 лет);
2) прививки делают однократно более простыми способами (перорально, интраназально, накожно, подкожно);
3) менее реактогенны, т.к. не содержат консервантов и адъювантов.
Недостатки живых вакцин:
1) трудоемкость получения вакцинных штаммов;
2) малый срок хранения (1 – 2 года);
3) хранение и транспортировка при пониженной температуре (+4С — +8С).
Для обеспечения безопасности живых вакцин необходимо проводить постоянный контроль реверсии вирулентности возбудителя, строго соблюдать требования, обеспечивающие сохранность и активность вакцинных микробов.
Примеры живых вакцин:
1) бактериальные вакцины – туберкулезная (БЦЖ), чумная, туляремийная, сибиреязвенная, бруцеллезная, против Ку-лихорадки;
2) вирусные вакцины – полиомиелитная, коревая, гриппозная, паротитная, против желтой лихорадки.
Характеристика неживых вакцин.
Корпускулярные вакцины – препараты из инактивированных культур патогенных (высоко вирулентных) или вакцинных штаммов бактерий и вирусов. Способы инактивирования: 1) физические: температура, УФ-лучи, ионизирующее излучение; 2) химические – формалин, спирт, ацетон, -пропиолактон.
Корпускулярные вакцины из целых бактерий называют цельноклеточными, а из целых (неразрушенных) вирусов – цельновирионными.
Получение корпускулярных вакцин:
1) выращивают в асептических условиях чистую культуру микробов;
2) проводят инактивацию в оптимальном режиме (нужно лишить микроорганизмы жизнеспособности, но сохранить их иммуногенность), например, гретые вакцины инактивируют путем прогревания взвеси микробов при 56С;
3) стандартизуют (по концентрации микробов), добавляют консервант (мертиолат, формальдегид, 2-феноксиэтанол и др.), который подавляет постороннюю микрофлору при хранении, фасуют;
Вакцины могут быть жидкие (суспензии) или сухие. Готовые вакцины подвергают контролю на стерильность, безвредность, иммуногенность, проверяют густоту вакцины или титр (количество микробов в 1 мл).
Преимущества цельноклеточных и цельновирионных вакцин:
1) простота получения;
2) большая устойчивость при хранении и более длительный срок хранения.
Недостатки цельноклеточных и цельновирионных вакцин:
1) менее прочный и продолжительный иммунитет;
2) необходимость 2-х и 3-х-кратных прививок парентеральным путем (подкожно, внутримышечно), иногда перорально;
3) реактогенность – боль, чувство жжения на месте введения, повышение температуры, судорожный синдром и т.д.
Примеры вакцин: против гриппа, коклюша, холеры, гепатита А, герпеса, вирусного энцефалита и др. Они используются для профилактики соответствующих заболеваний. Некоторые вакцины используют для лечения (вакцинотерапии) хронических инфекционных заболеваний – бруцеллеза, хронической дизентерии, хронической гонореи, хронических стафилококковых инфекций. Для лечебных целей используют и аутовакцины – препараты из убитых бактерий, выделенных из организма больного.
Корпускулярные вакцины из разрушенных бактерий и вирусов называются субклеточными и субвирионными. Такие вакцины содержат антигенные комплексы, выделенные из бактерий и вирусов после их разрушения.
Раньше эти вакцины назывались химическими. Однако этот термин более применим к вакцинам, полученным методам химического синтеза.
Получение субклеточных и субвирионных вакцин более сложное, чем цельноклеточных и цельновирионных (например, ферментативное переваривание с последующим осаждением антигенов этиловым спиртом), но они содержат меньше баластных веществ.
Преимущества субклеточных и субвирионных вакцин:
1) содержат только иммунологически активные части клеток – антигены без других компонентов;
2) менее реактогены;
3) более стабильны и лучше подвергаются стандартизации и более точной дозировке;
4) можно вводить в больших дозах и в виде ассоциированных препаратов.
1) слабая иммуногенность;
2) малые размеры, что приводит к быстрому выведению и к краткому антигенному раздражению.
Для устранения недостатков к таким вакцинам добавляют адъванты. Адъванты усиливают иммуногеность вакцин. Они укрупняют антигенные частицы, создают в месте введения «депо», из которого антигены медленно высвобождаются, что удлиняет время их воздействия на иммунную систему. В качестве адъювантов используют минеральные коллоиды( фосфат алюминия, фосфат кальция, гидрат окиси алюминия, алюмо-калиевые квасцы), полимерные вещества (липополисахариды, синтетические полимеры), растительные вещества (сапонины) и др. Вакцины с адъювантами называются адъювантными, сорбированными, адсорбированными или депонированными вакцинами.
Примеры субклеточных и субвирионных вакцин: против брюшного тифа на основе О-, Н- и Vi –антигенов, против гриппа на основе антигенов вируса (нейраминидаза и гемагглтинин), против сибирской язвы на основе капсульного антигена, проив дизентерии, менингита, холеры.
Молекулярные вакцины – это специфические антигены в молекулярной форме.
Они могут быть получены путем биосинтеза, химического синтеза и генной инженерии.
Метод биосинтеза заключается в том, что из микроба или из культуральной жидкости выделяют протективный антиген в молекулярной форме. Например, возбудители дифтерии, ботулизма, столбняка при росте синтезируют и выделяют в культуральную жидкость молекулы экзотоксинов. После обработки формалином экзотоксины теряют свои токсические свойства, но сохраняют иммуногенность.Таким образом, к типичным молекулярным вакцинам, которые получают путем биосинтеза, относятся анатоксины.
1) выращивают возбудителей, которые образуют экзотоксины (возбудители столбняка, ботулизма, дифтерии, газовой гангрены), глубинным способом в жидкой питательной среде, в результате этого в культуральной жидкости накапливается экзотоксин;
2) отделяют микробные клетки от культуральной жидкости путем фильтрации через бактериальные фильтры;
3) добавляют к культуральной жидкости, в которой находится экзотоксин, 0,4% формалин и выдерживают при 37С в течение 3 – 4 недель;
4) анатоксин очищают, концентрируют, стандартизуют – определяют активность анатоксина, добавляют консервант и адъювант и фасуют. Такие анатоксины называют очищенными сорбированными.
Активность анатоксина выражают в антигенных единицах : единицах связывания (ЕС) или единицах флоккуляции (ЛФ).
1 ЛФ – это то количество анатоксина, которое с 1 МЕ антитоксической сыворотки дает начальную реакцию флокулляции.
Титр анатоксина – это содержание ЛФ в 1 мл вакцины.
Применяют анатоксины подкожно, внутримышечно, 2 или 3-екратно с последующими ревакцинациями. Анатоксины вырабатывают антитоксический иммунитет.
Примеры молекулярных вакцин: противостолбнячный анатоксин, противоботулинический анатоксин, противогангренозный анатоксин.
Получение молекулярных вакцин методом химического (искусственного) синтеза – новое направление. Некоторые низкомолекулярные антигены получены методом химического синтеза. Кроме того, получают синтетические высокомолекулярные носители и соединяют их с естественными антигенами. Например, гриппозная вакцина состоит из антигенов вируса гриппа и полиоксидония, который обладает выраженными адъювантными свойствами.
Молекулярные вакцины получают также методом генной инженерии. Так получена вакцина против гепатита В, антигены которого синтезируются клетками дрожжей.
Характеристика ассоциированных вакцин.
Ассоциированные вакцины состоят из вакцин разного типа и вырабатывают иммунитет к нескольким заболеваниям. Они еще называются комплексными или поливалентными.
Они могут включать однородные антигены (например, анатоксины) и антигены различной природы (например, корпускулярные и молекулярные антигены, убитых и живых микробов). Антигены в вакцинах содержатся в дозировках, не создающих взаимной конкуренции, чтобы иммунитет вырабатывался ко всем антигенам.
Примеры ассоциированных вакцин: АКДС (ассоциированная коклюшно-дифтерийно-столбнячная вакцина) из столбнячного и дифтерийного анатоксина и коклюшной корпускулярной вакцины; живая ассоциированная полиомиелитная вакцина из штаммов вируса полиомиелита I, II,III типов; гриппозная вакцина из трех штаммов вируса гриппа; менингококковая вакцина из антигенов 4-х серотипов менингококка; живая комплексная вакцина против кори, паротита и краснухи.
Источник