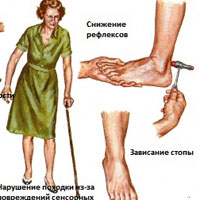
Полинейропатия
Периферическая нервная система передает информацию от головного и спинного мозга (центральной нервной системы) к остальным частям тела. Периферическая нейропатия может быть результатом травматических повреждений, инфекций, нарушения обмена веществ, наследственных причин и воздействия токсинов. Одной из наиболее распространенных причин полинейропатии является сахарный диабет.
Пациенты с периферической нейропатией обычно описывают боли, как ощущения покалывания или жжения. Во многих случаях, симптомы снижаются, если возникает компенсация основного заболевания.
Каждый нерв в периферической нервной системе имеет определенную функцию, так что симптомы зависят от типа нервов, которые оказались повреждены. Нервы подразделяются на:
- Чувствительные нервы, которые получают ощущения от кожи, такие как температура, боли, вибрации или давление
- Двигательные (моторные) нервы, которые контролируют движения мышц
- Вегетативные нервы, которые контролируют такие функции, как кровяное давление, частота сердечных сокращений, пищеварение и функцию мочевого пузыря
Симптомы
Симптомы полинейропатии, могут включать:
- Постепенное появление онемения и покалывание в ногах или руках, которые могут распространяться вверх по рукам и ногам
- Острая колющая или жгучая боль
- Повышенная чувствительность к прикосновениям
- Отсутствие координации и падения
- Мышечная слабость или паралич, если повреждены двигательные нервы
Если задействованы вегетативные нервы, симптомы могут включать:
- Непереносимость жары, а также изменение потоотделения
- Проблемы с пищеварением, мочевым пузырем или кишечником
- Изменения артериального давления, в результате чего могут появиться головокружение
Причины
Ряд факторов может привести к развитию невропатии, в том числе:
- Алкоголизм. Скудная диета может привести к дефициту витаминов.
- Аутоиммунные заболевания. Они включают такие заболевания как синдром Шегрена, системная красная волчанка, ревматоидный артрит, синдром Гийена-Барре, хроническая воспалительная демиелинизирующая полинейропатия и некротический васкулит.
- Диабет. Более чем у половины пациентов с диабетом развиваются некоторые типы нейропатии.
- Воздействие ядов. Токсичные вещества включают в себя тяжелые металлы или химикаты.
- Лекарства. Некоторые лекарства, особенно те, что используются для лечения рака (химиотерапия), могут привести к развитию периферической невропатии.
- Инфекции. К ним относятся некоторые вирусные или бактериальные инфекции, в том числе болезнь Лайма, опоясывающий лишай, вирус Эпштейна-Барр, гепатит С, проказа, дифтерия и ВИЧ.
- Наследственные заболевания. Например такое заболевание как болезнь Шарко-Мари-является наследственным типом нейропатии.
- Травма или компрессия на нерв. Травмы, такие как дорожно-транспортные происшествия, падения или спортивные травмы, могут повредить или даже привести к разрыву периферических нервов. Компрессия нерва может возникать при постоянном воздействии на периферические нервы.
- Опухоли. Злокачественные и доброкачественные опухоли могут повреждать нервы или оказывать давление на них.
- Дефицит витаминов. Витамины группы В, в том числе B-1, B-6 и B-12, витамин Е и ниацин имеют большое значение для нервов.
- Заболевания костного мозга. Они включают в себя наличие аномального белка в крови (моноклональные гаммопатии), миеломная болезнь, лимфома и амилоидоз.
- Другие заболевания. К ним относятся заболевания почек, заболевания печени, заболевания соединительной ткани и щитовидной железы (гипотиреоз).
Осложнения полинейропатии могут включать
- Ожоги и травмы кожи. Если есть онемение частей тела пациент не может чувствовать изменения температуры или боль.
- Инфекции. Ноги и другие области тела со сниженной чувствительностью могут незаметно повреждаться. Необходимо следить за целостностью кожных покровов, особенно если есть сахарный диабет так как даже незначительные повреждения кожи могут приводить к инфицированию тканей.
Диагностика
Врача при диагностике полинейропатии, в первую очередь, могут интересовать ответы на следующие вопросы
- Есть ли у пациента соматические заболевания, такие как диабет или заболевания почек?
- Когда появились симптомы?
- Были ли симптомы были постоянными или возникали эпизодически?
- Насколько выражены симптомы?
- Что приводит к увеличению или снижению симптомов?
- Были ли аналогичные симптомы у кого – то в семье пациента?
- Врачу необходима полная медицинская история болезни. Врач рассмотрит историю болезни, в том числе симптомы, образ жизни пациента, воздействие токсинов, наличие вредных привычек и семейную историю неврологических заболеваний.
- При неврологическом обследовании врач может проверить сухожильные рефлексы, силу и тонус мышц, способность чувствовать определенные ощущения, и координацию.
Врач может назначить обследование
- Методы визуализации КТ или МРТ могут выявить различные заболевания (в том числе опухоли).
- Нейрофизиология. Электромиография записывает электрическую активность в мышцах, что позволяет определить, вызваны ли симптомы, в том числе слабость, повреждением мышечной ткани или повреждением нерва. ЭНМГ проверяет проведения импульса по нервам и позволяет определить степень повреждения нервных волокон. Могут быть также проведены нейрофизиологические исследования вегетативной нервной системы — сенсорные тесты, которые регистрируют, как пациент чувствует касание, вибрацию, холод и тепло.
- Биопсия нерва. Врач может рекомендовать удаление небольшой части нерва, обычно чувствительного нерва, чтобы изучить морфологические изменения в нерве для того, чтобы определить причину повреждения нерва.
- Биопсия кожи. При этом исследовании удаляется небольшая часть кожи для исследования количества нервных окончаний. Снижение количества нервных окончаний свидетельствует о невропатии.
- Лабораторные методы исследования необходимы для исключения различных заболеваний, таких как сахарный диабет, аутоиммунные заболевания болезни почек и Т.Д.
Лечение
Целью лечения полинейропатии является лечение основного заболевания и минимизация симптомов. Если лабораторные тесты и другие методы обследования указывают на отсутствие основного заболевания, врач может рекомендовать выжидательную тактику, для того чтобы увидеть, есть самостоятельное уменьшение симптомов нейропатии. Если есть воздействие токсинов или алкоголя, врач будет рекомендовать избегать этих веществ.
Медикаментозное лечение
Лекарства, используемые для облегчения болей при полинейропатии включают в себя:
- Обезболивающие, такие как парацетамол или из группы НПВС снижают болевые проявления
- Лекарства, содержащие опиоиды, такие как трамадол (Conzip, Ultram ER и другие) или оксикодон (Oxycontin, Roxicodone и другие), могут привести к развитию зависимости и наркомании, так что эти препараты, как правило, назначают только тогда, когда другие методы лечения не оказывают эффекта.
- Противосудорожные. Медикаменты, такие как габапентин (Gralise, Neurontin) и прегабалин (Лирика), синтезированные для лечения эпилепсии, могут значительно снижать боль при нейропатии. Побочные эффекты этих препаратов могут включать сонливость и головокружение.
- Капсаицин. Крем, содержащий это вещество (в природе встречается в остром перце) может применяться для некоторого облегчения симптомов нейропатии. Но учитывая раздражающее действие капсаицина на кожу не все пациенты могут терпеть действие кремов с капсаицином.
- Антидепрессанты. Некоторые трициклические антидепрессанты, такие как амитриптилин, доксепин и нортриптилин (Pamelor), могут применяться для уменьшения болей при нейропатии через воздействия на центральную нервную систему.
- Ингибитор серотонина и обратного захвата норадреналина дулоксетин (Cymbalta) и антидепрессант венлафаксин (Effexor XR), также могут облегчить боль при периферической нейропатии, вызванной диабетом. Побочные эффекты могут включать сухость во рту, тошноту, сонливость, головокружение, снижение аппетита и запор.
- Внутривенное введение иммуноглобулина является основой лечения хронической воспалительной демиелинизирующей полинейропатии и других воспалительных нейропатий.
- Альфа-липоевая кислота. Используется для лечения периферической невропатии в Европе в течение многих лет. Этот антиоксидант помогает уменьшить симптомы. Прием альфа-липоевой кислота необходимо обсудить с врачом, потому он может повлиять на уровень сахара в крови. Другие побочные эффекты могут включать желудочные расстройства и сыпь на коже.
- Травы. Некоторые травы, такие как масла энотеры, может помочь уменьшить нейропатическую боль у пациентов с диабетом.
- Аминокислоты. Аминокислоты, такие как ацетил-L-карнитин, может помочь улучшить симптоматику периферической нейропатии у пациентов, перенесших химиотерапию и у пациентов с сахарным диабетом. Побочные эффекты могут включать тошноту и рвоту.
Кроме медикаментозного лечения могут применяться и другие методы лечения.
- Миостимуляция позволяет в определенной степени восстановить проведение нервно импульса по мышцам.
- Плазмаферез и внутривенное введение иммуноглобулина.
- ЛФК. При наличии мышечной слабости физические нагрузки позволяет улучшить силу и тонус мышц. Регулярные физические упражнения, такие как ходьба три раза в неделю, могут уменьшить боль при нейропатии, улучшить мышечную силу и помогают контролировать уровень сахара в крови. Гимнастики, такие как йога и тай-чи также могут быть достаточно эффективны.
- Акупунктура. Воздействие на биологически активные точки позволяет улучшить чувствительность нервных рецепторов и снизить болевые проявления.
Источник
Лечение острой и хронической воспалительной демиелинизирующей полирадикулоневропатии
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
ММА имени И.М. Сеченова
О страя воспалительная демиелинизирующая полиневропатия (ОВДП), известная также как синдром Гийена-Барре, острая постинфекционная полирадикулоневропатия – одно из наиболее тяжелых заболеваний периферической нервной системы. В настоящее время ОВДП является наиболее частой причиной развития острого периферического паралича, наряду с полимиозитом, миастенией и полиомиелитом. Заболевание встречается с частотой 1,7 на 100000 человек в год, равномерно в разных регионах, в любом возрасте, у мужчин чаще, чем у женщин.
Ранними и характерными клиническими симптомами ОВДП являются прогрессирующая мышечная слабость, легкие сенсорные расстройства, поражение краниальных нервов (чаще лицевых и бульбарных), арефлексия на конечностях. Для заболевания характерно монофазное течение, когда все клинические симптомы развиваются в течение 1-3 недель, затем наступает фаза “плато”, а после нее начинается регресс симптомов. В острую фазу заболевания наиболее серьезными и опасными для жизни больного осложнениями являются тяжелые двигательные нарушения (параличи), периферическая вегетативная недостаточность и слабость дыхательных мышц. Поэтому все больные, вне зависимости от тяжести состояния, должны быть госпитализированы и находиться под тщательным наблюдением из-за значительного риска появления у них дыхательной и вегетативной недостаточности. Развитие дыхательной недостаточности не всегда коррелирует с выраженностью двигательного дефекта и тяжестью полиневропатии. Например, описана тяжелая дыхательная недостаточность у больных с синдромом Фишера (атаксия, арефлексия, офтальмоплегия) – наиболее легким вариантом ОВДП. Иногда дыхательная недостаточность может быть первым симптомом дебюта заболевания. Дыхательная недостаточность при ОВДП имеет нервно-мышечное происхождение и развивается у 25% больных. Значительно увеличивают риск развития дыхательной недостаточности предшествующие заболевания дыхательной системы, особенно хроническая обструктивная патология легких. Для предварительной оценки дыхательной функции рекомендуется исследовать величину дыхательного объема и частоту дыхания, но “золотым стандартом” в оценке функции легких остается измерение жизненной емкости легких (ЖЕЛ). В первые дни заболевания у больных появляется прогрессирующая слабость дыхательных мышц, которая затрудняет активный выдох, угнетает кашлевой рефлекс, что приводит к развитию милиарного ателектаза легких, невидимого при рентгенологическом исследовании. Обусловленная ателектазом гипоксия выражается в учащении дыхания и повышении утомляемости дыхательных мышц. Клинически она проявляется одышкой, постоянной тахикардией и избыточной потливостью. При слабости диафрагмы развивается парадоксальный тип дыхания с инверсией брюшной стенки при вдохе. С целью устранения гипоксии при ЖЕЛ менее 15 мл/кг массы тела необходимо перевести больного на ИВЛ, причем желательно сделать это до появления первых признаков дыхательной недостаточности и утомляемости дыхательных мышц. Наличие бульбарных нарушений у больного является показанием к более быстрому переходу на ИВЛ. Если эндотрахеальная интубация продолжается более 5-7 дней, проводится трахеостомия с целью предотвращения стеноза трахеи. Время прекращения ИВЛ зависит от клинической картины. Вначале больной переводится на вспомогательный дыхательный режим, при ЖЕЛ более 15 мл/кг ИВЛ прекращается, но на несколько дней сохраняется вспомогательная вентиляция во время сна. Применение ИВЛ снизило смертность при ОВДП с 15% до 5%, и в настоящее время только дыхательная недостаточность редко является причиной смерти [1, 2].
Кроме коррекции дыхательной недостаточности, больные с тяжелой формой ОВДП нуждаются в рациональном питании, поддержании водно-электролитного баланса и других важнейших составляющих гомеостаза, профилактике инфекционных и гемокоагуляционных осложнений. Первоочередной задачей является также профилактика пролежней, контрактур, компрессионных невропатий, тромбоза глубоких вен голеней. Эти задачи выполняются частой сменой положения тела, пассивной лечебной гимнастикой, наложением шин на запястья и голеностопные суставы, введением 5000 ЕД гепарина натрия подкожно 2 раза в сутки. Вегетативные нарушения отмечаются почти у всех больных в прогрессирующую фазу заболевания и при тяжелых двигательных нарушениях. Клинические симптомы периферической вегетативной недостаточности обычно коррелируют с тяжестью полиневропатии и состоянием больных, однако описаны случаи, когда острая периферическая вегетативная недостаточность была дебютом заболевания. Синдром периферической вегетативной недостаточности проявляется у больных нарушением потоотделения, ортостатической гипотензией, артериальной гипо- и гипертензией, постоянной тахикардией, преходящей сердечной аритмией, повышением температуры, кратковременнной задержкой мочеиспускания. Самым грозным осложнением является поражение вегетативного аппарата сердца, что может привести к его внезапной остановке. Поэтому необходимо мониторирование сердечной деятельности и наблюдение за интервалом R-R на ЭКГ. Выраженные вегетативные расстройства являются причиной почти половины летальных исходов. Однако у подавляющего числа больных вегетативные нарушения умеренны и транзиторны, для их уменьшения рекомендуется феноксибензамин (20-60 мг/сутки). Задержка мочеиспускания обычно наблюдается у 10-20% больных в первые дни заболевания. Вследствие поражения парасимпатической иннервации развивается слабость детрузора мочевого пузыря, увеличивается остаточная моча, появляется задержка мочеиспускания, что ведет к развитию мочевой инфекции у 20% больных. Назначение адекватной дозы ампициллина (2-4 г/сутки) обычно санирует мочевую инфекцию. При появлении запора рекомендуется введение слабительных (пикосульфат натрия 10-15 капель внутрь) или ректальных свеч. Непроходимость кишечника развивается, как правило, в первые недели и только у единичных больных, страдающих сахарным диабетом [2].
В первые дни и недели заболевания около 50% больных жалуются на сильную боль. Клинический анализ показал, что боль может быть миогенной, артрогенной и невропатической. Миалгии и артралгии успешно купируются ацетилсалициловой кислотой (2 г/сут), кетопрофеном (100-300 мг/сут), парацетамолом (1,5 г/сут) в течение 1-2 недель. Скелетно-мышечные боли иногда быстро стихают после однократной внутримышечной инъекции метилпреднизолона (20-40 мг). При невропатической боли показано назначение амитриптилина (75 мг/сут), карбамазепина (400 мг/сут) в сочетании с транквилизаторами и бензодиазепинами. Но данные препараты следует использовать с осторожностью, так как они могут спровоцировать артериальную гипотензию, сердечную аритмию и угнетение дыхания. При невропатической боли эффективна чрескожная стимуляция периферических нервов. При гиперпатии и дизестезии показано местное применение капсаицина. При выраженной боли можно назначить кодеин (180-360 мг/сут), во многих центрах в подобных случаях с успехом используют эпидуральное введение опиоидов.
В патогенезе ОВДП ведущая роль принадлежит иммунопатологическим нарушениям. Аутоиммунная гипотеза патогенеза привела к широкому применению кортикостероидов для лечения этого заболевания. Анализ литературы, посвященной многолетнему лечению больных кортикостероидами, показал, что убедительных данных, свидетельствующих об их эффективности, не получено. В течение 1950-1970 гг. в литературе опубликовано большое количество наблюдений об эффективном использовании при ОВДП кортикостероидов и адренокортикотропного гормона (внутрь, парентерально и внутривенно). Однако проведенные в последние годы многоцентровые, проспективные, двойные слепые, плацебо-контролируемые исследования показали, что кортикостероиды не укорачивали острую фазу болезни, не уменьшали сроки госпитализации, не приводили к более быстрому регрессу неврологических симптомов [2]. Кортикостероиды способствовали рецидивированию заболевания и увеличению гнойно-септических и гиперкоагуляционных осложнений. Поэтому в настоящее время сформулировано правило, согласно которому лечение тяжелых форм ОВДП с помощью кортикостероидов является врачебной ошибкой. К сожалению, следует признать, что в России кортикостероиды еще продолжают использоваться в лечении данного заболевания [3, 4].
Цитостатики в комплексном лечении ОВДП начали применять после того, как их эффективность была установлена у животных с экспериментальным аллергическим невритом, являющимся адекватной моделью ОВДП. Применение различных цитостатиков (6-меркаптопурин, циклофосфамид, азатиоприн) внутрь или внутривенно было эффективным при подостром и рецидивирующем течении заболевания, однако степень улучшения не отличалась от тех больных, которые не получали лечения. Применение цитостатиков часто сопровождается серьезными осложнениями, свойственными этим препаратам (тошнота, рвота, аллопеция, изменение крови и др.). В отношении применения цитостатиков при ОВДП контролируемых исследований пока не проведено, и их использование при данном заболевании является проблематичным [2, 5].
В настоящее время плазмаферез является основным, наиболее эффективным и доступным методом лечения больных с ОВДП. Плазмаферез впервые с успехом был применен R. Bretfle и соавт в 1978 г. В последующие годы во многих странах были проведены многоцентровые, проспективные, двойные слепые плацебо-контролируемые исследования, охватывающие сотни больных, с целью изучения эффективности плазмафереза при ОВДП. Результаты этих исследований и пятнадцатилетний мировой опыт позволяет рекомендовать этот метод лечения больным в стадии нарастания неврологической симптоматики, требующей искусственной вентиляции легких (ИВЛ), или с выраженной слабостью, когда больные неспособны пройти более 5 метров. За одну процедуру удаляется объем не менее 35-40 мл плазмы на 1 кг массы тела и не менее 160 мл плазмы на 1 кг массы тела на курс лечения; количество сеансов – 3-5 с интервалом не более 2 суток. В качестве замещающего компонента при плазмаферезе используется 5% раствор альбумина, так как этот препарат, в отличие от свежезамороженой плазмы, дает меньшее количество осложнений и лишен риска переноса гепатита В и СПИДа. При применении плазмафереза наполовину сокращается срок проведения ИВЛ и время пребывания в отделении интенсивной терапии, быстрее восстанавливается сила мышц и способность к самостоятельному передвижению. Эффективность плазмафереза выше, если он проводится в первые 10 дней болезни. Плазмаферез безопасен для беременных женщин и детей, страдающих ОВДП. Не рекомендуется сочетать плазмаферез с кортикостероидами, так как последние уменьшают его терапевтическую эффективность. Примерно у 5-10% больных после применения плазмафереза могут наблюдаться рецидивы заболевания, которые, как правило, быстро регрессируют на фоне применения прежней схемы лечения [1, 6].
В последнее десятилетие предложен новый эффективный способ лечения ОВДП с помощью внутривеннного введения иммуноглобулина G в дозе 0,4 г/кг массы тела через день 5 раз. Терапевтический эффект иммуноглобулина базируется на противовоспалительном действии, нейтрализации антивирусных, антибактериальных антител и аутоантител, связывании и нейтрализации активированнного комплемента. По эффективности иммуноглобулин равен плазмаферезу, но имеет меньше осложнений (головная боль, кожные реакции, боль в пояснице, озноб, асептический менингит). Иммуноглобулин противопоказан больным с недостаточностью иммуноглобулина А, так как у них имеется риск развития анафилактического шока. В отечественной литературе имеется 2 сообщения об успешном применении иммуноглобулина при ОВДП [4, 7, 8].
Клинический статус больных ОВДП оценивается по общепринятой в настоящее время шкале (в баллах):
1 – минимальные признаки поражения
2 – может самостоятельно пройти 5 метров
3 – может пройти 5 метров с поддержкой
4 – не способен пройти 5 метров, пользуется коляской
5 – нуждается в ИВЛ.
Больные с тяжестью 1-3 балла не нуждаются в проведении плазмафереза, им показана симптоматическая терапия. Все больные с ОВДП из-за двигательных нарушений, бульбарного синдрома, поражения краниальных нервов, дыхательной недостаточности нуждаются в психологической поддержке. В настоящее время у 85% больных ОВДП наблюдается полное функциональное восстановление, 20% больных умирают, у 10-20% отмечаются остаточные явления (чаще всего парезы различной степени выраженности). После перенесенного ОВДП больным противопоказаны прививки в течение 1 года, а противостолбнячная сыворотка – на всю жизнь из-за опасности развития хронической демиелинизирующей полирадикулоневропатии (ХВДП).
ХВДП по своим клиническим, электрофизиологическим и морфологическим данным напоминает ОВДП, но имеет рецидивирующий, прогрессирующий или монофазный тип течения. Каждый больной имеет свой, не меняющийся тип течения. Заболевание является относительно редким, мужчины болеют в 2 раза чаще, чем женщины. При ХВДП бульбарные и вегетативные нарушения выражены незначительно, и больные, как правило, не нуждаются в проведении ИВЛ. Вопросы клинического течения, диагноза и лабораторного исследования при ХВДП изложены в отечественной литературе [9, 10]. Лечение ХВДП является трудной задачей. Всем больным рекомендуется преднизолон в дозе 1,5 мг/кг ежедневно в течение 2-4 недель, при улучшении состояния постепенно переходят на прием этой же дозы преднизолона через день. При удовлетворительном течении восстановительного периода дозу преднизолона можно постепенно уменьшать (на 5 мг каждые 2 недели). Через 3-4 месяца переходят на поддерживающую дозу (20 мг через день), которую принимают еще в течение 2-х месяцев. Таким образом, курсовое лечение продолжается в среднем 6 месяцев. Отменяется преднизолон при полном восстановлении силы мышц конечностей и удовлетворительных показателях электронейромиографического (ЭНМГ) исследования. Если в течение 1-2 месяцев лечения не отмечается клинического улучшения, рекомендуется к терапии преднизолоном присоединить плазмаферез (2 раза в неделю в течение 3-х недель). Если после проведения плазмафереза наступает ремиссия, рекомендуется его продолжить 1 раз в 2 недели еще 1,5 месяца. Техника проведения плазмафереза описана выше. Альтернативой плазмаферезу является иммуноглобулин внутривенно (0,4 мг/кг массы тела в течение 5 дней). При отсутствии клинического улучшения на фоне лечения преднизолоном в сочетании с плазмаферезом рекомендуют сочетать преднизолон (доза при этом уменьшается в 2 раза) с азатиоприном или лечить только азатиоприном (2-3 мг/кг массы тела в сутки). Под нашим наблюдением находились больные, которые не реагировали на преднизолон, но выздоровели после курсового (6-8 месяцев) лечения азатиоприном. Следут помнить, что азатиоприн – потенциально опасный препарат, поэтому за больным необходимо постоянное наблюдение (анализы крови, уровень тромбоцитов, печеночные пробы). В литературе имеются сообщения о благоприятном эффекте циклофосфамида при ХВДП (внутрь, пульс-терапия). При любой схеме лечения ХВДП во время снижения дозы препаратов может возникнуть ухудшение состояния. Чтобы не потерять контроль над болезнью, необходимо вновь увеличить дозу препарата, а после стабилизации состояния начать снижение дозы, но в более медленном темпе. В настоящее время отсутствуют научно разработанные схемы лечения больных ХВДП, поэтому большое значение в лечении имеет практический опыт врача. Около 65-70% больных ХВДП выздоравливают, 5-10% умирают, остальные имеют сенсомоторные дефекты различной степени выраженности [1, 2].
Этиология и патогенез ОВДП и ХВДП в настоящее время интенсивно изучаются, поэтому есть надежда на появление новых и более эффективных способов лечения этих заболеваний.
1. Latov N., Wokke J.N., Kelly J. Immunological and infectious diseases of the peripheral nerves/ Cambridge, University Press/ — 1998. 435 p.
2. Parry G.I. Guillian-Barre Syndrome. — Thieme Medical Publishers. N.Y. — 1993.-200 p.
3. Неретин В.Я., Кирьяков В.А., Сапфирова В.А. Инфекционно-аллергические полирадикулоневриты Гийена-Барре (Обзор) // Журн.неврол и психиатр.-1992.-№3.-С. 111-114.
4. Пирадов М.А., Авдюнина И.А. Синдром Гийена-Барре: проблемы лечения и терминологии // Неврол. журн.- 1 996.-№3.-С.ЗЗ-36.
5. Мозолевский Ю.В. Клиника и лечение острой воспалительной демиелинизирующей полирадикулоневропатии // Журн. невропатол. и психиатр.- 1992.-№2.-С.6-9.
6. Пирадов М.А. Плазмаферез в терапии острой воспалительной демиелинизирующей полирадикулоневропатии (Обзор иностранной литературы) // Журн. невропатол. и психиатр.-1991.-№9.-С. 102-106.
7. Артемьев Д.В., Нодель М.Р., Дубанова Е.А. и соавт. Аксональный вариант синдрома Гийена-Барре, излеченный иммуноглобулином // Неврол. журн.-1997.-№5.-С.9-13.
8. Быкова О.В., Бойко А.Н., Маслова О.И. Внутривенное применение иммуноглобулинов в неврологии (Обзор литературы и собственные наблюдения) // Неврол. журн. -2000.-5.-С.32-39.
9. Гехт Б.М., Меркулова Д.М. Практические аспекты клиники и лечения полиневропатий // Неврол. журн.-1997.-№2.-С.4-9.
10. Мозолевский Ю.В., Дубанова Е.А., Иванов М.И. Клиника и лечение хронической воспалительной демиелинизирующей полирадикулоневропатии // Журн. неврол. и психиатр. — 1992. — №3.- С.106-110.
Источник