- ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ И МЕДИЦИНСКИХ ИЗДЕЛИЙ В РОССИИ
- Количество одобренных исследований лекарственных препаратов
- Семь лет клинических исследований в России
- Реестр разрешений на проведение клинических исследований (РКИ). Или ещё раз о вакцинах от COVID-19.
- Сведения о вакцине ЭпиВакКорона от COVID-19 из РКИ
- Личное мнение
- Постскриптум
- Алгоритм поиска клинических исследований
- Пошаговый алгоритм поиска клинического исследования
- Дополнительно
- Полезные ссылки
- Российские вакцины не прошли все фазы клинического исследования?
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ И МЕДИЦИНСКИХ ИЗДЕЛИЙ В РОССИИ
Вы на сайте онлайн-системы аналитики и мониторинга зарегистрированных клинических исследований лекарственных препаратов в России.
Воспользуйтесь технологичным и современным способом изучения, просмотра и экспресс-аналитики статистических данных государственных ведомств в сфере клинических исследований.
Вся информация проходит проверку которая заключается в анализе исходных данных сотрудниками Sciencefiles, что позволяет исправлять часть ошибок первоисточников.
Количество одобренных исследований лекарственных препаратов
Семь лет клинических исследований в России
С 2014 года эксперты Sciencefiles заботятся об успехе компаний фармацевтического и исследовательского рынков, предоставляя услугу ежемесячного бесплатного мониторинга реестра клинических исследований Минздрава России. Профессиональные эксперты Sciencefiles исправляют ошибки, допущенные в реестре Минздрава, и дополняют данные о клинических исследованиях расширенной полезной информацией. Результаты аналитики компания рассылает в формате обзоров клинических исследований. Сегодня обзоры от Sciencefiles ежемесячно получают по подписке более 800 экспертов в сфере клинических исследований из разных стран, в том числе и стран ЕАЭС. Информация будет полезна профессионалам, участвующим в разработке и выводе на рынок лекарственных препаратов, в планировании новых клинических исследований, а именно представителям фармацевтических компаний, контрактно-исследовательских организаций, научно-исследовательских центров. Подписаться на ежемесячную рассылку обзоров клинических исследований в РФ можно здесь.
Каким был 2020 год для клинических исследований в России: что одобряли в пандемию? Смотрите в видео-презентации директора Sciencefiles, к.м.н. Андрея Алашеева. В презентации представлена уникальная аналитика одобренных в России в период пандемии клинических исследований лекарственных препаратов. Данные для презентации были подготовлены с помощью Реестра клинических исследований.
Источник
Реестр разрешений на проведение клинических исследований (РКИ). Или ещё раз о вакцинах от COVID-19.
И снова здравствуйте, уважаемые подписчики, читатели и гости сайта 9111. ру!
А вы знаете про существование реестра разрешений на проведение клинических исследований (РКИ)?
Если нет, то эта публикация для вас!
Сведения о вакцине ЭпиВакКорона от COVID-19 из РКИ
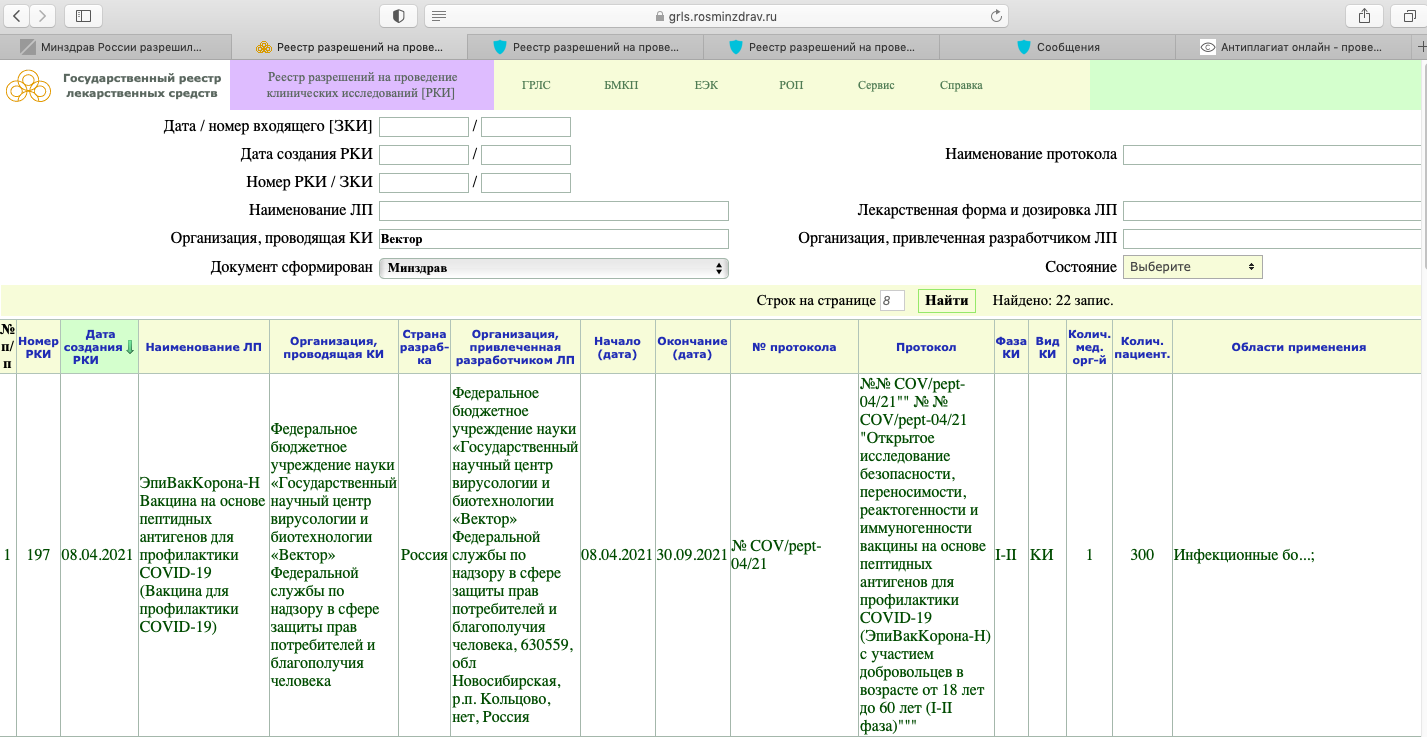
Справка: Все скрины, которые представлены в данной публикации, сделаны с сайта grls.rosminzdrav.ru. Полная ссылка на источник информации предоставлена в конце публикации.
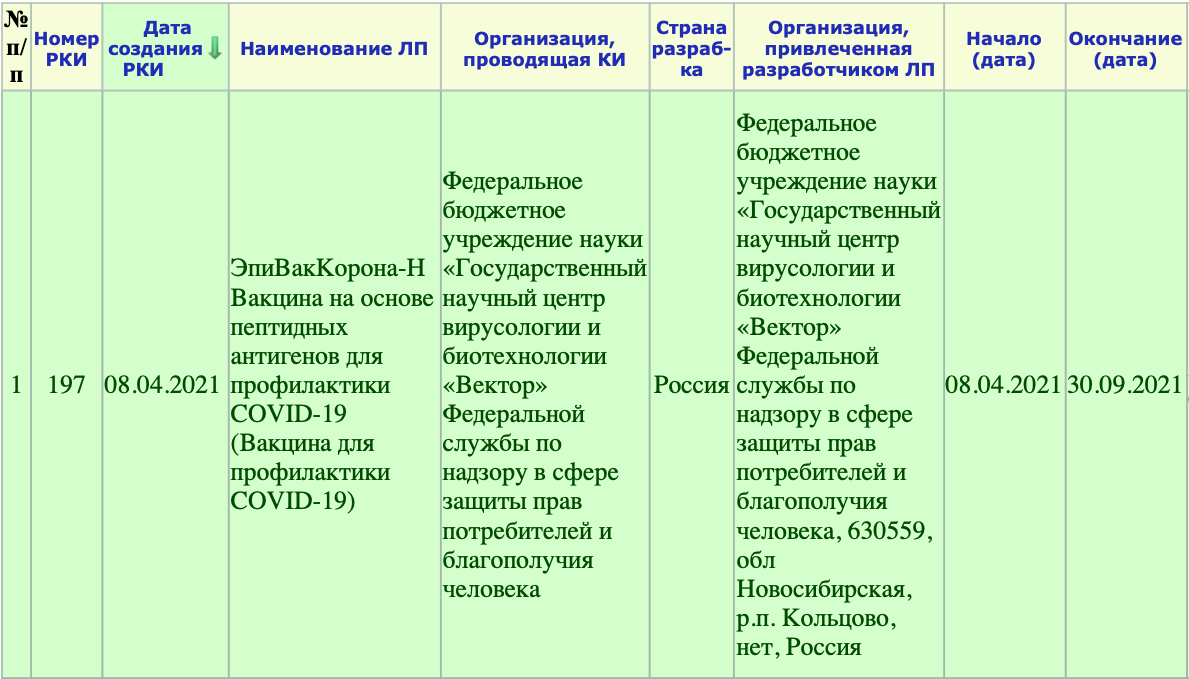
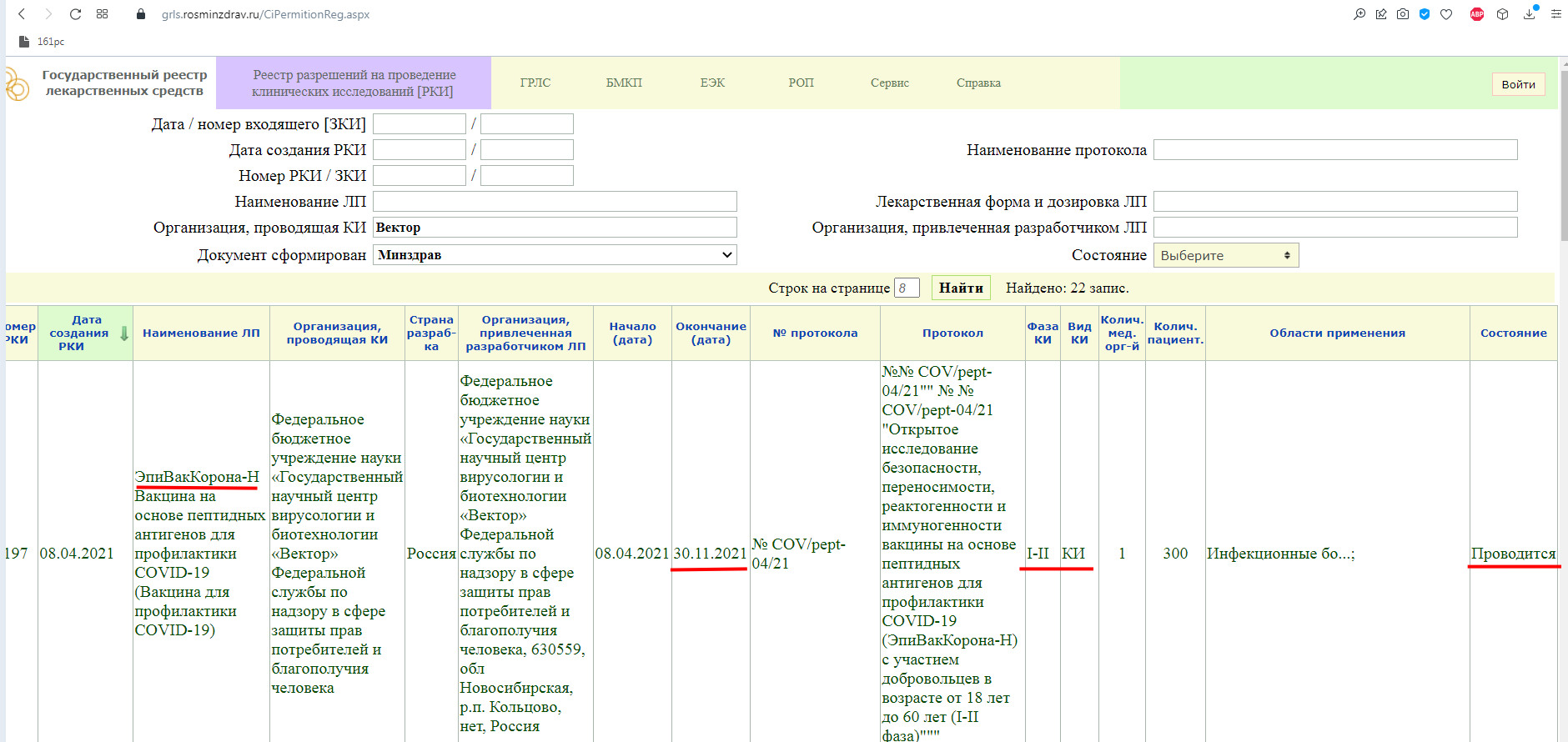
РКИ №197. Дата создания данной вакцины — 8 апреля текущего года. В этот же день начались и её испытания. Окончание испытаний — 30 сентября текущего года. То есть на данный момент проводясь её клинические испытания (КИ). При этом это только лишь I-II фаза КИ.
РКИ №644. Эти клинические испытания ЭпиВакКороны зарегистрированы 18 ноября 2020 года. Именно в этот день начались её клинические испытания. Дата окончания клинических испытаний — 31 августа 2021 года. Это III-IV фазы КИ и на данный момент, как мы видим КИ продолжаются (!). Хочется отметить, что многих россиян, которые решились делись прививку от COVID-19, прививали именно этой вакциной. Что же получается? Люди, которые привились ЭпиВакКороной, выступили в роли подопытных животных? Или я неправильно воспринимаю информацию из РКИ?
РКИ №639. Третья их фаза закончилась 15 мая текущего года. Тут я стесняюсь спросить: » На людях закончилась третья фаза исследования?»
РКИ №376. Это клинические испытания ЭпиВакКороны на I-II стадиях, которые закончатся только 30 декабря 2021 года (!). Как так? Людей уже прививали ЭпиВакКороной (!).
Для справки: В РКИ есть сведения и о других вакцинах от COVID-19, но как не старалась я у меня не получилось на них выйти, однако сведения о них там имеются.
Личное мнение
Сразу хочу сказать, что я не медик! У меня нет медицинского образования. Но, я с уверенностью говорю о том, что я такой вакцине доверять не буду! ПОЧЕМУ? Да, потому что никто не знает какие последствия могут быть после её вливания в человеческий организм, ведь испытания-то ещё проводятся. И поэтому возникают резонные вопросы:
Как доверять вакцине, которая не прошла все этапы клинических испытаний? Как можно испытывать на людях такую вакцину? Кто взял на себя ответственность за это?
Вот мне интересно. Кто мне ответит на первые два вопроса?
Ответ на третий вопрос я знаю, так как каждый человек, который решил сделать прививку, подписывает согласие, а это значит, что он сам в ответе за это. То есть, по моему личному мнению, подписывая согласие, мы сбрасываем ответственность за свою вакцинацию с тех, кто нас сейчас вынуждает тем или иным образом (увольнение или отстранение от работы) вакцинироваться.
Постскриптум
Уважаемые медики! Укажите, пожалуйста, на мои ошибки, если я что не так поняла. Убедите меня в том, что можно и нужно вакцинироваться вакциной, которая не прошла все фазы клинических испытаний.
С нетерпением жду от вас комментарии. Заранее благодарна вам за уважительное отношение к своим оппонентам.
Источник
Алгоритм поиска клинических исследований
Для поиска клинического исследования (КИ), проводимого в России, воспользуйтесь следующими ресурсами:
- Государственный реестр лекарственных средств Минздрава России
www.grls.rosminzdrav.ru
Содержит список медицинских центров в России, в которых проводятся исследования, а также информацию о названии протокола.
www.clinicaltrials.gov
В дополнение к реестру Минздрава РФ здесь можно узнать о критериях включения/исключения пациентов в клиническое исследование.
Пошаговый алгоритм поиска клинического исследования
Поиск клинического исследования на сайте Государственного реестра лекарственных средств Минздрава России
- Зайдите на сайт www.grls.rosminzdrav.ru .
- Наведите курсор мышки на кнопку «ГРЛС» в верхнем меню сайта.
- На всплывающем меню в подразделе «Клинические исследования» кликните на ссылку «Реестр разрешенных клинических исследований». Откроется страница поиска.
- Выполните поиск по названию препарата (поле «Наименование ЛП») или по нозологии (поле «Наименование протокола»).
- Нажмите на интересующее исследование для получения информации о центрах, где оно проводится.
Поиск клинического исследования на сайте roche.ru.
- Если вас интересует клиническое исследование, проводимое компанией «Рош», и в которое ведется набор пациентов, посетите https://www.roche.ru/ru/issledovaniya/areas.html.
- Нажмите на название исследования в списке, чтобы получить дополнительную информацию.
Поиск клинического исследования на сайте Международного реестра клинических исследований Национального института здоровья США.
Если вы нашли подходящее исследование на сайте «Рош» или на сайте Минздрава РФ, то следующим шагом нужно найти информацию о критериях включения/исключения.
Критерии включения/ исключения – это те характеристики, при соответствии которым пациент может быть принят в клиническое исследование. Это может быть пол, возраст, определенное заболевание, стадия и его длительность, особенности предшествующего лечения и т.д.
- Запомните номер протокола интересующего исследования. Его можно найти в графе «Номер исследования» на сайте «Рош» или «№ протокола» на сайте Минздрава РФ.
- Зайдите на сайт www.clinicaltrials.gov.
- Введите номер протокола в окно «Other terms». Дополнительно укажите страну проведения клинического исследования – Russian Federation.
- Нажмите ссылку «Advanced search», чтобы указать дополнительные параметры поиска, например, статус исследования (набираемое или закрытое и т.п).
- Нажмите кнопку «Search».
- На странице с результатами поиска нажмите интересующую строку, чтобы получить развернутое описание с дополнительной информацией:
- Purpose — цель исследования
- Drug — название лекарственного препарата
- Eligibility — критерии включения в клиническое исследование и т.д.
Если у вас остались вопросы, пожалуйста, свяжитесь с нашей службой медицинской информации «МедИнфо» (только для специалистов здравоохранения).
Дополнительно
Полезные ссылки
- Пример поиска клинического исследования
- Реестр разрешенных клинических исследований в РФ
- Международный реестр клинических исследований
- Европейский реестр клинических исследований
Данный веб-сайт содержит информацию для пациентов и специалистов в области медицины и фармацевтики России, и может содержать информацию по продукции «Рош», по тем или иным причинам не доступную или не являющуюся официально утвержденной в вашей стране. Информация на данном сайте не должна использоваться для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Источник
Российские вакцины не прошли все фазы клинического исследования?
Клиническое исследование лекарственного препарата — изучение диагностических, лечебных, профилактических, фармакологических свойств лекарственного препарата в процессе его применения у человека, животного, в том числе процессов всасывания, распределения, изменения и выведения, путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного препарата, данных о нежелательных реакциях организма человека, животного на применение лекарственного препарата и об эффекте его взаимодействия с другими лекарственными препаратами и (или) пищевыми продуктами, кормами. (Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» Статья 4 Пункт 41)
Клинические исследования во всем мире являются неотъемлемым этапом разработки препаратов, который предшествует его регистрации и широкому медицинскому применению. В ходе клинических исследований новый препарат изучается для получения данных о его эффективности и безопасности. На основании этих данных уполномоченный орган здравоохранения принимает решение о регистрации препарата или отказе в регистрации.
Проведение клинических исследований в РФ регламентируют: Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» (Статья 40. Проведение клинического исследования лекарственного препарата для медицинского применения), ГОСТ Р 56701-2015 от 2016-07-01 ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ (УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 11 ноября 2015 г. N 1762-ст.), ГОСТ Р 52379-2005 от 2006-04-01 НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКА (УТВЕРЖДЕН Приказом Федерального агентства по техническому регулированию и метрологии от 27 сентября 2005 года N 232-ст), Правила надлежащей клинической практики ОСТ 42-511-99 (согласно международного стандарта этических норм и качества научных исследований Good Clinical Practice; GCP), Приказ Минздрава России от 01.04.2016 N 200н «Об утверждении правил надлежащей клинической практики» (Зарегистрировано в Минюсте России 23.08.2016 N 43357), приказ Минздрава России от 09.01.2014 № 2н «Об утверждении порядка проведения оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий».
Обычно выделяют четыре фазы клинических испытаний. Фаза I. Цель этапа — убедиться, что препарат можно применять у людей. Фаза II. Цель этапа — дополнительно оценить безопасность лекарства и выяснить, работает ли препарат. Фаза III. Цель этапа — сравнить новый препарат со стандартным лечением. Фаза IV называется постмаркетинговой — этот этап клинического испытания начинается, когда готовое лекарство уже поступает в продажу.
Существует государственный реестр лекарственных средств, который содержит перечень лекарственных препаратов, прошедших государственную регистрацию (Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» Статья 33), другими словами реестр разрешений на проведение клинических исследований (РКИ).
В настоящий момент, у Российской Федерации известно существование нескольких вакцин от коронавируса: «Спутник V» и «Спутник Лайт» («Гам-КОВИД-Вак», Национального исследовательского центра эпидемиологии и микробиологии имени Н. Ф. Гамалеи), «ЭпиВакКорона» (Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии Вектор» Роспотребнадзора), «КовиВак» (Федерального научного центра исследований и разработки иммунобиологических препаратов имени М.П. Чумакова Российской академии наук).
Как мы видим, в настоящий момент, проводится фаза клинического исследования 1-2 с участием добровольцев от 18 до 60 лет, и завершится она 30 ноября 2021 года.
Так же, проводится фаза клинического исследования 3-4 с участием добровольцев от 18 лет, и завершится она 31 августа 2021 года.
Завершенная фаза 3 клинического исследования, с участием добровольцев от 60 лет, и завершилась она 15 мая 2021 года.
Фаза клинического исследования 1-2 с участием добровольцев от 18 до 60 лет, проводится до 30 декабря 2021 года.
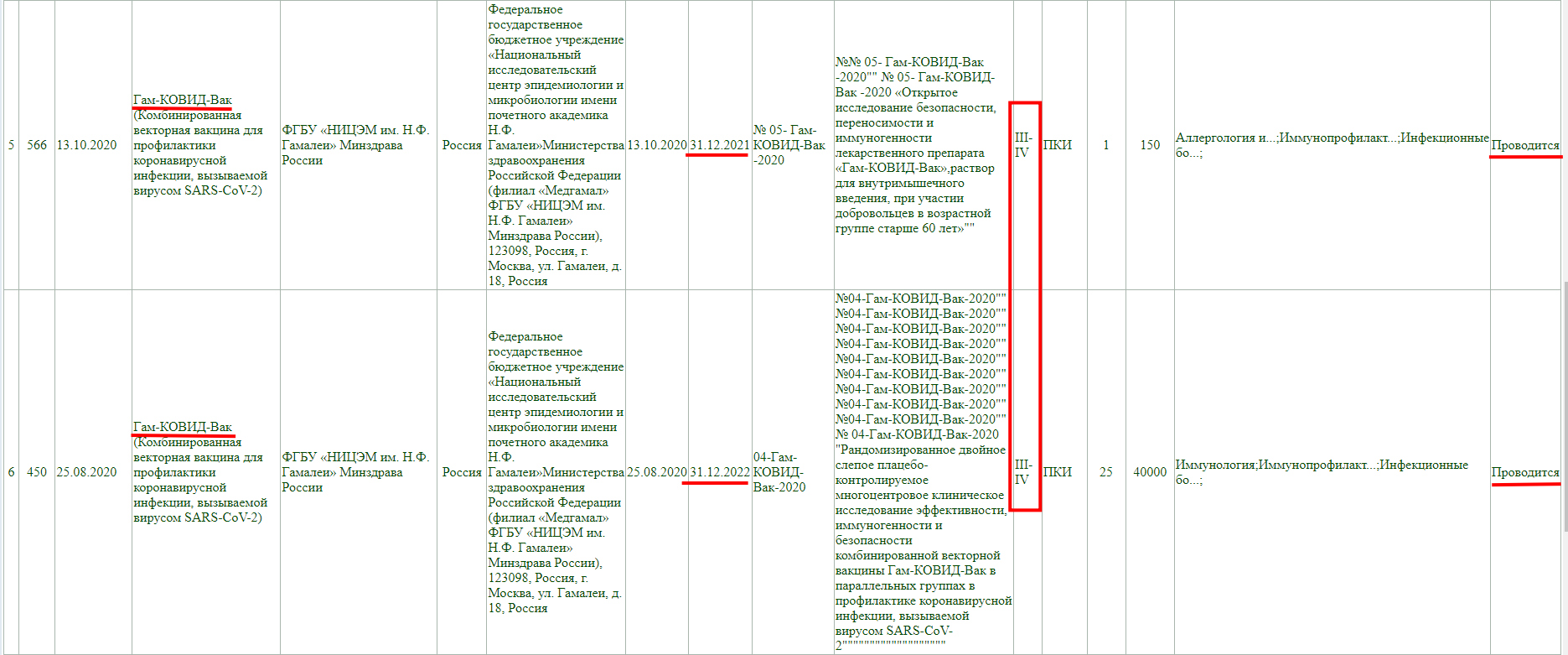
Тут так же видно, что проводится фаза клинического исследования 3 с участием добровольцев от 18 до 60 лет, и завершится она 30 декабря 2022 года.
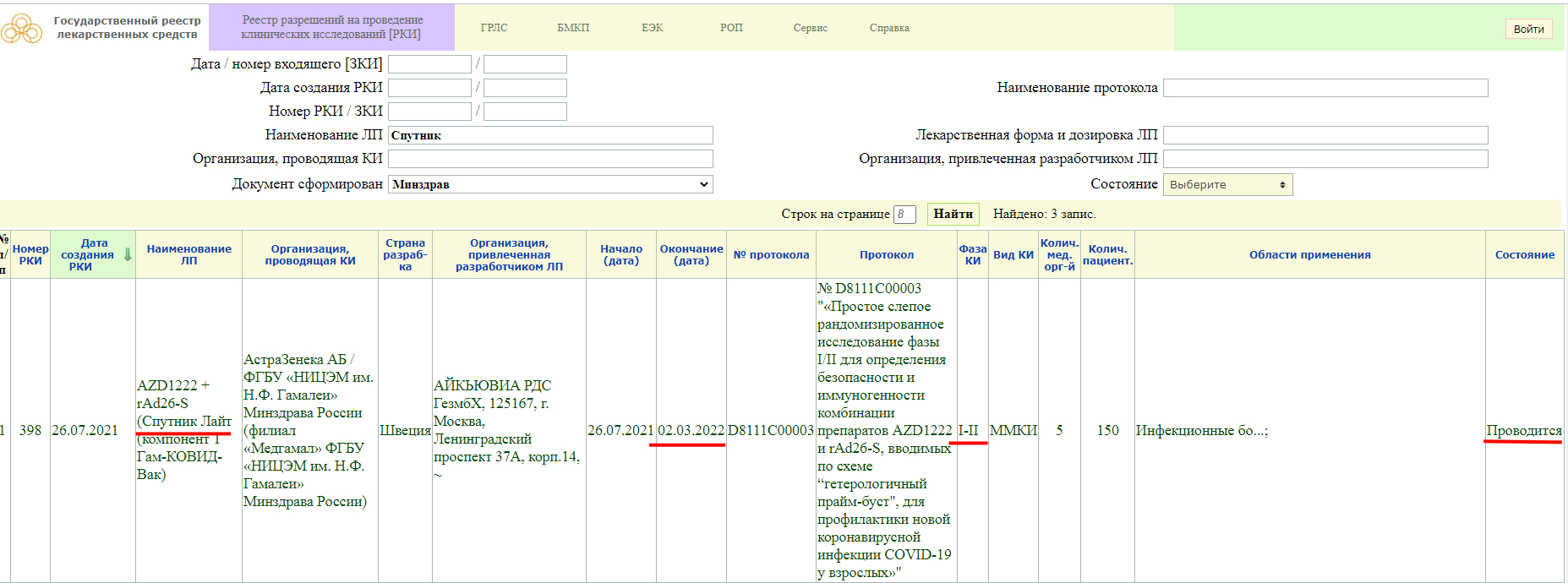
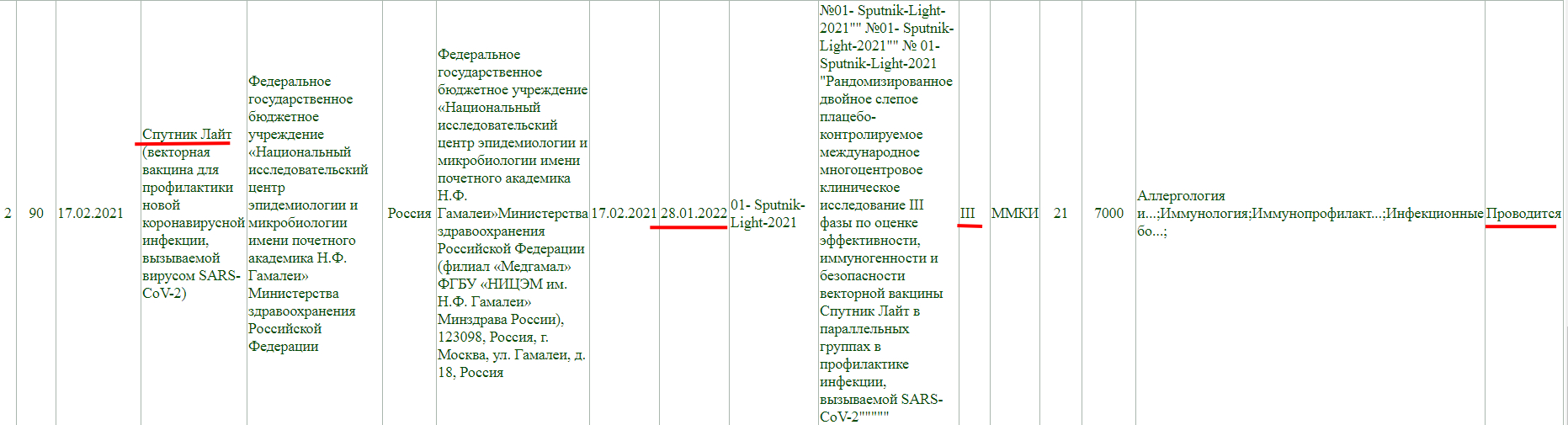
Как мы видим, в настоящий момент, у «Спутника Лайт» проводится фаза клинического исследования 1-2, и завершится она 2 марта 2022 года. Кстати обратите внимание, страна разработки Швеция.
Так же, проводится фаза клинического исследования 3, и завершится она 28 января 2022 года.
Фаза клинического исследования 1-2, проводится до 31 декабря 2021 года.
Важно отметить, что согласно разъяснениям Минздрава: «Гам-Ковид-Вак» и «Спутник V» — это одна и та же вакцина, у которой есть медицинское и коммерческое названия. Всем знакомая и понятная фраза «Спутник V» является торговым наименованием «Гам-Ковид-Вак.
Как и у остальных, клинические исследования не завершены, и в настоящий момент проводится фаза 3 с участием добровольцев от 18 до 60 лет, а завершится она 30 декабря 2022 года.
Тут аналогично, клинические исследования не завершены, проводится фаза 3-4, и завершится она 30 декабря 2022 года.
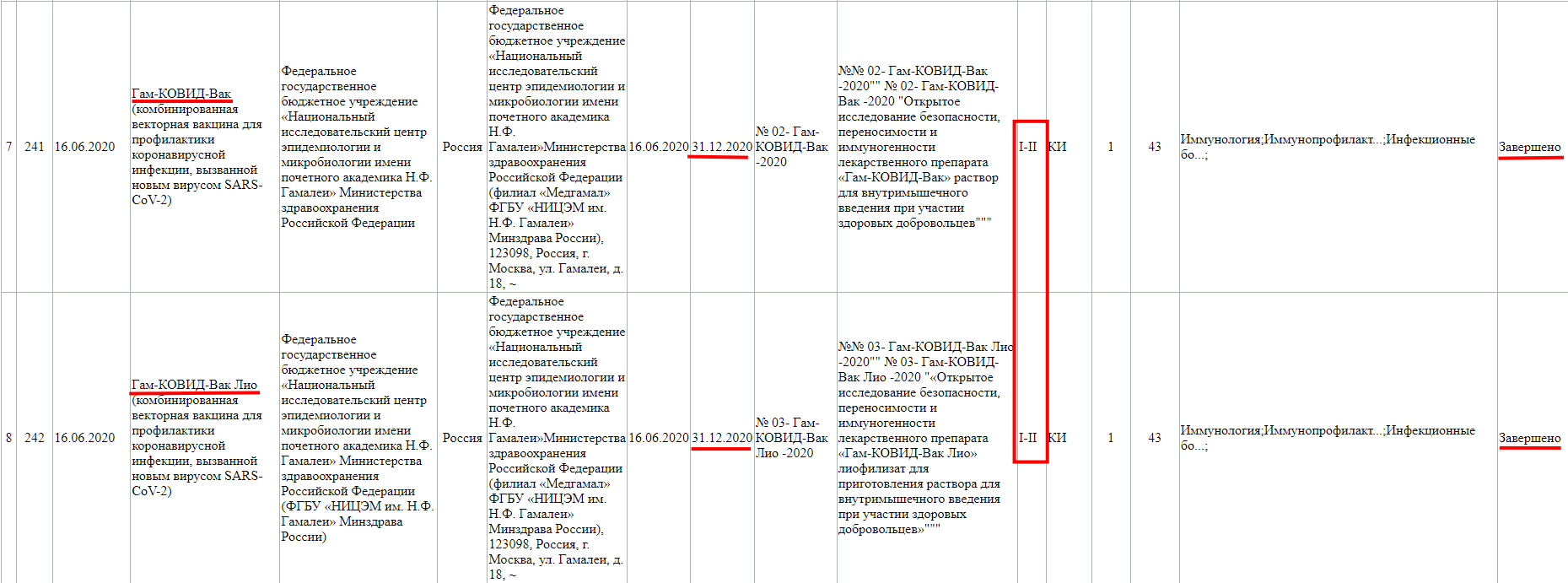
А тут клиническое исследование завершено, но только фазы 1-2.
Кроме того, отсутствие данных о клинических испытаниях вакцины «Спутник V» необходимых для ее регистрации в Европе, 15 мая 2021 года, уже сообщало одно из крупнейших в мире международных агентств новостей и финансовой информации, Reuters.
И в завершение, по данным ВОЗ на 14 марта 2021 г., российские вакцины против COVID-19, в перечне безопасных и эффективных, отсутствуют.
Добавьте АН в свои источники, чтобы не пропустить важные события — Яндекс Новости
Россияне в соцсетях высказывают недовольство по поводу штрафа за кур на садовом участке
Британцы разгадывают головоломки от Мишустина
В России за сутки скончались 812 человек с коронавирусом
Эксперт рассказал, как удалось снизить употребления алкоголя в России
В Великобритании начали прививать от COVID-19 детей от 12 лет
Греция ужесточила ограничения, введенные из-за пандемии COVID-19
Глава Крыма Аксёнов: «Сам получу сертификат фармацевта, надоело враньё»
Минздрав обеспокоен высоким уровнем смертности среди пенсионеров
В России за сутки выявили 19 179 случаев заражения коронавирусом
Как выбирали «Единую Россию» и кто ответит за будущее нашей страны. Резонансные новости недели
Власти США в ближайшие недели могут одобрить препарат Pfizer для вакцинации детей
РЕН ТВ опубликовал видео с места стрельбы в Пермском госуниверситете
Россию накроет четвёртая волна коронавируса
Станьте членом КЛАНА и каждый вторник вы будете получать свежий номер «Аргументы Недели», со скидкой более чем 70%, вместе с эксклюзивными материалами, не вошедшими в полосы газеты. Получите премиум доступ к библиотеке интереснейших и популярных книг, а также архиву более чем 700 вышедших номеров БЕСПЛАТНО. В дополнение у вас появится возможность целый год пользоваться бесплатными юридическими консультациями наших экспертов.
- Введите свой электронный адрес, после чего выберите любой удобный способ оплаты годовой подписки
Источник