- Реестр разрешений на проведение клинических исследований (РКИ). Или ещё раз о вакцинах от COVID-19.
- Сведения о вакцине ЭпиВакКорона от COVID-19 из РКИ
- Личное мнение
- Постскриптум
- Российские вакцины не прошли все фазы клинического исследования?
- Лекарственные средства
- Счетчик обращений граждан и организаций
- Лекарственные средства
- Контроль качества лекарственных средств
- Информационные письма
Реестр разрешений на проведение клинических исследований (РКИ). Или ещё раз о вакцинах от COVID-19.
И снова здравствуйте, уважаемые подписчики, читатели и гости сайта 9111. ру!
А вы знаете про существование реестра разрешений на проведение клинических исследований (РКИ)?
Если нет, то эта публикация для вас!
Сведения о вакцине ЭпиВакКорона от COVID-19 из РКИ
Справка: Все скрины, которые представлены в данной публикации, сделаны с сайта grls.rosminzdrav.ru. Полная ссылка на источник информации предоставлена в конце публикации.
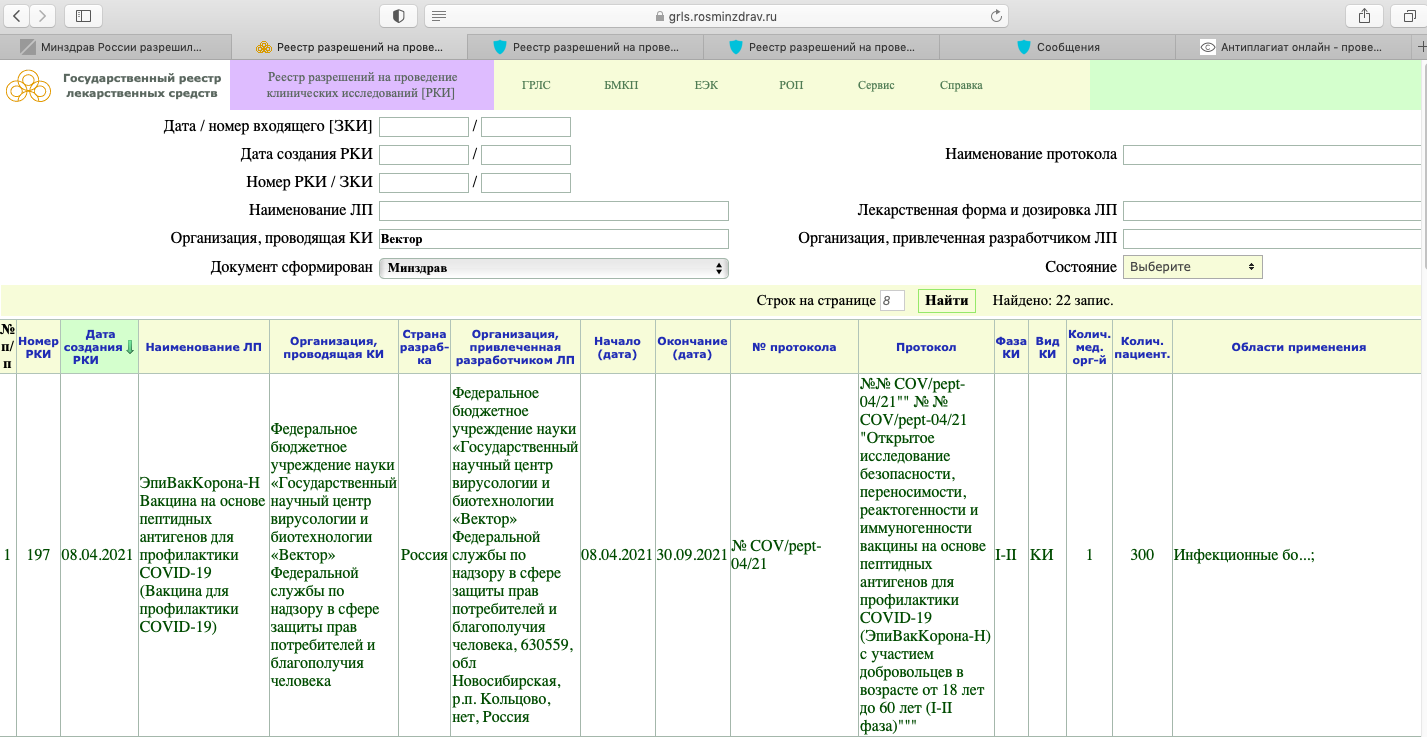
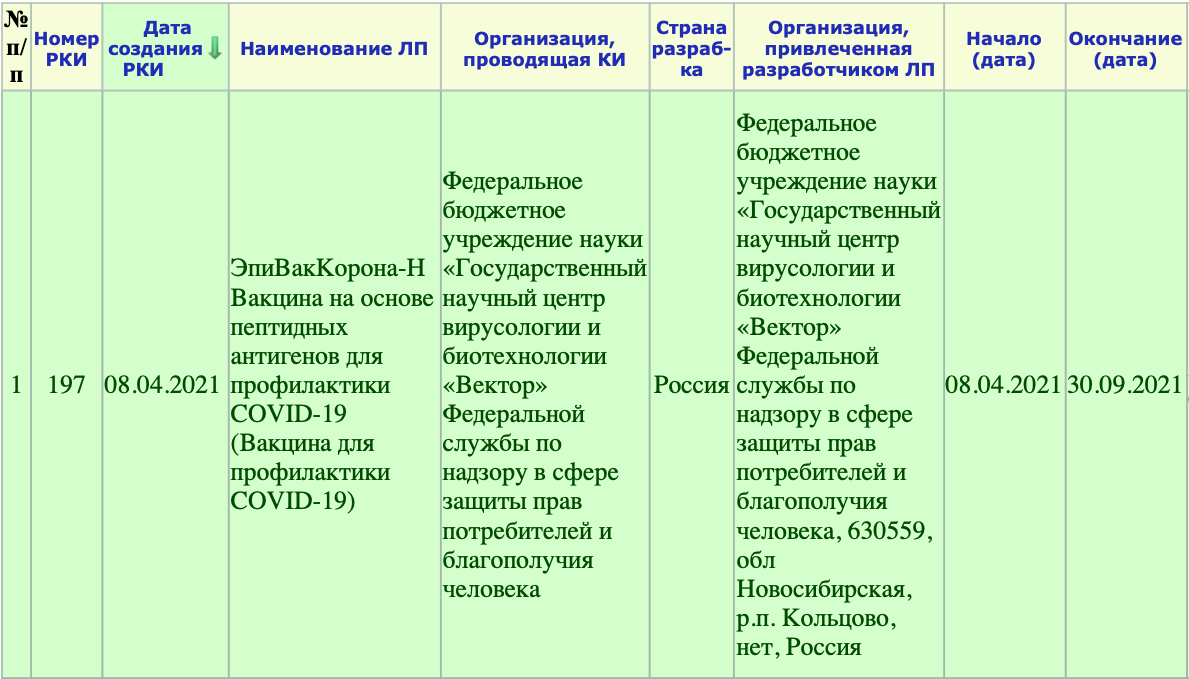
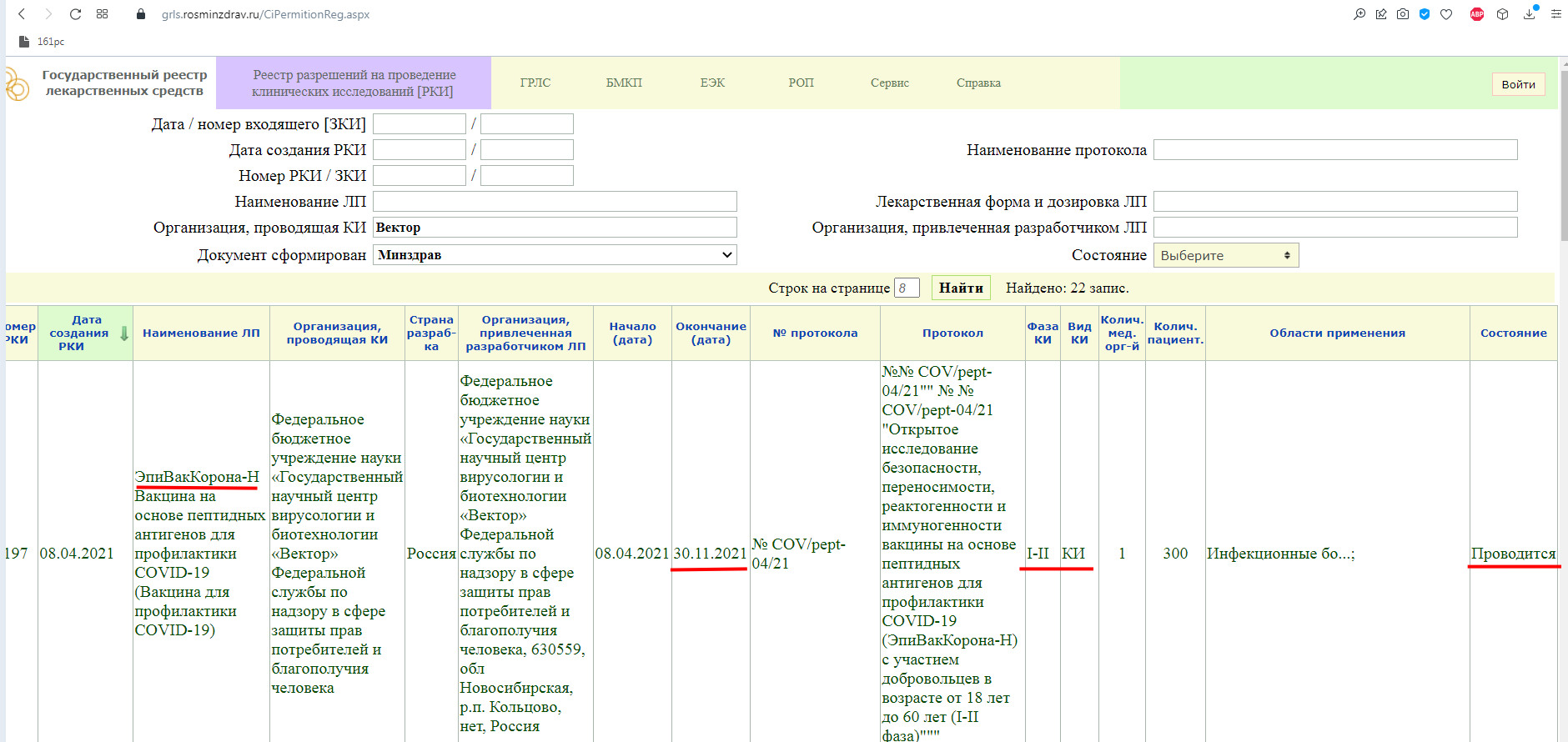
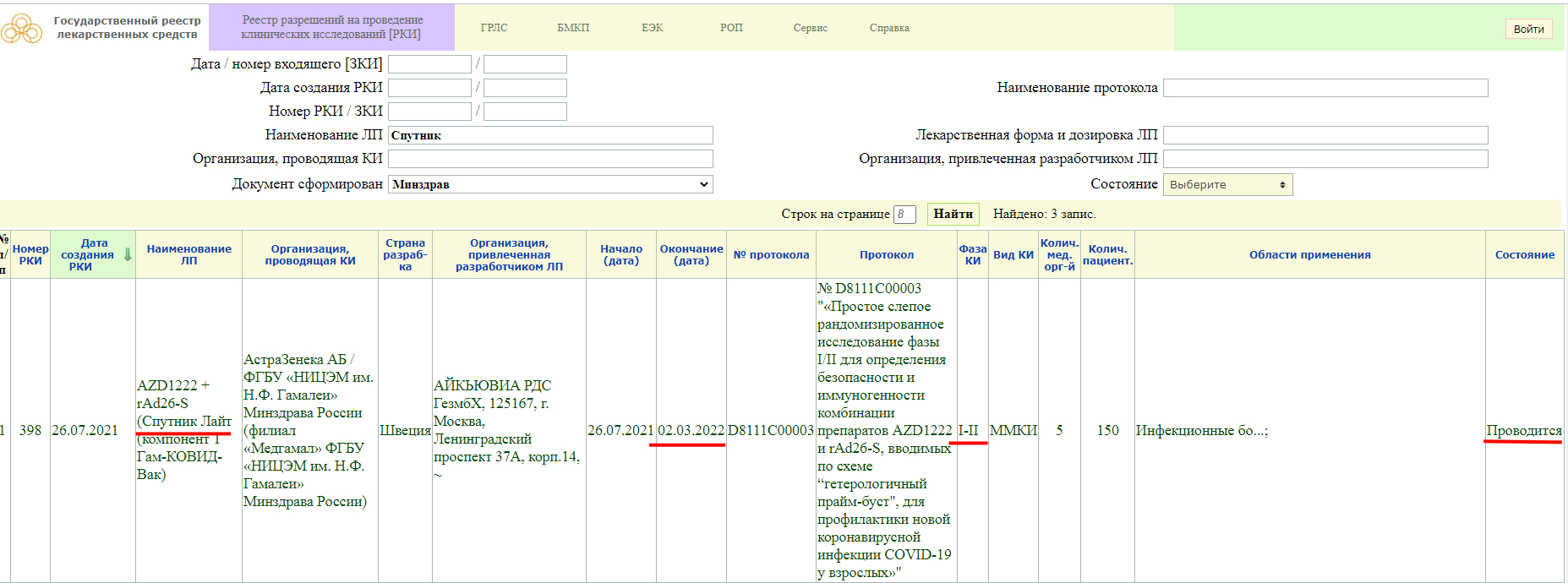
РКИ №197. Дата создания данной вакцины — 8 апреля текущего года. В этот же день начались и её испытания. Окончание испытаний — 30 сентября текущего года. То есть на данный момент проводясь её клинические испытания (КИ). При этом это только лишь I-II фаза КИ.
РКИ №644. Эти клинические испытания ЭпиВакКороны зарегистрированы 18 ноября 2020 года. Именно в этот день начались её клинические испытания. Дата окончания клинических испытаний — 31 августа 2021 года. Это III-IV фазы КИ и на данный момент, как мы видим КИ продолжаются (!). Хочется отметить, что многих россиян, которые решились делись прививку от COVID-19, прививали именно этой вакциной. Что же получается? Люди, которые привились ЭпиВакКороной, выступили в роли подопытных животных? Или я неправильно воспринимаю информацию из РКИ?
РКИ №639. Третья их фаза закончилась 15 мая текущего года. Тут я стесняюсь спросить: » На людях закончилась третья фаза исследования?»
РКИ №376. Это клинические испытания ЭпиВакКороны на I-II стадиях, которые закончатся только 30 декабря 2021 года (!). Как так? Людей уже прививали ЭпиВакКороной (!).
Для справки: В РКИ есть сведения и о других вакцинах от COVID-19, но как не старалась я у меня не получилось на них выйти, однако сведения о них там имеются.
Личное мнение
Сразу хочу сказать, что я не медик! У меня нет медицинского образования. Но, я с уверенностью говорю о том, что я такой вакцине доверять не буду! ПОЧЕМУ? Да, потому что никто не знает какие последствия могут быть после её вливания в человеческий организм, ведь испытания-то ещё проводятся. И поэтому возникают резонные вопросы:
Как доверять вакцине, которая не прошла все этапы клинических испытаний? Как можно испытывать на людях такую вакцину? Кто взял на себя ответственность за это?
Вот мне интересно. Кто мне ответит на первые два вопроса?
Ответ на третий вопрос я знаю, так как каждый человек, который решил сделать прививку, подписывает согласие, а это значит, что он сам в ответе за это. То есть, по моему личному мнению, подписывая согласие, мы сбрасываем ответственность за свою вакцинацию с тех, кто нас сейчас вынуждает тем или иным образом (увольнение или отстранение от работы) вакцинироваться.
Постскриптум
Уважаемые медики! Укажите, пожалуйста, на мои ошибки, если я что не так поняла. Убедите меня в том, что можно и нужно вакцинироваться вакциной, которая не прошла все фазы клинических испытаний.
С нетерпением жду от вас комментарии. Заранее благодарна вам за уважительное отношение к своим оппонентам.
Источник
Российские вакцины не прошли все фазы клинического исследования?
Клиническое исследование лекарственного препарата — изучение диагностических, лечебных, профилактических, фармакологических свойств лекарственного препарата в процессе его применения у человека, животного, в том числе процессов всасывания, распределения, изменения и выведения, путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного препарата, данных о нежелательных реакциях организма человека, животного на применение лекарственного препарата и об эффекте его взаимодействия с другими лекарственными препаратами и (или) пищевыми продуктами, кормами. (Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» Статья 4 Пункт 41)
Клинические исследования во всем мире являются неотъемлемым этапом разработки препаратов, который предшествует его регистрации и широкому медицинскому применению. В ходе клинических исследований новый препарат изучается для получения данных о его эффективности и безопасности. На основании этих данных уполномоченный орган здравоохранения принимает решение о регистрации препарата или отказе в регистрации.
Проведение клинических исследований в РФ регламентируют: Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» (Статья 40. Проведение клинического исследования лекарственного препарата для медицинского применения), ГОСТ Р 56701-2015 от 2016-07-01 ЛЕКАРСТВЕННЫЕ СРЕДСТВА ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ (УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 11 ноября 2015 г. N 1762-ст.), ГОСТ Р 52379-2005 от 2006-04-01 НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКА (УТВЕРЖДЕН Приказом Федерального агентства по техническому регулированию и метрологии от 27 сентября 2005 года N 232-ст), Правила надлежащей клинической практики ОСТ 42-511-99 (согласно международного стандарта этических норм и качества научных исследований Good Clinical Practice; GCP), Приказ Минздрава России от 01.04.2016 N 200н «Об утверждении правил надлежащей клинической практики» (Зарегистрировано в Минюсте России 23.08.2016 N 43357), приказ Минздрава России от 09.01.2014 № 2н «Об утверждении порядка проведения оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий».
Обычно выделяют четыре фазы клинических испытаний. Фаза I. Цель этапа — убедиться, что препарат можно применять у людей. Фаза II. Цель этапа — дополнительно оценить безопасность лекарства и выяснить, работает ли препарат. Фаза III. Цель этапа — сравнить новый препарат со стандартным лечением. Фаза IV называется постмаркетинговой — этот этап клинического испытания начинается, когда готовое лекарство уже поступает в продажу.
Существует государственный реестр лекарственных средств, который содержит перечень лекарственных препаратов, прошедших государственную регистрацию (Федеральный закон от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» Статья 33), другими словами реестр разрешений на проведение клинических исследований (РКИ).
В настоящий момент, у Российской Федерации известно существование нескольких вакцин от коронавируса: «Спутник V» и «Спутник Лайт» («Гам-КОВИД-Вак», Национального исследовательского центра эпидемиологии и микробиологии имени Н. Ф. Гамалеи), «ЭпиВакКорона» (Федерального бюджетного учреждения науки «Государственный научный центр вирусологии и биотехнологии Вектор» Роспотребнадзора), «КовиВак» (Федерального научного центра исследований и разработки иммунобиологических препаратов имени М.П. Чумакова Российской академии наук).
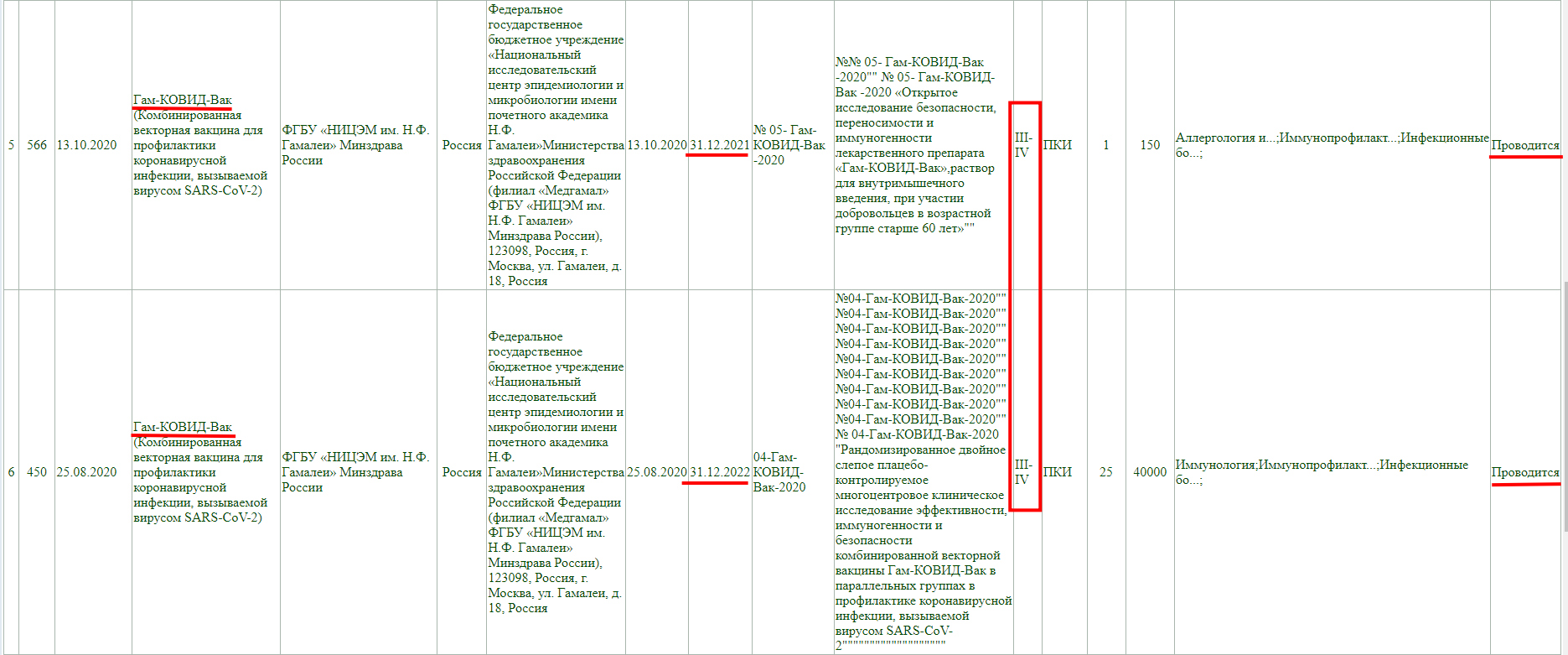
Как мы видим, в настоящий момент, проводится фаза клинического исследования 1-2 с участием добровольцев от 18 до 60 лет, и завершится она 30 ноября 2021 года.
Так же, проводится фаза клинического исследования 3-4 с участием добровольцев от 18 лет, и завершится она 31 августа 2021 года.
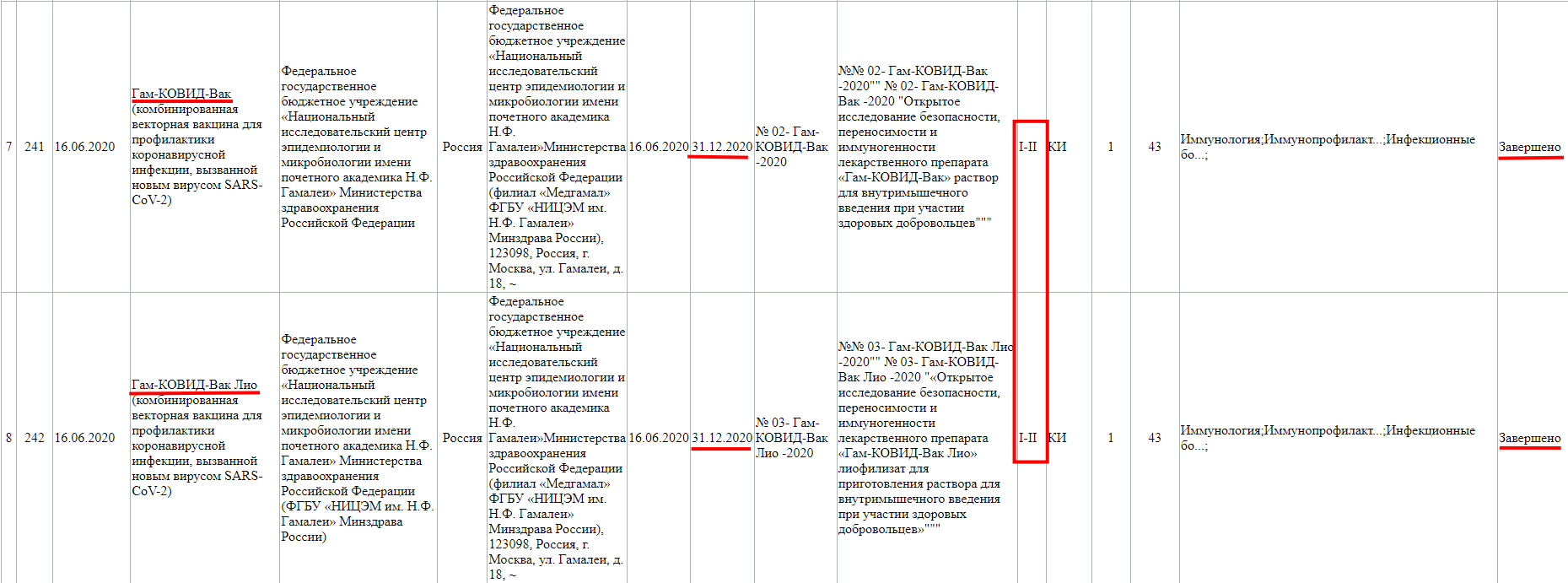
Завершенная фаза 3 клинического исследования, с участием добровольцев от 60 лет, и завершилась она 15 мая 2021 года.
Фаза клинического исследования 1-2 с участием добровольцев от 18 до 60 лет, проводится до 30 декабря 2021 года.
Тут так же видно, что проводится фаза клинического исследования 3 с участием добровольцев от 18 до 60 лет, и завершится она 30 декабря 2022 года.
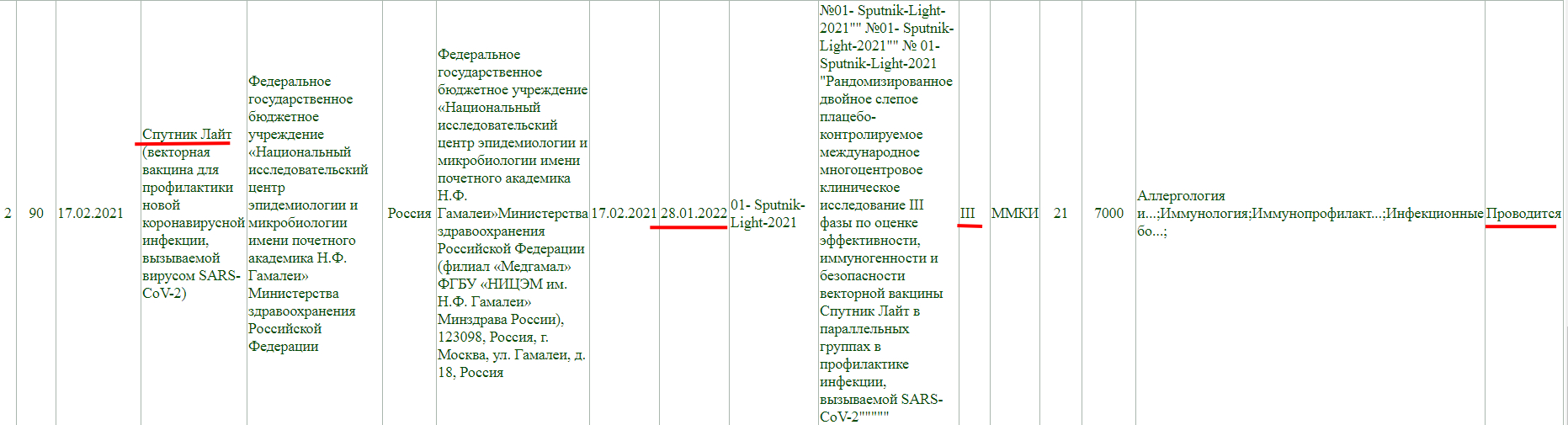
Как мы видим, в настоящий момент, у «Спутника Лайт» проводится фаза клинического исследования 1-2, и завершится она 2 марта 2022 года. Кстати обратите внимание, страна разработки Швеция.
Так же, проводится фаза клинического исследования 3, и завершится она 28 января 2022 года.
Фаза клинического исследования 1-2, проводится до 31 декабря 2021 года.
Важно отметить, что согласно разъяснениям Минздрава: «Гам-Ковид-Вак» и «Спутник V» — это одна и та же вакцина, у которой есть медицинское и коммерческое названия. Всем знакомая и понятная фраза «Спутник V» является торговым наименованием «Гам-Ковид-Вак.
Как и у остальных, клинические исследования не завершены, и в настоящий момент проводится фаза 3 с участием добровольцев от 18 до 60 лет, а завершится она 30 декабря 2022 года.
Тут аналогично, клинические исследования не завершены, проводится фаза 3-4, и завершится она 30 декабря 2022 года.
А тут клиническое исследование завершено, но только фазы 1-2.
Кроме того, отсутствие данных о клинических испытаниях вакцины «Спутник V» необходимых для ее регистрации в Европе, 15 мая 2021 года, уже сообщало одно из крупнейших в мире международных агентств новостей и финансовой информации, Reuters.
И в завершение, по данным ВОЗ на 14 марта 2021 г., российские вакцины против COVID-19, в перечне безопасных и эффективных, отсутствуют.
Добавьте АН в свои источники, чтобы не пропустить важные события — Яндекс Новости
РЕН ТВ опубликовал видео с места стрельбы в Пермском госуниверситете
Центр Чумакова завершил модернизацию оборудования и увеличит мощности производства вакцины «КовиВак» в 2-2,5 раза
Минздрав обеспокоен высоким уровнем смертности среди пенсионеров
The Sun назвал новую секретную ракету России «убийцей» американских спутников
Глава Крыма Аксёнов: «Сам получу сертификат фармацевта, надоело враньё»
Одобрение вакцины «Спутник V» в ВОЗ приостановлено
Коллективный иммунитет против COVID-19 оказался недостижимым даже при вакцинации
В России за сутки скончались 812 человек с коронавирусом
Если население мира не будет прививаться, появятся новые виды более опасных штаммов вируса
Вице-премьер Юрий Борисов: Проблемы с грузоподъёмностью Ил-112В решены
В Кызыле бывший министр сельского хозяйства Тувы найден с ножевым ранением, его жена убита
Эксперт рассказал, как удалось снизить употребления алкоголя в России
В России за сутки выявили 19 179 случаев заражения коронавирусом
Станьте членом КЛАНА и каждый вторник вы будете получать свежий номер «Аргументы Недели», со скидкой более чем 70%, вместе с эксклюзивными материалами, не вошедшими в полосы газеты. Получите премиум доступ к библиотеке интереснейших и популярных книг, а также архиву более чем 700 вышедших номеров БЕСПЛАТНО. В дополнение у вас появится возможность целый год пользоваться бесплатными юридическими консультациями наших экспертов.
- Введите свой электронный адрес, после чего выберите любой удобный способ оплаты годовой подписки
Источник
Лекарственные средства
Счетчик обращений граждан и организаций
Лекарственные средства
Контроль качества лекарственных средств
Постановлением Правительства Российской Федерации от 30.06.2004 № 323 «Об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения» на Росздравнадзор возложены полномочия по федеральному государственному надзору в сфере обращения лекарственных средств посредством проведения проверок соответствия лекарственных средств установленным обязательным требованиях к их качеству, и выборочный контроль качества лекарственных средств.
В данном разделе размещены:
Рубрика «Нормативная документация», где можно ознакомиться с нормативными правовыми актами, которые регулируют требования к лекарственным средствам, находящимся в обращении.
Рубрика «Информационные письма», которая содержит письма Росздравнадзора о выявленных недоброкачественных, фальсифицированных лекарственных средствах; об отзыве лекарственных средств; об изменении дизайна упаковок лекарственных препаратов для медицинского применения; о подлежащих изъятию из оборота лекарственных средствах; о результатах проверок соответствия лекарственных средств, проведенных Росздравнадзором, а также о решениях Росздравнадзора о соответствии лекарственных средств установленным требованиям к их качеству и решениях Росздравнадзора, принятым по результатам выборочного контроля качества лекарственных средств.
Рубрика «Справочная информация», в которой опубликованы обобщенные сведения о результатах государственного контроля в сфере обращения лекарственных средств.
Информационные письма
Информационное письмо от 22.09.2021 № 01И-1204/21
Решение о соответствии лекарственных средств требованиям нормативной документации
Источник