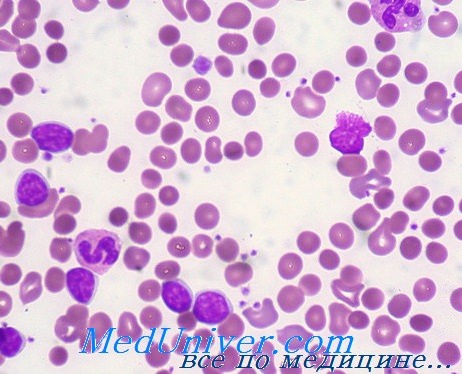
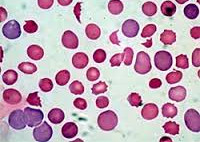
- Гемолитическая анемия лекарственное средство
- Медикаменты, оказывающие сенсибилизирующее действие при гемолитической анемии (по Swisher)
- Гемолитическая анемия
- МКБ-10
- Общие сведения
- Причины
- Патогенез
- Классификация
- Симптомы
- Наследственные мембранопатии, ферментопении и гемоглобинопатии
- Приобретенные гемолитические анемии
- Осложнения
- Диагностика
- Лечение
- Прогноз и профилактика
Гемолитическая анемия лекарственное средство
Гемолитическая анемия за счет сенсибилизации к лекарственным препаратам составляет обособленную группу и хотя заболевание рассматривается как анемия за счет иммунологического расстройства, тем не менее аутоиммунная характеристика отсутствует. Болезнь развивается в результате сенсибилизации организма к лекарственным препаратам, начинается процесс расплавления крови за счет антител, которые, однако, не представляют собой антиэритроцитные аутоантитела.
Современные этиопатогенетические данные уточнили эту обособленную группу, механизм и течение которой отличаются от иммунологической гемолитической анемии.
Патогенез гемолиза за счет сенсибилизации лекарственными препаратами впервые был объяснен Ackroyd (1953—1956) на аутоиммуной почве. С тех пор был выявлен ряд иных механизмов, среди которых наиболее обоснованным представляется механизм Shulmann, выдвинувшего гипотезу о гемолитическом действии иммуных комплексов. Однако не исключается возможность, что отдельные группы лекарственных препаратов обусловливают различные механизмы сенсибилизации, а следовательно, и определенные патогенетические группы гемолитической анемии за сенсибилизации к лекарственным препаратам.
Хотя с клинической точки зрения разница между ними невелика, тем не менее иммуносерологические исследования специфичны каждой группе в отдельности.
Так, в гемолитической анемии за счет седормида, первой исследованной Ackroyd (1954—1962) сенсибилизирующий лекарственный препарат действует как гаптен, соединяется с антигенными структурами оболочки эритроцитов и образует иммуногенный комплекс. Последний обусловливает первичную иммунологическую реакцию или через короткий срок после скрытых предыдущих сенсибилизации — вторичный иммуный ответ и выработку антител.
По мнению Ackroyd антитела специфичны комплексу эритроциты+лекарственный препарат, причем подобно аутоантителам аутоиммунной гемолитической анемии, они действуют на обложенные медикаментозным препаратом гематии и определяют процесс расплавления путем нанесения поражений II типа. Неполные антитела, дающие положительную реакцию Кумбса с сывороткой антигамма, закреплены на красных кровяных тельцах, но находятся и в сыворотке; в таких условиях сенсибилизированные в пробирке данным лекарственным препаратом гематии дают косвенную реакцию Кумбса.
Однако дальнейшие исследования выявили, что этот вид гаптеновой сенсибилизации наблюдается, в основном, при продолжительном применении пенициллина (Levine и сотр., Petz и сотр.), в то время как при сенсибилизации седормидом хотя и существует гаптеновый механизм, все же антитела не имеют специфического действия в отношении комплекса лекарственный препарат + красная кровяная клетка, о чем будет говориться в дальнейшем.
При сенсибилизации к пенициллину видимо разрабатываются оба вида гаптеновой сенсибилизации, причем один — результат закрепления лекарственного препарата на гематиях, а другой — на белках плазмы. Первый вид — это тот, в котором антитела специфичны в отношении иммуного комплекса эритроцит+пенициллин, при этом антигенное свойство последнего объясняется наличием бензилпенициллоидной и безнилпенальдиевой групп.
Первая группа обусловливает иммуную реакцию с антителами IgM, однако не известно какой из этих двух антигенов создает антитела гемолитического действия. Вместе с тем доказано, что гематии, сенсибилизированные пенициллином в пробирке и затем введенные в кровообращение больного в активный период гемолиза, отличаются такой же непродолжительностью жизни, как и гематии больного.
Прижизненно гемолитические антитела — это IgG, причем их можно смыть с красных кровяных телец больного. Однако они не расплавляют эритроциты в норме, а это свидетельствует о том, что речь идет не о аутоиммунных антителах, а о антителах, специфического противопенициллинного действия, которые поражают покрытые медикаментозным препаратом красные кровяные тельца. Вот аргументы, говорящие в пользу той мысли, что сенсибилизация к пенициллину вооружает антитела не против иммунного комплекса лекарственный препарат+гематия, как это предполагал Ackroyd, а против собственно данного медикамента.
Их воздействие в пробирке, равно как и прижизненно требует неуклонного присутствия закрепленного на красном кровяном тельце медикаментозного препарата (Swanson и сотр., Levine и Redmond, Davies и сотр.).
Как отмечалось ранее, отдельные антигенные фракции пенициллина вырабатывают также антитела IgM и IgA, однако их роль в механизме расплавления крови еще не определена. В принципе результат реакции Кумбса с сывороткой антикомплемент — отрицательный, следовательно связывающий комплемент IgM не вступает в иммунные, зависимые от комплемента реакции.
Второй вид расплавления крови путем сенсибилизации к лекарственным препаратам, описан Shulmann по результатам исследований, в основном, при тромбоцитопении после применения седормида, В этом механизме хинидин, хинин или стилбофен действуют подобно гаптену, но в закрепленном на протеиноплазматической группировке. Комплекс гаптен-протеин обусловливает образование антител вида IgM, которые оказываются активными лишь на антигенных структурах медикаментозного препарата. Образуются иммуные комплексы «противомедикаментозное антитело + медикаментозный препарат», которые закрепляются на оболочке красных кровяных телец и вызывают их расплавление.
По мнению Шульмана — которое в принципе не опровергается — поражение красных кровяных телец результат косвенного иммунного процесса, подобно отмечаемому при заболевании за счет иммунного комплекса типа III путем связывания комплемента. При этой реакции красные кровяные тельца являются «невинными зрителями» (innocent bystander) и подвергаются расплавляющему действию вследствие токсического влияния антиген+антитело+комплемент.
Серологическая диагностика использует реакцию Кумбса с сывороткой антинонгамма (антикомплемент) (Shulmann, Croft и сотр.).
Косвенная реакция Кумбса отрицательная; тест положителен при использовании сыворотки антикомплемент, но при условии чтобы она была свеже отобранной у больного, содержавшего иммунные комплексы+комплемент; реакция положительна и в дальнейшем, после выделения лекарственного препарата, когда еще сохраняются антитела и в реакцию вводится специфическое лекарственное вещество. Слвдовательно, реакция остается положительной, поскольку в сыворотке больного сохраняются противолекарственные, закрепляющие комплемент антитела.
С патогенетической точки зрения не доказан исходно описанный Ackroyd механизм, поскольку лекарственные препараты более сродствены к белковым комплексам и антителам, чем к оболочке красных кровяных клеток. На симпозиуме по проблеме патологии путем сенсибилизации к лекарственным препаратам (Клуж-Напока) был уточнен этот механизм, который составляет методологическую основу диагноза (Берчану).
В исключительно редких случаях сенсибилизации, например хлорпропамидом, как отмечает Swisher, механизм не меняется, но противолекарственные антитела принадлежат виду IgG
Третий вид сенсибилизации — помимо механизмов Ackroyd и Shulmann — это собственно аутоиммунный тип. При этом, сенсибилизирующий медикаментозный препарат — характерным является альфаметилдопа (альдомет) — обусловливает развитие аутоантител, отличающихся непосредственным специфическим антиэритроцитным действием. При подобной сенсибилизации данный медикамент оказывает неспецифическое действие нарушения иммунологической переносимости после длительного 3—б-месячного применения. Гемолитическая болезнь развивается реже, однако аутоиммунные антитела вида антирезус, как и при генуинной аутоиммунной гемиолитической анемии, развиваются у 10—30% больных, леченных альфаметилдопа.
Серологическое диагностирование проводится так же, как при аутоиммунной гемиолитической анемии с тепловыми антителами, т.е. посредством прямой или косвенной реакции Кумбса с сывороткой антигамма, при этом реакция в пробирке, равно как и прижизненный гемолитический эффект не требуют наличия медикаментозного препарата (Feldkamp и сотр., Lobuglio и Jandl, Bakemeyer и Leddy). Явление наблюдается и после назначения иных медикаментов, в том числе L-допа, мафенаминовой кислоты и прочих, отмеченных в ниже по Swisher. Также выявлено развитие противобелковых антител.
Медикаменты, оказывающие сенсибилизирующее действие при гемолитической анемии (по Swisher)
1. Антибиотики, противобактерицидные и противопротозойные средства:
Пенициллин
Стрептомицин
Цефалотин
Цефалоридин
Стилбофен
Изониазид
Парааминосалицилат
2. Противоопухолевые и болеутоляющие препараты:
Индометацин
Фенилбутазон
Фенацетин
Мефенаминовая кислота
Флюфенаминовая кислота
3. Противосудорожные и успокаивающие средства:
Мезантонин
Дилантин
Хлорпромазин
Хлордиазэпоксид
4. Прочие медикаментозные препараты:
Хинидин
Хинин
Альфаметилдопа
Допа
Хлорпропамид
С клинической точки зрения расплавление крови — явление непродолжительное, оно исчезает с прекращением приема данного медикамента; тем не менее присутствие антител наблюдается еще долгое время. В условиях случайно проведенной давшей положительный результат реакции пренебрежение составления точного анамнеза способствует постановке ошибочного диагноза аутоиммунной генуинной гемолитической болезни.
Иногда встречаются сочетания с развитием противоядерных антител, когда наблюдаемые явления положительной РКВ объясняются тем же механизмом.
Среди отмеченных, в таблице Swisher, сенсибилизирующих препаратов значатся и некоторые антибиотики, в том числе цефалотин и цефалоридии, которые, хотя и не вызывают клиническое расплавление крови, тем не менее, непосредственно после введения медикамента, способствуют развитию гемолитических антител. Видимо речь идет об определенных неспецифических перекрестных реакциях (Maltham и сотр., Gralrrick и сотр.).
Что касается дифференциальной диагностики гемолитических анемий, за счет сенсибилизации к лекарственным препаратам, трудности не возникают если учитываются этиологический фактор, сенсибилизирующий медикамент и механизм развития расплавления крови, соответственно виду медикамента. Поскольку в общих чертах известны описанные три механизма, принимая во внимание легкую, преходящую форму гемолиза, равно как и непосредственную связь этого процесса с назначением медикамента направить исследования на путь серологического диагноза с помощью реакции Кумбса.
Однако следует не упускать из виду непосредственное гемолитическое действие отдельных медикаментозных препаратов в связи с их токсическим влиянием на оболочку эритроцита, особенно на внутриэритроцитную структуру. Ранее рассматривалось непосредственное действие медикаментозных препаратов на набор ферментов и на гемоглобин, у здоровых людей, равно как и их влияние у носителей ферментативных отягчений.
Наиболее важную проблему дифференциальной диагностики составляет возможность отличить гемолитическую болезнь, за сенсибилизации к медикаментозному препарату, от генуинной или вторичной аутоиммунной гемолитической анемии. Преходящий клинический характер, эриологическая взаимосвязь с медикаментом и набор серологических реакций с положительным результатом, в присутствии данного медикаментозного препарата, составляют элементы диагноза, характеризующие гемолитическую болезнь за счет сенсибилизации к медикаменту.
Преходящий характер болезни при ее известной этиологии и краткосрочном течении оправдывают хороший прогноз и в принципе не требуют специального лечения. Прекратить медикамент как противопоказанный и запретить применение иных сенсибилизирующих препаратов в целях профилактики возвратного течения гемолитического процесса.
Кортикотерапия представляется целесообразной лишь в редких случаях продолжительного наличия гемолитических аутоантител после применения альфа-метилдопа. Следует предполагать, что, в определенных случаях, подобное положение может привести к развитию аутоиммунной гемолитической анемии, приобретающей генуинный характер в результате нарушения иммунной переносимости.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Гемолитическая анемия
Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для данной группы заболеваний типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
МКБ-10
Общие сведения
Гемолитическая анемия (ГА) — малокровие, обусловленное нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Данная группа анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных когортах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. Патология характеризуется укорочением жизненного цикла эритроцитов и их распадом (гемолизом) раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).
Причины
Этиопатогенетическую основу наследственных гемолитических синдромов составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфофункциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды, среди которых:
- Аутоиммунные процессы. Образование антител, агглютинирующих эритроциты, возможно при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии). Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода.
- Токсическое действие на эритроциты. В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Вызывать разрушение клеток крови может прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков).
- Механическое повреждение эритроцитов. Гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.
Патогенез
Центральным звеном патогенеза ГА является повышенное разрушение эритроцитов в органах ретикулоэндотелиальной системы (селезенке, печени, костном мозге, лимфатических узлах) или непосредственно в сосудистом русле. При аутоиммунном механизме анемии происходит образование антиэритроцитарных АТ (тепловых, холодовых), которые вызывают ферментативный лизис мембраны эритроцитов. Токсические вещества, являясь сильнейшими окислителями, разрушают эритроцит за счет развития метаболических, функциональных и морфологических изменений оболочки и стромы красных кровяных телец. Механические факторы оказывают прямое воздействие на клеточную мембрану. Под влиянием этих механизмов из эритроцитов выходят ионы калия и фосфора, а внутрь поступают ионы натрия. Клетка разбухает, при критическом увеличении ее объема наступает гемолиз. Распад эритроцитов сопровождаются развитием анемического и желтушного синдромов (так называемой «бледной желтухой»). Возможно интенсивное окрашивание кала и мочи, увеличение селезенки и печени.
Классификация
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные. Наследственные ГА включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз – болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) – анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) – анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии— анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные ГА подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия – б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные) – обусловлены воздействием антител
- токсические – анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- механические — анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Симптомы
Наследственные мембранопатии, ферментопении и гемоглобинопатии
Наиболее распространенной формой данной группы анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке. Манифестация микросфероцитарной ГА возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом — обтурационная желтуха. При микросфероцитозе во всех случаях увеличена селезенка, а у половины пациентов – еще и печень. Кроме наследственной микросфероцитарной анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Энзимопенические анемии связаны с недостатком определенных ферментов эритроцитов (чаще — Г-6-ФД, глутатион-зависимых ферментов, пируваткиназы и др). Гемолитическая анемия может впервые заявлять о себе после перенесенного интеркуррентного заболевания или приема медикаментов (салицилатов, сульфаниламидов, нитрофуранов). Обычно заболевание имеет ровное течение; типична «бледная желтуха», умеренная гепатоспленомегалия, сердечные шумы. В тяжелых случаях развивается ярко выраженная картина гемолитического криза (слабость, рвота, одышка, сердцебиение, коллаптоидное состояние). В связи с внутрисосудистым гемолизом эритроцитов и выделением гемосидерина с мочой последняя приобретает темный (иногда черный) цвет. Особенностям клинического течения гемоглобинопатий — талассемии и серповидно-клеточной анемии посвящены самостоятельные обзоры.
Приобретенные гемолитические анемии
Среди различных приобретенных вариантов чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер. Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка. При некоторых формах аутоиммунных анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Токсические анемии протекают с прогрессирующей слабостью, болями в правом подреберье и поясничной области, рвотой, гемоглобинурией, высокой температурой тела. Со 2-3 суток присоединяется желтуха и билирубинемия; на 3-5 сутки возникает печеночная и почечная недостаточность, признаками которых служат гепатомегалия, ферментемия, азотемия, анурия. Отдельные виды приобретенных гемолитических анемий рассмотрены в соответствующих статьях: «Гемоглобинурия» и «Тромбоцитопеническая пурпура», «Гемолитическая болезнь плода».
Осложнения
Каждый вид ГА имеет свои специфические осложнения: например, ЖКБ – при микросфероцитозе, печеночная недостаточность – при токсических формах и т.д. К числу общих осложнений относятся гемолитические кризы, которые могут провоцироваться инфекциями, стрессами, родами у женщин. При остром массивном гемолизе возможно развитие гемолитической комы, характеризующейся коллапсом, спутанным сознанием, олигурией, усилением желтухи. Угрозу жизни больного несут ДВС-синдром, инфаркт селезенки или спонтанный разрыв органа. Неотложной медицинской помощи требуют острая сердечно-сосудистая и почечная недостаточность.
Диагностика
Определение формы ГА на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки. Лабораторный диагностический комплекс включает:
- Исследование крови. Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. При аутоиммунных анемиях большое диагностическое значение имеет положительная проба Кумбса.
- Анализы мочи и кала. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина.
- Миелограмму. Для цитологического подтверждения выполняется стернальная пункция. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, порфирии, гемобластозы. Пациента консультируют гастроэнтеролог, клинический фармаколог, инфекционист и другие специалисты.
Лечение
Различные формы ГА имеют свои особенности и подходы к лечению. При всех вариантах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной анемии выполняется спленэктомия. Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов.
Прогноз и профилактика
Течение и исход зависят от вида анемии, тяжести протекания кризов, полноты патогенетической терапии. При многих приобретенных вариантах устранение причин и полноценное лечение приводит к полному выздоровлению. Излечения врожденных анемий добиться нельзя, однако возможно достижение длительной ремиссии. При развитии почечной недостаточности и других фатальных осложнений прогноз неблагоприятен. Предупредить развитие ГА позволяет профилактика острых инфекционных заболеваний, интоксикаций, отравлений. Запрещается бесконтрольное самостоятельное использование лекарственных препаратов. Необходимо тщательная подготовка пациентов к гемотрансфузиям, вакцинации с проведением всего комплекса необходимых обследований.
Источник