- Подключаемся к системе мониторинга оборота лекарственных препаратов
- Обязанность участия в системе мониторинга.
- Ответственность субъектов обращения лекарственных средств.
- Алгоритм подключения к ИС МДЛП.
- О системе мониторинга движения лекарств на основе маркировки. К чему следует подготовиться МО и разработчикам МИС?
Подключаемся к системе мониторинга оборота лекарственных препаратов
Автор: Тарасова Е. А., эксперт журнала
О системе мониторинга движения лекарственных препаратов для медицинского применения и необходимости подключения к ней участников оборота этих препаратов, а также о принимаемых мерах по созданию данной системы мы неоднократно писали на страницах нашего журнала. Теперь пора переходить от теории к практике. И поможет в этом аптекам и аптечным сетям Инструкция по подключению к ИС МДЛП, опубликованная Росздравнадзором в Письме от 20.05.2019 № 01и-1269/19.
Обязанность участия в системе мониторинга.
Юридические лица и ИП, осуществляющие производство, хранение, ввоз в РФ, отпуск, реализацию, передачу, применение и уничтожение лекарственных препаратов для медицинского применения, должны обеспечить внесение информации о лекарственных препаратах для медицинского применения в информационную систему движения мониторинг лекарственных препаратов (ИС МДЛП) с 1 января 2020 года. Напомним: эта обязанность обусловлена положениями Федерального закона от 28.12.2017 № 425-ФЗ[1] и ч. 7 ст. 67 Закона № 61-ФЗ[2].
Организации и ИП, не подключившиеся к ИС МДЛП, с 1 января 2020 года не смогут осуществлять обращение лекарственных препаратов, имеющих маркировку контрольными (идентификационными) знаками DataMatrix.
Порядок внесения информации о лекарственных препаратах в ИС МДЛП субъектами обращения лекарственных средств и ее состав регламентирован Положением о ИС МДЛП (утверждено Постановлением Правительства РФ от 14.12.2018 № 1556)[3]. А инструкция, определяющая порядок действий субъектов обращения лекарственных средств при подключении к ИС МДЛП, приведена в вышеупомянутом Письме Росздравнадзора № 01и-1269/19.
Итак, организации и ИП, имеющие намерение осуществлять оборот лекарственных препаратов для медицинского применения, до 1 января 2020 года обязаны (Письмо Росздравнадзора № 01и-1269/19)[4]:
пройти регистрацию в ИС МДЛП для медицинского применения;
иметь личный кабинет субъекта обращения лекарственных средств с целью внесения информации о лекарственных препаратах в систему мониторинга.
Ответственность субъектов обращения лекарственных средств.
За производство или продажу лекарственных препаратов для медицинского применения без нанесения средств идентификации, с нарушением установленного порядка их нанесения, а также за несвоевременное внесение данных в ИС МДЛП для медицинского применения или внесение в нее недостоверных данных организации и ИП несут ответственность в соответствии с действующим законодательством.
Так, несвоевременное внесение данных в ИС МДЛП для медицинского применения либо внесение в нее недостоверных данных согласно ст. 6.34 КоАП РФ (действует с 1 января 2020 года[5]) влечет штраф:
для должностных лиц – в размере от 5 до 10 тыс. руб.;
для юридических лиц (и ИП) – в размере от 50 до 100 тыс. руб.
Кроме того, согласно ч. 2 ст. 15.12 КоАП РФ продажа товаров и продукции без маркировки и (или) нанесения информации, предусмотренной законодательством РФ, в случае если такая маркировка и (или) нанесение такой информации обязательны, а также хранение, перевозка либо приобретение таких товаров и продукции в целях сбыта, за исключением продукции, указанной в ч. 4 названной статьи, влечет наложение штрафа:
на должностных лиц – в размере от 5 до 10 тыс. руб. с конфискацией предметов административного правонарушения;
на юридических лиц – в размере от 50 до 300 тыс. руб. с конфискацией предметов административного правонарушения.
Алгоритм подключения к ИС МДЛП.
Для начала работы с ИС МДЛП аптекам и аптечным сетям необходимо выполнить следующие действия (причем некоторые из них могут выполняться параллельно – для ускорения процесса подключения к системе).
Этап
Описание
Определите круг лиц (пользователей), которые будут регистрировать те или иные действия с лекарственными препаратами в ИС МДЛП, а также то, как они будут это делать и в какой момент
Справка. Какие именно действия должны регистрироваться в ИС МДЛП, описано в документе «Паспорта процессов». Он размещен в разделе «Маркировка лекарств» на сайте https://честныйзнак.рф в подразделе «Документы», блок «Основные действия участников МДЛП»
Получите для руководителя организации и каждого пользователя усиленную квалифицированную электронную подпись (УКЭП) в аккредитованном Минкомсвязи удостоверяющем центре (УЦ).
При получении УКЭП руководителя необходимо обратить внимание на точное соответствие данных сертификата данным ЕГРЮЛ. В случае их несоответствия доступ в ИС МДЛП с использованием такого сертификата будет невозможен
Справка. Список центров размещен по адресу https://digital.gov.ru/ru/activity/govservices/2
Установите средство криптографической защиты информации (СКЗИ), содержащее криптопровайдер (CSP), с поддержкой ГОСТ Р 34.10-2012** на компьютер, с которого предполагается регистрировать ответственных пользователей, работающих с ИС МДЛП
Справка. Процесс установки СКЗИ и сертификата УКЭП детально описан в «Руководстве пользователя личного кабинета субъекта обращения лекарственных препаратов» в разд. 2.1 «Установка ПО и сертификатов» и приложении Б «Инструкции по установке криптографического ПО». Документ расположен в разделе «Маркировка лекарств» на сайте https://честныйзнак.рф в подразделе «Документы», блок «Основные действия участников МДЛП».
При возникновении сложностей с выполнением этого и последующих шагов можно обратиться в службу технической поддержки оператора системы по адресу support@crpt.ru или через форму обратной связи на сайте https://честныйзнак.рф
С этого компьютера, используя полученную УКЭП руководителя, зарегистрируйте субъект обращения мониторинг лекарственных препаратов в ИС МДЛП.
О факте регистрации субъекта в ИС МДЛП необходимо проинформировать территориальный орган Росздравнадзора, орган управления здравоохранением субъекта РФ и центр компетенции в соответствующем субъекте РФ
Справка. Для этого нужно воспользоваться ссылкой https://mdlp.crpt.ru или кнопкой «Вход в систему» в разделе «Маркировка лекарств» на сайте https://честныйзнак.рф. Данный шаг подробно описан в «Руководстве пользователя личного кабинета…» в разд. 2.2 «Регистрация Личного кабинета Участника в ИС «Маркировка»
Получите УКЭП пользователей (определенных на шаге 1), если они не были получены на шаге 2, а затем зарегистрируйте этих пользователей в ИС МДЛП (используя средства личного кабинета ИС МДЛП, УКЭП руководителя и установленное СКЗИ). Установите СКЗИ и сертификаты УКЭП данных пользователей на их рабочие места
Справка. Подробно данный шаг описан в разд. 4.11 «Добавить запись пользователя в ЛК Участника (Администрирование)» «Руководства пользователя личного кабинета…»
Закрепите (при необходимости) определенный на шаге 1 порядок действий сотрудников по регистрации действий с лекарственными препаратами во внутренних организационно-распорядительных документах организации
Закажите (при необходимости) доработку используемых информационных систем для автоматизации разработанных бизнес-процессов в соответствии с порядком действий, определенном на шаге 1.
Кроме того, необходимо зарегистрировать в ИС МДЛП используемую субъектом обращения информационную систему, с помощью которой предполагается выполнять обмен данными с ИС МДЛП
Справка. Список разработчиков информационных систем, активно сотрудничающих с Оператором системы, можно найти в подразд. «Партнеры» по ссылке https://честныйзнак.рф/business/projects/21/#87.
Порядок регистрации информационной системы подробно описан в разд. 4.12 «Добавить, удалить учетную систему в ЛК Участника (Администрирование)» «Руководства пользователя личного кабинета…»
– порядок отзыва (при увольнении и изменении должностных обязанностей) ключей электронной подписи пользователей и закрепите его (при необходимости) во внутренних организационно-распорядительных документах;
– иные действия, необходимые для снижения риска компрометации ключей электронной подписи
Составьте перечень мест хранения лекарственных препаратов и мест их выбытия, проверьте его соответствие лицензиям. Опишите в личном кабинете список мест осуществления деятельности в соответствии с составленным перечнем
Справка. Эти действия подробнее описаны в разд. 4.5 «Добавить место деятельности Участника в ЛК Участника» «Руководства пользователя личного кабинета…»
При наличии у субъекта договорных отношений с другими участниками оборота, в соответствии с которыми субъект выполняет действия с лекарственными препаратам в местах осуществления деятельности другими участниками, эти места необходимо указать в соответствии с разд. 4.6 «Добавить место ответственного хранения в ЛК Участника» «Руководства пользователя личного кабинета…»***
Определите порядок действий пользователей при отказе ИС МДЛП зарегистрировать действие с лекарственным препаратом
Справка. Перечень возможных причин отказа приведен в документе «Описание XSD» для каждой регистрируемой в ИС МДЛП операции
В «песочнице» ИС МДЛП (https://sb.mdlp.crpt.ru) с помощью технической поддержки оператора системы (support@crpt.ru) зарегистрируйте тестовые коды маркировки лекарственных препаратов и уведомление об их отгрузке в адрес субъекта-получателя
Справка. Максимальное количество выдаваемых службой технической поддержки в рамках одного обращения кодов маркировки вторичных упаковок для использования в «песочнице» составляет не более 5 штук
Проверьте работоспособность разработанных бизнес-процессов и обученность пользователей (их готовность к реализации этих процессов), используя в качестве исходных данных для прохождения контрольных примеров зарегистрированные на предыдущем шаге в «песочнице» МДЛП коды маркировки лекарственных препаратов
Проверьте (при необходимости) подключение к рабочему контуру ИС МДЛП и работоспособность заказанных доработок информационных систем (шаг 7) во взаимодействии с организацией, обслуживающей данные информационные системы
* Шаги 1 и 2 – 5 могут выполняться параллельно.
** Список сертифицированных на соответствие указанному ГОСТу СКЗИ доступен на сайте ФСБ по ссылке http://clsz.fsb.ru/certification.htm.
***Следует учесть, что реализацию и вывод из оборота для медицинского применения в местах ответственного хранения зарегистрировать невозможно.
[1] «О внесении изменений в Федеральный закон «Об обращении лекарственных средств».
[2] Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств».
[3] Утверждено Постановлением Правительства РФ от 14.12.2018 № 1556.
[4] Дополнительно информацию по данному вопросу можно получить на официальном сайте Росздравнадзора (http://roszdravnadzor.ru) в разделе «Система маркировки лекарственных препаратов (пилотный проект)» и на официальном сайте оператора системы ООО «Оператор-ЦРПТ» по ссылке https://честныйзнак.рф/business/projects/21.
[5] Федеральный закон от 15.04.2019 № 58-ФЗ «О внесении изменений в Кодекс Российской Федерации об административных правонарушениях».
Источник
О системе мониторинга движения лекарств на основе маркировки. К чему следует подготовиться МО и разработчикам МИС?
Об истории создания системы
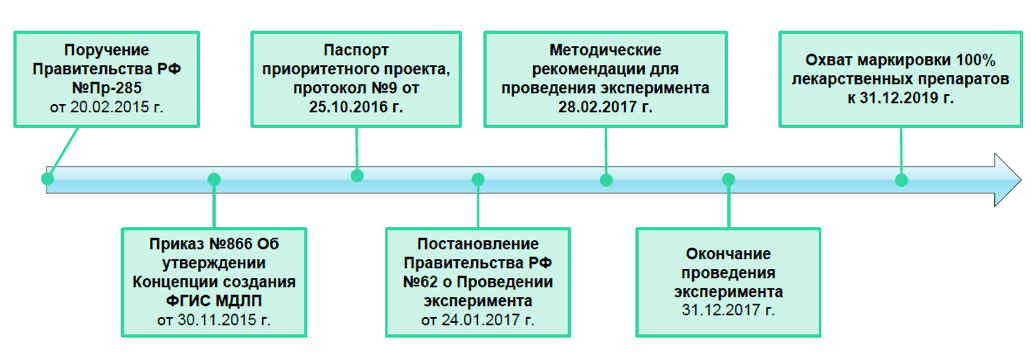
Решение о создании федеральной государственной информационной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки (далее ФГИС МДЛП) было принято 4 февраля 2015 г. на совещании президента РФ Владимира Путина с членами правительства. Согласно подписанному 20 февраля 2015 г. поручению №Пр-285, министерству здравоохранения было поручено обеспечить разработку и поэтапное внедрение системы.
Временная шкала, иллюстрирующая подготовку и запуск системы, показана на рисунке ниже.
Общее описание системы и участники проекта
Разрабатываемая система призвана защитить население от нелегальных лекарственных средств и предоставить гражданам и организациям возможность оперативной проверки их легальности. Общая функциональная схема системы приведена на рисунке ниже.
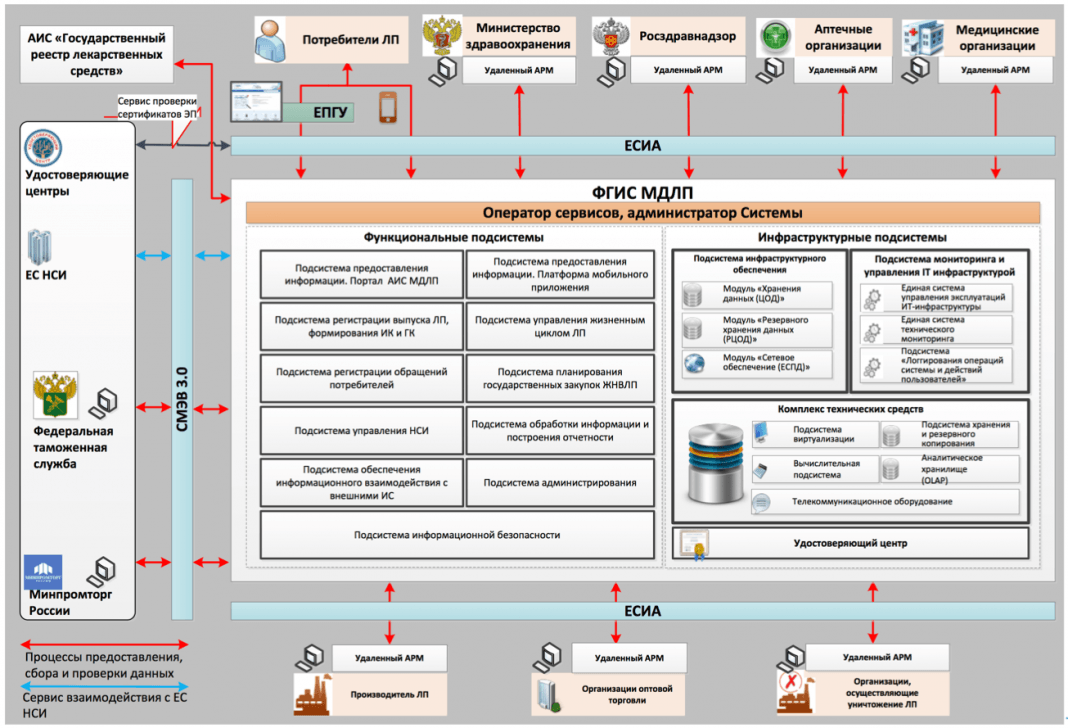
По такому же принципу, только с использованием специализированных приборов, сканеров, предполагается проводить проверку подлинности лекарственных средств в аптеках и медицинских учреждениях при получении их от поставщика. Помимо этого, внедрение системы позволит получать детальные сведения о перемещении упаковки, а также информацию, которая делает невозможным дальнейшее ее обращение (например, наличие данных о том, что упаковка была ранее продана или выведена из обращения по какой-либо другой причин).
Разработчиком и оператором системы МДЛП является Федеральная налоговая служба (ФНС). На сайте ФНС создан специализированный раздел, посвященный системе маркировки лекарственных препаратов. Также подробная информация о ходе реализации проекта публикуется на сайте Федеральной службы по надзору в сфере здравоохранения (Росздравнадзора) – еще одного из задействованных во внедрении системы федеральных органов государственной власти. Кроме этого участниками со стороны государства, помимо самого Минздрава, являются министерство финансов Российской Федерации, министерство промышленности и торговли Российской Федерации и Федеральная таможенная служба.
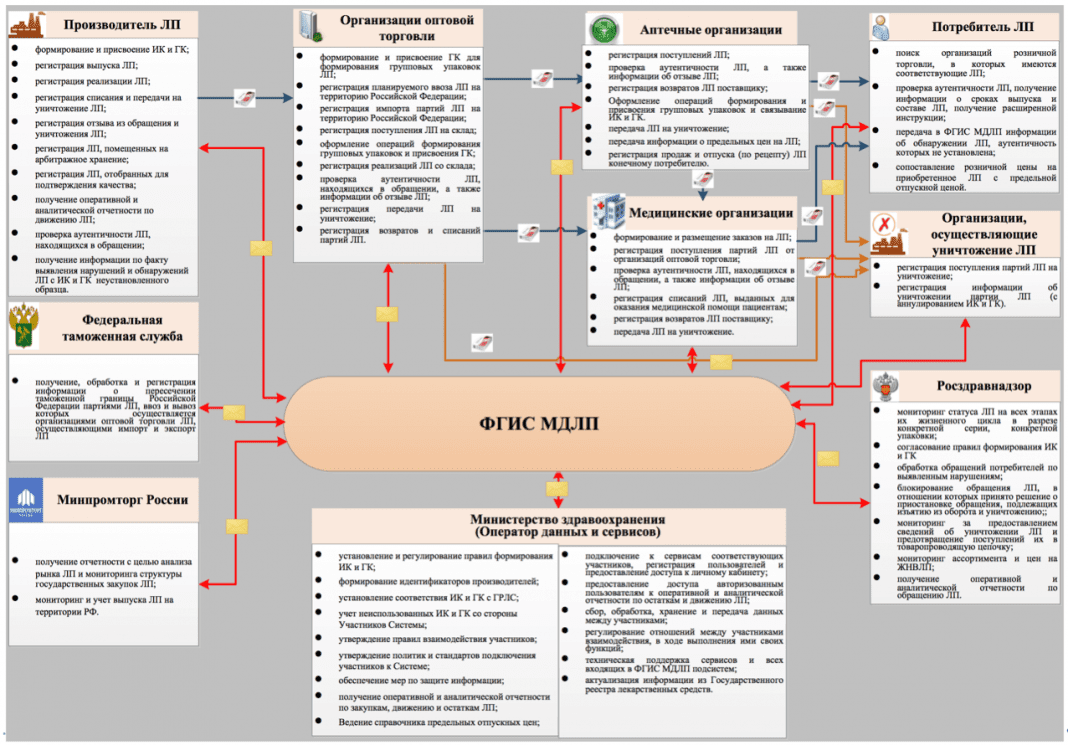
Непосредственными пользователями системы станут все субъекты обращения лекарственных препаратов (ЛП), а именно
- российские производители ЛП;
- иностранные держатели регистрационных удостоверений ЛП и их представительства;
- организации оптовой и розничной торговли ЛП (аптеки);
- медицинские организации (МО).
Планируется, что по результатам реализации проекта будут задействованы более 350 тысяч субъектов.
Взглянув на общую блок-схему организационного взаимодействия участников (рис. ниже), после нескольких минут пристального изучения, становится ясно, что ФГИС МДЛП позволит отслеживать каждое движение лекарственного препарата, начиная с момента его выпуска из производства и заканчивая реализацией конечному потребителю.
25 октября 2016 г. президиумом Совета при президенте Российской Федерации по стратегическому развитию и приоритетным проектам был утвержден паспорт приоритетного проекта «Внедрение автоматизированной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя для защиты населения от фальсифицированных лекарственных препаратов и оперативного выведения из оборота контрафактных и недоброкачественных препаратов».
Согласно паспорту проекта (в редакции протокола от 21 декабря 2016 года №12), реализацию предполагалось выполнять в два этапа:
1. На первом этапе на территории Российской Федерации проводится эксперимент по маркировке контрольными (идентификационными) знаками лекарственных препаратов для медицинского применения для ограниченного набора препаратов преимущественно из перечня семи высокозатратных нозологий.
2. На втором этапе должна осуществляться обязательна маркировка всех 100% лекарственных препаратов.
Изначально первый этап должен был продлиться с 1 января 2017 г. до 31 декабря 2017 г., однако его старт был немного сдвинут. 24 января 2017 г. Дмитрий Медведев подписал постановление правительства №62 «О проведении эксперимента по маркировке контрольными знаками отдельных видов лекарственных препаратов и по мониторингу за их оборотом». Подписанным документом был запущен эксперимент по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения, под который отвели 11-месячный срок проведения: с 01.02.2017 по 31.12.2017.
Второй этап планировалось выполнить с 1 января 2018 г. до 31 декабря 2018 г. Однако на фоне активного общественного обсуждения и критики проекта со стороны производителей и поставщиков препаратов они были пересмотрены.
В итоге 29 декабря 2017 года президент России подписал доработанный правительством Федеральный закон №425-ФЗ «О внесении изменений в Федеральный закон “Об обращении лекарственных средств”.
Согласно №425-ФЗ, срок маркировки 100% лекарственных средств и полномасштабное использование системы (срок завершения второго этапа) перенесен на 1 января 2020 года, таким образом внедрение системы продлено на один год.
При этом необходимо отметить, что 425-ФЗ одновременно дает право правительству самостоятельно устанавливать особенности и сроки внедрения системы МДЛП. Это означает, что участники оборота лекарственных средств (и, соответственно, разработчики задействованных информационных систем) должны на протяжении всего процесса внедрения отслеживать актуальные изменения порядка внедрения системы.
Проведение эксперимента (первый этап) по идее уже завершено. Участники эксперимента выбирались на добровольной основе на основании заявок, поданных в Росздравнадзор. Известно, что в эксперименте участвует 34 производителя лекарственных препаратов, при этом информации о перечне организаций торговли или медицинских организаций, также участвующих в эксперименте, Росздравнадзор пока не раскрывает. Результаты проведения данного эксперимента следует ожидать в феврале 2018 года. Всем задействованным в проекте федеральным органам государственной власти поручено провести оценку результатов эксперимента и представить соответствующий доклад в правительство Российской Федерации.
Как подготовиться к внедрению системы
Учитывая вышесказанное, с 1 января 2020 года любая медицинская организация, которая участвует в обороте лекарственных средств, должна работать в системе МДЛП.
Согласно приказу Минздрава №866, аптечные организации должны:
1. Выгружать из ФГИС МДЛП актуальную информацию о лекарственных препаратах, в том числе выведенных из обращения.
2. Загружать в ФГИС МДЛП информацию о поступлении, отгрузке, возврате, списании и передаче на уничтожение партий лекарственных препаратов.
3. Загружать в ФГИС МДЛП сведения, необходимые для осуществления мониторинга предельной цены на ЛП из перечня ЖВНЛП.
Медицинские организации обязаны:
1. Выгружать из ФГИС МДЛП актуальную информацию о лекарственных препаратах, в том числе выведенных из обращения.
2. Загружать в ФГИС МДЛП информацию о поступлении, отгрузке, возврате, списании и передаче на уничтожение партий лекарственных препаратов.
Согласно приказу Минздрава №866, аптечные и медицинские организации должны иметь рабочие места, оснащенные персональными компьютерами, устройствами считывания специальной маркировки, а также иметь ключи электронной подписи (ЭП), которые требуются для информационного взаимодействия с ФГИС МДЛП. Для работы с системой должно быть обеспечено подключение к Интернету. В случае отсутствия такой возможности информация может накапливается на компьютерном оборудовании аптечных и медицинских организаций и затем передаваться по определенному графику офлайн.
И, что совершенно логично, требуется доработать информационные системы аптечных и медицинских организаций в целях интеграции с ФГИС МДЛП для организации контроля на местах получения и отпуска лекарственных препаратов. Информация о всех операциях в процессе оборота ЛП должна автоматически передаваться из таких систем в ФГИС МДЛП. Для этого ФНС уже разработала и опубликовала описания интеграционных профилей для разработчиков учетных систем.
В частности, на данное время доступны:
- протокол обмена интерфейсного уровня, версия 2.6;
- схемы и форматы для разработчиков учетных систем.
Схема работы пользователей в режиме интеграции учетной системы с ФГИС МДЛП выглядит следующим образом:
1. Пользователь аптечного учреждения (или подразделения МО) получает лекарственный препарат от поставщика и сканирует маркировку (код коробки SSCC, код упаковки sGTIN).
2. Учетная система передает эти сведения в ФГИС МДЛП и получает от нее ответ:
а) если ФГИС МДЛП «бракует» препарат – то сведения о нем автоматически фиксируются в системе и он выводится из оборота. Такой препарат должен быть возвращен поставку для уничтожения – это подделка;
б) если ФГИС МДЛП возвращает положительный ответ, то информация о таком поступлении фиксируется в учетной системе, с ней можно работать, в том числе осуществлять выписку и выдачу препарата пациентам.
3. В случае, если препарат перемещается между подразделениями аптечной/медицинской организации, эти сведения передаются в ФГИС МДЛП.
4. Как только препарат фактически израсходован (аптечная организация продала препарат пациенту или выдала его по льготному рецепту, или в стационаре осуществили расход препарата по врачебному назначению и т.д.) – учетная система должна передать эти сведения в ФГИС МДЛП, при этом персональные данные пациента не передаются. Этим шагом учетная система выводит препарат из оборота в ФГИС МДЛП.
Отметим, что сервисы электронного взаимодействия на текущий момент находятся на стадии тестирования, что означает возможное изменение протоколов обмена – об этом красноречиво свидетельствуют информационные сообщения на сайте ФНС. Ожидается, что после завершения анализа результатов эксперимента методологические рекомендации к внедрению и использованию системы МДЛП могут быть расширены и дополнены, а также, что немаловажно для разработчиков задействованных учетных систем, будут уточнены и технические детали интеграции.
В связи с этим мы рекомендуем в настоящее время проводить предварительные (начальные) мероприятия по оснащению и автоматизации аптечных и медицинских организаций в части учета лекарственных препаратов, включая следующее:
- Ознакомиться с актуальными НПА и описанием схемы работы системы, отслеживать изменения (тут рекомендуем пользоваться специализированными ресурсами ФНС и Росздравнадзора).
- Разработать и издать приказ по организации о назначении ответственного за внедрение системы и создании соответствующей рабочей группы.
- Осуществить подготовку рабочих мест сотрудников: оснастить их необходимым количеством персональных компьютеров (ПК), сканеров, закупить и установить усиленную квалифицированную электронную подпись (УКЭП), ПО для работы с ней, провести базовое компьютерное обучение.
- Определиться и внедрить программный продукт для учета движения ЛП, если это еще не сделано.
- Зарегистрироваться в системе по адресу mdlp.markirovka.nalog.ru. Для работы с системой придется учесть технические требования: Операционная система — не старше Microsoft Windows 7 или Mac OS X 10.8, браузер не ниже Internet Explorer 10 или Safari, плагин и программное обеспечение «КриптоПро» по версии 3.6.7777 или позднее.
- По возможности, провести работы с ФГИСЗ МДЛП хотя бы в тестовом режиме.
Для разработчиков аптечных систем и МИС МО реализация интеграции соответствующих учетных систем с ФГИСЗ МДЛП, на наш взгляд, пока является несколько преждевременной, по крайней мере, до публикации результатов эксперимента и официального утверждения финальных версий интеграционных механизмов. После того как эксперимент будет завершен и все необходимое программное обеспечение и сопроводительная документация ФГИСЗ МДЛП будут окончательно отлажены, можно будет приступить к детальной проработке данного вопроса и доработкам в части интеграции. Тем не менее, аптечным и медицинским организациям, а также разработчикам соответствующих информационных систем уже сейчас необходимо «подготовить почву» и активно готовиться к предстоящим работам.
Для уточнения вопросов и консультирования участников проекта (аптек и медицинских организаций) в регионах России созданы специализированные «Центры компетенций». Информацию о таком центре в своем регионе можно найти здесь.
Следует понимать, что внедрение системы затронет все бизнес-процессы, связанные с получением, реализацией и списанием лекарственных препаратов. Поэтому, если пока данные процессы не автоматизированы внутри самой медицинской организации, то данный вопрос следует решить в самое ближайшее время. Для этого предлагаем обратить внимание на наш продукт «КМИС.Аптека», позволяющий в полной мере решить данные задачи.
Полностью налаженные и автоматизированные процессы лекарственного обеспечения внутри организации с помощью «КМИС.Аптека» позволят в будущем сделать подключение МО к ФГИС МДЛП незаметным для пользователей. Для сотрудников АСУ значительно упростится решение технической стороны вопроса – после завершения отладки протоколов интеграции со стороны ФНС, МО, которая использует в своей работе «КМИС.Аптека», вместе с обновлением получит новую версию продукта с готовым к эксплуатации интеграционным протоколом интеграции с МДЛП.
О перспективах развития системы
В планах развития системы, как отмечает министр здравоохранения России Вероника Скворцова, также стоит интеграция ФГИС МДЛП с информационно-аналитической системой (ИАС) мониторинга и контроля в сфере государственных и муниципальных закупок лекарственных препаратов, которая введена в промышленную эксплуатацию с 1 января 2018 г. Внедрение связки данных систем, совместно с использованием персонифицированного учета лекарственных средств, позволит взять под контроль весь процесс лекарственного обеспечения в рамках всей страны. При этом для работы этой системы Минздравом на основании Государственного реестра лекарственных средств (ГРСЛ) разработан единый справочник классификатор лекарственных препаратов (ЕСКЛП), а также выработаны единые принципы ведения и передачи соответствующих структурированных сведений, более подробный комментарий опубликован тут. Паспорт справочника ЕСКЛП доступен тут.
Об авторе: Екатерина Михайлова, аналитик коммерческой службы компании “К-МИС”.
Источник



