- Экскреция (выведение) лекарственных средств
- Содержание
- Экскреция (выведение) лекарственных средств [ править | править код ]
- Выведение с мочой [ править | править код ]
- Выведение с желчью и калом [ править | править код ]
- Другие пути выведения [ править | править код ]
- Пресистемное выведение [ править | править код ]
- ЭКСКРЕЦИЯ ЛЕКАРСТВ [ править | править код ]
- Экскреция через почки [ править | править код ]
- Экскреция через желудочно-кишечный тракт [ править | править код ]
- Экскреция через легкие [ править | править код ]
- Фармакокинетика. Всасывание, распределение, выведение ЛП
Экскреция (выведение) лекарственных средств
Содержание
Экскреция (выведение) лекарственных средств [ править | править код ]
Лекарственные средства выводятся из организма в неизмененном виде или в виде метаболитов. Полярные соединения экскретируются легче, чем неполярные, жирорастворимые (исключение составляет выведение через легкие), поэтому жирорастворимые препараты сначала превращаются в более полярные метаболиты.
Основной орган, отвечающий за выведение лекарственных средств и их метаболитов, — почки. С калом выводятся невсосавшиеся в кишечнике вещества, а также препараты (и их метаболиты), которые секретируются в желчь или непосредственно в ЖКТ и затем не подвергаются повторному всасыванию. Лекарственные средства, которые выводятся с грудным молоком, могут оказать неблагоприятное действие на ребенка. Легкими выводятся в основном газообразные и летучие соединения и, в очень незначительном количестве, некоторые другие лекарственные средства и их метаболиты.
Выведение с мочой [ править | править код ]
Лекарственные средства могут фильтроваться в почечных клубочках, секретироваться в просвет канальцев и реабсорбироваться из канальцев обратно в плазму. Возрастные изменения функции почек обычно затрагивают эти физиологические процессы в равной степени. У новорожденных функция почек снижена; в течение первых месяцев жизни происходит ее быстрое становление. У пожилых функция почек может быть существенно нарушена, так как в течение жизни она постепенно снижается со скоростью примерно 1% в год.
Количество профильтровавшегося в клубочках лекарственного средства зависит от СКФ и степени связывания препарата с белками плазмы (фильтруется только свободный препарат). В проксимальных почечных канальцах лекарственные средства могут дополнительно секретироваться путем активного транспорта. В роли переносчика амфифильных анионов выступает Р-гликопротеид, а конъюгированных метаболитов (продукты конъюгации с глюкуроновой кислотой, сульфатом и глутатионом) — белок MRP2 (белок полирезистентности-2). Эти переносчики локализуются в мембране щеточной каемки апикальной поверхности эпителиальных клеток.
Сходные системы транспорта органических катионов секретируют препараты, представляющие собой органические основания. Реабсорбируются лекарственные средства главным образом путем неионной диффузии, хотя существуют и системы активного транспорта из просвета канальцев в плазму (эти системы локализуются в основном в дистальных почечных канальцах).
В неионизированной форме слабые кислоты и основания пассивно реабсорбируются в проксимальных и дистальных канальцах по концентрационному градиенту, возникающему благодаря реабсорбции воды. Ионизированные формы слабых электролитов хуже проникают через мембрану эпителиальных клеток канальцев. Таким образом, пассивная реабсорбция слабых электролитов зависит от pH мочи. При ощелачивании мочи слабые кислоты присутствуют в ней преимущественно в ионизированной форме и потому хуже реабсорбируются и в большей степени экскретируются. При закислении мочи, напротив, экскреция слабых кислот снижается. Для слабых оснований ситуация обратная. Ощелачивание и закисление мочи используют при отравлениях некоторыми лекарственными средствами для усиления их почечной экскреции. Степень влияния pH мочи на экскрецию лекарственного средства зависит от выраженности и стойкости изменения pH, а также от того, какой вклад вносит пассивная реабсорбция путем неионной диффузии (см. выше) в элиминацию препарата. Наиболее ощутимо pH мочи влияет на экскрецию слабых кислот и оснований, наполовину диссоциированных при pH от 5 до 8 (то есть в диапазоне колебаний pH мочи). Вместе с тем экскреция и относительно сильных кислот, например салицилатов, возрастает в 4—6 раз при ощелачивании мочи с pH от 6,4 до 8. Доля неионизированных салицилатов при этом уменьшается с 1 до 0,04%.
Выведение с желчью и калом [ править | править код ]
Аналогичные транспортные системы в мембране гепатоцитов активно секретируют лекарственные средства и их метаболиты в желчь. Р-гликопротеид транспортирует амфифильные и жирорастворимые препараты, а белок MRP2 — в основном конъюгированные метаболиты (продукты конъюгации с глутатионом и глюкуроновой кислотой, некоторые сульфаты). Белок MRP2 участвует также в транспорте эндогенных соединений. Врожденное отсутствие этого белка приводит к синдрому Дубина—Джонсона. Органические катионы секретируются в желчь также путем активного транспорта. В кишечник лекарственные средства и их метаболиты попадают с желчью или непосредственно из крови, так как в апикальной мембране энтероцитов тоже присутствуют белки-переносчики, транспортирующие эти вещества в просвет кишечника (например, Р-гликопротеид). Из кишечника препараты и их метаболиты могут вновь всасываться в кровь (конъюгированные метаболиты, например глюкурониды, предварительно гидролизуются кишечной микрофлорой) и возвращаться в печень. При значительном кишечно-печеночном кругообороте время действия препарата существенно увеличивается.
Другие пути выведения [ править | править код ]
Довольно большое количество лекарственного средства может выводиться с потом, со слюной и слезами. Таким путем выводятся в основном неионизированные жирорастворимые препараты, которые проходят через эпителиальные клетки потовых, слюнных и слезных желез путем диффузии. Экскреция слабых электролитов зависит от градиента pH. Лекарственные средства, которые выводятся со слюной, попадают в полость рта и обычно проглатываются. Концентрации некоторых препаратов в слюне и в сыворотке изменяются параллельно друг другу, поэтому в тех случаях, когда получить пробу крови трудно, можно ориентироваться на концентрацию лекарственного средства в слюне. То же самое справедливо и в отношении молока. Поскольку pH молока ниже, чем крови, концентрация основных веществ в молоке может быть чуть выше, чем в крови, а концентрация кислых — наоборот. Неэлектролиты (этанол, мочевина) легко проникают в молоко независимо от pH и достигают в нем той же концентрации, что и в сыворотке. Накопление лекарственных средств в волосах и коже имеет значение для судебно-медицинских исследований.
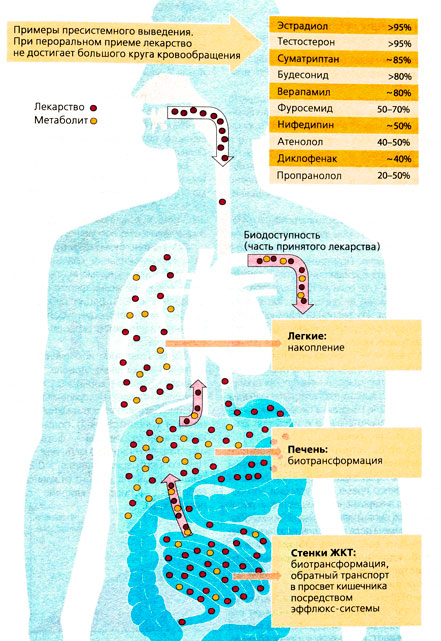
Пресистемное выведение [ править | править код ]
В зависимости от своих физико-химических свойств лекарства по-разному действуют на поверхности и внутри клеток, а также участвуют в бактериальном обмене веществ. Всегда, когда необходима системная терапия и нельзя использовать местные лекарственные средства, при обсуждении фармакокинетики надо учитывать влияние дополнительных факторов. Рассмотрим пероральный прием лекарства. Проследим «судьбу» лекарства до достижения им большого круга кровообращения.
1) Вещество проходит барьер кишечного эпителия и попадает в клетки слизистой оболочки (энтероциты), но Р-гликопротеины транспортируют его обратно. Тем самым в действительности происходит всасывание лишь небольшого количества лекарства. Прием одного и того же препарата может иметь неодинаковые последствия, так как у разных пациентов процесс всасывания протекает по-разному и зависит от приема других лекарств.
2) Действие вещества на пути от кишечника до большого круга кровообращения может быть ослаблено из-за взаимодействия с ферментами, например с цитохром оксид азой.
а) Лекарство способно разрушаться уже в кишечном эпителии. Активность цитохромоксидазы может усиливаться или блокироваться другими веществами. Например, грейпфрутовый сок тормозит действие СУРЗА4-оксидазы в кишечной стенке; в результате концентрация принимаемого препарата может возрасти и достичь токсического уровня.
б) Большую роль играет обмен веществ в печени, где происходит обезвреживание ядов. Ферменты печени так видоизменяют химически родственные и чужеродные организму вещества, что они затем могут выводиться. Количество вещества, достигшее венозной крови, зависит от того, сколько лекарства получено из печени и метаболизировано. Важно, что синтез ферментов (увеличение объема гладкого эндоплазматического ретикулума) может индуцироваться другими лекарствами.
Этот путь лекарства в организме называют «пресистемным выведением».
3) При парентеральном приеме лекарства пресистемное выведение исключается. Лекарство после инъекции в вену попадает через полую вену в правое предсердие, затем в легкие, левое предсердие, наконец, пройдя большой круг кровообращения, в коронарную систему. Легкие, богатые липидами и имеющие большую поверхность, принимают значительную часть амфифильных и липофильных лекарственных веществ, а при падении концентрации лекарства в крови легкие медленно возвращают его обратно. При быстром введении лекарства путем внутривенных инъекций легкие действуют как буфер, защищая сердце от высоких концентраций вещества.
В определенных ситуациях высокий уровень пресистемного выведения может быть желательным. Важный пример — применение глюкокортикоидов при астме, когда основное количество введенного путем ингаляции лекарства проглатывается, и благодаря пресистемному выведению нагрузка на организм весьма незначительна. Примером положительной роли пресистемного выведения являются превращения ацетилсалициловой кислоты, которую назначают в целях снижения тромбообразования.
ЭКСКРЕЦИЯ ЛЕКАРСТВ [ править | править код ]
Лекарства экскретируются из организма различными путями: через почки (моча), кишечный тракт (желчь и фекалии), легкие (выдыхаемый воздух), материнское молоко и пот. Экскреция с мочой и фекалиями — наиболее важные пути элиминации лекарств.
- Почечная и фекальная экскреция — наиболее важные пути элиминации лекарств
- Некоторые лекарственные конъюгаты гидролизуются в нижнем отделе ЖКТ с образованием исходного лекарства, которое реабсорбируется (процесс энтерогепатической циркуляции), тем самым увеличивая продолжительность действия лекарства
- Часть введенной дозы некоторых лекарств, экскретируемая почками в неизмененном виде, зависит от pH мочи
- Клиренс креатинина может быть использован для определения поражения почек и как показатель необходимости снижения дозы, если экскреция почками играет существенную роль в элиминации лекарства больным раком и с недостаточностью экспрессии изоформы UGTIA1 глюкуронозилтрансферазы следует снизить дозу иринотекана, ингибитора топоизомеразы I, чтобы уменьшить вероятность возникновения миелосупрессии и диареи.
Экскреция через почки [ править | править код ]
Экскреция через почки осуществляется путем фильтрации и секреции. Фильтрация происходит в клубочках почек, секреция — по ходу нефрона. При заболеваниях почек процесс экскреции некоторых лекарств нарушается. Почечная экскреция многих лекарств коррелирует со способностью почек экскретировать креатинин. Если трудно или невозможно определить функцию почек непосредственно, измеряя 24-часовой клиренс креатинина, почечную функцию можно определить, используя общепринятый алгоритм Кокрофта и Голта. Эти исследователи установили соотношение между возрастом пациента, массой его тела и концентрацией креатинина в сыворотке (Cs cr), из которого можно вычислить клиренс креатинина (С1сг) почками у пациентов мужского пола:
Сlсr (мл/мин) = [(140 — возраст) X идеальная МТ (кг)] / [0,8145 X Cscr (мкмоль/л)]
Для женщин величину клиренса креатинина нужно умножить на 0,85.
Экскреция креатинина почками осуществляется за счет фильтрации и секреции, но по мере снижения функции почек возрастает величина секретируемой фракции. Возможно, что это соотношение применимо ко всем лекарствам, которые фильтруются и секретируются почками.
Различные способы повышения экскреции лекарств почками
На основании соотношения между рКа и pH мочи определяют долю ионизированного лекарства и, соответственно, его количество после фильтрации, не способное реабсорбироваться путем диффузии через люминальную поверхность нефрона. Так, салициловая кислота, относящаяся к слабым кислотам (рКа 3,0), в основном метаболизируется до экскреции с мочой. Однако по мере повышения pH мочи все большая часть дозы теряется с мочой. И действительно, для лечения интоксикации, вызванной салицилатами, может быть использовано подщелачивание мочи с помощью перорального или парентерального введения бикарбонатов с целью повышения элиминации салициловой кислоты почками. Этот способ также может быть полезен в случае передозировки фенобарбитала.
Повышение оттока мочи увеличивает элиминацию некоторых лекарств почками, поскольку при этом сокращается время контакта вещества с люминальной поверхностью и тем самым уменьшается время для реабсорбции неионизированных молекул.
Экскреция через желудочно-кишечный тракт [ править | править код ]
Удаление лекарств из ЖКТ можно ускорить применением лаважного электролитного раствора полиэтиленгликоля. Большие объемы этого раствора можно либо принять внутрь, либо ввести в ЖКТ через назогастральную трубку, чтобы усилить кишечную перистальтику и ускорить экскрецию неабсорбированного лекарства через прямую кишку. Уменьшение времени прохождения через ЖКТ связано с индукцией диареи и снижением абсорбции питательных веществ, однако в острой ситуации это не имеет клинического значения.
Энтерогепатическая циркуляция удлиняет фармакологический эффект некоторых лекарств
Некоторые конъюгаты лекарств, экскретируемые в желчь, гидролизуются в нижнем отделе тонкой кишки, высвобождая исходное лекарство, которое реабсорбируется в кровоток, благодаря чему действие лекарства удлиняется. Этот процесс рециклирования называют энтерогепатической циркуляцией. Например, клиническое значение имеют следующие процессы:
- энтерогепатическая циркуляция седативного снотворного лекарства лоразепама включает гидролиз его глюкуронидного конъюгата в нижнем отделе тонкой кишки;
- предполагается, что отсутствие эффекта оральной контрацепции может быть обусловлено ингибированием энтерогепатической циркуляции после антибиотикотерапии, в результате которой удаляются кишечные бактерии, гидролизующие стероидный конъюгат, поэтому клиренс стероидов усиливается, и становится более вероятным исчезновение контрацептивного эффекта.
Экскреция через легкие [ править | править код ]
Летучие лекарства экскретируются через легкие. Такой путь имеет основное значение для анестетиков общего действия газо- или парообразной форме. Эти анестетики вводятся и выводятся через легкие, давая возможность легко контролировать анестезию с помощью коррекции концентрации анестетика во вдыхаемой газовой смеси. Экскреция через легкие позволяет осуществлять мониторинг концентрации выдыхаемого анестетика в конце спокойного выдоха, что может служить суррогатным показателем уровня анестезии. Этанол экскретируется через легкие в небольших количествах. Этот путь элиминации для этанола количественно незначим, однако он стал основой неинвазивного метода определения концентрации этанола в крови для юридических целей.
Источник
Фармакокинетика. Всасывание, распределение, выведение ЛП
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Фармакокинетика
Глава 1. Фармакокинетика (Т.А. Зацепилова, Д.А. Еникеева)
Фармакокинетические процессы — всасывание, распределение, депонирование, биотрансформация и выведение – связаны с проникновением ЛВ через биологические мембраны (в основном через цитоплазматические мембраны клеток). Существуют следующие способы проникновения веществ через биологические мембраны: пассивная диффузия, фильтрация, активный транспорт, облегченная диффузия, пиноцитоз (рис. 1.1).
Пассивная диффузия. Путем пассивной диффузии вещества проникают через мембрану по градиенту концентрации (если концентрация вещества с одной стороны мембраны выше, чем с другой, вещество перемещается через мембрану от большей концентрации к меньшей). Этот процесс не требует затраты энергии. Поскольку биологические мембраны в основном состоят из липидов, таким способом через них легко проникают вещества, растворимые в липидах и не имеющие заряда, т.е. л и -пофильные неполярные вещества. И напротив, гидрофильные полярные соединения непосредственно через липиды мембран практически не проникают.
Если ЛВ являются слабыми электролитами – слабыми кислотами или слабыми основаниями, то проникновение таких веществ через мембраны зависит от степени их ионизации, так как путем пассивной диффузии через двойной липид-ный слой мембраны легко проходят только неионизированные (незаряженные) молекулы вещества.
Степень ионизации слабых кислот и слабых оснований определяется:
- значениями рН среды;
- константой ионизации (Ка) веществ.
Слабые кислоты в большей степени ионизированы в щелочной среде, а слабые основания — в кислой.
Ионизация слабых кислот
НА = Н + + А- щелочная среда
Ионизация слабых оснований
ВН + = В + Н + Кислая среда
Константа ионизации характеризует способность вещества к ионизации при определенном значении рН среды. На практике для характеристики способности веществ к ионизации используют показатель рКа, который является отрицательным логарифмом Ka(-lg Ka). Показатель рКа численно равен значению рН среды, при котором ионизирована половина молекул данного вещества. Значения рКа слабых кислот, так же как и слабых оснований, варьируют в широких пределах. Чем меньше рКа слабой кислоты, тем легче она ионизируется даже при относительно низких значениях рН среды. Так, ацетилсалициловая кислота (рКа= 3,5) при рН 4,5 ионизирована более чем на 90%, в то же время степень ионизации аскорбиновой кислоты (рКа=11,5) при том же значении рН составляет доли % (рис. 1.2). Для слабых оснований существует обратная зависимость. Чем выше рКа слабого основания, тем в большей степени оно ионизировано даже при относительно высоких значениях рН среды.
Степень ионизации слабой кислоты или слабого основания можно рассчитать по формуле Гендерсона-Гассельбальха:
Эта формула позволяет определить, какова будет степень проникновения ЛВ (слабых кислот или слабых оснований) через мембраны, разделяющие среды организма с различными значениями рН, например при всасывании Л В из желудка (рН 2) в плазму крови (рН 7,4).
Пассивная диффузия гидрофильных полярных веществ возможна через водные поры (см. рис. 1.1). Это белковые молекулы в мембране клеток, проницаемые для воды и растворенных в ней веществ. Однако диаметр водных пор невелик (порядка 0,4 нм) и через них могут проникать только небольшие гидрофильные молекулы (например, мочевина). Большинство гидрофильных лекарственных веществ, диаметр молекул которых составляет более 1 нм, через водные поры в мембране клеток не проходят. Поэтому большинство гидрофильных лекарственных веществ не проникают внутрь клеток.
Фильтрация — этот термин используют как по отношению к проникновению гидрофильных веществ через водные поры в мембране клеток, так и по отношению к их проникновению через межклеточные промежутки. Фильтрация гидрофильных веществ через межклеточные промежутки происходит под гидростатическим или осмотическим давлением. Этот процесс имеет существенное значение для всасывания, распределения и выведения гидрофильных Л В и зависит от величины межклеточных промежутков.
Так как межклеточные промежутки в различных тканях не одинаковы по величине, гидрофильные ЛВ при различных путях введения всасываются в неодинаковой степени и распределяются в организме неравномерно. Например, промежутки между эпителиальными клетками слизистой оболочки кишечника невелики, что затрудняет всасывание гидрофильных ЛВ из кишечника в кровь.
Промежутки между эндотелиальными клетками сосудов периферических тканей (скелетных мышц, подкожной клетчатки, внутренних органов) имеют достаточно большие размеры (порядка 2 нм) и пропускают большинство гидрофильных ЛВ, что обеспечивает достаточно быстрое проникновение ЛВ из тканей в кровь и из крови в ткани. В то же время в эндотелии сосудов мозга межклеточные промежутки отсутствуют. Эндотелиальные клетки плотно прилегают к друг другу, образуя барьер (гематоэнцефалический барьер), препятствующий проникновению гидрофильных полярных веществ из крови в мозг (рис. 1.3).
Активный транспорт осуществляется с помощью специальных транспортных систем. Обычно это белковые молекулы, которые пронизывают мембрану клетки (см. рис. 1.1). Вещество связывается с белком-переносчиком с наружной стороны мембраны. Под влиянием энергии АТФ происходит изменение конформации белковой молекулы, что приводит к уменьшению силы связывания между переносчиком и транспортируемым веществом и высвобождению вещества с внутренней стороны мембраны. Таким образом в клетку могут проникать некоторые гидрофильные полярные вещества.
Активный транспорт веществ через мембрану обладает следующими характеристиками:
- специфичностью (транспортные белки избирательно связывают и переносят через мембрану только определенные вещества),
- насыщаемостью (при связывании всех белков-переносчиков количество вещества, переносимого через мембрану, не увеличивается),
- происходит против градиента концентрации,
- требует затраты энергии (поэтому угнетается метаболическими ядами).
Активный транспорт участвует в переносе через клеточные мембраны таких веществ, необходимых для жизнедеятельности клеток, как аминокислоты, сахара, пиримидиновые и пуриновые основания, железо, витамины. Некоторые гидрофильные лекарственные вещества проникают через клеточные мембраны с помощью активного транспорта. Эти Л В связываются с теми же транспортными системами, которые осуществляют перенос через мембраны вышеперечисленных соединений.
Облегченная диффузия — перенос веществ через мембраны с помощью транспортных систем, который осуществляется по градиенту концентрации и не требует затраты энергии. Так же, как активный транспорт, облегченная диффузия — это специфичный по отношению к определенным веществам и насыщаемый процесс. Этот транспорт облегчает поступление в клетку гидрофильных полярных веществ. Таким образом через мембрану клеток может транспортироваться глюкоза.
Кроме белков-переносчиков, которые осуществляют трансмембранный перенос веществ внутрь клетки, в мембранах многих клеток есть транспортные белки — Р-гликопротеины, способствующие удалению из клеток чужеродных соединений. Р-гликопротеиновый насос обнаружен в эпителиальных клетках кишечника, в эндотелиальных клетках сосудов мозга, образующих гематоэнцефалический барьер, в плаценте, печени, почках и других тканях. Эти транспортные белки препятствуют всасыванию некоторых веществ, их проникновению через гистогема-тические барьеры, влияют на выведение веществ из организма.
Пиноцитоз (от греч. pino — пью). Крупные молекулы или агрегаты молекул соприкасаются с наружной поверхностью мембраны и окружаются ею с образованием пузырька (вакуоли), который отделяется от мембраны и погружается внутрь клетки. Далее содержимое пузырька может высвобождаться внутри клетки или с другой стороны клетки наружу путем экзоцитоза.
РАСПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ В ОРГАНИЗМЕ
После поступления в системный кровоток ЛВ распределяются в различные органы и ткани. Характер распределения ЛВ во многом определяется их способностью растворяться в воде или липидах (т.е. их относительной гидрофильноетью или липофильностью), а также интенсивностью регионарного кровотока.
Гидрофильные полярные вещества распределяются в организме неравномерно. Большинство гидрофильных ЛВ не проникают в клетки и распределяются в основном в плазме крови и интерстициальной жидкости. В интерстициальную жидкость они попадают через межклеточные промежутки в эндотелии сосудов. В эндотелии капилляров мозга межклеточные промежутки отсутствуют – эндотелиальные клетки плотно прилегают друг к другу (между клетками имеются так называемые плотные контакты). Такой непрерывный слой эндотелиальных клеток образует гематоэнцефалический барьер (ГЭБ), препятствующий распределению гидрофильных полярных веществ (в том числе ионизированных молекул) в ткани мозга (см. рис. 1.3). Определенную барьерную функцию выполняют, по-видимому, и клетки глии. Через этот барьер немногие гидрофильные ЛВ (например, леводопа) проникают только с помощью активного транспорта.
Однако есть участки мозга, не защищенные гематоэнцефалическим барьером. Триггерная зона рвотного центра доступна для действия веществ, не проникающих через ГЭБ, таких как антагонист дофаминовых рецепторов домперидон. Это позволяет использовать домперидон в качестве противорвотного средства, не оказывающего влияния на другие структуры мозга. Кроме того, при воспалении мозговых оболочек гематоэнцефалический барьер становится более проницаемым для гидрофильных Л В (это позволяет вводить внутривенно натриевую соль бен-зилпенициллина для лечения бактериального менингита).
Кроме ГЭБ, в организме есть другие гистогематические барьеры (т.е. барьеры, отделяющие кровь от тканей), которые являются препятствием для распределения гидрофильных Л В. К ним относятся гематоофтальмический барьер, не пропускающий гидрофильные полярные Л В в ткани глаза, гематотестику-лярный и плацентарный барьеры. Плацентарный барьер во время беременности препятствует проникновению некоторых гидрофильных полярных ЛВ из организма матери в организм плода.
Относительно равномерно распределяются в организме липофильные неполярные вещества. Они проникают путем пассивной диффузии через мембраны клеток и распределяются как во внеклеточной, так и во внутриклеточной жидкостях организма. Липофильные ЛВ проходят через все гистогематические барьеры, в частности, диффундируют непосредственно через мембраны эндотелиаль-ных клеток капилляров в ткани мозга. Липофильные Л В легко проходят через плацентарный барьер. Многие лекарственные средства могут оказывать нежелательное действие на плод и поэтому прием препаратов беременными женщинами должен находиться под строгим врачебным контролем.
Влияние на распределение ЛВ оказывает также интенсивность кровоснабжения органов и тканей. Лекарственные вещества распределяются быстрее в хорошо перфузируемые органы, т.е. органы с интенсивным кровоснабжением, такие как сердце, печень, почки и достаточно медленно — в ткани с относительно плохим кровоснабжением – подкожную клетчатку, жировую и костную ткань.
ДЕПОНИРОВАНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ В ОРГАНИЗМЕ
г При распределении в организме некоторые Л В частично могут задерживаться и накапливаться в различных тканях. Происходит это в основном вследствие обратимого связывания ЛВ с белками, фосфолипидами и нуклеопротеинами клеток. Этот процесс носит название депонирование. Концентрация вещества в месте его депонирования (в депо) может быть достаточно высокой. Из депо вещество постепенно высвобождается в кровь и распределяется по другим органам и тканям, в том числе достигая места своего действия. Депонирование может привести к удлинению (пролонгированию) действия препарата или возникновению эффекта последействия. Так происходит при введении средства для внутривенного наркоза, — тиопентала-натрия, высоколипофильного соединения, которое накапливается в жировой ткани. Препарат вызывает непродолжительный наркоз (порядка 15 мин), после прекращения которого наступает посленаркозный сон (в течение 2-3 ч), связанный с высвобождением тиопентала из депо.
Депонирование ЛВ в некоторых тканях может привести к развитию побочных эффектов. Например, тетрациклины связываются с кальцием и накапливаются в костной ткани. При этом они могут нарушать развитие скелета у маленьких детей. По этой же причине эти препараты не должны назначаться беременным женщинам.
Многие Л В связываются с белками плазмы крови. Слабокислые соединения (нестероидные противовоспалительные средства, сульфаниламиды) связываются в основном с альбуминами (самой большой фракцией белков плазмы), а слабые основания – с α1-кислым гликопротеином и некоторыми другими белками плазмы крови. Связывание ЛВ с плазменными белками – обратимый процесс, который может быть представлен следующим образом:
ЛВ + белок комплекс ЛВ-белок.
Комплексы вещество — белок не проникают через мембраны клеток и через межклеточные промежутки в эндотелии сосудов (не фильтруются они и в капиллярах почечных клубочков) и поэтому являются своеобразным резервуаром или депо данного вещества в крови.
Связанное с белками ЛВ не проявляет фармакологической активности. Но поскольку это связывание обратимо, часть вещества постоянно высвобождается из комплекса с белком (происходит это при снижении концентрации свободного вещества в плазме крови) и оказывает фармакологическое действие.
Связывание Л В с белками плазмы крови не является специфичным. Разные ЛВ могут связываться с одними и теми же белками с достаточно высоким аффинитетом, при этом они конкурируют за места связывания на белковых молекулах и могут вытеснять друг друга. При этом большое значение имеет степень связывания веществ с белками при их терапевтических концентрациях в крови. Так, например, толбутамид (гипогликемическое средство, применяемое при сахарном диабете) приблизительно на 96% связывается с белками плазмы крови (при этом в свободном, а, следовательно, в активном состоянии в крови находится только около 5% вещества). При одновременном назначении сульфаниламидов, которые в терапевтических концентрациях связываются со значительной фракцией белков плазмы крови, происходит быстрое вытеснение толбутамида из мест связывания. Это приводит к повышению концентрации свободного толбутамида tfc крови. Результатом, как правило, является чрезмерное гипогликемическое действие препарата, а также более быстрое прекращение его эффекта, так как одновременно ускоряется биотрансформация и выведение из организма несвязанного с белками вещества. Особую опасность представляет одновременное назначение сульфаниламидов и антикоагулянта варфарина, который связывается с белками плазмы крови на 99%. Быстрое повышение концентрации свободного варфарина (препарата с малой широтой терапевтического действия) приводит к резкому снижению свертываемости крови и кровотечениям.
ВЫВЕДЕНИЕ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ИЗ ОРГАНИЗМА
Лекарственные вещества и их метаболиты выводятся (экскретируются) из организма в основном с мочой (почечная экскреция), а также с желчью в просвет кишечника.
Почечная экскреция. Выведение лекарственных веществ и их метаболитов почками происходит с участием трех основных процессов: клубочковой фильтрации, активной секреции в проксимальных канальцах и канальцевой реабсорбции.
Клубочковая фильтрация. Лекарственные вещества, растворенные в плазме крови (за исключением веществ, связанных с плазменными белками и высокомолекулярных соединений), фильтруются под гидростатическим давлением через межклеточные промежутки в эндотелии капилляров почечных клубочков и попадают в просвет канальцев. Если эти вещества не реабсорбируются в почечных канальцах, они выводятся с мочой.
Активная секреция. Путем активной секреции в просвет канальцев выделяется большая часть веществ, экскретируемых почками. Вещества секретируются в проксимальных канальцах с помощью специальных транспортных систем против градиента концентрации (этот процесс требует затраты энергии). Существуют отдельные транспортные системы для органических кислот (пенициллины, салицилаты, сульфаниламиды, тиазидные диуретики, фуросемид и др.) и органических оснований (морфин, хинин, дофамин, серотонин, амилорид и ряд других веществ). В процессе выделения органические кислоты (также как органические основания) могут конкурентно вытеснять друг друга из связи с транспортными белками, вследствие чего экскреция вытесняемого вещества снижается.
Реабсорбция (обратное всасывание). Через мембраны почечных канальцев лекарственные вещества реабсорбируются путем пассивной диффузии по градиенту концентрации. Таким образом, реабсорбируются липофильные неполярные соединения, так как они легко проникают через мембраны эпителиальных клеток почечных канальцев. Гидрофильные полярные вещества (в том числе ионизированные соединения) практически не реабсорбируются и выводятся из организма. Таким образом, выведение почками слабых кислот и слабых оснований прямо пропорционально степени их ионизации и, следовательно, в значительной степени зависит от рН мочи.
/Кислая реакция мочи способствует экскреции слабых оснований (например, алкалоидов никотина, атропина, хинина) и затрудняет выделение слабых кислот (барбитуратов, ацетилсалициловой кислоты). Чтобы ускорить выведение почками слабых оснований, следует изменить реакцию мочи в кислую сторону (снизить рН мочи). Обычно в таких случаях назначают хлорид аммония. И наоборот, если необходимо повысить экскрецию слабых кислот, назначают натрия гидрокарбонат и другие соединения, сдвигающие реакцию мочи в щелочную сторону (повышают рН мочи). Внутривенное введение натрия бикарбоната, в частности, используют для ускоренного выведения барбитуратов или ацетилсалициловой кислоты в случае их передозировки.
Реабсорбция некоторых эндогенных веществ (аминокислоты, глюкоза, мочевая кислота) осуществляется путем активного транспорта.
Выведение через желудочно-кишечный тракт. Многие лекарственные вещества (дигоксин, тетрациклины, пенициллины, рифампицин и др.) выделяются с желчью в просвет кишечника (в неизмененном виде или в виде метаболитов и конъюгатов) и частично выводятся из организма с экскрементами. Однако часть веществ может повторно всасываться и при прохождении через печень снова
выделяться с желчью в просвет кишечника и т.д. Этот циклический процесс называется энтерогепатической (кишечно-печеночной) циркуляцией. Некоторые вещества (морфин, хлорамфеникол) выделяются с желчью в виде конъюгатов с глю-куроновой кислотой (глюкуронидов), гидролизующихся в кишечнике с образованием активных веществ, которые снова подвергаются реабсорбции. Таким образом энтерогепатическая циркуляция способствует пролонгированию действия лекарственных веществ. Некоторые лекарственные вещества плохо всасываются из желудочно-кишечного тракта и полностью выводятся из организма через кишечник. Такие вещества в основном применяют для лечения или профилактики кишечных инфекций и дисбактериоза (неомицин, нистатин).
Газообразные и летучие вещества выделяются легкими. Таким образом выводятся средства для ингаляционного наркоза. Некоторые вещества могут выделяться потовыми, слюнными железами (пенициллины, йодиды), железами желудка (хинин) и кишечника (слабые органические кислоты), слезными железами (ри-фампицин), молочными железами в период лактации (снотворные средства, спирт этиловый, никотин и др.). Во время кормления лекарственные вещества, которые выделяются молочными железами, могут вместе с молоком попасть в организм ребенка. Поэтому кормящим матерям противопоказано назначение лекарственных препаратов (цитостатиков, наркотических анальгетиков, хлорамфеникол а, изониазида, диазепама, антитиреоидных средств и др.), которые могут вызвать серьезные нарушения развития и неблагоприятно воздействовать на ребенка.
Для характеристики совокупности процессов, в результате которых активное лекарственное вещество удаляется из организма, вводится понятие элиминация, которое объединяет два процесса: биотрансформацию и выведение. Количественно процесс элиминации характеризуется рядом фармакокинетических параметров (см. раздел «Математическое моделирование фармакокинетических процессов»).
Источник





