- Лекарственные средства
- Счетчик обращений граждан и организаций
- Лекарственные средства
- Контроль за проведением доклинических и клинических исследований лекарственных средств и лекарственных препаратов
- Проведение доклинических исследований лекарственных препаратов
- Проведение доклинических исследований лекарственных препаратов
- Фазы клинических исследований
- Разработка лекарственных средств
- Первый этап
- Второй этап: доклинические исследования
- Третий этап
- I ФАЗА клинического исследования
- II ФАЗА Клинического Исследования
- III ФАЗА Клинического Исследования
- IV ФАЗА Клинического Исследования
- ЧТО ТАКОЕ КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ?
- Клинические исследования как необходимость научной точности
- Четыре фазы клинических испытаний
- Фармацевтические компании, исследователи, врачи и пациенты — все вовлечены!
- Обеспечение прозрачности результатов в строгих правовых рамках
- ВПЕРЕДИ НОВЫЕ ЗАДАЧИ
- Читайте также
Лекарственные средства
Счетчик обращений граждан и организаций
Лекарственные средства
Контроль за проведением доклинических и клинических исследований лекарственных средств и лекарственных препаратов
В соответствии с п. 5.1.4.1 постановления Правительства Российской Федерации от 30.06.2004 № 323 «Об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения» Росздравнадзор осуществляет федеральный государственный надзор в сфере обращения лекарственных средств посредством организации и проведения проверок соблюдения субъектами обращения лекарственных средств требований к доклиническим исследованиям лекарственных средств, клиническим исследованиям лекарственных препаратов, установленных Федеральным законом от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» и принятыми в соответствии с ним иными нормативными правовыми актами Российской Федерации.
В соответствии с п. 40 ст. 4 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» под доклиническим исследованием лекарственного средства подразумевается биологические, микробиологические, иммунологические, токсикологические, фармакологические, физические, химические и другие исследования лекарственного средства путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного средства.
В соответствии с п. 41 ст. 4 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» клиническим исследованием лекарственного препарата является изучение диагностических, лечебных, профилактических, фармакологических свойств лекарственного препарата в процессе его применения у человека, животного, в том числе процессов всасывания, распределения, изменения и выведения, путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного препарата, данных о нежелательных реакциях организма человека, животного на применение лекарственного препарата и об эффекте его взаимодействия с другими лекарственными препаратами и (или) пищевыми продуктами, кормами.
Источник
Проведение доклинических исследований лекарственных препаратов
Главная → Услуги → Проведение доклинических исследований лекарственных препаратов
Проведение доклинических исследований лекарственных препаратов
В последние годы для лечения многих заболеваний стали широко применяться препараты растительного происхождения. В отличие от синтетических, фитопрепараты обладают, как правило, малой токсичностью и лучшей переносимостью, проявляя при этом заметную фармакологическую активность, что позволяет гораздо шире использовать фитопрепараты для симптоматического, профилактического и восстановительного лечения.
Основные направления изучения биологической активности образцов растительного происхождения включают: проведение первичного фармакологического и микробиологического скрининга, проведение в полном объеме доклинических исследований фитопрепаратов, включая их доклиническое фармакологическое изучение, осуществление комплекса мероприятий, связанных с подготовкой необходимой документации по доклиническому и клиническому изучению фитопрепаратов, организацией проведения клинических испытаний и получение рекомендаций на применение в медицинской практике. 
В России доклинические исследования по безопасности обязательны для всех новых лекарственных средств растительного происхождения, независимо от источника и способа получения, а также для препаратов с измененным количественным и качественным составом, в том числе за счет вспомогательных веществ, и для новых лекарственных форм. Объем таких исследований включает изучение общетоксического действия (острая и хронической токсичность), а также специфических видов токсичности — аллергенность, иммунотоксичность, мутагенность и репродуктивная токсичность. 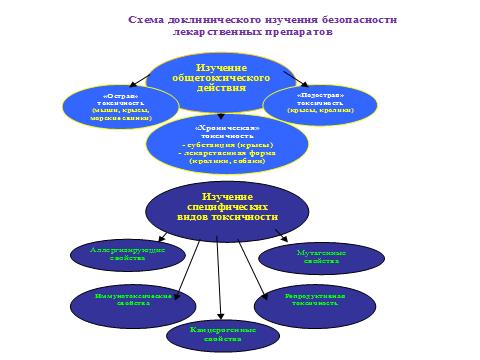
Доклинические исследования лекарственных препаратов выполняются согласно Правилам лабораторной практики в Российской Федерации (Приказ Министерства здравоохранения и социального развития Российской Федерации № 708н от 23.08.2010, Национальному стандарту Российской Федерации ГОСТ 33044-2014 «Принципы надлежащей лабораторной практики»), «Руководству по проведению доклинических исследований лекарственных средств» (2012 г.) и в соответствии с Федеральным законом от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств».
Эксперименты на животных осуществляются в соответствии с «Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей» (Страсбург, 1996).
Проведение доклинических исследований лекарственных препаратов, разрабатываемых в институте проводятся в Центре медицины. Центр медицины состоит из двух отделов: отдела экспериментальной и клинической фармакологии и отдела токсикологии.
Основной задачей отдела экспериментальной и клинической фармакологии является проведение фармакологических исследований: скрининговых — направленных на поиск новых лекарственных растений и выделяемых из них фракций и веществ, с целью определения потенциальных источников для разработки новых эффективных фитопрепаратов; углубленных для определения механизма их действия на патологические состояния в модельных экспериментах на животных.
Сотрудники отдела экспериментальной и клинической фармакологии: зав отделом к.мед.н. Ферубко Е.В., с.н.с. Лескова Т.Е., Калачева З.С., Игнатова З.В., с.н.с. Леонидова Ю.А., Антонова Е.Д., в.н. с. к.б.н. Трумпе Т.Е., с.н.с. Карабаева В.В.
Рук. Центра медицины к. мед. н. Ферубко Е.В., в.н.с. к.б.н. Трумпе Т.Е. Подготовка необходимой документации по доклиническому и клиническому изучению фитопрепаратов.
Курманов Р.К. н.с. отдела экспериментальной и клинической фармакологии. Изучение фармакологической активности лекарственных фитопрепаратов с использованием биомоделей.
Д.м.н., г.н.с. отдела экспериментальной и клинической фармакологии Колхир В.К.
Лупанова И.А. н.с. к.б.н. Первичный биохимический скрининг БАВ с применением специфических ферментных биотест-систем.
В отделе разрабатываются новые биотест-системы и биомодели, позволяющие проводить верифицированные исследования.
Проведение экспериментов по изучению специфической активности. Н.с. Курманова Е.Н.
Лаборатория микробиологических исследований организована в Институте в 1959 году Заслуженным Деятелем науки, доктором биологических наук, профессором Серафимой Александровной Вичкановой для разработки и создания эффективных химиотерапевтических средств для лечения вирусных, бактериальных, грибковых и других инфекций.
В настоящее время лабораторий руководит Фатеева Татьяна Владимировна.
Заведующая лабораторией микробиологических исследований Фатеева Татьяна Владимировна
Лаборант-микробиолог Липкина Н.В. Просмотр культур микроорганизмов под микроскопом
Изучение обсемененности фитопрепаратов в стерильном боксе.
Сотрудники отдела токсикологии: ст.н.с. Боровкова М.В., зав. отделом к.б.н. Крепкова Л.В., в.н.с. к.б.н. Савинова Т.Б., в.н.с. к.б.н. Бортникова В.В., с.н.с. Гнутов В.Б., с.н.с. Кузина О.С., лаборант Кривошеина Н.Н.
Боровкова М.В. с.н.с. Проведение гематологических исследований.
С.н.с. Кузина О.С. Проведение биохимических исследований.
Савинова Т.Б. в.н.с., к.б.н. Изучение репродуктивной токсичности.
Сотрудники вивария: зав. виварием Букатова Н.В., Наумычева И.В., Силкина Е.С.
Источник
Фазы клинических исследований
Для полного понимания о процессе клинического исследования нового лекарственного препарата разберем этапы создания нового препарата.
Разработка лекарственных средств
Первый этап
- Дизайн новой молекулы, синтез и скрининг новых веществ.
Второй этап: доклинические исследования
- In vitro — в пробирке / in vivo — на животных.
- Изучение кинетики всасывания, распределения, метаболизма и выведения
фармакологических веществ в организме. - Оценка токсичности и безопасности.
- Мутации/канцерогенез (мутации — изменения генотипа; канцерогенез — сложный
патофизиологический процесс зарождения и развития опухоли). - Влияние на репродуктивную функцию / наследственная патология.
- In silico — компьютерное моделирование эксперимента.
Третий этап
I ФАЗА клинического исследования
В ней могут участвовать как здоровые добровольцы, так и пациенты с определенным
заболеванием.
- изучение безопасности;
- изучение фармакокинетики/фармакодинамики;
- изучение метаболизма препарата;
- оценка токсичности/переносимости.
- одноцентровые/многоцентровые;
- открытые (часто);
- без групп сравнения (часто).
Во время I фазы изучается насколько хорошо переносится исследуемый препарат. Вся
информация обрабатывается, а после того, как в ходе исследований фазы I врачи изучили
фармакодинамику, фармакокинетику и предварительную безопасность исследуемого
лекарственного препарата, запускается следующая фаза КИ — фаза II.
II ФАЗА Клинического Исследования
В ней участвуют пациенты, страдающие патологией, для лечения которой предназначен
исследуемый препарат. Основная цель клинических исследований второй фазы — найти
оптимальный уровень дозировки и подобрать схему приёма препарата для следующей, третьей фазы. Дозы препарата, которые получают пациенты на данном этапе, зачастую ниже, чем самые высокие дозы, которые принимали участники фазы I.
- исследование на пациентах;
- определение отношения доза/эффект;
- определение дозировки/дозировок;
- помочь определиться с дальнейшим дизайном исследований;
- оценка безопасности;
- оценка эффективности;
- принятие решения о целесообразности дальнейших исследований.
- сравнительные (разные дозы препарата);
- заслепленные/рандомизированные.
III ФАЗА Клинического Исследования
В ней участвуют пациенты, страдающие патологией, для лечения которой предназначен
исследуемый препарат и основная цель получить результат эффективности и безопасности
препарата.
- подтвердить эффективность и безопасность;
- доказать безопасность на большой популяции;
- получение полной информации, необходимой для терапевтического применения
исследуемого препарата; - основание для регистрации исследуемого препарата.
- интернациональные/мультицентровые;
- заслепленные;
- сравнительные (группы контроля: плацебо/стандарт лечения).
После того, как в ходе исследований фазы III фармацевтическая компания подтвердила
эффективность и безопасность нового препарата, формируется регистрационное досье
препарата, где описываются методология и результаты доклинических исследований и трех
фаз клинических исследований лекарственного препарата, особенности производства, состав лекарственного препарата и его срок годности. Регистрационное досье оформляют и направляют в уполномоченный орган здравоохранения, осуществляющий регистрацию новых препаратов. После получения регистрационного удостоверения лекарственный препарат выводится на рынок лекарственных средств и поступает в аптеки.
IV ФАЗА Клинического Исследования
В ней участвуют пациенты, страдающие патологией, для лечения которой предназначен
исследуемый препарат. Наступает после того, как лекарственный препарат зарегистрирован и уже появился в аптеках.
- установить взаимосвязь польза-риск;
- получение новых данных по безопасности;
- коррекция дозы;
- возможность применения у новых групп пациентов;
- изучение опроса на рынке сбыта.
- интернациональные/мультицентровые;
- открытые;
- сравнительные/несравнительные.
Источник
ЧТО ТАКОЕ КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ?
Клинические исследования проводятся с участием людей и относятся к серии научных исследований, которые необходимо выполнить для разработки новых лекарств.
Они подлежат строгому регулированию и являются важнейшим этапом в процессе регистрации лекарственного средства и определении методов его оптимального применения для обеспечения терапевтического эффекта у пациентов.
Клинические исследования могут длиться несколько лет и должны быть организованы в строгом соответствии с протоколом исследования, который гарантирует безопасность участников.
Клинические исследования как необходимость научной точности
Под клиническими исследованиями понимаются все научные исследования с участием людей, которые проводятся с целью оценки эффективности и безопасности нового лекарственного препарата / изделия медицинского назначения или расширения показаний к применению существующего на рынке лекарственного препарата / изделия медицинского назначения. 1 Клинические исследования проводятся квалифицированными специалистами в области медицины на базе стационаров или амбулаторно.
Клинические исследования используются для оценки безопасности и эффективности новых методов лечения, и являются обязательным условием для вывода лекарственного препарата на рынок. Они требуют применения строгого научного подхода, чтобы гарантировать как терапевтический эффект, так и безопасность участников. Помимо терапевтического интереса, клинические исследования также вносят вклад в развитие медицины и биологии. 2
Четыре фазы клинических испытаний
До начала клинических исследований с участием человека в обязательном порядке проводятся доклинические исследования, которые включают в себя тестирование изучаемой молекулы на животных.
Разработка нового лекарственного препарата обычно состоит из четырех последовательных фаз клинических исследований, целью которых является изучение действия препарата в организме человека и оценка его эффективности.
Фаза I: соответствует первому применению исследуемого препарата у человека и может длиться несколько месяцев.Молекула обычно тестируется в группе от 20 до 100 человек (здоровых добровольцев) для оценки переносимости и фармакокинетики (изучение того, что происходит с лекарством в организме). На этом этапе также определяется самая высокая и безопасная доза для применения у пациентов.
Фаза II: оценка эффективности препарата в группе от нескольких десятков до нескольких сотен пациентов. На этом этапе проверяется, активна ли молекула в лечении целевого заболевания, определяется оптимальная доза и регистрируются побочные эффекты.
Фаза III: часто упоминается как «ключевое исследование». Молекула тестируется на большей группе пациентов, состав которой может достигать нескольких тысяч человек. На этом этапе можно определить соотношение польза / риск и выработать меры предосторожности при дальнейшем использовании молекулы. По завершении этого этапа в органы здравоохранения может быть подана заявка на получение регистрационного удостоверения (РУ).
Фаза IV: проводится после получения регистрационного удостоверения. На этом этапе изучается переносимость и эффективность лекарства в долгосрочной перспективе. Постмаркетинговый мониторинг важен, потому что даже после многочисленных исследований определенные эффекты препарата могут быть не полностью изучены. 4
На данный момент только одна молекула из десяти проходит все вышеописанные стадии 3 . Однако процесс клинической разработки лекарств для лечения онкологических или редких заболеваний может быть ускорен путем уменьшения количества участвующих в исследованиях пациентов и объединения определенных фаз.
Фармацевтические компании, исследователи, врачи и пациенты — все вовлечены!
Клинические исследования обычно занимают несколько лет, а иногда могут длиться до десяти лет, и требуют ежедневных усилий всех вовлеченных в них сторон, направленных на поиск новых, жизненно важных для пациентов методов лечения.
Клинические исследования чаще всего инициируются и финансируются фармацевтическими компаниями. Все клинические исследования проводятся квалифицированными специалистами в соответствующей области медицины, которых называют исследователями. Они несут ответственность за надлежащее проведение исследования, за включение пациентов в исследование и за их безопасность. Что касается участников, то они всегда привлекаются на добровольной основе.
Обеспечение прозрачности результатов в строгих правовых рамках
Чтобы начать клиническое исследование, требуются различные разрешения от компетентных органов каждой страны. Сроки получения разрешений варьируются в различных странах: от 30 до более чем 200 дней. В Российской Федерации этот срок составляет около 90-100 дней.
Каждый участник должен получить всю информацию об исследовании в письменной форме (включая все преимущества и риски, связанные с исследованием) и должен дать свое согласие, подписав форму информированного согласия, прежде чем он/она сможет начать участие в исследовании. Этические аспекты медицинских исследований во всем мире регулируются Нюрнбергским кодексом и Хельсинкской декларацией 1964 года, а также их последующими редакциями.
Публикация результатов клинических исследований представляет большой интерес для медицинского и научного сообществ, поскольку помогает обеспечить прозрачность результатов, независимо от их характера. Хельсинская декларация гласит: «Каждое исследование с участием людей в качестве субъектов исследования должно быть зарегистрировано в публично доступной базе данных прежде, чем в него будет включен первый субъект».
ВПЕРЕДИ НОВЫЕ ЗАДАЧИ
- Ускорение исследований и получения регистрационного удостоверения.Столкнувшись с пандемией COVID-19, многие фармацевтические компании ведут настоящую «гонку вакцин» и стремятся ускорить исследования, чтобы в срочном порядке предоставить эффективную вакцину, доступную для всех.
- Повышенная потребность в прозрачности:в контексте, когда широкая общественность выражает недоверие к фармацевтической промышленности, заинтересованные стороны мобилизуются для большей прозрачности. Поскольку в Европе публикуется только половина результатов исследований 5 , было принято несколько нормативных актов, способствующих публикации результатов клинических испытаний.
- Цифровизация клинических испытаний. Ускорение перехода к цифровому формату – важная задача для всех заинтересованных сторон в сфере здравоохранения. Использование цифровых технологий в клинических исследованиях может быть целесообразным, поскольку это облегчит участие пациентов, живущих далеко от исследовательских центров, повысит их приверженность лечению (например, посредством уведомлений) и обеспечит доступ к данным в режиме реального времени.
- Пациент в центре исследований: . Они могут лучше всех рассказать о своем заболевании / состоянии, его течении и эффективности лечения, которое они получают. Вовлечение пациентов на как можно более раннем этапе позволяет ускорить клинические исследования и разработать методы лечения, которые наилучшим образом соответствует их потребностям.
А как в Сервье?
Клинические исследования Группы проводятся командами экспертов с применением высоких и строгих стандартов. Надлежащее проведение исследований требует слаженной работы команд, ответственных за международную координацию, и локальных команд в 18 странах, что позволяет организовывать клинические исследования во всем мире. Таким образом, глобализация процесса разработки лекарственных препаратов в Сервье играет фундаментальную роль в формировании научного имиджа компании и позволяет разрабатывать инновационные лекарства, соответствующие различным потребностям пациентов.
Чтобы создавать лекарственные препараты, которые наилучшим образом отвечали бы потребностям пациентов, Сервье стремится привлекать их к разработке лекарственных препаратов напрямую или через ассоциации пациентов: сюда включают обсуждение протоколов клинических исследований, разработку форм информированного согласия и брошюр для повышения осведомленности пациентов, получение отзывов пациентов после исследования и предоставление им адаптированных резюме исследования.
Цифровые технологии и данные повышают гибкость, эффективность и продуктивность, ускоряя процесс разработки лекарственных средств, итеративный алгоритм идентификации молекул и проведение клинических исследований, а также помогают лучше понимать пациентов. Для внедрения цифровых технологий в клинические исследования используется программа SCORE: она обеспечивает удаленную связь между пациентами и медицинскими и научными специалистами, позволяя им получать доступ к данным исследований в режиме реального времени, тем самым упрощая принятие решений. Платформа FEDERATES, которая в настоящее время находится в стадии разработки, повысит качество передачи информации и данных в режиме реального времени и ускорит проведение исследования на разных этапах.
5 Goldacre Ben, DeVito Nicholas J, Heneghan Carl, Irving Francis, Bacon Seb, Fleminger Jessica et al. Compliance with requirement to report results on the EU Clinical Trials Register: cohort study and web resource BMJ 2018; 362 :k3218
Читайте также
САХАРНЫЙ ДИАБЕТ 2 ТИПА — БОЛЕЗНЬ ОБРАЗА ЖИЗНИ
Источник


















