- Мониторинг движения лекарственных препаратов (маркировка лекарств)
- Человеческий ресурс
- Места хранения
- Финансовый ресурс
- Время
- Прямой порядок
- Обратный порядок
- Как изменится работа медорганизаций с введением обязательной маркировки ЛП
- Общая характеристика системы МДЛП
- Роль Регистратора выбытия
- Противоречия в требованиях
- Перемещение препаратов внутри клиники
- Для справки
- Текущие недоработки системы
- Наказание за нарушения
- Что делать медицинским организациям
Мониторинг движения лекарственных препаратов (маркировка лекарств)
Правительством Российской Федерации в числе основных направлений определена работа по модернизации процесса движения лекарственных препаратов в соответствии с лучшими международными практиками, в том числе по унификации и упрощению процедур вывода лекарств на рынок без ущерба качеству, проведению мониторинга ассортиментной политики и цен на лекарственные препараты, совершенствованию методики регистрации предельных отпускных цен производителей на жизненно необходимые лекарственные препараты, мониторингу движения лекарственных препаратов для медицинского применения от производителя до конечного потребителя с использованием средств идентификации.
25 октября 2016 г. президиумом Совета при Президенте Российской Федерации по стратегическому развитию и приоритетным проектам утвержден паспорт приоритетного проекта «Внедрение автоматизированной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя для защиты населения от фальсифицированных лекарственных препаратов и оперативного выведения из оборота контрафактных и недоброкачественных препаратов». Краткое наименование — «Лекарства. Качество и безопасность».
Ключевые участники приоритетного проекта:
- Минздрав России;
- Росздравнадзор;
- ФНС России;
- Минпромторг России;
- Минфин России;
- Минкомсвязи России.
Субъекты обращения лекарственных препаратов:
- российские производители;
- российские и иностранные держатели регистрационных удостоверений и их представительства;
- организации оптовой и розничной торговли лекарствами;
- медицинские организации.
Цель приоритетного проекта:
- Защита населения от фальсифицированных, недоброкачественных и контрафактных лекарственных препаратов и предоставление неограниченному кругу потребителей (граждан) возможности проверки легальности зарегистрированных лекарственных препаратов, находящихся в гражданском обороте. Обеспечение прозрачности и развития справедливой конкуренции на фармацевтическом рынке.
Основными ресурсами, освещающими реализацию проекта МДЛП, являются официальные сайты Минздрава России, Росздравнадзора, Национальной системы цифровой маркировки «Честный знак». Информации в соответствующих разделах много, но в сегменте вопросов, касающихся медицинских организаций, она крайне дозированная и отвечает далеко не на все вопросы. При этом важно разобраться, что находится в силах и компетенции самой медицинской организации, и к чему придется тщательно готовиться, особенно к тем аспектам процесса лекарственного обеспечения, на которые система МДЛП влияет опосредованно, без регуляторного или технического воздействия.
Система мониторинга движения лекарственных препаратов будет внедряться с 01.07.2020 одномоментно по всей стране, вовлекая огромное число субъектов обращения лекарственных препаратов. По официальным оценкам в системе будут зарегистрированы около тысячи производителей и держателей регистрационных удостоверений на лекарственные препараты, порядка 2,5 тысяч оптовых фармацевтических организаций и 350 тысяч медицинских и аптечных организаций, не говоря о том, что эта система коснется всех без исключения конечных потребителей — пациентов, а это, без преувеличения, всё население Российской Федерации.
Эксперимент по внедрению системы маркировки лекарств в соответствии с Постановлением Правительства РФ от 24.01.2017 № 62 «О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения» (вместе с «Положением о проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения») стартовал в начале 2017 года и закончится непосредственно перед переходом к промышленной эксплуатации в конце 2019 года. Промежуточные результаты и опыт добровольных участников эксперимента уже сегодня объективно показывают, что задачи, стоящие перед субъектами оборота лекарственных препаратов, далеко не простые и требуют серьезной подготовки, как организационной, так и финансовой.
При подготовке к внедрению системы МДЛП руководству медицинской организации необходимо самым тщательным образом подойти к оценке готовности и достаточности всех видов её ресурсов.
Человеческий ресурс
Трудоёмкость приемки товара при внедрении системы маркировки неизбежно возрастает, особенно, если мест приемки и выбытия лекарств из гражданского оборота в организации несколько. Частично решить этот вопрос можно при применении автоматизированных средств оптимизации считывания кодов с упаковок, но на рынке пока нет доступных решений, которые бы подходили для данных целей.
Места хранения
С 29.11.2019 ст. 67 Федерального закона от 12.04.2010 № «Об обращении лекарственных средств» дополняется ч. 7.1 в следующей редакции «Лекарственные препараты для медицинского применения, введенные в гражданский оборот до 1 января 2020 года, подлежат хранению, перевозке, отпуску, реализации, передаче, применению без нанесения средств идентификации до истечения срока их годности.». Это значит, что с 1 января 2020 года поток медикаментов разделится на маркированный подтвержденный, маркированный неподтвержденный и немаркированный, что потребует увеличения площадей и мест хранения препаратов, так как совместное хранение этих групп товаров может привести к нарушению требований системы мониторинга движения.
С учетом вышеописанных возможных проблем с увеличением длительности проведения закупочных процедур необходимо пересмотреть в сторону увеличения нормативы складских запасов лекарств, которые смогут обеспечить непрерывность лечебно-диагностического процесса в случае непредвиденных обстоятельств.
Финансовый ресурс
Вышеуказанный прирост численности работников требует увеличения фонда оплаты труда. Потребуются затраты на организацию новых рабочих мест, оснащенным специальным оборудованием, оптимизацию систем хранения, увеличение объемов складских запасов, а также на закупку или развитие информационных систем. Это существенные затраты для любой организации, их надо планировать и своевременно изыскивать.
Время
Временные затраты на администрирование всех этапов движения лекарственных препаратов также вырастут, этот фактор крайне важно заложить в систему управления производственными процессами.
Одним из важнейших аспектов внедрения системы МДЛП для медицинского учреждения является необходимость перенастройки порядка взаимодействия с поставщиками лекарственных препаратов. В соответствии с п. 44 Положения о системе мониторинга движения лекарственных препаратов для медицинского применения, утвержденного Постановлением Правительства Российской Федерации от 14.12.2018 № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения» (далее — Положение) при передаче лекарственных препаратов между субъектами обращения внесение информации в ФГИС МДЛП может происходить двумя способами:
При этом решение о выборе типа порядка предоставления сведений принимается субъектами обращения лекарственных препаратов, предоставляющими данные сведения, самостоятельно. Это решение необходимо закрепить в контракте на поставку лекарственных препаратов.
Прямой порядок
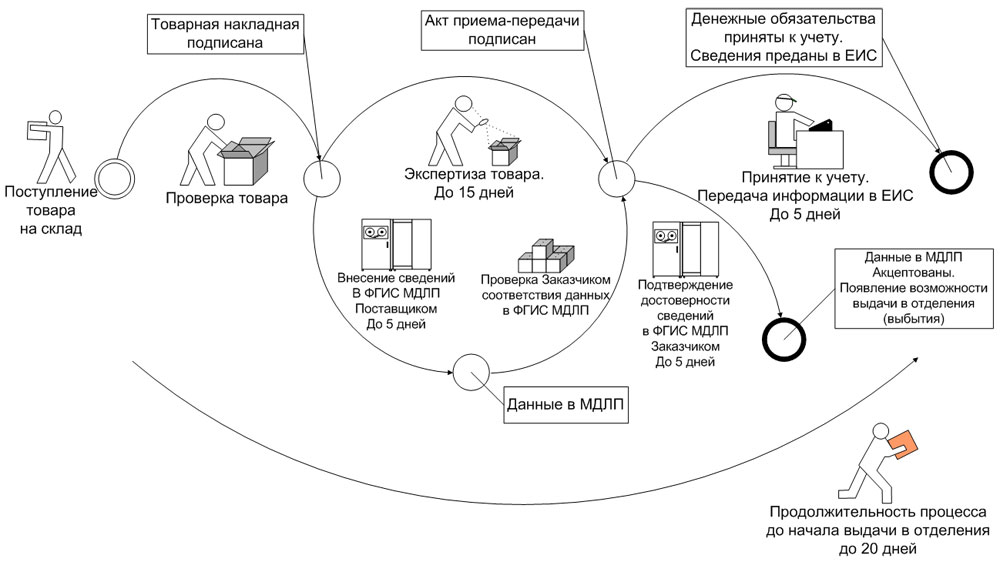
В случае выбора прямого порядка предоставления сведений субъект обращения, осуществляющий передачу лекарственных препаратов другому субъекту обращения в рамках гражданско-правовых отношений (поставщик), предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты отгрузки лекарственных препаратов предоставляет об этом в ФГИС МДЛП сведения, предусмотренные пунктом 2 приложения № 6 к Положению.
При этом субъект обращения, осуществляющий приемку лекарственных препаратов от другого субъекта обращения ЛП в рамках гражданско-правовых отношений (заказчик, медицинская организация), предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты приемки лекарственных препаратов и регистрации в ФГИС МДЛП сведений об отгруженных медикаментах, но до предоставления сведений о дальнейших операциях с данными препаратами, подтверждает достоверность сведений, содержащихся в ФГИС МДЛП о принимаемых лекарственных препаратах, предоставляя об этом сведения в ФГИС МДЛП, предусмотренных пунктом 4 приложения № 6 к Положению (рис. 1).
Рис. 1. Прямой способ внесения информации в ФГИС МДЛП
Обратный порядок
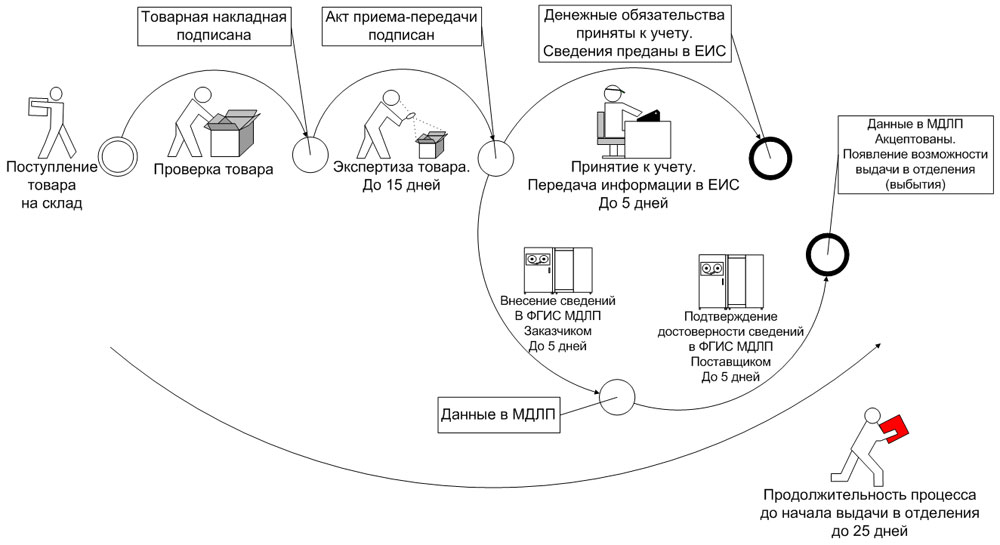
В случае выбора обратного порядка предоставления сведений субъект обращения, осуществляющий приемку медикамента от другого субъекта обращения в рамках гражданско-правовых отношений, предусматривающих переход права собственности на ЛП, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты приемки ЛП предоставляет в ФГИС МДЛП сведения о принятых ЛП, предусмотренные пунктом 3 приложения № 6 к Положению.
При этом субъект обращения, осуществивший передачу лекарства другому субъекту обращения в рамках гражданско-правовых отношений, предусматривающих переход права собственности на данные лекарственные препараты, или в рамках посреднических отношений (агентский или комиссионный договор), в течение 5 рабочих дней* с даты регистрации в ФГИС МДЛП сведений о принятом товаре, но до предоставления сведений о дальнейших операциях с данными препаратами, подтверждает достоверность сведений, содержащихся в ФГИС МДЛП о переданных лекарственных препаратов, предоставляя об этом сведения в ФГИС МДЛП, предусмотренные пунктом 4 приложения № 6 к Положению (рис. 2).
Рис. 2. Обратный способ внесения информации в ФГИС МДЛП
В ходе подготовки к работе в новых условиях системы МДЛП важно учесть особенности медицинской организации в части её системы финансирования, организационной структуры, наличию удаленных (обособленных) подразделений, организации закупок лекарственных препаратов, в том числе участие в централизованных поставках и иные аспекты деятельности, обусловливающие многочисленные внутренние и внешние взаимосвязи, необходимые для бесперебойной работы системы лекарственного снабжения, и проводить внедрение новой системы в контексте данных качественного анализа деятельности организации.
* На заседании рабочей группы Росздравнадзора было принято решение о внесении изменений в Положение, предусматривающих сокращение сроков регистрации операций в ИС МДЛП по передаче лекарственных препаратов всеми участниками до 1 рабочего дня, в целях соблюдения приоритета интересов пациента и предоставления медицинской организации возможности выполнения требований законодательства в сфере охраны здоровья, обращения лекарственных препаратов и закупок (контрактной системы) без нарушений.
Источник
Как изменится работа медорганизаций с введением обязательной маркировки ЛП
В России продолжается эксперимент по внедрению системы маркировки лекарственных препаратов. Она станет обязательной с 1 января 2020 г., тогда все организации, имеющие лицензии на фармацевтическую и медицинскую деятельность, будут передавать данные в Федеральную государственную информационную систему «Мониторинг движения лекарственных препаратов» (МДЛП или ИС «Маркировка»). Для этого клиникам необходимо внедрить специальный электронный документооборот. Сделать это можно с помощью доработки существующей системы складского учета или установки дополнительного решения.
Общая характеристика системы МДЛП
Медучреждениям придется передавать информацию о получении ЛП от поставщика, их перемещении между отделениями, отпуске препаратов для медицинского применения, уничтожении и временном выводе из оборота. И если во время приемки препаратов информация о маркировке на упаковке и в системе мониторинга не совпадет, лекарства нужно будет возвращать поставщику. Закупать и применять ЛП, данные о которых не внесены в систему, запретят.
Перемещение препаратов должно отражаться в системе в течение 5 рабочих дней. Вероятно, после запуска системы в промышленную эксплуатацию срок будет сокращен до 1 рабочего дня.
ИС «Маркировка» – это электронный документооборот: принимаются только готовые документы, заверенные усиленной цифровой подписью. В ответ на загруженные данные приходит квитанция с положительным или отрицательным результатом. Поэтому к системе нельзя подключить сканнер штрих-кодов или формировать в ней документы о поступлении лекарств (они должны быть подготовлены во внешней системе). Требования к форме и содержанию описаны на официальном сайте оператора МДЛП в разделе «Маркировка лекарств» – «Документы» – «Разработчикам».
Способы организации обмена данными:
2) автоматически – по API.
Ручной вариант предполагает выгрузку документов с помощью личного кабинета на сайте и получение квитанций с результатом в ответ. При этом сами документы нужно готовить вне системы мониторинга. Интеграция по API позволяет организовать автоматический обмен.
Для регистрации на сайте потребуется усиленная цифровая подпись и данные из лицензии на медицинскую или фармацевтическую деятельность. Регистрация двухэтапная. Вначале нужно подтвердить, что организация – резидент РФ и авторизоваться с помощью электронной подписи. Затем откроется окно с заявлением.
ФИО руководителя и ИНН организации в цифровой подписи и в ЕГРЮЛ должны быть одинаковыми. Иначе для регистрации придется перевыпускать электронную подпись или вносить изменения в ЕГРЮЛ.
Срок рассмотрения заявления – 10 рабочих дней. Ответ придет на электронную почту. Статус заявления можно самостоятельно проверить на сайте системы. После подтверждения регистрации необходимо добавить пользователей и места оказания деятельности. Подробно процесс регистрации описан в Руководстве пользователя Личного кабинета.
Процесс выгрузки данных при получении лекарств от поставщика
Первая выгрузка данных в систему мониторинга должна произойти при получении лекарств от поставщика. Работа с ИС «Маркировка» предполагает заключение соглашения в свободной форме между поставщиком и клиникой об информационном обмене через систему. После заключения соглашения стороны добавляют друг друга в список доверенных контрагентов в личном кабинете системы. Заводить данные поставщика не нужно, он выбирается из готового реестра и появится в списке доверенных контрагентов после того, как подтвердит готовность к взаимодействию. Клиника может получить запрос на добавление и от поставщика.
Прямое и обратное акцептирование при приемке лекарств от поставщика
В информационном соглашении обязательно отражается, каким будет акцептирование: прямым или обратным. Загрузка документов с информацией о лекарствах и их передаче силами поставщика является прямым акцептированием. В этом случае клинике остается только подтвердить получение и согласиться с данными поставщика, либо инициировать процедуру возврата. Отсутствие входящего документа является обратным акцептированием. Это означает, что необходимо вносить информацию самостоятельно:
- заполнить реквизиты документа, включая данные о сроках годности, серии, контрольных идентификационных знаках и т.п.;
- отсканировать вторичную и транспортную упаковки.
После отправки документа, подготовленного самостоятельно, нужно получить подтверждение отгрузки от поставщика.
Согласно закону оба варианта равноправны. С точки зрения организации бизнес-процессов разработчики системы предпочтительным считают вариант прямого акцептирования. Скорее всего, именно он получит распространение.
При выгрузке данных в систему важно отслеживать результат регистрации документа в получаемой квитанции. Если он положительный, лекарства можно использовать. В противном случае нужно будет инициировать процесс возврата. Принять от поставщика можно и часть предложенной партии ЛП. Для этого нужно будет самостоятельно создать документ и получить подтверждение от контрагента.
Роль Регистратора выбытия
Второй раз клинике придется выгружать информацию во время использования препаратов или при их перемещении между отделениями. При использовании лекарств отправляемый в систему документ должен содержать указания на законодательные и/или установленные внутренними правилами основания для этого. В документе «Паспорта процессов, автоматизированные в ИС МДЛП» отражено, что можно выгружать информацию об использовании лекарств в первичной и вторичной упаковках. Но в рамках эксперимента маркируется только вторичная. Выгрузка информации о передаче лекарства для медицинского применения означает, что оно выбыло из оборота.
В требованиях к организации процесса выбытия прописано, что он должен проходить с обязательным применением специального прибора – «Регистратора выбытия». Речь о небольшом электронном устройстве с экраном, клавиатурой, встроенным сканером маркировки и несколькими разъемами для подключения к компьютеру или локальной сети. Работа с Регистратором начинается с создания накладной, акта списания или другого подобного документа со списком выбывающих препаратов. После создания документов нужно просканировать коды маркировки препаратов из списка. Подключение устройства к компьютеру позволяет сразу видеть результаты сканирования на экране. В противном случае сканирование происходит вслепую.
Для отправки информации в систему мониторинга с помощью Регистратора нужно еще внести номер и дату документа-основания выбытия. При интеграции устройства с информационной системой клиники вводить номера документов вручную не придется. Подключение Регистратора выбытия к локальной сети позволяет работать с ним сразу с нескольких компьютеров. При этом пользоваться встроенным сканером не получится. Вместо него можно будет использовать обычные сканеры штрих-кодов, подключенные к компьютеру. Но информация о выбытии будет отправляться с помощью Регистратора. Такой вариант подходит для крупных клиник и медицинских центров, так как у них, скорее всего, уже есть компьютеры и сканеры на рабочих местах.

Оператор системы должен предоставлять Регистратор выбытия за свой счет. Для получения устройства необходимо оформить запрос в разделе «Анкеты и договоры» личного кабинета. Перед оформлением запроса нужно ознакомиться с проектом договора на оснащение. После остается выбрать место деятельности, заполнить анкету на получение и дождаться результата ее рассмотрения.
Пока маркировка не станет обязательной, регистратор выдается только клиникам, которые участвуют в тестировании системы.
Противоречия в требованиях
С точки зрения частных клиник в требованиях к процессу выгрузки информации об использовании препаратов есть противоречие. Пациент получает препараты во время покупки медицинской услуги, продажа происходит через кассу, выписывается чек. Согласно требованиям, любой процесс продажи ЛП предполагает отправку данных в ИС «Маркировка» с помощью онлайн-кассы. То есть аналогично процессу передачи данных при розничных продажах в аптеках. Но такой вариант не подходит клиникам. Потому что для медицинского применения лекарства отгружаются в первичной упаковке или без нее. А передавать информацию пока возможно только о препаратах во вторичной упаковке. Как именно решится этот вопрос, скорее всего, выяснится только после 1 января 2020 г.
Перемещение препаратов внутри клиники
Процесс перемещения ЛП между складами или отделениями наиболее прост, так как информация уже загружена во время получения препаратов. Регистратор выбытия при этой процедуре тоже не используется. Достаточно подготовить документ-основание перемещения. Ошибки при выгрузке данных могут возникнуть, если информация о месте перемещения не указана в системе. При этом регистрировать можно только места, указанные в лицензии на медицинскую или фармацевтическую деятельность.
Для справки
Основная информация об обязательной маркировке ЛП располагается на портале «Честный знак» и официальном сайте Росздравнадзора. Там же можно найти ссылки на законодательные акты и постановления правительства.
Для тестирования механизмов взаимодействия медучреждений с ИС «Маркировка» созданы региональные Центры компетенций. Их список есть на сайте оператора системы. Московская ГКБ им. М.П. Кончаловского стала всероссийским Центром компетенции. На ее базе проводится обучение специалистов других медорганизаций. В специальном разделе на сайте больницы выложены материалы с описанием опыта взаимодействия с системой. Во многих материалах указано, что по различным вопросам можно обращаться на электронную почту начальника ИТ-отдела. Однако ответ можно получить только если клиника расположена в Москве и Московской области. Остальным придется обращаться в региональные Центры компетенции. При этом можно столкнуться с тем, что приказ о назначении такого центра не принят. Но в любом случае клиники из списка настраивали обмен с системой и скорее всего поделятся опытом.
Полезные документы
Текущие недоработки системы
Дублирование наименований лекарств
Работа в ИС «Маркировка» построена так, что одна из сторон соглашается с тем, какая информация ей передается. И возможности ее редактирования нет. При этом одинаковые лекарственные препараты в документах разных контрагентов могут называться по-разному. Это приводит к дублям в системе учета, от которых не избавиться. Когда появится единый реестр с названиями препаратов, неизвестно.
Передача информации о выводе лекарств из оборота раньше их использования
Маркировка только вторичной упаковки привела к тому, что при отгрузке ЛП для медицинского применения в систему мониторинга выгружается информация только о ней. То есть препараты выводятся из оборота раньше, чем могут быть израсходованы. Поэтому возникают ситуации, когда по законным причинам лекарства могут быть не израсходованы, но выведены из оборота. Механизм обратного ввода в оборот существует. Но в случае с медорганизациями пока не понятно, что является достаточным основанием для этого.
Брак при нанесении штрихкодов с криптозащитой
Есть нерешенные проблемы и на этапе упаковки препаратов. Фармпроизводители утверждают, что при нанесении штрихкодов с криптозащитой, процент брака доходит до 89%. Связано это с длиной электронной подписи. По действующим нормативным актам она должна состоять из 88 знаков. Производители просят ее сократить до 20. Вопрос пока не решен, однако переносить сроки внедрения обязательной маркировки не планируется.
Согласно постановлению Правительства РФ от 14.12.2018 г. № 1557, субъекты обращения лекарственных средств из перечня высокозатратных нозологий обязаны зарегистрироваться в ИС «Маркировка» в период с 1 июля по 8 июля 2019 г. После регистрации есть 21 календарный день на подготовку к информационному взаимодействию с системой и оформление заявки для участия в тестировании, которое продлится 2 месяца.
Наказание за нарушения
Согласно подготовленным изменениям в Кодекс об административных правонарушениях РФ, за несвоевременное внесение данных в систему мониторинга, либо внесение в нее недостоверной информации с 1 января 2020 г. будет грозить штраф для должностных лиц в размере от 5 тыс. до 10 тыс. руб., для юрлиц – от 50 до 100 тыс. руб. Составлять протоколы и рассматривать дела будет Росздравнадзор.
Что делать медицинским организациям
Выгрузка документов в ИС «Маркировка» возможна только при использовании внешней системы для их формирования. Это можно сделать в медицинской информационной системе (МИС) или в отдельном решении для складского учета. Обмен данными через МИС возможен при наличии нужной функциональности. Если клиника уже работает с МИС, то внедрение отдельного решения усложнит учет и увеличит нагрузку на персонал. Доработка МИС будет более эффективным решением. Финансовая сторона доработки зависит от системы, с которой работает клиника.
Установка отдельной системы для учета – рабочий вариант для медорганизаций, которые не используют МИС. Правда, при условии, что установка МИС не планируется. Если система для складского учета разработана самостоятельно, логично будет сопоставить бюджет доработки со стоимостью готовых продуктов на рынке.
Материал подготовлен МИС «МедАнгел».
Источник